文章信息
- 周琳, 王雁, 彭镇华.
- Zhou Lin, Wang Yan, Peng Zhenhua
- 黄色花形成机制及基因工程研究进展
- Advances in Study on Formation Mechanism and Genetic Engineering of Yellow Flowers
- 林业科学, 2009, 45(2): 111-119.
- Scientia Silvae Sinicae, 2009, 45(2): 111-119.
-
文章历史
- 收稿日期:2008-02-27
-
作者相关文章
花色的优劣直接关系到观赏植物的观赏价值和商业价值,是观赏植物最重要的质量指标之一。因此,培育具有新型花色的花卉新品种一直是观赏植物育种领域的研究热点(Mol et al., 1999)。长期以来,传统杂交育种和定向选择育种在花色改良中做出了重要贡献,但传统育种难以打破植物生殖隔离,造成一些重要的观赏植物仍然欠缺某些花色品系,如天竺葵(Pelargonium graveolens)、仙客来(Cyclamen persicum)、翠菊(Callistephus chinensis)等缺乏纯黄色,月季(Rosa chinensis)、香石竹(Dianthus caryophyllus)、菊花(Dendranthema morifolium)等缺少蓝色和紫色,球根鸢尾(Iris xiphium)、紫罗兰(Matthiola incana)等缺乏猩红色或砖红色(彭镇华等,2001)。
近年来,随着花色形成机制研究的不断深入,参与花色形成的色素生物合成途径中很多相关酶和基因相继被分离和克隆(Springob et al., 2003;Grotewold,2006;Tanaka et al., 2008b)。在此基础上,利用基因工程技术能够扩大植物基因库、定向修饰等特点开展花色分子育种已成为花卉基因工程研究的重点(Tanaka et al., 1998;2005)。其中,蓝色花形成机制和转基因育种研究得最为深入,并取得了一系列令人瞩目的成果(Brugliera et al., 2000;Katsumoto et al., 2007)。
色彩鲜艳的黄色花以其能够给人以活力、明朗和高贵的感觉而受到广泛喜爱。针对一些重要观赏植物欠缺黄色品系的问题,近年来育种工作者对黄色花的形成机制也进行了不断探索,为实现黄色花分子育种提供了有益的借鉴。然而,尽管有关花色形成机制及其基因工程改良的综述有很多(于晓南等,2002;Tanaka et al., 2005;2008a),但目前针对黄色花研究进展的综述还未见发表。本文根据前人的研究,就黄色花形成的化学基础、黄色花色素的生物合成途径以及相应的分子育种思路进行了阐述,并探讨了存在的问题及发展前景,以期为今后黄色花基因工程改良提供理论依据。
1 黄色花的花色素组成决定花色的化学物质主要包括类黄酮(flavonoids)、类胡萝卜素(carotenoids)和甜菜色素(betalains)三类。类黄酮是大多数花色形成的决定性色素群(黄金霞等,2006),存在于花瓣表皮细胞液泡中,除花色素苷(anthocyanin)属红色系,控制花的粉红、红、蓝、紫和紫红色外,其他均属黄色系,其中查耳酮(chalcone)和噢哢(aurone)为深黄色,黄酮(flavone)、黄酮醇(flavonol)、黄烷酮(flavanone)等为淡黄色或接近无色;类胡萝卜素是胡萝卜素(carotene)和叶黄素(xanthophylls)的统称,存在于质体内,广泛分布在植物的花、叶、根和果皮等部位,使其呈现黄色、橙色或红色;甜菜色素是由酪氨酸衍生而来的含氮化合物,它是三大色素群中含量最少的一类,由(深)红色的甜菜红素(betacyanins)和黄色的甜菜黄素(betaxanthins)组成,参与花瓣黄色、橙色及红色的形成,仅存在于除粟米草科(Molluginaceae)和石竹科(Dianthus)以外的石竹目(Caryophyllales)的一些植物中,如苋科(Amaranthaceae)、紫茉莉科(Nyctaginaceae)、商陆科(Phytolaccaceae)等(Strack et al., 2003)。
广义的黄色花根据其颜色深浅的不同,从接近白色的浅黄到鲜艳的深黄可以分为多种花色。其中,肉眼难以辨别的几乎为白色的浅黄色花,如白蔷薇花(Rosa spp.)、白菊花等色素构成非常简单,只含浅黄色或接近无色的类黄酮,如黄酮、黄酮醇等这一类色素;而肉眼能够感知的黄色花色素组成相对比较复杂,主要与类黄酮和类胡萝卜素两大色素类群有关,并根据植物种类的不同,有的只含类黄酮或类胡萝卜素其中一类,如郁金香(Tulipa gesneriana)、向日葵(Helianthus annuus)等;有的则是类黄酮和类胡萝卜素两者并存,如万寿菊(Tagetes erecta)、酢酱草(Oxalis corniculata)等等(安田齐,1989)。另外,甜菜黄素在鸡冠花(Celosia cristata)、马齿苋属(Portulaca)、叶子花属(Bougainvillea)等植物的黄色花形成中起了主要作用(Toyama et al., 1992;Schliemann et al., 2001;Kugler et al., 2007)。
从图 1可以看出,呈黄色的类黄酮类化合物主要有查耳酮和噢哢两类(Tanaka et al., 2005)。其中2′,4′,6′,4-四羟基查耳酮(2′,4′,6′,4-tetrapydroxychalcone,THC)容易在查耳酮异构酶或自发异构的作用下形成无色的柚皮素(naringenin),因此,它往往以2′-糖苷即异杞柳苷(isosalipurposide,ISP)的形式稳定存在于液泡中,构成香石竹、金莲牡丹(Paeonia potaninii var. trollioides)、长春花属(Catharanthus)等植物黄色花瓣中的主要色素(Harborne,1966;Yoshida et al., 2004);另外,还发现了其他几种分布较为集中的黄色查耳酮糖苷,如菊科植物中的6′-脱氧查耳酮(6′-deoxychalcones)和红花(Carthamus tinctorius)中的红花黄色素A(safflomin A)等(Tanaka et al., 2005;2008b)。噢哢比查耳酮类色素呈现更鲜艳的黄色,但能够积累噢哢的植物比较有限,主要分布在菊科(Asteraceae)、玄参科(Scrophulariaceae)和补血草属(Limonium)中,如金鱼草(Antirrhinum majus)和波斯菊(Cosmos bipinnatus)等,此外一些苔类植物中也有噢哢合成(Nakayama,2002)。
在含有类胡萝卜素的黄色花瓣中起主要作用的是叶黄素类化合物(Tanaka et al., 2008b)。它是在橙黄色的胡萝卜素分子中引入羟基、甲氧基及酯键等转化成的一类含氧衍生物,常见的有隐黄质(cryptoxanthin)、玉米黄质(zeaxanthin)、叶黄素(lutein)、堇菜黄质(violaxanthin)和新黄质(neoxanthin)等。通常,这类植物花瓣黄色的深浅与其积累的叶黄素的种类和含量有关。宫灯百合(Sandersonia aurantiaca)金黄色花瓣中主要为隐黄质和玉米黄质(Nielsen et al., 2003);金盏菊(Calendula officinalis)中主要为毛茛黄素(flavoxanthin)和金黄质(auroxanthin)(Bakó et al., 2002);旱金莲(Tropaeolum majus)中以叶黄素为主,另外还含有少量的堇菜黄质和玉米黄质(Niizu et al., 2005);万寿菊(Moehs et al., 2001)和菊花(Kishimoto et al., 2004)黄色花瓣中90%以上的类胡萝卜素为叶黄素及其衍生物,且万寿菊中叶黄素含量的不同是使其花色由白色到深橙色变异的主要原因(Khachik et al., 1999)。
2 黄色花花色素的生物合成及其基因目前,除甜菜色素外,类黄酮和类胡萝卜素类色素的生物合成途径都已基本明确(图 1、图 2,Tanaka et al., 2008b),相关酶和基因的研究也非常深入(Springob et al., 2003;Tanaka et al., 2008b)。本文中主要针对上述在黄色花呈色中起重要作用的花色素生物合成相关酶和基因进行阐述。
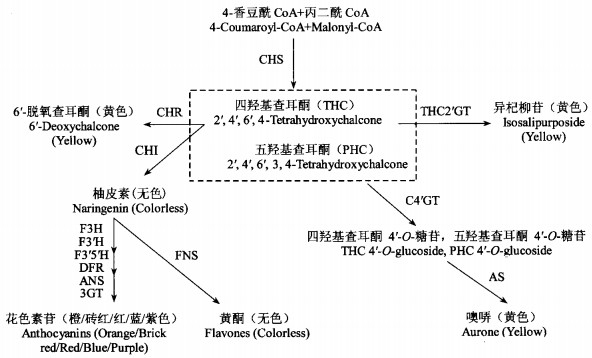
|
图 1 类黄酮类色素的生物合成途径 Figure 1 The biosynthetic pathway of flavonoids CHS:查耳酮合酶Chalcone synthase;CHI:查耳酮异构酶Chalcone isomerase;THC2′GT:查耳酮2′葡糖基转移酶THC 2′-glucosyltransferase;CHR:查耳酮还原酶Chalcone reductase;C4′GT:查耳酮4′-O-葡糖基转移酶Chalcone 4′-O-glucosyltransferase;F3H:黄烷酮-3-羟基化酶Flavanone 3-hydroxylase;F3′H:黄烷酮-3′-羟基化酶Flavonoid 3′-hydroxylase;F3′5′H:黄烷酮3′5′-羟基化酶Flavonoid 3′5′-hydroxylase;DFR:二氢黄酮醇4-还原酶Dihydroflavonol 4-reductase;ANS:花色素合成酶Anthocyanidin synthase;3GT:类黄酮3-O-葡糖基转移酶3-Glucosyltransferases;FNS:黄酮合成酶Flavone synthase;AS:金鱼草素合酶Aureusidin synthase. |
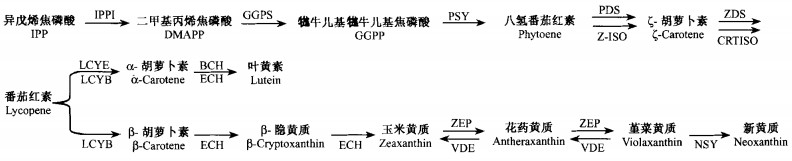
|
图 2 植物类胡萝卜素的生物合成途径(Tanaka et al., 2008b) Figure 2 Carotenoid biosynthesis pathway in plants(Tanaka et al., 2008b) IPPI:IPP异构酶Isopentenyl pyrophosphate isomerase;GGPS:牻牛儿基牻牛儿基焦磷酸合酶Geranylgeranyl pyrophosphate synthase;PSY:八氢番茄红素合酶Phytoene synthase;PDS:八氢番茄红素脱氢酶Phytoene desaturase;Z-ISO:类胡萝卜素异构酶Carotenoid isomerase;ZDS:ζ-胡萝卜素脱氢酶ζ-Carotene desaturase;CRTISO:类胡萝卜素异构酶Carotenoid isomerase;LCYE:ε环化酶Lycopene ε-cyclase;LCYB:β环化酶Lycopene β-cyclase;BCH:β-环羟化酶β-Hydroxylase;ECH:ε-环羟化酶ε-Hydroxylase;ZEP:玉米黄质环氧化酶Zeaxanthin epoxidase;VDE:堇菜黄质脱环氧化酶Violaxanthin de-epoxidase;NSY:新黄质合酶Neoxanthin synthase. |
在类黄酮生物合成途径中(图 1),查耳酮合酶(chalcone synthase,CHS)催化1个分子的香豆酰CoA与3个分子的丙二酰CoA缩合形成黄色的四羟基查耳酮THC。THC为类黄酮类化合物提供了基本碳骨架,是一个重要的中间产物。因此,CHS作为生物合成途径中的限速酶和关键酶,已从多种植物中分离、纯化,相应的蛋白结构也已明确(Ferrer et al., 1999)。
CHS是类黄酮合成途径中第一个被分离的基因,最早是从欧芹(Petroselinum hortense)悬浮细胞中得到的(Kreuzaler et al., 1983)。此后,豆科(Leguminosae)、十字花科(Brassicaceae)、旋花科(Convolvulaceae)等多种植物的CHS相继被克隆。序列同源性分析发现,CHS编码区保守性很强,不同科植物间核苷酸水平上的同源性超过60%,氨基酸水平上的同源性达80%,可以用于研究基因进化(王金玲等,2000)。Yang等(2003)通过对山茶属(Camellia)植物CHS外显子2序列的分析,认为CHS基因家族在进化过程中已分化为3个亚家族。
研究表明,除欧芹、金鱼草和拟南芥(Arabidopsis thaliana)基因组中的CHS为单拷贝外,迄今鉴定过的所有植物的CHS都以多基因家族形式存在(Martin,1993)。不同CHS成员的组织发育和环境诱导的特异性表达在豌豆(Pisum sativum)(Ito et al., 1997)、牵牛(Pharbifis nil)(Durbin et al., 2000)、葡萄(Vitis vinifera)(Goto-Yamamoto et al., 2002)、蝴蝶兰(Phalaenopsis hybrida)(Han et al., 2006)等植物中得到验证。在此基础上,通过操作CHS进行花色基因工程改良的探索也迅速展开,并因其处于花色素苷合成途径的起始位置,抑制其表达已成为目前浅色花色育种中广泛采用的手段。van der Krol等(1988)首次将反义CHS导入紫色矮牵牛(Petunia hybrida)中,明显抑制了花色苷的形成,得到开白花的植株;Fukusaki等(2004)利用RNAi技术,使蓝色夏堇(Torenia hybrida)中的CHS基因沉默后,获得了开白色和灰白色花的转基因植株;此外,成功的例子在非洲菊(Gerbera hybrida)、菊花、月季、香石竹、洋桔梗(Eustoma grandiflorum)和龙胆(Gentiana triflora)中也相继报道(Tanaka et al., 1998;2005)。
2.1.2 查耳酮异构酶在植物体细胞质内,查耳酮异构酶(chalcone isomerase,CHI)催化查耳酮分子的环化,将黄色的THC转化成无色的柚皮素(图 1)。由于THC是合成黄色花花色素的重要底物,而柚皮素是其他类黄酮物质合成的直接前体,可以进一步形成黄酮醇或花色素苷等红色、蓝色花卉的主要色素来源,因此CHI在黄色花花色素生物合成中起关键作用。
CHI最早从菜豆(Phaseolus vulgaris)中以抗体技术分离(Mehdy et al., 1987)。香石竹、大豆(Glycine max)、矮牵牛、烟草(Nicotiana tabacum)等植物的CHI也已被克隆(Li et al., 2006)。研究表明,矮牵牛基因组中存在2个CHI,CHIA在花组织和经紫外线照射的幼苗中表达,CHIB仅在未成熟的花粉中表达(van Tunen et al., 1989);过表达矮牵牛CHIA可以提高番茄(Lycopersicon esculentum)果实中黄酮醇的含量(Muir et al., 2001);导入反义水母雪莲(Saussurea medusa)CHI可抑制烟草中类黄酮的合成(Li et al., 2006)。目前,CHI表达分析和调控机制的研究相对不足,在花色基因工程改良中有关CHI转基因的报道也很少(Nishihara et al., 2005)。
2.1.3 查耳酮2′葡糖基转移酶如图 1所示,查耳酮2′葡糖基转移酶(THC 2′-glucosyltransferase,THC2′GT)催化THC合成花瓣液泡中能稳定存在的黄色花色素ISP。Itoh等(2002)发现THC2′GT在黄色香石竹花瓣呈色过程中起重要作用。Yoshida等(2004)推测THC2′GT基因表达量或酶活性的不同是造成不同品种黄色香石竹花瓣中ISP含量差异的主要原因。随后,Ogata等(2004)利用RT-PCR技术从香石竹花瓣中分离到18条GT基因的同源序列,并通过大肠杆菌表达系统从中筛选出2条编码蛋白具有合成查耳酮2′糖苷活性的cDNA克隆,分别命名为DicGT4和DicGT5。目前,THC2′GT的cDNA克隆已从香石竹中得到分离,并通过过表达该基因促使了矮牵牛花瓣中ISP的积累(Ishida et al., 2003;Okuhara et al., 2004)。
2.1.4 查耳酮还原酶在一些开黄色花的菊科植物中,查耳酮还原酶(chalcone reductase,CHR)与CHS共同作用,将THC转化为稳定的6′-脱氧查耳酮。由于6′-脱氧查耳酮是大豆异黄酮的合成前体,因此CHR基因最早从大豆中获得(Welle et al., 1991)。目前,紫花苜蓿(Medicago sativa)(Ballance et al., 1995)、刺甘草(Glycyrrhiza echinata)(Akashi et al., 1996)、长喙田菁(Sesbania rostrata)(Goormachtig et al., 1999)等植物中的CHR也得到分离。序列分析发现,CHR属于醛酮还原酶超家族(aldo-keto reductase superfamily,AKR),在植物体内以多拷贝存在。在过表达葛藤(Pueraria montana var. lobata)CHR的转基因烟草中,花青素含量减少了40%,花色由红色变为白色或粉色(Joung et al., 2003);Shimada等(2006)将百脉根(Lotus japonicus)CHR导入红色矮牵牛中,同样抑制了花青素的合成,并使花色变淡。
2.2 噢哢生物合成相关酶及基因噢哢是类黄酮合成途径中由查耳酮支化产生的一类最终产物,以金鱼草素(aureusidin)及其糖苷为代表,是形成金鱼草和波斯菊等明黄色花的主要色素来源(安田齐,1989;Nakayama,2002)。目前,有关噢哢的研究都是以金鱼草为材料展开的。然而,尽管早在20世纪50年代初人们就已发现了噢哢的存在,但其生物合成途径中相关酶和基因的分离和鉴定直到近几年才有所突破。
研究发现,噢哢由THC或2′,4′,6′,3,4-五羟基查耳酮(2′,4′,6′,3,4-pentahydroxychalcone,PHC)氧化产生(Nakayama,2002)。在噢哢生物合成途径中,THC或PHC首先在查耳酮4′-O-葡糖基转移酶(chalcone 4′-O-glucosyltransferase,C4′GT)的作用下在细胞质内合成THC 4′-O-糖苷或PHC 4′-O-糖苷,转移至液泡后,以此为底物再在金鱼草素合酶(aureusidin synthase,AS)的催化下合成噢哢(金鱼草素6-O-糖苷)(图 1,Ono et al., 2006a)。Nakayama等(2000)首次从金鱼草花瓣中获得AS蛋白,并通过消减杂交分离了AmAS1的cDNA克隆,Northern杂交表明该基因的表达与黄色花瓣的呈色密切相关。后来AS被证明为一种含铜糖蛋白,是催化噢哢合成的专一酶(Sato et al., 2001)。对AS的初级结构和底物特异性进行分析后,认为AS属于在高等植物中广泛存在的多酚氧化酶(polyphenol oxidase,PPO)家族(Nakayama et al., 2000;2001)。但最新研究发现,与PPO家族定位于质体不同,AmAS1通过高尔基体由内质网膜转移定位在液泡内,进一步证明噢哢合成于液泡内,而并非细胞质内(Ono et al., 2006b)。
2.3 叶黄素生物合成相关酶及基因在类胡萝卜素生物合成途径中(图 2),合成前体异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)在IPP异构酶(isopentenyl pyrophosphate isomerase,IPPI)的作用下异构化为二甲基丙烯焦磷酸(dimethylallyl diphosphate,DMAPP),然后在牻牛儿基牻牛儿基焦磷酸合酶(geranylgeranyl pyrophosphate synthase,GGPS)催化下,DMAPP与3个IPP分子缩合生成含有20个碳的牻牛儿基牻牛儿基焦磷酸(geranylgeranyl pyrophosphate,GGPP)。两分子的GGPP经头对头缩合,由八氢番茄红素合酶(phytoene synthase,PSY)催化形成具40个碳原子的八氢番茄红素(phytoene)。随后,八氢番茄红素在八氢番茄红素脱氢酶(phytoene desaturase,PDS)、ζ-胡萝卜素脱氢酶(ζ-carotene desaturase,ZDS)和类胡萝卜素异构酶(carotenoid isomerase,CRTISO)3个酶的共同催化下经4步去饱和反应转变为番茄红素(lycopene)。由β环化酶(lycopene β-cyclase,LCYB)和ε环化酶(lycopene ε-cyclase,LCYE)催化的番茄红素环化是植物体内类胡萝卜素合成途径的一个重要分支点,环化产物主要为含1个β-环和1个ε-环的α-胡萝卜素及其衍生物,以及含2个β-环的β-胡萝卜素及其衍生物(Grotewold,2006;Tanaka et al., 2008b)。
α-胡萝卜素和β-胡萝卜素是叶黄素类化合物的合成前体。α-胡萝卜素在β-环羟化酶(β-hydroxylase,BCH)和ε-环羟化酶(ε-hydroxylase,ECH)的共同作用下生成叶黄素(Tian et al., 2004)。β-胡萝卜素在BCH作用下转变成β-隐黄质,进而生成玉米黄质。玉米黄质在玉米黄质环氧化酶(zeaxanthin epoxidase,ZEP)作用下生成花药黄质(antheraxanthin),进而生成堇菜黄质。在强光胁迫下,堇菜黄质脱环氧化酶(violaxanthin de-epoxidase,VDE)催化堇菜黄质转化为花药黄质,进而再转化为玉米黄质。堇菜黄质在新黄质合酶(neoxanthin synthase,NSY)催化下转化为高等植物类胡萝卜素生物合成β,β分支的最终产物——新黄质(图 2,Grotewold,2006;Tanaka et al., 2008b)。
在上述途径中,涉及叶黄素生物合成的酶和基因已在多种植物中分离和鉴定(Cunningham et al., 1998;郑阳霞等,2006)。基因转录水平上的表达分析表明,类胡萝卜素合成基因参与花色形成的转录调控。如黄花龙胆(Gentiana lutea)花发育过程中,LCYB和LCYE表达的相对强弱决定了由α-胡萝卜素生成的叶黄素和β-胡萝卜素生成的玉米黄质和新黄质在类胡萝卜素总量中的比例(Zhu et al., 2003);万寿菊花瓣中随着LCYB表达量的增加,花色由白色到黄色、深黄色转变(Del et al., 2005)。
早期植物类胡萝卜素遗传工程主要以增加粮食作物的类胡萝卜素含量为目的展开(Sandmann et al., 2006)。Ye等(2000)将黄水仙(Narcissus pseudo-narcissus)PSY、LCYB基因和细菌八氢番茄红素脱氢酶crtI基因一起构成表达载体转入到一个水稻(Oryza sativa)品种中,得到胚乳呈黄色的“金大米”。后来,烟草、番茄、马铃薯(Solanum tuberosum)等植物组织中类胡萝卜素含量的提高也相继实现(Ralley et al., 2004;Morris et al., 2006)。然而,类胡萝卜素基因工程在花色分子育种中的应用还很少。Ohmiya等(2006)发现白色菊花中虽有类胡萝卜素的合成,但随后却在类胡萝卜素裂解双加氧酶CmCCD4a的作用下裂解,从而使花瓣表现白色;抑制CmCCD4a的表达可使花瓣由白色变为黄色;反之,过表达CmCCD4a可使花瓣由黄色转变为白色(Tanaka et al., 2008a)。Suzuki等(2007)将细菌中编码β-胡萝卜素酮化酶的crtW基因在百脉根中过表达,使其花瓣和叶片中积累了虾青素(astaxanthin)、角黄素(canthaxanthin)等新的类胡萝卜素化合物,花朵颜色由浅黄色转变成深黄色或橙色。
3 黄色花基因工程的主要途径通过上述分析可以发现,实现黄色花分子育种主要有以下2条途径:对于不含类胡萝卜素的物种,可以查耳酮和噢哢生物合成途径中的关键基因为突破口,通过基因工程调控类黄酮的合成方向,抑制花青素的合成和促进查耳酮或噢哢的积累;而花瓣内同时含有类黄酮和类胡萝卜素2类物质的物种中,抑制花青素的合成,使花瓣中只积累类胡萝卜素,也能使花色变黄。
3.1 抑制花青素的合成促进花瓣中查耳酮的积累大量证据表明,CHI活性的抑制是通过积累查耳酮类化合物使花朵呈现黄色的先决条件(Nishihara et al., 2005)。但目前,通过该方法进行花色改良的研究仅在烟草中有所报道。Nishihara等(2005)采用RNAi技术抑制了烟草中CHI的表达,使花瓣中花青素含量降低,查耳酮含量上升,花朵颜色变浅,且花粉中也积累了大量查耳酮而表现黄色。值得注意的是,对于某些植物如矮牵牛、洋桔梗等,通过反义抑制或RNAi的方法均不能抑制CHI的活性,或即使抑制了其活性但仍不能改变花色(van Blokland et al., 1993)。推测在这些植物体内查耳酮可以在CHI失活的情况下产生自发异构,形成黄酮醇。为此,Davies等(1998)尝试将紫花苜蓿查耳酮还原酶基因CHR导入白色矮牵牛中,增强了查耳酮的稳定性,并促进了它的积累,最终获得开淡黄色花的转基因植株。另外,Zuker等(2002)将反义F3H转入到只含天竺葵色素苷的橙色香石竹中后,转基因株系中F3H的表达受到抑制,只积累了痕量的天竺葵色素苷,并由于其自身具有合成ISP的活性,从而使花色变成了黄色或乳黄色。
3.2 导入新基因和基因抑制相结合促使噢哢的合成噢哢生物合成相关基因的分离使得通过导入这些外源基因来实现黄色花分子育种成为可能。在类黄酮代谢途径中(图 1),噢哢合成酶C4′GT和AS与CHI、F3H等花青素合成酶存在底物竞争的关系,它们分别催化查耳酮向噢哢和花青素的方向代谢。因此,在导入外源新基因的同时,必须与抑制花青素合成基因相结合才能最大限度地积累噢哢。Ono等(2006a)在蓝花的夏堇中异源表达金鱼草AmAS1,并没有检测到噢哢的合成,花朵颜色也未发生改变;而将AmAS和C4′GT共同表达时,花色变成了黄色,但仍能积累较多的花青素;最后,通过RNAi技术抑制花青素合成相关基因F3H或DFR的表达,再共同表达AmAS1和C4′GT,成功得到了后代的花朵中几乎不能积累花青素的开黄色花的转基因植株。
3.3 抑制花青素基因的表达只积累类胡萝卜素对于花瓣中既含有花青素又含有类胡萝卜素的种或品种,通过抑制花青素生物合成相关基因的表达,阻断其在花瓣中的积累,而类胡萝卜素的合成和积累并不受影响,从而使花色变成黄色。Suzuki等(2000)抑制了深褐紫色夏堇花瓣中的CHS表达,花青素的合成即被阻断,由于植株中同时含有类胡萝卜素,因而转基因后代中出现了开淡黄色花的植株。
3.4 通过转录因子调控花色素的合成除直接编码花色素生物合成酶的结构基因外,转录因子调节基因通过调节生物合成酶活性和色素积累基因的时空表达等方式也在花色形成中起着重要作用。因此,在花色基因工程改良中,也可以利用转录因子以增强或减弱原有代谢产物来改变花色。
目前,研究较多的花色素苷基因转录调控因子主要有baisc-helix-loop-helix(bHLH)和R2R3-MYB两大类相互作用的转录因子(Springob et al., 2003)。此外,WD40类蛋白的调控作用也广泛存在于多种植物的花青素合成过程中。然而,尽管花色素苷转录因子的调控作用模式在玉米(Zea mays)、拟南芥、矮牵牛等植物中已获得较深入的研究(Koes et al., 2005),但已知的转录因子主要参与花色素苷生物合成后期阶段的调控,且转录调节在花色改良中的应用主要集中在过表达这些调控因子以促进花色素苷合成的研究中,如Ray等(2003)将玉米MYC(bHLH)转录因子调节基因Lc转入紫花苜蓿中后,转化植株中CHS、F3H基因的表达明显增强,花色素苷大量积累,植株表现紫红色。同时,也有证据表明该方法具有正向与反向的双重作用。Aharoni等(2001)将草莓(Fragaria grandiflora)FaMYB1转入烟草中过量表达后,转化植株花瓣中花色素苷合成酶ANS、GT的活性降低,其基因表达受到抑制,花色素苷积累明显减少,花冠由粉红色变为白色。
研究发现,噢哢生物合成调控机制独立于花色素苷的合成调控(Schwinn et al., 2006),但有关噢哢生物合成调控因子的了解很少。Davies等(2006)在金鱼草中发现了2个调控噢哢合成的基因座,即Sulfurea和Violacea。隐性的sulfurea等位基因能够促进噢哢的生成,因此该等位基因对噢哢的生物合成有负调控或竞争作用;而violacea等位基因则对噢哢生物合成基因的空间表达起调控作用。
4 存在的问题及展望综上所述,植物类黄酮和类胡萝卜素生物合成途径中有关黄色花形成的大多数酶和基因均已被分离和鉴定,并且黄色花基因工程也取得了一定进展。但是,目前针对黄色花形成机制,尤其是黄色花分子育种的研究还处于起步阶段,很多方面还有待进一步研究:如黄色花形成化学机制的进一步阐明;黄色花花色素生物合成途径中新基因的分离;黄色花呈色过程中相关内源基因表达规律的研究;黄色花花色素生物合成转录调节因子的分离;类黄酮和类胡萝卜素生物合成调控机制的进一步研究;转录因子蛋白质如何相互作用来协作调节花色素的生物合成;CHI基因正、反义抑制失败原因的阐明;花器官特异表达启动子的克隆和应用;转类胡萝卜素合成相关基因的黄色花基因工程的研究;色素间相互关系及共同着色的研究;其他因子如花色素苷生物合成的液泡扣押与沉积、液泡内pH值、金属元素的含量和花瓣的结构等对黄色花呈色的影响等。而且,尽管噢哢合成基因的克隆为黄色花分子育种提供了一条新的思路并具有广阔的应用前景,但表达载体中花器官特异表达启动子的选择及外源基因导入后如何克服基因沉默,保证其在植物体内能够稳定遗传与表达也是黄色花基因工程研究中的重要问题。另外,目前有关甜菜色素生物合成的研究还非常有限,其合成途径中的关键酶和基因仍未得到分离,转录调控机制及基因工程的研究更未见报道,因此相关研究也亟待开展。
植物黄色花基因工程改良是一个系统工程,单单调控一个基因的表达难以达到预期效果,需要综合考虑相关因素。目前,许多观赏植物的遗传转化体系已经建立,随着黄色花形成机制和调控机理研究的不断深入,以及转基因技术的不断完善,采用多种技术手段相结合的方法,多方面探索,相信不久的将来终能实现仙客来、天竺葵等观赏植物的黄色花新品种创制。
安田齐(日).1989.花色的生理生物化学.傅玉兰, 译.北京: 中国林业出版社, 1-144.
|
黄金霞, 王亮生, 李晓梅, 等. 2006. 花色变异的分子基础与进化模式研究进展. 植物学通报, 23(4): 321-333. DOI:10.3969/j.issn.1674-3466.2006.04.001 |
彭镇华, 汪政科.2001.观赏植物基因工程研究进展//高俊平, 姜伟民.中国花卉科技进展.北京: 中国农业出版社, 166-172. http://www.wanfangdata.com.cn/details/detail.do?_type=conference&id=3211875
|
王金玲, 顾红雅.2000.CHS基因的分子进化研究现状//李承森.植物科学进展: 第三卷.北京: 高等教育出版社, 施普林格出版社, 17-24.
|
于晓南, 张启翔. 2002. 观赏植物的花色素苷与花色. 林业科学, 38(3): 147-153. |
郑阳霞, 季静, 王罡, 等. 2006. 宁夏枸杞八氢番茄红素合成酶基因的克隆与序列分析. 林业科学, 42(5): 138-141. |
Aharoni A, De Vos C H, Wein M, et al. 2001. The strawberry FaMYB1 transcription factor suppresses anthocyanin and flavonol accumulation in transgenic tobacco. Plant J, 28(3): 319-332. DOI:10.1046/j.1365-313X.2001.01154.x |
Akashi T, Furuno T, Futami K, et al. 1996. A cDNA for polyketide reductase (Accession No. D83718) that catalyzes the formation of 6′-deoxychalcone from cultured Glycyrrhiza echinata L. cells (PGR96-023). Plant Physiol, 111: 347. DOI:10.1104/pp.111.1.347 |
Bakó E, Deli J, Tóth G. 2002. HPLC study on the carotenoid composition of Calendula products. J Biochem Bioph Methods, 53: 241-250. DOI:10.1016/S0165-022X(02)00112-4 |
Ballance G M, Dixon R A. 1995. Medicago sativa cDNAs encoding chalcone reductase. Plant Physiol, 107: 1027-1028. DOI:10.1104/pp.107.3.1027 |
Brugliera F, Tull D, Holton T A, et al.2000.Introduction of a cytochrome b5 enhances the activity of floavonoid 3′, 5′hydroxylase(a cytochrome P450) in transgenic carnation//Sixth International Congress of Plant Molecular Biology.Quebec: University of Laval, S6-S8.
|
Cunningham F X Jr, Gantt E. 1998. Genes and enzymes of carotenoid biosynthesis in plants. Annu Rev Plant Physiol Plant Mol Biol, 49: 557-583. DOI:10.1146/annurev.arplant.49.1.557 |
Davies K M, Bloor S J, Spiller G B, et al. 1998. Production of yellow color in flowers:redirection of flavonoid biosynthesis in petunia. Plant J, 13: 259-266. DOI:10.1046/j.1365-313X.1998.00029.x |
Davies K M, Marshall G B, Bradley J M, et al. 2006. Characterization of aurone biosynthesis in Antirrhinum majus. Physiologia Plantarum, 128: 593-603. DOI:10.1111/ppl.2006.128.issue-4 |
Del Villar-Martinez A A, Garcia-Saucedo P A, Carabez-Trejo A, et al. 2005. Carotenogenic gene expression and ultrastructural changes during development in marigold. J Plant Physiol, 162: 1046-1056. DOI:10.1016/j.jplph.2004.12.004 |
Durbin M L, McCaig B, Clegg M T. 2000. Molecular evolution of the chalcone synthase multigene family in the Morning Glory. Plant Mol Biol, 42: 79-92. DOI:10.1023/A:1006375904820 |
Ferrer J L, Jez J M, Bowman M E, et al. 1999. Structure of chalcone synthase and the molecular basis of plant polyketide biosynthesis. Nat Struct Biol, 6: 775-784. DOI:10.1038/11553 |
Fukusaki E, Kawasaki K, Kajiyama S, et al. 2004. Flower color modulations of Torenia hybrida by downregulation of chalcone synthase genes with RNA interference. Journal of Biotechnology, 111: 229-240. DOI:10.1016/j.jbiotec.2004.02.019 |
Goormachtig S, Lievens S, Herman S, et al. 1999. Chalcone reductase-homologous transcripts accumulate during development of stem-borne nodules on the tropical legume Sesbania rostrata. Planta, 209: 45-52. DOI:10.1007/s004250050605 |
Goto-Yamamoto N, Wan G H, Masaki K, et al. 2002. Structure and transcription of three chalcone synthase genes of grapevine (Vitis vinifera). Plant Science, 162: 867-872. DOI:10.1016/S0168-9452(02)00042-0 |
Grotewold E. 2006. The genetics and biochemistry of floral pigments. Annu Rev Plant Biol, 57: 761-780. DOI:10.1146/annurev.arplant.57.032905.105248 |
Han Y Y, Ming F, Wang J W, et al. 2006. Cloning and characterization of a novel chalcone synthase gene from Phalaenopsis hybrida orchid flowers. Russion Journal of Plant physiology, 53(2): 223-230. DOI:10.1134/S1021443706020129 |
Harborne J B. 1966. Comparative biochemistry of flavonoids Ⅰ: Distribution of chalcone and aurone pigments in plants. Phytochemistry, 5: 111-115. DOI:10.1016/S0031-9422(00)85088-8 |
Ishida M, Ogata J, Yoshida H, et al. 2003. Isolation of a cDNA for the chalcone 2′-glucosyltransferase gene and its expression profile in carnation flowers. Supplement to Plant and Cell Physiol, 44: 536. |
Ito M, Ichinose Y, Kato H, et al. 1997. Molecular evolution and functional relevance of the chalcone synthase genes of Pea. Mol Gen Genet, 255: 28-37. DOI:10.1007/s004380050471 |
Itoh Y, Higeta D, Suzuki A, et al. 2002. Excision of transposable elements from the chalcone isomerase and dihydroflavonol 4-reductase genes may contribute to the variegation of the yellow-flowered carnation (Dianthus caryophyllus). Plant Cell Physiol, 43(5): 578-585. DOI:10.1093/pcp/pcf065 |
Joung J, Kasthuri G M, Pank J, et al. 2003. An overexpression of chalcone reductase of Pueraria montana var. lobata alters biosynthesis of anthocyanin and 5′-deoxyflavonoids in transgenic tobacco. Biochemical and Biophysical Research Communications, 303: 326-331. DOI:10.1016/S0006-291X(03)00344-9 |
Katsumoto Y, Fukuchi-Mizutani M, Fukui Y. 2007. Engineering of the rose flavonoid biosynthetic pathway successfully generated blue-hued flowers accumulating delphinidin. Plant Cell Physiol, 48(11): 1589-1600. DOI:10.1093/pcp/pcm131 |
Khachik F, Steck A, Pfander H. 1999. Isolation and structural elucidation of (13Z, 130Z, 3R, 30R, 60R)-lutein from marigold flowers, kale, and human plasma. J Agric Food Chem, 47: 455-461. DOI:10.1021/jf980823w |
Kishimoto S, Maoka T, Nakayama M, et al. 2004. Carotenoid composition in petals of chrysanthemum (Dendranthema grandiflorum (Ramat.) Kitamura). Phytochemistry, 65: 2781-2787. DOI:10.1016/j.phytochem.2004.08.038 |
Koes R, Verweij W, Quattrocchio F. 2005. Flavonoids:a colorful model for the regulation and evolution of biochemical pathways. Trends Plant Sci, 10: 236-242. DOI:10.1016/j.tplants.2005.03.002 |
Kreuzaler F, Ragg H, Fautz E, et al. 1983. UV-induction of chalcone synthase mRNA in cell suspension cultures of Petrosklinum hortense. Proc Nat1 Acad Sci USA, 80: 2591-2593. DOI:10.1073/pnas.80.9.2591 |
Kugler F, Stintzing F C, Carle R. 2007. Characterisation of betalain patterns of differently coloured inflorescences from Gomphrena globosa L. and Bougainvillea sp. by HPLC-DAD-ESI-MS. Anal Bioanal Chem, 387: 637-648. DOI:10.1007/s00216-006-0897-0 |
Li F, Jin Z, Qu W, et al. 2006. Cloning of a cDNA encoding the Saussurea medusa chalcone isomerase and its expression in transgenic tobacco. Plant Physiology and Biochemistry, 44: 435-461. DOI:10.1016/j.plaphy.2006.08.001 |
Martin C R. 1993. Structure, function and regulation of the chalcone synthase. Int Rev Cytol, 147: 233-284. DOI:10.1016/S0074-7696(08)60770-6 |
Mehdy M C, Lamb C J. 1987. Chalcone isomerase cDNA cloning and mRNA induction by fungal elicitor, wounding and infection. EMBO J, 6: 1527-1533. DOI:10.1002/embj.1987.6.issue-6 |
Moehs C P, Tian L, Osteryoung K W, et al. 2001. Analysis of carotenoid biosynthetic gene expression during marigold petal development. Plant Molecular Biology, 45: 281-293. DOI:10.1023/A:1006417009203 |
Mol J, Cornish E, Mason J, et al. 1999. Novel coloured flowers. Current Opinion in Biotechnology, 10: 198-201. DOI:10.1016/S0958-1669(99)80035-4 |
Morris W L, Ducreuxa L J M, Fraserb P D, et al. 2006. Engineering ketocarotenoid biosynthesis in potato tubers. Metab Eng, 8: 253-263. DOI:10.1016/j.ymben.2006.01.001 |
Muir S, Collins G, Robinson S, et al. 2001. Overexpression of petunia chalcone isomerase in tomato results in fruit containing increased levels of flavonols. Nature Biotechnology, 19(5): 470-474. DOI:10.1038/88150 |
Nakayama T, Sato T, Fukui Y, et al. 2001. Specificity analysis and mechanism of aurone synthesis catalyzed by aureusidin synthase, a polyphenol oxidase homolog responsible for flower coloration. FEBS Lett, 499(1/2): 107-111. |
Nakayama T, Yonekura-Sakakibara K, Sato T, et al. 2000. Aureusidin synthase:a polyphenol oxidase homolog responsible for flower coloration. Science, 290: 1163-1166. DOI:10.1126/science.290.5494.1163 |
Nakayama T. 2002. Enzymology of aurone biosynthesis. Journal of Bioscience and Bioengineering, 94(6): 487-491. DOI:10.1016/S1389-1723(02)80184-0 |
Nielsen K M, Lewis D H, Morgan E R. 2003. Characterization of carotenoid pigments and their biosynthesis in two yellow flowered lines of Sandersonia aurantiaca (Hook.). Euphytica, 130: 25-34. DOI:10.1023/A:1022328828688 |
Niizu P Y, Rodriguez-Amaya D B. 2005. Flowers and leaves of Tropaeolum majus L. as rich sources of lutein. Journal of Food Science, 70(9): 605-609. |
Nishihara M, Nakatsuka T, Yamamura S. 2005. Flavonoid components and flower color change in transgenic tobacco plants by suppression of chalcone isomerase gene. FEBS Lett, 579: 6074-6078. DOI:10.1016/j.febslet.2005.09.073 |
Ogata J, Itoh Y, Ishida M, et al. 2004. Cloning and heterologous expression of cDNAs encoding flavonoid glucosyltransferases from Dianthus caryphyllus. Plant Biotechnol, 21: 367-375. DOI:10.5511/plantbiotechnology.21.367 |
Ohmiya A, Kishimoto S, Aida R, et al. 2006. Carotenoid cleavage dioxygenase (CmCCD4a) contributes to white color formation in chrysanthemum petals. Plant Physiol, 142: 1193-1201. DOI:10.1104/pp.106.087130 |
Okuhara H, Ishiguro K, Hirose C, et al. 2004. Molecular cloning and functional expression of tetrahydroxychalcone 2′-glucosyltransferase genes. Supplement to Plant and Cell Physiol, 45: 420. |
Ono E, Fukuchi-Mizutani M, Nakamura N, et al. 2006a. Yellow flowers generated by expression of the aurone biosynthetic pathway. Proc Natl Acd Sci USA, 103(29): 11075-11080. DOI:10.1073/pnas.0604246103 |
Ono E, Hatayama M, Isono Y, et al. 2006b. Localization of a flavonoid biosynthetic polyphenol oxidase in vacuoles. Plant J, 45(2): 133-143. DOI:10.1111/tpj.2006.45.issue-2 |
Ralley L, Enfissi E M A, Misawa N, et al. 2004. Metabolic engineering of ketocatenoid formation in higher plants. Plant J, 39: 477-486. DOI:10.1111/tpj.2004.39.issue-4 |
Ray H, Yu M, Auser P, et al. 2003. Expression of anthocyanins and proanthocyanidins after transformation of alfalfa with maize Lc. Plant Physiol, 132: 1448-1463. DOI:10.1104/pp.103.025361 |
Sandmann G, Romer S, Fraser P D. 2006. Understanding carotenoid metabolism as a necessity for genetic engineering of crop plants. Metab Eng, 8: 291-302. DOI:10.1016/j.ymben.2006.01.005 |
Sato T, Nakayama T, Kikuchi S, et al. 2001. Enzymatic formation of aurones in the extracts of yellow snapdragon flowers. Plant Sci, 160: 229-236. DOI:10.1016/S0168-9452(00)00385-X |
Schliemann W, Cai Y, Degenkolb T, et al. 2001. Betalains of Celosia argentea. Phytochemistry, 58: 151-165. |
Schwinn K E, Venail J, Shang Y, et al. 2006. A small family of MYB-regulatory genes controls floral pigmentation intensity and patterning in the genus Antirrhinum. Plant Cell, 18: 831-851. DOI:10.1105/tpc.105.039255 |
Shimada N, Nakatsuka T, Nishihara M, et al. 2006. Isolation and characterization of a cDNA encoding polyketide reductase in Lotus japonicus. Plant Biotechnol, 23: 509-513. DOI:10.5511/plantbiotechnology.23.509 |
Springob K, Nakajima J, Yamazaki M, et al. 2003. Recent advances in the biosynthesis and accumulation of anthocyanins. Nat Prod Rep, 20: 288-303. DOI:10.1039/b109542k |
Strack D, Vogt T, Schliemann W. 2003. Recent advances in betalain research. Phytochemistry, 62: 247-269. DOI:10.1016/S0031-9422(02)00564-2 |
Suzuki K, Xue H, Tanaka Y, et al. 2000. Flower color modifications of Torenia hybrida by cosuppression of anthocyanin biosynthesis genes. Molecular Breeding, 6(3): 239-246. DOI:10.1023/A:1009678514695 |
Suzuki S, Nishihara M, Nakatsuka T, et al. 2007. Flower color alteration in Lotus Japonicus by modification of the carotenoid biosynthetic pathway. Plant Cell Rep, 26(7): 951-959. DOI:10.1007/s00299-006-0302-7 |
Tanaka Y, Katsumoto Y, Brugliera F, et al. 2005. Genetic engineering in floriculture. Plant Cell, Tissue and Organ Culture, 80: 1-24. DOI:10.1007/s11240-004-0739-8 |
Tanaka Y, Ohmiya A. 2008a. Seeing is believing:Engineering anrhocyanin and carotenoid biosynthetic pathways. Curr Opin Biotechnol, 19: 190-197. DOI:10.1016/j.copbio.2008.02.015 |
Tanaka Y, Sasaki N, Ohmiya A. 2008b. Biosynthesis of plant pigments:anthocyanins, betalains and carotenoids. Plant J, 54: 733-749. DOI:10.1111/j.1365-313X.2008.03447.x |
Tanaka Y, Tsuda S, Kusumi T. 1998. Metabolic engineering to modify flower color. Plant & Cell Physiology, 11: 1119-1126. |
Tian L, Musetti V, Kim J, et al. 2004. The Arabidopsis LUT1 locus encodes a member of the cytochrome P450 family that is required for carotenoid epsilon-ring hydroxylation activity. Proc Natl Acad Sci USA, 101(1): 402-407. DOI:10.1073/pnas.2237237100 |
Toyama J, Terahara N, Adachi T. 1992. Identification of betalain pigments and the changes of HPLC pattern during developmental stages in some Portulaca genotypes. Breed Science, 42: 330-331. |
van Blokland R, de Lange P, Mol J N M, et al.1993.Modulation of gene expression in plants by antisense genes//Crooke S T, Lebeleu B.Antisense Research and Applications.London: CRC Press, 125-148.
|
van der Krol A R, Lenting R J, Veenstra J G, et al. 1988. An antisense chalcsynthase gene in transgenetic plants inhibits flower pigmentation. Nature, 333: 860-869. |
van Tunen A J, Hartmen S A, Mur L A, et al. 1989. Regulation of chalcone flavone isomerase(CHI)gene expression in Petunia hybrida:the use of alternative promoters in corolla, anther and pollen. Plant Mol Biol, 12: 539-551. DOI:10.1007/BF00036968 |
Welle R, Schriider G, Schiltz E, et al. 1991. Induced plant responses to pathogen attack:analysis and heterologous expression of the key enzyme in the biosynthesis of phytoalexins in soybean (Glycine max L. Merr. cv. Harosoy 63). Eur J Biochem, 196: 423-430. DOI:10.1111/ejb.1991.196.issue-2 |
Yang J B, Tian X, Li D Z, et al. 2003. Molecular composition and evolution of the chalcone synthase (CHS) gene family in five species of Camellia (Theaceae). Acta Botanica Sinica, 45(6): 659-666. |
Ye X, Al-Babili S, Kloti A, et al. 2000. Engineering the provitamin A (beta-carotene) biosynthetic pathway into (carotenoid-free) rice endosperm. Science, 287: 303-305. DOI:10.1126/science.287.5451.303 |
Yoshida H, Itoh Y, Ozeki Y, et al. 2004. Variation in chalcononaringenin 2-O-glucoside content in the petals of carnations (Dianthus caryophyllus) bearing yellow flowers. Scientia Horticulturae, 99: 175-186. DOI:10.1016/S0304-4238(03)00093-1 |
Zhu C, Yamamura S, Nishihara M, et al. 2003. cDNAs for the synthesis of cyclic arotenoids in petals of Gentiana lutea and their regulation during flower development. Biochim Biophys Acta, 1625(3): 305-308. DOI:10.1016/S0167-4781(03)00017-4 |
Zuker A, Tzfira T, Ben-Meir H, et al. 2002. Modification of flower color and fragrance by an tisense suppression of the flavanone 3-hydroxylase gene. Molecular Breeding, 9(1): 33-41. DOI:10.1023/A:1019204531262 |
 2009, Vol. 45
2009, Vol. 45

