文章信息
- 杨春霞, 李火根, 程强, 陈英.
- Yang Chunxia, Li Huogen, Cheng Qiang, Chen Ying
- 南林895杨抗旱耐盐基因DREB1C的转化
- Transformation of Drought and Salt Resistant Gene (DREB1C) in Populus×euramericana cv. Nanlin 895
- 林业科学, 2009, 45(2): 17-21.
- Scientia Silvae Sinicae, 2009, 45(2): 17-21.
-
文章历史
- 收稿日期:2008-01-21
-
作者相关文章
2. 江西省林业科学院 南昌 330032
2. Jiangxi Academy of Forestry Nanchang 330032
世界范围内土壤盐碱化和荒漠化的问题严重影响了农林业生产的可持续发展,培育农林抗逆新品种已成发展趋势。相对于常规育种途径,基因工程育种可快速获得抗逆新品种(王敏杰等,2002)。杨树生长快、适应性广,是工业用材及防护林建设的重要造林树种。迄今已对杨树进行了转耐旱基因(张冰玉等,2005;李义良等,2007)及转耐盐基因(樊军锋等,2002;王亮等,2007)研究,并在一定程度上提高了杨树的耐旱或耐盐性。但是,单基因的转化仅能改良植物单方面抗性,要想改良植物多方面的抗性,一般需转入多价抗性基因或多次转入抗性基因,但存在操作方法较烦琐,多价表达载体容量有限、目的基因易丢失或沉默等问题(刘志等,2001)。
目前,植物抗逆基因研究较多的是脱水应答元件DREB(dehydration responsive element)类基因。该类基因编码一类与逆境胁迫相关的转录因子DREB,能够识别与干旱、高盐及低温等胁迫应答相关基因启动子区域中的DRE顺式作用元件并与之结合,启动其下游抗逆基因的表达,从而提高植物多方面的抗逆性(王少侠等,2004)。DREB1C为DREB类转录因子的一种,从拟南芥(Arabidopsis thaliana)cDNA文库中克隆获得(Liu et al., 1998)。有关DREB类基因在提高植物抗逆性方面已有成功报道(Kasuga et al., 1999; 2004; Pellegrineschi et al., 2004; Agarwal et al., 2006),但在杨树转化中还未见报道。本研究利用农杆菌介导法将DREB1C基因转入南林895杨(Populus×euramericana cv. Nanlin895)中,以期获得抗逆性综合改良的转基因杨树植株。
1 材料与方法 1.1 受体材料、目的基因与表达载体南林895杨为南京林业大学林木遗传与基因工程省部共建教育部重点实验室提供的组培苗。根癌农杆菌(Agrobacterium tumefaciens)GV3101与植物表达载体pDR2(携带目的基因DREB1C,该基因从拟南芥基因组克隆)由中国科学院遗传与发育生物学研究所提供。
1.2 潮霉素本底浓度的确定选取生长状态良好的南林895杨组培苗,取其顶部往下第3—5片完全伸展、大小形状及色泽一致的叶片,去除主脉和叶边缘,剪成0.5 cm×1.0 cm大小的叶盘,分别接种到潮霉素质量浓度为0、1、3、5、7 mg·L-1的分化培养基上,每15 d换1次培养基,50 d后统计观察结果;将再生小苗接种到潮霉素质量浓度为0、0.5、1、1.5、2 mg·L-1的生根培养基中,1月后观察并统计结果,以确定生根本底浓度。
1.3 遗传转化与转基因植株获得选取生长大约4周左右且状态良好的南林895杨的叶片,去除主脉和叶边缘,将其剪成大小一致的叶盘,放入分化培养基中黑暗预培养3 d;同时制备农杆菌侵染液,使其OD600=1.0~1.3,然后将预培后的叶盘浸入制备好的侵染液中侵染20 min,期间不断地摇动使叶盘与菌液充分接触;取出叶盘用无菌滤纸吸干多余菌液,放回原培养基中,黑暗共培养4 d后转至筛选培养基中;每15 d换1次培养基,待可见芽出现,再把叶盘转至芽伸长培养基,芽长至1~2 cm时转入生根培养基诱导生根。
1.4 转基因植株的分子检测 1.4.1 PCR检测转基因杨树DNA提取按植物基因组DNA提取试剂盒(购自TIANGEN公司)说明操作。引物根据NCBI上报道的DREB1C基因序列设计,由上海英俊生物公司合成。DREB1C基因上游引物序列为5′-ATG TTT GGC TCC GAT TAC GAG T-3′;下游引物序列为5′-GAC CAT GAG CAT CCG TCG TC-3′。扩增反应体系20 μL:DNA模板1 μL,2 μL 10×buffer,1.3 μL Mg2+(25 mmol·L-1),1.5 μL dNTP(2.5 mmol·L-1),上下游引物(10 μmol·L-1)各1 μL,0.1 μL rTaq酶(5 U·μL-1),超纯水补足20 μL。扩增反应条件:94 ℃预变性5 min;94 ℃ 30 s,58 ℃ 1 min,72 ℃ 45 s,35个循环;72 ℃延伸10 min。
1.4.2 实时定量PCR检测转基因植株的实时定量PCR分别从DNA水平和RNA水平两方面来做,比较外源基因转入植物体内及其在体内表达的差异。选取6株阳性转基因无性系的DNA为模板进行实时定量PCR,同时以未转基因植株(CK)和无模板超纯水(NTC)作为对照,并且每个样品设置4次重复。20 μL反应体系:10 μL 2×SYBR green,上下游引物各1 μL,3 μL DNA,5 μL超纯水。实时定量PCR在Applied Biosystems 7500 Real-time PCR System上进行操作,反应条件为50 ℃ 2 min,95 ℃ 10 min,后40个循环为95 ℃ 15 s,60 ℃ 1 min。
转录水平的实时定量PCR,转基因杨树RNA的提取按RNA提取试剂盒(购自Qiagen公司)说明操作,反转录PCR反应体系20 μL:8 μL RNA模板(浓度不同,补水至8 μL),1 μL Radom 6 primer(0.5 μg·μL-1),4 μL 5×buffer,2.5 μL Mg2+(2.5 mmol·L-1),1 μL dDNT mix(10 mmol·L-1),0.5 μL Ribo nuclease inhibitor(40 U·μL-1),1 μL improm Ⅱ反转录酶(promega)。反应条件为:25 ℃ 5 min,42 ℃ 60 min,70 ℃ 15 min。实时定量PCR反应体系及条件同上。
基因特异性引物采用PCR检测时使用的引物(见1.4.1),DNA水平和cDNA水平扩增均采用杨树编码延伸因子β亚基(elongation factor 1-beta,EF1β)基因作为内对照基因(GenBank accession No.BI125345)。
1.5 转基因植株的抗旱性检测转化植株叶片相对含水量(RWC)的测定参照王韶唐(1986)的方法进行。抗旱性检测是在无菌条件下用PEG-6000对转基因杨树进行干旱胁迫,设置了6个梯度,分别是0、50、100、150、200、250 g·L-1(用1/2MS液体培养基配制),每个梯度设置3次重复,2周后观察植株的萎蔫情况。
1.6 转基因植株耐盐性检测耐盐性试验在无菌条件下进行,在2种盐浓度梯度(150、200 mmol·L-1)下对转基因植株进行胁迫,同时以非转基因植株为对照,4周后观察萎蔫情况。
1.7 转基因植株与未转基因植株的表型差异转基因植株与未转基因植株同时生长5周左右,观察2种植株表型上的差异,看是否存在矮化现象。
2 结果与分析 2.1 潮霉素本底浓度的确定确定抗生素浓度的原则是抗生素的浓度能有效抑制非转化细胞的生长,使之慢慢死亡,而不是直接杀死非转化细胞,因为其周围的非转化细胞对转化细胞有滋养作用,单独的转化细胞生长能力太弱很难形成转化体。潮霉素对叶片分化的筛选浓度,当潮霉素质量浓度为0时,叶片切口正常分化不定芽;加大潮霉素质量浓度到3 mg·L-1时,叶片分化不定芽的数量急剧减少,20 d后芽点逐渐黄化,死亡;潮霉素质量浓度加至5 mg·L-1时,叶片黄化,没有不定芽分化,故叶片分化的潮霉素临界浓度定为3 mg·L-1。
潮霉素对南林895杨不定芽生根诱导也有很大影响。30 d后,对照生根率100%,且根粗壮;当潮霉素质量浓度加到1.5 mg·L-1时,生根率降至11.11%,生根的芽长势较弱,根较短较细,且生根的芽呈现黄化状态;继续加大潮霉素质量浓度至2 mg·L-1,生根率为0,未生根的小芽黄化死亡。故南林895杨不定芽生根诱导的潮霉素临界质量浓度为1.5 mg·L-1。
2.2 转基因再生植株的获得经3 mg·L-1潮霉素筛选获得的抗性芽长至1~2 cm时,将其转移到加有1.5 mg·L-1潮霉素的生根培养基中进行抗性植株的生根筛选,获得南林895杨转基因再生植株80株。
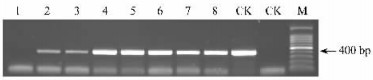
2.3 潮霉素抗性植株的分子检测 2.3.1 抗性植株的PCR分析用DREB1C基因序列设计的上下游引物,以质粒为阳性对照,未转基因895杨为阴性对照,对获得的抗性转化株进行PCR扩增结果表明(图 1):阳性的转DREB1C基因的895杨检测出与目标基因(422 bp)大小相同的扩增条带。检测的80株抗性植株中有30株为阳性,检测的阳性率占供检植株的37.5%。
|
图 1 转基因杨树DREB1C基因的PCR检测 Figure 1 PCR detection of transgenic poplar of DREB1C gene M: 100 bp ladder; 1~8:转化植株Transgenic plants; CK+:阳性对照Positive control; CK-:阴性对照Negative control. |
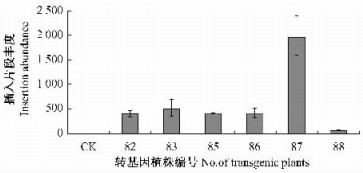
由于实时定量PCR可以准确定量地检测起始模板DNA浓度,因此被广泛应用于基因表达分析和转基因植物插入拷贝数目的鉴定。在本研究中,使用实时定量PCR的方法对转基因南林895杨基因组DNA进行了分析,数据处理采用相对量方法,未进行转化的南林895杨设定为1,以此来衡量转化植株中T-DNA插入片段的丰度,进而初步估计不同转基因植株之间插入拷贝数的相对差异(图 2)。
|
图 2 实时定量PCR检测插入片段丰度 Figure 2 Real-time PCR detection of insertion abundance CK:未转基因杨树Non-transgenic plant; 82、83、85~88:转化植株Transgenic plants. |
由图 2可知,在6个转化植株中,插入片段的丰度出现了明显的差异。转化植株插入片段丰度最低的是88号,是非转化植株的71.52倍;插入片段丰度最高的是87号,是非转化植株的1 948.12倍;其他4个转化植株插入片段丰度无明显差异,大小介于两者之间。不难看出,外源基因在南林895杨中插入片段丰度存在很大差异。
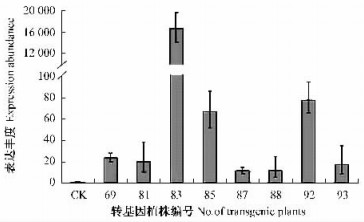
2.3.3 实时定量RT-PCR和半定量RT-PCR检测转入DREB1C基因表达采用RNA试剂盒的方法分别提取转化植株编号为69、81、83、85、87、88、92、93及未转基因植株(CK)的RNA,然后将其反转录为cDNA,以其为模板进行实时定量PCR(图 3)。同时以cDNA为模板进行PCR反应,电泳结果见图 4。
|
图 3 实时定量PCR检测插入片段表达丰度 Figure 3 Real-time PCR detection of expression abundance of insert segments |

|
图 4 转基因植株反转录PCR Figure 4 Reverse transcription PCR of transgenic plants |
插入片段DREB1C在南林895杨中的表达见图 3。插入片段在植物体内表达量最高的是83号,是未转化植株的16 509.06倍;其次是92号和85号,分别是未转化植株的77.82和66.65倍;69号、81号及93号插入片段的表达量大致相当,分别是未转化植株的23.79、20.00和17.20倍;87号和88号表达量最低,分别是未转化植株的11.57和11.43倍,且大小相当。反转录PCR结果(图 4)中,83号最亮,说明DREB1C基因在其体内表达最强,与实时定量PCR结果一致,间接证明了以cDNA为模板进行实时定量PCR的准确性。
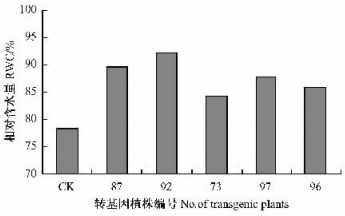
2.4 转基因植株的抗旱性检测 2.4.1 转基因植株的相对含水量测定相对含水量(RWC)反映了植物体内水分亏缺的程度,抗旱性强的品种有较强的保水能力,自身水分调节能力较强,因而能维持较高的RWC。由图 5可知,转DREB1C基因杨树的RWC均在80%以上,明显高于CK(78.3%),其中样品87和样品92的RWC最高,分别为89.5%和92.1%。这说明转DREB1C基因杨树的综合保水能力强于未转基因植株。
|
图 5 转DREB1C基因杨树叶片相对含水量 Figure 5 Relative water content of transgenic poplar for DREB1C gene |
转基因植株和对照植株在不同浓度的PEG-6000处理2周后表现出明显差异。在PEG-6000浓度为0时,转基因植株和对照植株无差别;50 g·L-1 PEG-6000处理时,差别不大;100 g·L-1 PEG-6000处理时,对照植株稍微枯黄,转基因植株生长正常;150 g·L-1 PEG-6000处理时,对照植株枯黄,转基因植株稍微发黄;200 g·L-1 PEG-6000处理时,对照植株死亡,转基因植株除了顶端发绿外,其他部位的叶片均枯死;250 g·L-1 PEG-6000处理时,对照植株和转基因植株均枯死。由此可见,植株对PEG的抗性随PEG浓度的增加而减弱,但与对照植株相比,转基因植株的抗旱性减弱较慢。转基因植株对PEG-6000的抗性可高达200 g·L-1。
2.5 转基因植株的抗盐性将4周大的对照植株和转基因植株分别放入NaCl浓度为150 mmol·L-1的1/2MS液体培养基,4周后萎蔫情况见图 6。对照株在盐的胁迫下顶端已经枯死,而转基因植株虽然也有枯黄现象,但植株仍能正常生长,说明转基因植株在150 mmol·L-1盐浓度下的抗性高于对照株。

|
图 6 转基因杨树抗NaCl试验 Figure 6 NaCl resistance of transgenic poplar 1, 3: CK未转基因杨树Non-transgenic plant; 2, 4:转基因杨树Transgenic plant; 1, 2: 150 mmol·L-1 NaCl; 3, 4: 200 mmol·L-1 NaCl |
加大NaCl的浓度到200 mmol·L-1,转基因植株与对照植株2周后就出现差异。由图 6可以看出,对照株茎段大部分已经枯死,只有顶端呈绿色,而转基因植株整个植株都呈绿色,仍能正常生长。由此不难看出,转基因植株对NaCl的抗性高于对照株。
2.6 转基因杨树的表型变异观察生长5周左右的转基因杨树和对照株,发现2种转基因植株和对照植株表型没有区别,35S启动子启动目的基因DREB1C表达的转基因植株的高度和对照株相当,即转基因植株没有出现矮化现象。
3 讨论本试验所用的筛选标记是潮霉素磷酸转移酶基因(HPTⅡ),其表达产物对潮霉素有抗性,故潮霉素本底浓度的选择是遗传转化的关键。在以往的杨树转化试验中,大多数是用卡那霉素来筛选转化体(王树耀等,2005;诸葛强等,2006),这是因为潮霉素对植物的伤害较大,过高的潮霉素浓度会杀死植物,过低的潮霉素浓度起不到选择压的作用。本试验采用的叶盘分化与生根培养基中的潮霉素本底浓度略低于理论值,虽然增大了产生假阳性的可能,但可以防止阳性转化体的逃逸,并且假转化体又可对阳性转化体起到滋养作用,促进其生长。假阳性植株可通过后期强度选择进行控制。
实时定量PCR可以检测外源基因的丰度及在植物体内的转录水平。本试验用实时定量PCR方法分别以DNA为模板来检测外源基因的丰度,即相对拷贝数,以cDNA为模板来检测外源基因表达丰度,结果发现,二者之间不存在正相关关系,即外源基因插入植物体内的丰度高,其在植物体内的表达丰度不一定高(图 2,图 3)。究其原因,可能是插入的外源基因在后期筛选中逐渐丢失;也可能插入的外源基因不表达(即基因沉默)等。
对拟南芥的研究表明,DREB转录因子家族是抗逆适应过程中主要成分之一(Shinozaki et al., 2003)。DREB基因的组成型表达诱导下游抗性基因的组成型表达,在逆境刺激下增加转基因植物的抗逆性(Gilmour et al., 2000)。本试验将由组成型启动子35S启动DREB1C基因表达的载体转入南林895杨中,通过实时定量PCR方法检测,初步证明DREB1C基因在某些转基因杨树体内高表达,高表达的转基因杨树的抗旱性和抗盐性均优于未转基因杨树,并且用该启动子并没有出现矮化现象,这与以往的报道不一致(Hsieh et al., 2002a;2002b)。有关转基因植物矮化的机制,很多研究者对其进行了研究,但到目前为止,矮化机制还存在争议。当然,要深入了解DREB1C基因在转基因杨树中的表达情况,尚需开展转基因植株相关的生理生化研究,这是下一步的研究重点之一。
樊军锋, 韩一凡, 李玲, 等. 2002. 84K杨树耐盐基因转化研究. 西北林学院学报, 17(4): 33-37. DOI:10.3969/j.issn.1001-7461.2002.04.009 |
李义良, 苏晓华, 张冰玉, 等. 2007. 外源SacB基因在银腺杂种杨基因组中的表达及抗旱性分析. 北京林业大学学报, 29(2): 1-5. |
刘志, 袁小玲, 张天真. 2001. 获得多价转基因作物的策略. 遗传, 23(2): 182-186. DOI:10.3321/j.issn:0253-9772.2001.02.022 |
王亮, 苏乔, 安利佳. 2007. 甜菜碱醛脱氢酶基因转化速生杨107的研究. 安徽农业科学, 35(4): 1000-1001. DOI:10.3969/j.issn.0517-6611.2007.04.037 |
王敏杰, 卢孟柱. 2002. 林木基因工程育种现状与发展趋势. 世界林业研究, 15(3): 7-13. DOI:10.3969/j.issn.1001-4241.2002.03.002 |
王韶唐. 1986. 植物生理学实验指导. 西安: 陕西科学技术出版社, 149-151.
|
王少侠, 王振英, 彭永康. 2004. DREB转录因子及其在植物抗逆中的作用. 植物生理学通讯, 40(1): 7-13. |
王树耀, 陈其军, 王文龙, 等. 2005. 转OsNHX1基因耐盐84K杨的培育. 科学通报, 50(2): 140-144. DOI:10.3321/j.issn:0023-074X.2005.02.007 |
张冰玉, 苏晓华, 黄秦军, 等. 2005. 转果聚糖蔗糖转移酶基因银腺杨的获得. 林业科学, 41(3): 48-53. DOI:10.3321/j.issn:1001-7488.2005.03.008 |
诸葛强, 房丹, 李秀芬, 等. 2006. 美洲黑杨杂种优良无性系转抗虫基因(Bt和CpTI)的研究. 分子植物育种, 4(6): 819-824. DOI:10.3969/j.issn.1672-416X.2006.06.010 |
Agarwal P K, Agarwal P, Reddy M K, et al. 2006. Role of DREB transcription factors in abiotic and biotic stress tolerance in plants. Plant Cell Rep, 25(12): 1263-1274. DOI:10.1007/s00299-006-0204-8 |
Gilmour S J, Sebolt A M, Salazar M P, et al. 2000. Overexpression of the Arabidopsis CBF3 transcriptional activator mimics multiple biochemical changes associated with cold acclimation. Plant Physiol, 124: 1854-1865. DOI:10.1104/pp.124.4.1854 |
Hsieh T H, Lee J T, Charng Y Y, et al. 2002a. Tomato plants ectopically expressing Arabidopsis CBF1 show enhanced resistance to water deficit stress. Plant Physiol, 130: 618-626. DOI:10.1104/pp.006783 |
Hsieh T H, Lee J T, Yang P T, et al. 2002b. Heterology expression of the Arabidopsis C-repeat/dehydration response element binding factor 1 gene confers elevated tolerance to chilling and oxidative stresses in transgenic tomato. Plant Physiol, 129: 1086-1094. DOI:10.1104/pp.003442 |
Kasuga M, Liu Q, Miura S, et al. 1999. Improving plant drought, salt and freezing tolerance by gene transfer of a single stress-inducible transcription factor. Nat Biotechnol, 17: 287-291. DOI:10.1038/7036 |
Kasuga M, Miura S, Shinozaki K, et al. 2004. A combination of the Arabidopsis DREB1A gene and stress-inducible rd29A promoter improved drought- and low-temperature stress tolerance in tobacco by gene transfer. Plant and Cell Physiology, 45(3): 346-350. DOI:10.1093/pcp/pch037 |
Liu Q, Kasuga M, Sakuma Y, et al. 1998. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain, separate two cellular signal transduction pathways in drought- and low temperature-responsive gene expression, respectively, in Arabidopsis. Plant Cell, 10: 1391-1406. DOI:10.1105/tpc.10.8.1391 |
Pellegrineschi A, Reynolds M, Pacheco M, et al. 2004. Stress-induced expression in wheat of the Arabidopsis thaliana DREBlA gene delays water stress symptoms under greenhouse conditions. Genome, 47: 493-500. DOI:10.1139/g03-140 |
Shinozaki K, Yamaguchi-Shinozaki K, Seki M. 2003. Regulatory network of gene expression in the drought and cold stress responses. Curr Opin Plant Biol, 6: 410-417. DOI:10.1016/S1369-5266(03)00092-X |
 2009, Vol. 45
2009, Vol. 45

