文章信息
- 李昌晓, 钟章成, 陶建平.
- Li Changxiao, Zhong Zhangcheng, Tao Jianping
- 不同水分条件下池杉幼苗根系的苹果酸、莽草酸含量及生物量
- Malic Acid, Shikimic Acid, and Biomass Accumulation in the Roots of Taxodium ascendens Seedlings under Different Soil Water Conditions
- 林业科学, 2008, 44(10): 1-7.
- Scientia Silvae Sinicae, 2008, 44(10): 1-7.
-
文章历史
- 收稿日期:2007-05-08
-
作者相关文章
2. 三峡库区森林生态保护与恢复重庆市市级重点实验室 重庆 400036
2. Chongqing Key Laboratory for the Protection and Restoration of Forest Ecology of the Three Gorges Reservoir Region Chongqing 400036
三峡水库“蓄清排浑”的运行方式使得每年汛期(6—9月)的库水位降至145 m,汛期过后库水位升至175 m(刁承泰等,1999)。由此形成的消落带将因淹水变化而导致土壤含水量梯度性变化。消落带土壤含水量的这种梯度性变化势必影响到适生造林树种池杉(Taxodium ascendens)的生长发育及其生理生态学特性,其根系代谢过程以及生长将很可能发生某些适应性变化。在逆境胁迫条件下,植物重要中间代谢产物含量的变化,特别是苹果酸、莽草酸等含量的增加,基本上被公认为是植物对逆境条件的一种适应性生理生化响应(刘友良,1992;钟章成,1988)。植物苹果酸、莽草酸等次生代谢物质含量的增加,一方面可以避免乙醇等有毒物质的伤害;另一方面可以为合成其他类物质提供资源(Tesfaye et al., 2001;Visser et al., 2003)。国内外已经对该树种的生物学特征(曹福亮等,1995;汪企明等,1995)、生长发育规律(吴祖映等,1995;1996;汪企明等,1998)以及光合特性(李昌晓等,2005)等方面进行过报道,但对于不同土壤水分条件特别是三峡库区消落带水位变化条件下池杉树种的代谢及生长却鲜有报道。本研究试图通过模拟消落带土壤水分变化,了解池杉幼苗根部苹果酸、莽草酸及生物量变化,从生理生化角度来认识池杉树种的物质代谢适应机制以及生长响应,以期为三峡库区消落带植被恢复建设提供技术和理论支持,同时还可为其他水淹地或滩地的池杉造林提供相应技术指导。
1 材料与方法 1.1 树种和试验地点选择池杉当年实生幼苗作为研究对象。2004年6月中旬将生长基本一致的120株幼苗带土盆栽(土壤为紫色土),每盆1株。盆中央内径为13 cm,盆内土层厚度12 cm。将所有盆栽试验用苗置于原西南师范大学生态试验园地中(海拔249 m),进行相同土壤基质、光照和水分管理适应,于2004年7月25日搭建透明塑料遮雨棚,开展试验。
1.2 试验设计将试验用苗随机分成4组,每组30盆,包括对照组(CK)、轻度干旱组(T1)、水分饱和组(T2)和水淹组(T3):CK即为常规生长组,土壤含水量为田间持水量的60%~63%(土壤含水量采用称重法测定),池杉幼苗在晴天无萎蔫现象;T1组为轻度干旱水分胁迫,土壤含水量为田间持水量的47%~50%,植株嫩叶在晴天13:00左右出现萎蔫,17:00左右恢复正常(胡新生等,1998;胡哲森等,2000);T2组为土壤表面一直处于潮湿状态的水饱和土壤;T3组苗木根部土壤全部被淹没,淹水超过土壤表面1 cm(水淹处理时,将30个苗盆放入直径68 cm、高22 cm的大型塑料盆内,然后向盆内注水,直到盆内水面超过土壤表面1 cm为止)(Bragina et al., 2001)。
从试验处理之日算起,每隔5 d为一个处理期,对各项指标连续进行5次测定,每个处理每次测定5个重复,最后取5次测定的平均值作为比较结果。2004年8月25日结束试验。
1.3 根系生物量的测定将每株根系分别按主、侧根2部分取样,随后立即放入80 ℃烘箱中烘干至恒重,用分析天平称量根系质量。总根生物量指每株主、侧根2部分以干质量计的生物量之和。
1.4 根系苹果酸、莽草酸含量的测定参照高智席等(2005)的方法,采用离子抑制-反相高效液相色谱(ion-suppression reversed-phase high performance liquid chromatography,简称ISRP-HPLC),用HClO4 (pH=2.5)溶液作流动相,在国产Hypersil ODS2 5 μm(4.6 mm×150 mm)色谱柱上进行测定。检测器为Agilent 1100二极管阵列多波长检测器,流动相流速0.8 mL·min-1;检测波长214 nm,带宽4 nm;参比波长300 nm,带宽80 nm;柱温30 ℃, 进样量20 μL。98.5%的分析纯苹果酸标样由上海化学试剂研究所提供,98.5%的分析纯莽草酸标样(Fluka,Cat No.: S5375-10MG)由北京舒伯伟化工仪器有限责任公司提供。
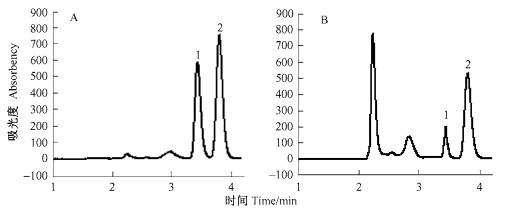
溶液制备时,向事先称取好的主、侧根样品中加入少量去离子水,分别研磨至匀浆,转入25 mL具塞试管中定容至10 mL。然后在80 ℃恒温条件下水浴30 min,静置、冷却。取上清液转入5 mL离心试管,8 000 r·min-1离心10 min。最后取上清液,用孔径为0.45 μm的注射式过滤器(美国Millipore)过滤。滤液用1.5 mL离心试管盛装,用高效液相色谱分析苹果酸与莽草酸含量。标样和样品色谱图见图 1。
|
图 1 标样(A)和样品(B)色谱图 Figure 1 Chromatograms of standard sample (A) and sample (B) 1.苹果酸Malic acid;2.莽草酸Shikimic acid. |
主根、侧根苹果酸与莽草酸含量分别以每克主根、侧根干物质含有的苹果酸、莽草酸毫克数计(mg·g-1);总根苹果酸与莽草酸含量指由主根、侧根组成的根系整体所含有的苹果酸、莽草酸平均含量(mg·g-1)。
1.5 统计分析根据测定生理指标,将水分处理作为独立因数,用一元方差分析(one-way ANOVA)揭示水分变化对池杉生理特征的影响(GLM程序,SPSS 10.0版)。用Duncan检验法进行多重比较,检验每个生理指标在处理间(α=0.05)的差异显著性(杜荣骞,2003)。
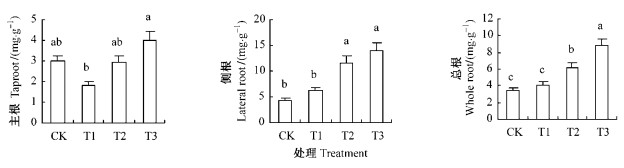
2 结果与分析 2.1 根系苹果酸含量池杉幼苗各处理组随着水分处理时间的延长,根系各部分苹果酸含量表现出不同的变化趋势(表 1、图 2)。T1组主根苹果酸含量在整个处理期间始终处于CK组及其以下水平, 其平均值低于CK组达39.5%,这与T3组主根苹果酸含量平均值高于CK组34.2%形成明显对照。T2组主根苹果酸含量变化界于T1与T3组之间,与CK组相比并未出现显著差异。
|
|
|
图 2 不同处理下的苹果酸含量 Figure 2 Malic acid content under different treatments 不同字母表示不同处理组之间差异显著(P =0.05),下同。 The values with different letters are significantly different at the 0.05 level, the same below. |
与主根变化有所不同的是,T1组侧根苹果酸含量在整个试验期内始终处于CK组及其以上水平, 但其平均值并未与CK组表现出显著性差异;然而,T3组侧根的苹果酸含量在整个试验期间一直显著高于CK组1.5~2.9倍。T2、T3组侧根的苹果酸含量平均值均显著高于CK和T1组。
在整个试验期内,总根苹果酸平均含量以T3组最高,其次为T2组,2者均极显著地高于CK和T1组(各组间的P<0.01),T3组依次分别高出CK、T1组1.5和1.2倍,T2组则依次分别高出0.8和0.5倍。对总根而言,T1与CK组之间并无显著差异存在(P=0.239)。
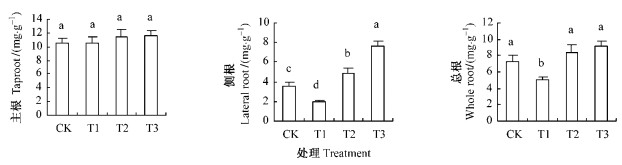
2.2 根系莽草酸含量不同水分条件对各组主根、侧根和总根莽草酸含量的影响不同(表 1、图 3)。随着水分处理时间的延长,池杉幼苗T1、T2和T3组主根莽草酸含量均表现出先升后降的的变化趋势,与CK组先降后升的变化趋势刚好相反,但4组的主根莽草酸含量在整个试验期间的平均值相互之间均无显著差异(图 3)。
|
图 3 不同处理下的莽草酸含量 Figure 3 Shikimic acid content under different treatments |
在整个试验期间,T3组侧根莽草酸含量一直处于CK组及其以上水平,与T1组一直处于CK组及其以下水平正好相反。从而使得T3组侧根莽草酸含量平均值显著高出CK组1.1倍, 与T1组显著低于CK组0.5倍形成反差。T2组侧根莽草酸含量变化则界于T1与T3组之间,其平均值也显著高出CK组0.4倍。
总根莽草酸含量在T2和T3组的平均值虽然分别高出CK组,但并未与之达到显著差异的程度(T3与CK组P=0.068;T2与CK组P=0.267);截然相反,T1组则显著低于CK组达30%(P=0.036)。
2.3 根系生物量不同水分处理对池杉幼苗主根、侧根和总根生物量的影响程度存在差异(表 1、图 4)。与CK组各对应部分相比,T2组主根、侧根以及总根的生物量尽管分别均未表现出显著差异性,但却分别显著低于T1和T3组各对应部分。T1组主根、侧根和总根的生物量与T3组各对应部分相比均无差异性显著,但却显著高出CK组的侧根与总根生物量,分别高出0.7和0.5倍(图 4)。虽然T3组主根、侧根以及总根的生物量均比CK组偏大,但并未与之分别达到显著差异的程度(各比较间的P<0.05)。
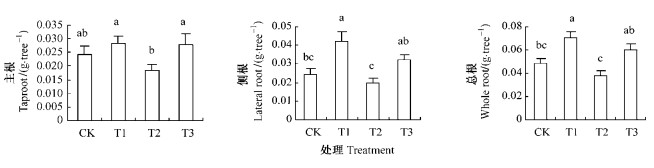
|
图 4 不同处理下的根系生物量 Figure 4 Root biomasses under different treatments |
池杉幼苗T1组主根与侧根生物量之间有显著差异存在(P=0.014),但其余3组主根与侧根生物量之间均无显著差异存在(CK组P=0.987;T2组P=0.864;T3组P=0.450)。
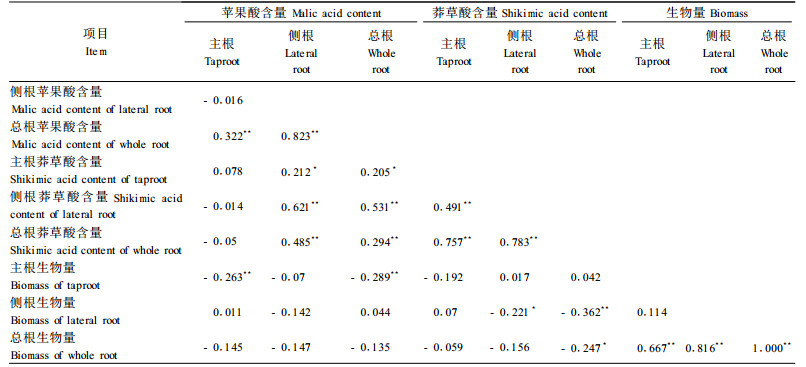
2.4 根系代谢与根系生物量相关性分析相关性分析(表 2)显示,池杉主根、侧根苹果酸平均含量分别与总根苹果酸平均含量表现出极显著正相关,而主根与侧根苹果酸含量之间却并未表现出显著相关性。但是,主根、侧根莽草酸含量不仅分别与总根莽草酸平均含量有极显著正相关,而且2者之间还具有极显著的相关性。侧根、总根苹果酸含量分别与侧根和总根的莽草酸含量表现出极显著正相关。
|
|
主根与侧根生物量之间并未表现出显著相关性,但2者却与总根生物量均达到极显著正相关。侧根生物量与侧根苹果酸含量、总根生物量与总根苹果酸含量之间分别均未表现出显著的相关性。与之相反,侧根生物量与侧根莽草酸含量、总根生物量与总根莽草酸含量之间分别表现出显著的负相关性。
3 结论与讨论池杉属杉科(Taxodiaceae)落羽杉属(Taxodium),耐湿性很强,长期在水中也能正常生长,与同属的落羽杉(Taxodium distichum)树种所表现出来的这些特性非常类似(Middleton et al., 2005;Randall et al., 2005)。本试验发现,在T3和T2组,池杉幼苗总根苹果酸含量均显著高出CK组,主要是因为侧根苹果酸含量显著增加所致。这预示着池杉幼苗显著增加侧根、进而增加总根苹果酸含量是适应根部淹水变化的有效途径之一。有些耐涝植物如桦木属(Betula)植物、蚊母草(Veronica peregrina)等,PEP(磷酸稀醇式丙酮酸)羧化形成草酰乙酸,草酰乙酸还原为苹果酸,由于体内缺乏苹果酸脱氢酶或它的活性受水涝的抑制,苹果酸不能转变为丙酮酸和乙醇,从而积累于根细胞液泡中,或通过维管束系统运至地上部参与正常有氧代谢,当土壤通气条件改善后,积累于根细胞液泡中的苹果酸也可再次利用,且无能量和碳源的浪费(刘友良,1992)。在T1组,池杉幼苗主根、侧根以及总根苹果酸含量总均值均维持在CK组的正常水平,由此证实池杉幼苗具有较强的苹果酸代谢调控能力,能积极地对轻度干旱的水分条件作出适应性响应。根部苹果酸代谢生理显示出池杉幼苗具有一定的耐旱能力,先前光合生理研究也表征出池杉幼苗具有耐旱特征(李昌晓等, 2005)。
与主根苹果酸含量变化有些类似,T2和T3组主根的莽草酸含量与CK组相比也未表现出显著差异性。由于2者侧根具有显著高出CK组的莽草酸含量,从而使得这2组总根的莽草酸含量适度高于CK组。由此充分说明土壤水淹或饱和水条件也能显著诱导池杉幼苗侧根产生大量莽草酸,使池杉幼苗总根的莽草酸含量增加。这也同时预示着池杉幼苗显著增加侧根莽草酸含量是适应根部淹水变化的有效途径之一。许多根茎湿生植物糖酵解产生的PEP能与4-P-赤藓糖缩合为莽草酸,储存于液泡中,用于合成氨基酸和木素(刘友良,1992)。在T1组,侧根莽草酸含量显著低于CK组,说明轻度干旱水分条件能够显著抑制侧根莽草酸的合成,进而导致总根莽草酸含量减少,这与前人研究的鸢尾(Iris pseudacorus)根在夏季土壤干燥条件下仅含有痕量莽草酸的结果相类似(钟章成,1988),但是轻度干旱水分条件并不显著影响侧根苹果酸的代谢变化。已有研究表明,对镰刀菌(Fusarium sporotrichiella)感染具有抗性的欧洲赤松(Pinus sylvestris)幼苗(苗期12 d),在遭受到镰刀菌感染72 h后,苗木下胚轴莽草酸含量比不具有抗性的苗木高出5.1倍(Shein et al., 2003)。具有Ru(ruderal)适应策略的苋属(Amaranthus)植物(Amaranthus retroflexus)和益母草(Leonurus quinquelobatus),在矿质元素缺乏的胁迫条件下也能增加植物莽草酸和酚类化合物的含量(Rakhmankulova et al., 2003)。
由于T3和T2组池杉幼苗根部处于缺氧的环境之中,其有氧呼吸受到限制,三羧酸循环受阻,相应地糖酵解与戊糖磷酸途径必将得到加强,否则池杉幼苗将因呼吸困难而生长不良。但是,本试验却发现T3和T2组池杉幼苗根系生物量只是在CK组上下适度波动,并未表现出与CK组各对应部分生物量的显著差异性。由此可以推测,T3和T2组池杉幼苗根部糖酵解产生的大量丙酮酸,经戊糖磷酸途径产生的NADPH羧化还原成了苹果酸,代替了乙醇的形成;根部糖酵解产生的PEP,与戊糖磷酸途径产生的赤藓糖-4-磷酸合成了莽草酸,没有乙醇积累。本试验发现池杉幼苗在耐淹涝代谢适应过程中,苹果酸和莽草酸次生代谢途径均在发挥作用,这也可能是池杉树种具有突出的耐水淹能力的重要原因之一。因为在通常情况下,池杉幼苗根部缺氧时糖酵解和三羧酸循环中产生的NADH和电子不能通过呼吸链传递给O2,糖酵解的末端产物——乙醛积累,诱导乙醇脱氢酶(ADH)合成,ADH和乳酸脱氢酶活性增加,丙酮酸还原为乳酸,乙醛还原为乙醇,从而产生大量对植物有害的乙醇、乳酸和乙醛(潘瑞炽等,2004)。池杉幼苗在根部将糖酵解的中间产物转变为苹果酸、莽草酸等无毒的物质,可以有效地避开或缓解淹涝伤害(Visser et al., 2003)。与此同时,根部产生的莽草酸作为重要的中间代谢产物,可以为植物进一步合成木素以及苯甲酸等酚类化合物提供前体;根部产生的苹果酸则可以进一步参与植物的多种生理过程,诸如营养吸收、氮同化与脂肪酸氧化等(Tesfaye et al., 2001)。
在整个试验期间,CK组主根与侧根苹果酸平均含量相互间均未表现出显著性差异(P>0.05),但T1、T2与T3组侧根苹果酸平均含量却分别显著高出同组主根苹果酸平均含量的2.4,3.0和2.5倍(P>0.01),这显示出池杉幼苗根部在适应土壤水分胁迫过程中,侧根在苹果酸的适应性代谢变化中占据着主导地位,几乎决定着池杉幼苗总根苹果酸的平均含量变化。同样,池杉幼苗T1,T2与T3组主根的莽草酸含量平均值分别维持在CK组的正常水平,相互间并无显著差异性存在,然而侧根莽草酸含量的显著变化导致了各处理组总根莽草酸含量的显著差异,充分说明池杉幼苗侧根在莽草酸的适应性代谢变化中仍然占据着主导地位。由此反映了池杉幼苗侧根在抵抗和调适水分逆境胁迫中的重要作用。这与前人研究发现三叶草(Trifolium)植物的耐水湿能力与侧根的形成有密切关系(Gibberd et al., 2001)具有相似性。有研究表明,根部处于水淹状态下的玉米,其主根与不定根之间的生理功能进行了某种程度的重新分配,由不定根来完成主要的生理功能,诸如不定根中纤维素酶和木聚糖酶活性增强形成通气组织,通过不定根供应氧气等(Bragina et al., 2001)。可见,在造林实践过程中,应当特别注意保护好池杉幼苗的侧根。
在T2和T3组条件下,侧根苹果酸、莽草酸含量在较短时间内便成倍地显著增加,显示出池杉幼苗根部很可能还存在某种应急反应机制。一旦根部遇到淹水或者过多水分条件时,合成苹果酸、莽草酸的途径可能得到加强,分解转化苹果酸、莽草酸的酶活性可能受到抑制。这与前人所得灯心草(Juncus effusus)根在淹水时积累苹果酸、鸢尾根在淹水时含有很多莽草酸的结论一致(李瑞智等,1982)。由此反映出池杉幼苗根部在适应土壤淹水变化过程中具有复杂的代谢机制与积极的应对措施。
大量研究文献表明,在根部淹水条件下,耐水淹树种根系将因通气组织的形成和发展而增加空隙度(Kozlowski, 1984; Armstrong et al., 1994),生物量生长很可能受到影响(McLeod et al., 1986; Eclan et al., 2002),然而有些耐淹涝树木并没有明显的通气系统,因此依靠根部代谢适应的耐涝机制就显得非常重要(Simone et al., 2003)。与CK组相比,T2和T3组水分条件并未显著影响到池杉幼苗包括主根、侧根在内的整个根系生物量的生长,揭示出池杉幼苗根部代谢适应是其耐涝机理的重要组成部分。与CK组相比,T1组的水分条件反而能显著地促进侧根、进而促进总根生物量的生长。由此说明池杉幼苗在轻度干旱条件下,通过显著增加侧根生长的方式,来为植株获取更多的水分,弥补因土壤水分不足而带来的水分亏缺,这更进一步反映出池杉幼苗不仅具有较强的耐水湿性特征,而且还具有较强的耐旱性(曾慧卿等,1999)。T1与T3组池杉幼苗的根系生物量均显著高于T2组,说明土壤水淹与轻度干旱比土壤饱和水条件更为有利于池杉幼苗的根系生长。池杉幼苗总根生物量与莽草酸含量极显著负相关表明,根部产生的莽草酸并未对根部生物量积累起到正向促进作用;对总根的生物量与苹果酸含量没有出现显著相关性的具体原因还有待于继续深入研究。
可见,在三峡库区消落带,池杉幼苗将通过维持主根苹果酸、莽草酸含量的正常水平,显著增加侧根苹果酸、莽草酸含量及保持根系生物量正常生长来应对水淹或饱和水环境;通过维持根系苹果酸含量,显著降低侧根、进而降低总根莽草酸含量,显著增加侧根、进而增加总根生物量生长应对轻度干旱的环境条件。
曹福亮, 方升佐, 唐罗忠, 等. 1995. 美国落羽杉种源试验初报— —种子特性与苗期生长测定. 南京林业大学学报, 19(1): 65-70. |
刁承泰, 黄京鸿. 1999. 三峡水库水位涨落带土地资源的研究. 长江流域资源与环境, 8(1): 75-80. |
杜荣骞. 2003. 生物统计学. 2版. 北京: 高等教育出版社, 104-116.
|
高智席, 周光明, 黄成, 等. 2005. 离子抑制-反相高效液相快速测定池杉、落羽杉根系中有机酸. 药物分析杂志, 25(9): 1082-1085. |
胡新生, 王世绩. 1998. 树木水分胁迫生理与耐旱性研究进展及展望. 林业科学, 34(2): 77-88. DOI:10.3321/j.issn:1001-7488.1998.02.011 |
胡哲森, 许长钦, 傅瑞树. 2000. 锥栗幼苗对水分胁迫的生理响应及6-BA的作用. 福建林学院学报, 20(3): 1-4. |
李昌晓, 钟章成. 2005. 三峡库区消落带土壤水分变化条件下池杉幼苗光合生理响应的模拟研究. 水生生物学报, 29(6): 712-716. DOI:10.3321/j.issn:1000-3207.2005.06.020 |
李瑞智, 钟章成. 1982. 植物对环境的生物化学适应——兼介绍哈鲍恩的《生态生物化学导论》. 植物生态学与地植物学丛刊, 6(2): 147-152. |
刘友良. 1992. 植物水分逆境生理. 北京: 农业出版社, 182-184.
|
潘瑞炽, 王小菁, 李娘辉. 2004. 植物生理学:第五版. 北京: 高等教育出版社, 282-305.
|
汪企明, 江泽平, 吕祥生, 等. 1995. 落羽杉属种源研究:树种生物学特性. 江苏林业科技, 22(2): 14-18. |
汪企明, 王伟, 蒋志新, 等. 1998. 落羽杉属种源研究:生长和生物量变异. 江苏林业科技, 25(1): 1-6. |
吴祖映, 储家淼, 唐明荣, 等. 1995. 不同立地对池杉林生长的影响. 浙江林学院学报, 12(2): 144-148. |
吴祖映, 储家淼, 唐明荣, 等. 1996. 土壤水分状况对池杉形态结构及生长状况的影响. 浙江林学院学报, 13(3): 364-366. |
曾慧卿, 薛建辉. 1999. 江苏池杉人工林培育研究综述. 江苏林业科技, 26(3): 52-55. |
钟章成. 1988. 常绿阔叶林生态学研究. 重庆: 西南师范大学出版社, 53-89.
|
Armstrong W, Brandle R, Jackson M B. 1994. Mechanisms of flood tolerance in plants. Acta Botanica Neerlandica, 43: 307-358. DOI:10.1111/plb.1994.43.issue-4 |
Bragina T V, Martinovich L I, Rodionova N A, et al. 2001. Ethylene-induced activation of xylanase in adventitious root s of maize as a response to the stress effect of root submersion. Applied Bioche mistry and Microbiology, 37(6): 618-621. DOI:10.1023/A:1012363319758 |
Eclan J M, Pezeshki S R. 2002. Effects of flooding on susceptibility of Taxodium distichum L. seedlings to drought. Photosynthetica, 40(2): 177-182. DOI:10.1023/A:1021381204684 |
Gibberd M R, Gary J D, Cocks P S, et al. 2001. Waterlogging tolerance among a diverse range of Trifolium accessions is related to root porosity, lateral root formation and aerotropic rooting'. Annals of Botany, 88: 579-589. DOI:10.1006/anbo.2001.1506 |
Kozlowski T T. 1984. Plant responses to soil flooding. Biological Science, 34: 162-167. |
McLeod K W, Donovan L A, Stumpff N J, et al. 1986. Biomass, photosynthesis, and water use efficiency of woody swamp species subjected to flooding and elevated water temperature. Tree Physiology, 2: 341-346. DOI:10.1093/treephys/2.1-2-3.341 |
Middleton B A, McKee K L. 2005. Primary production in an impounded baldcypress swamp (Taxodium distichum) at the northern limit of the range. Wetlands Ecology and Management, 13: 15-24. DOI:10.1007/s11273-003-5024-9 |
Rakhmankulova Z F, Fedyaev V V, Podashevka O A, et al. 2003. Alternative respiration pathways and secondary metabolism in plants with different adaptive strategies under mineral deficiency. Russian Journal of Plant Physiology, 50(2): 206-212. DOI:10.1023/A:1022973130775 |
Randall C K, Duryea M L, Vince S W. 2005. Factors influencing stump sprouting by pondcypress (Taxodium distichum var. nutans). New Forests, 29: 245-260. DOI:10.1007/s11056-005-5652-4 |
Shein I V, Shibistova O B, Zrazhevskaya G K, et al. 2003. The content of phenolic compounds and the activity of key en zymes of their synthesis in Scots pine hypocotyls infected with Fusarium. Russian Journal of Plant Physiology, 50(4): 581-586. |
Simone O D, Junk W J, Schmidt W. 2003. Central Amazon floodplain forests: root adaptations to prolonged flooding. Russian Journal of Plant Physiology, 50(6): 848-855. DOI:10.1023/B:RUPP.0000003285.70058.4c |
Tesfaye M, Temple S J, Allan D L, et al. 2001. Overexpression of malate dehydrogenase in transgenic alfalfa enhances organic acid synthesis and confers tolerance to aluminum. Plant Physiology, 127: 1836-1844. DOI:10.1104/pp.010376 |
Visser E J W, Voesenek L A C J, Vartapetian B B, et al. 2003. Flooding and plant growth. Annals of Botany, 91: 107-109. DOI:10.1093/aob/mcg014 |
 2008, Vol. 44
2008, Vol. 44