文章信息
- 黎明, 翟晓巧, 范国强, 张变莉, 刘飞.
- Li Ming, Zhai Xiaoqiao, Fan Guoqiang, Zhang Bianli, Liu Fe
- 土霉素对豫杂一号泡桐丛枝病幼苗形态和DNA甲基化水平的影响
- Effect of Oxytetracycline on the Morphology of Seedling with Witches' Broom and DNA Methylation Level of Paulownia tomentosa×P. fortunei
- 林业科学, 2008, 44(9): 152-156.
- Scientia Silvae Sinicae, 2008, 44(9): 152-156.
-
文章历史
- 收稿日期:2006-09-29
-
作者相关文章
植原体是一类寄生于植物细胞内至目前仍不能进行离体培养的微生物,它可导致世界范围内1000余种植物发生病害(Agrios, 1997)。Doi等(1967)首先发现植原体后,科技工作者发现利用四环素类抗生素可在一定程度减轻其给农业、林业等行业造成的经济损失(任国兰等, 1987;许晓风, 1989;张锐等, 1993;李加友, 1997;Ishiie et al., 1967; Wongkaew et al., 2004),但不能从根本上防止病害发生。泡桐(Paulownia spp.)是我国重要的速生用材树种之一,对改善我国生态环境具有重要作用。然而,由于植原体引起的丛枝病,每年给我国林业造成了数千万元的直接经济损失。过去,虽然有人进行过四环素等抗生素与泡桐丛枝病发生关系的研究(任国兰等, 1987;范国强等, 2007b;李加友, 1997),但至今国内外未见土霉素在泡桐丛枝病发生方面的报道。因此,本文用豫杂一号泡桐(Paulownia tomentosa×P. fortunei)丛枝病幼苗为材料,通过不同浓度土霉素处理后幼苗形态变化观察、植原体检测和DNA甲基化水平的测定,研究了土霉素对豫杂一号泡桐丛枝病幼苗形态和DNA甲基化水平的影响,以期为阐明泡桐丛枝病发生与DNA甲基化关系和筛选防治泡桐丛枝病有效药物奠定基础。
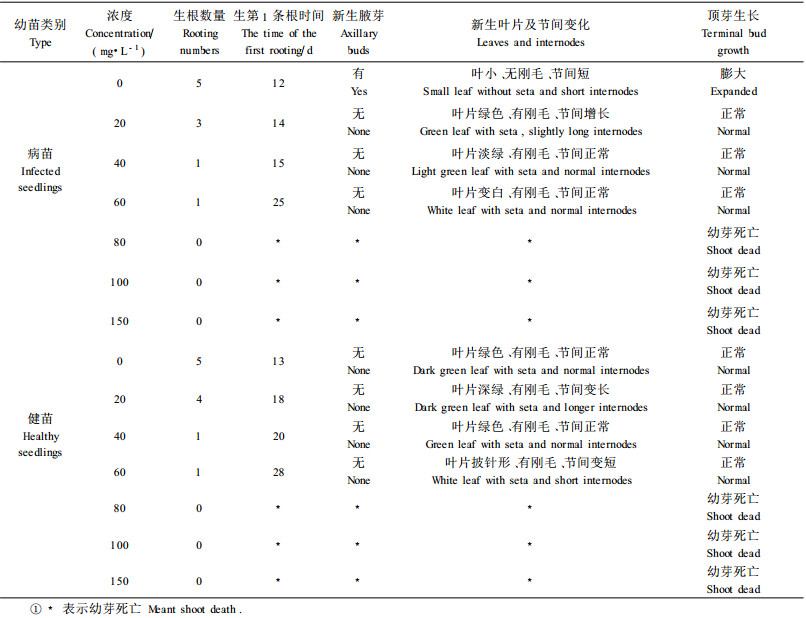
1 材料与方法 1.1 试验材料及处理试验以河南农业大学泡桐研究所培养30 d的豫杂一号泡桐健康和丛枝病组培幼苗为材料。将培养的组培苗从基部剪断,分别接种到装有40 mL土霉素质量浓度分别为0(对照,CK), 20,40,60,80,100,150 mg·L-1不含任何植物激素的1/2MS培养基的100 mL三角瓶中,培养基中蔗糖为25 g·L-1,琼脂为8 g·L-1。每瓶3个幼芽(外植体),每浓度处理20瓶。然后,在温度(25±2) ℃, 光辐射强度130 μmol·m-2s-1,光照时间16 h·d-1的条件下培养。30 d时,观察记录处理苗木的形态变化情况,并剪取适量土霉素处理幼苗顶芽用于DNA提取。
1.2 试验方法1) 幼苗形态变化观察处理结束后,观察记录幼芽的生根时间、幼苗新生腋芽情况、顶端膨大程度和叶片刚毛生长状况等。2)泡桐丛枝病幼苗DNA提取豫杂一号泡桐丛枝病幼苗DNA提取法参照范国强等(2003b)。3)泡桐丛枝病植原体PCR检测豫杂一号泡桐丛枝病幼苗植原体PCR扩增法参照范国强等(2007b)。PCR扩增结束后,取2 μL的PCR产物在1%琼脂糖凝胶(含0.5%EB)上40 V电泳1 h,凝胶在AlphaimagerTM 2200凝胶成像系统中观察、拍照。每一浓度处理幼苗的PCR检测试验重复3次。4)幼苗总DNA甲基化水平测定将上面提取的适量DNA利用Demeulemeester等(1999)改动方法进行水解。将50 μL的70%高氯酸加入盛有50 μL (约10 μg)的DNA溶液中振荡混匀,沸水中水解60 min后,用适量5 mol·L-1的KOH调溶液pH值至3~5,12 000×g室温离心10 min,取上清液10 μL在Waters高效液相色谱仪上(600型泵,717自动进样器)测定。色谱柱为Thermo Hypersil BDS C18 (250 mm×4.6 mm, 5 μm),柱温30℃;流动相为甲醇、10 mmol·L-1的戊烷磺酸钠溶液和三乙胺,三者体积比为10:90:0.2,用适量磷酸调pH至3~5, 流速为0.5 mL·min-1,紫外检测器为Waters 2487, 检测波长273 nm。通过标准样品胞嘧啶和5-甲基胞嘧啶(Sigma)的标准曲线计算出样品中胞嘧啶和5-甲基胞嘧啶的质量,计算总DNA甲基化水平[5-甲基胞嘧啶质量/(胞嘧啶质量+5-甲基胞嘧啶质量)×100%]。
2 结果与分析 2.1 土霉素对豫杂一号泡桐丛枝病幼苗形态变化的影响不同浓度土霉素处理对豫杂一号泡桐丛枝病幼苗形态变化的影响结果(表 1、图 1)表明,土霉素对豫杂一号泡桐丛枝病发生具有一定的抑制作用。当土霉素浓度为20 mg·L-1时,处理后的丛枝病幼苗无腋芽萌发,新生叶片密披刚毛、叶色淡绿,节间稍长,呈现健康幼苗形态。当土霉素浓度为40~60 mg·L-1时,虽然处理病苗的叶片变大、披刚毛,但叶色逐渐变黄、生长量逐渐下降。此外,随着土霉素浓度的增大,处理丛枝病幼芽生根数量逐渐减少,并且生出第1条根的时间逐渐推迟,直至当浓度为80 mg·L-1时,幼芽不能生根。对豫杂一号泡桐健康幼苗来说,随着土霉素浓度的增大,处理幼芽生根数量逐渐减少、第1条根出现的时间推迟,幼苗生长量明显下降。当土霉素浓度为60 mg·L-1时,处理幼苗叶片呈披针形,节间明显缩短。当土霉素浓度等于或大于80 mg·L-1时,因毒害作用,处理幼苗全部死亡。该结果说明,土霉素可使丛枝病幼苗形态呈现健康状态,但抑制了幼苗的生长量直至幼苗死亡。造成该结果的原因可能与土霉素在抑制泡桐植原体生长、分裂的同时,也抑制了泡桐本身生长涉及的一系列生理生化过程中蛋白质的合成有一定的关系。
|
|

|
图 1 土霉素处理后豫杂一号泡桐幼苗的形态变化 Figure 1 The morphological changes of the seedlings treated with different concerntrations of oxytetracycline A.病苗Diseased seedlings (0 mg·L-1);B. 20 mg·L-1处理的病苗Diseased seedlings treated with 20 mg·L-1;C. 40 mg·L-1处理的病苗Diseased seedlings treated with 40 mg·L-1;D. 60 mg·L-1处理的病苗Diseased seedlings treated with 60 mg·L-1;E.健苗Healthy seedlings (0 mg·L-1);F. 20 mg·L-1处理的健苗Healthy seedlings treated with 20 mg·L-1;G. 40 mg·L-1处理的健苗Healthy seedlings treated with 40 mg·L-1;H. 60 mg·L-1处理的健苗Healthy seedlings treated with 60 mg·L-1 |
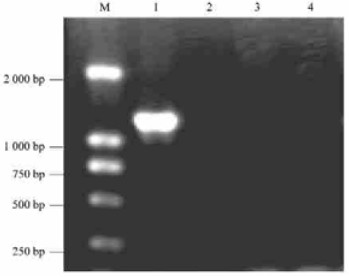
土霉素对豫杂一号泡桐丛枝病幼苗植原体的PCR检测(图 2)表明,土霉素对泡桐丛枝病植原体产生了抑制作用。当用浓度大于20 mg·L-1土霉素处理时,幼苗顶芽扩增不出分子量为1.2 Kb的泡桐丛枝病植原体特异的DNA条带。这表明,在试验所用的土霉素浓度处理豫杂一号泡桐丛枝病幼苗后,新生顶芽内没有植原体的存在。结合前面土霉素对豫杂一号泡桐丛枝病幼苗形态影响的结果可以得出,适宜浓度土霉素处理可抑制患病幼苗体内植原体的繁殖和生长,从而使幼苗呈现健康状态。
|
图 2 土霉素处理后患病幼苗植原体16S rRNA的PCR扩增 Figure 2 PCR of phytoplasmas 16S rRNA in the leaveswith wiches' broom M. DNA Marker; 1. 0 mg·L-1; 2. 20 mg·L-1; 3. 40 mg·L-1; 4. 60 mg·L-1. |
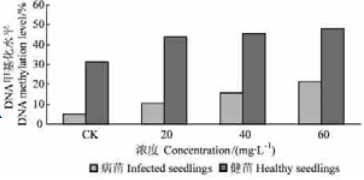
土霉素对豫杂一号泡桐丛枝病幼苗总DNA甲基化水平变化影响结果(图 3)表明,土霉素可提高处理幼苗叶片总DNA的甲基化水平。当土霉素浓度为0时,健康幼苗顶芽总DNA甲基化水平是病苗顶芽总DNA甲基化水平的9倍,明显高于病苗顶芽的水平。随着处理土霉素浓度的增大,处理丛枝病和健康幼苗顶芽总DNA甲基化水平均呈现逐渐升高的趋势,但DNA甲基化水平升高的幅度则有一定的差异。这可能与健康幼苗的DNA甲基化饱和度有一定的关系。当土霉素浓度等于或大于80 mg·L-1时,由于丛枝病和健康与杂一号泡桐幼苗死亡, 所以未测定其总DNA甲基化水平。此外,即使土霉素浓度达到60 mg·L-1时,处理丛枝病幼苗顶芽总DNA甲基化水平也没有达到健康(对照)幼苗的水平。结合土霉素对豫杂一号泡桐丛枝病幼苗形态变化影响和幼苗植原体PCR检测结果可以得出,该浓度土霉素处理丛枝病幼苗后,泡桐总DNA甲基化水平升高,病苗表达的部分基因被迫关闭,此时幼苗呈现健康状态。
|
图 3 土霉素对豫杂一号泡桐幼苗DNA甲基化水平的影响 Figure 3 Effect of oxytetracycline on DNA methylation level of the seedlings |
植原体是一类寄生于植物细胞内的无细胞壁、目前仍不能进行体外培养的微生物(Agrios, 1997)。当植原体侵入寄主细胞后就会导致其生长发育异常,出现不同的丛枝症状。因此,杀死植原体可减轻丛枝病症或本从根本上防治丛枝病的发生。过去人们常用四环素类抗生素防治泡桐丛枝病的发生,但效果皆不理想。本试验发现,20 mg·L-1土霉素处理的丛枝病幼苗就呈现健康幼苗状态,并且用PCR检测不到植原体的存在。这可能与四环素类抗生素对植原体蛋白质合成抑制作用特异性差、而土霉素特异性较强有关(周启等, 1998; Wongkaew et al., 2004)。植原体侵染泡桐后可引起寄主发生形态和一系列的生理生化变化(范国强等,1997;2007a; 2007b;2008;金开旋等,1989;巨关升等,1996;宋晓斌等,1997;田国忠等,1999;王蕤等,1981;袁巧平等,1994;张春立等,1994;朱澄等,1991),但没有改变与泡桐丛枝病发生相关基因的碱基序列(范国强等, 2003a;2007b)。由此可知,植原体的侵入导致了寄主细胞DNA发生了共价修饰作用,即植原体在利用寄主活体细胞生长和增殖同时,产生的代谢物质使寄主细胞DNA去甲基化,降低DNA甲基化水平(Guseinov et al., 1975),引起染色体结构发生变化,使本应处于沉默状态的分枝基因和细胞分裂素基因开始或过量表达表达(Ruiz et al., 2006),从而使健康幼苗呈丛枝病症状。当用半衰期和作用位点不同的土霉素、四环素和利福平等抗生素处理患病植株时,这些抗生素可在一定程度上可抑制植原体的分裂、生长或清除其存在,减少或停止其代谢物质对寄主细胞DNA结构的影响(Wongkaew et al., 2004),提高寄主细胞DNA甲基化水平,使病苗细胞染色质结构部分或全部恢复到健康幼苗细胞的状态,从而部分或全部关闭原来过量表达的相关基因。由于不同抗生素对植原体作用效果的差异,造成寄主细胞DNA甲基化水平和基因表达的差异,最终出现防治效果的不同。当抗生素浓度和用量适宜时,丛枝病幼苗内植原体完全被杀死,寄主细胞不存在降低DNA甲基化的代谢物质,原来过量表达的相关基因由于发生甲基化而关闭,染色体结构恢复到正常状态,植物又重新开始健康、正常生长。至于抗生素清除病苗内植原体后,其细胞DNA甲基化水平仍低于健康幼苗的原因还有待于进一步研究。
范国强, 蒋建平. 1997. 泡桐丛枝病的发生与叶片蛋白质氨基酸变化关系的研究. 林业科学研究, 10(6): 570-573. |
范国强, 李有, 郑建伟, 等. 2003a. 泡桐丛枝病发生相关蛋白质的电泳分析. 林业科学, 39(2): 119-122. |
范国强, 马新业. 2003b. 泡桐叶片DNA提取. 河南科学, 21(2): 172-175. |
范国强, 张变莉, 翟晓巧, 等. 2007a. 利福平对泡桐丛枝病幼苗形态和内源植物激素变化的影响. 河南农业大学学报, 41(4): 372-376. |
范国强, 张胜, 翟晓巧, 等. 2007b. 抗生素对泡桐植原体和发病相关蛋白质的影响. 林业科学, 43(3): 138-142. |
范国强, 曾辉, 翟晓巧. 2008. 泡桐丛枝病发生特异相关蛋白质亚细胞定位及质谱鉴定. 林业科学, 44(4): 83-86. |
金开璇, 田国忠. 1989. 组织化学技术快速检测泡桐丛枝病研究. 植物学报, 19(30): 185-189. |
巨关升, 王蕤, 周银莲, 等. 1996. 泡桐丛枝病的抗性与维生素C关系的研究. 林业科学研究, 9: 431-434. DOI:10.3321/j.issn:1001-1498.1996.04.018 |
李加友. 1997. 抗生素对组培条件下植物枝原体作用的初探. 南京农专学报, 13(4): 25-31. |
任国兰, 郑铁民, 李秀生, 等. 1987. "去丛灵"治疗泡桐丛枝病效果的研究. 河南农业大学学报, 21(1): 96-98. |
宋晓斌, 郑文锋. 1997. 类菌原体的侵入对泡桐组织和细胞的影响. 林业科学研究, 10(4): 429-434. DOI:10.3321/j.issn:1001-1498.1997.04.016 |
田国忠, 张锡津, 罗飞, 等. 1999. 抗病和感病泡桐无性系组培苗对嫁接传染植原体的不同反应. 林业科学, 35(4): 34-39. |
许晓风. 1989. 土霉素对桑树黄化萎缩病治疗机理的探讨. 植物保护学报, 16(2): 87-92. DOI:10.3321/j.issn:0577-7518.1989.02.005 |
王蕤, 孙秀琴, 王守宗, 等. 1981. 激素对泡桐丛枝病发生的影响. 林业科学, (3): 281-286. |
袁巧平, 田国忠. 1994. 泡桐丛枝病MLO在寄主离体组织中的保存与增殖. 植物学报, 36(4): 115-120. |
张春立, 林木兰, 胡学勤. 1994. 泡桐丛枝病类菌原体DNA的分子克隆与序列分析. 植物学报, 36(4): 278-282. DOI:10.3321/j.issn:1000-4025.1994.04.008 |
张锐, 王敏, 金开璇, 等. 1993. 土霉素对山楂丛枝病的治疗研究. 北京农业科学, 6(11): 29-31. |
周启, 王道本. 1998. 农用抗生素和微生物杀虫剂. 北京: 中国农业出版社.
|
朱澄, 金开璇. 1991. 用DAPI荧光显微术测泡桐丛枝病. 植物学报, 33(7): 495-498. |
Agrios G N. 1997. Plant diseases caused by Mollicutes: phytoplasmas and spiroplasmas//Agrios G N. Plant Pathology(4th Edition). New York: Academic Press.
|
Doi Y, Teranaka M, Yora K, et al. 1967. Mycoplasma or PLT group-like micro organisms found in phloem elements of plants infected with mulberry dwarf, potato witches' broom, aster yellows or paulownia witches' broom. Ann Phytopathol Soc Jpn, 33: 259-266. DOI:10.3186/jjphytopath.33.259 |
Guseinov V A, Kiryanov G I, Vanyushin B F. 1975. Intragenom distribution of 5-methylcytosine in DNA of healthy and wilt-infected cotton plants (Gossypium hirsutum L). Molecular Biology Reports, 2: 59-63. DOI:10.1007/BF00357298 |
Ishiie T, Doi Y, Yora K, et al. 1967. Suppressive effects of antibiotics of tetracycline group on the symptom development of mulberry dwarf disease. Ann Phytopathol Soc Jpn, 33: 267-275. |
Ruiz G L, Cervera M T, Martinez-Zapater J M. 2006. DNA methylation increases throughout Arabidopsis development. Planta, 222: 301-306. |
Wongkaew P, Fletcher J. 2004. Sugarcane white leaf phytoplasma in tissue culture: long-term maintenance, transmission, and oxytetracycline remission. Plant Ce ll Reports, 23: 426-434. DOI:10.1007/s00299-004-0847-2 |
 2008, Vol. 44
2008, Vol. 44