文章信息
- 王庆菊, 李晓磊, 王磊, 孙凡雅, 沈向.
- Wang Qingju, Li Xiaolei, Wang Lei, Sun Fanya, Shen Xiang.
- 紫叶稠李叶片花色苷及其合成相关酶动态
- Dynamic Changes of Anthocyanin and the Relevant Biosynthesis Enzymes in Padus virginiana 'Schubert' Leaves
- 林业科学, 2008, 44(3): 45-49.
- Scientia Silvae Sinicae, 2008, 44(3): 45-49.
-
文章历史
- 收稿日期:2006-12-27
-
作者相关文章
花色苷是一类广泛存在于植物中的黄酮类化合物,花色苷与叶绿素、类胡萝卜素等其他色素共同决定植物器官的着色。长期以来,花色苷的合成受到了科学家们的大量关注,目前花色苷的生物合成途径已经基本上清楚(Awad et al., 2001; Takos et al., 2006),其合成主要是在一系列酶的作用下,在细胞质中转化为花色苷,通过液泡膜进入液泡中。研究表明拟南芥(Arabidopsis thaliana)、苹果(Malus pumila)、荔枝(Litchi chinensis cv. Feizixiao)、葡萄(Vitis vinifera)等,苯丙氨酸解氨酶(PAL)、查儿酮异构酶(CHI)、二氢黄酮醇还原酶(DFR)和类黄酮糖基转移酶(UFGT)与花色苷的合成密切相关,但对不同酶在花色苷合成中的作用研究结果不尽一致(Murray et al., 1991; Lister et al., 1996; 周爱琴等, 1997; Kobayashi et al., 2001; Ashraf et al., 2002; 王惠聪等, 2004;Takos et al., 2006; Bogs et al., 2007)。目前,对花色苷合成相关酶的研究多集中于果实着色过程(Sweeney et al., 2006),而植物叶片中花色苷的含量和相关酶关系的研究报道尚少。
紫叶稠李(Padus virginiana 'Schubert')为蔷薇科(Rosaceae)落叶乔木,其叶片嫩叶鲜绿,自5月中旬起成熟叶自基部向上渐次转为紫红色。紫叶稠李叶片先绿后红,与紫叶李(Prunus cerasifera var. atropurpurea)相比叶色更鲜亮,与紫叶桃(Amygdalus persica f. atropurpurea)相比红色更持久,加之树体高大,冠形端庄,园林用途十分广泛。特别是叶色变化极为丰富,是研究叶片花色苷合成机制的良好试材。本研究以紫叶稠李为试材,以叶片为绿色的稠李(P. resemosa)为对照,旨在研究紫叶稠李叶片中花色苷合成的数量和时间与其叶色表现和变色过程的关系,检测其花色苷合成相关酶PAL、CHI、DFR、UFGT活性的变化,以期确定紫叶稠李叶色变化过程中调控花色苷合成的关键酶,从而为彩叶树种叶色的调控以及彩叶树育种提供理论参考。
1 材料与方法 1.1 试验材料试验于2006年5月在山东农业大学观赏果树试验园内进行,此期紫叶稠李1年生新梢上的叶片自顶端向下表现出鲜绿—淡紫红—深紫红色的颜色变化。选择生长健康、长势一致的3年生紫叶稠李和稠李为试材,将1年生枝平均分为梢部、中部、基部3部分,分别于2006年5月23日—7月13日,每隔10 d分别取梢部幼叶、中部功能叶、基部老叶进行花色苷含量和花色苷合成相关酶PAL、CHI、DFR、UFGT活性的测定。
1.2 花色苷含量的测定花色苷的测定参考仝月澳等(1982)的方法,将叶片取回、洗净、擦干、剪碎后,采用1.5 mol· L-1 HCl:95%乙醇=15:85(v/v)混合液,在黑暗条件下浸提24 h后用岛津UV-2450紫外-可见分光光度计检测535 nm波长的光密度值,参照胡位荣等(2004)的计算方法进行花色苷含量的计算。
1.3 花色苷合成相关酶活性测定待测酶液的提取参照王惠聪等(2004)方法,PAL、CHI、UFGT酶活性的测定参照Lister等(1996)的方法,DFR活性测定参照Stafford等(1982;1984)的方法。测定重复3次。
1.3.1 PAL活性取0.5 mL的酶液加入2.5 mL的反应液[硼酸缓冲液(pH8.8),10 mmol·L-1苯丙氨酸],34 ℃反应30 min后,用三氟乙酸终止反应,5 000 r·min-1离心5 min除去变性的蛋白质,比色,PAL的活性用反应生成的肉桂酸含量在290 nm处的吸光值来表示。
1.3.2 CHI活性取0.75 mL的酶液加入2 mL混合液[pH 7.4的50 mmol·L-1 Tris-HCl,7.5 mg·mL-1 BSA,50 mmol·L-1 KCN],然后加50 μL 1 mg·mL-1的查尔酮溶液,在34 ℃水浴30 min,另取同量的酶提液沸水浴10 min为对照,测定在381 nm处的吸光值的变化来表示CHI的酶活性。每小时光密度变化0.001所需的酶量为1个酶活性单位。
1.3.3 UFGT活性取酶液0.5 mL加入0.5 mL的反应液[50 mmol·L-1二甘氨酸缓冲液(pH8.0),1 mmol·L-1的栎精(quercetin)和2.5 mmol·L-1的UDP-葡萄糖],反应液在34 ℃水浴30 min后,用0.75 mL的20%三氯乙酸甲醇溶液终止反应,于5 000 r·min-1离心5 min,上清液用岛津LC2010A/C型高效液相色谱检测栎精-3-葡萄糖的生成量并用其表示酶活性。每小时光密度变化0.001所需的酶量为1个酶活性单位。
1.3.4 DFR活性取0.5 mL酶液,0.6 mL的反应液[100 mmol·L-1 Tris缓冲液(pH7.4),1 μmol·L-1的脱氢栎精(dihydroquercetin),1μmol·L-1NADPH,0.5 mL的酶提液,1单位的葡萄糖-6-磷酸脱氢酶以及6 μmol·L-1的葡萄糖-6-磷酸],34 ℃水浴1 h后,用1 mL的乙酸乙脂提取3次,合并提液,然后用0.2 mL的蒸馏水抽提3次。乙酸乙脂部分用氮气吹干,然后加入2 mL的丁醇:盐酸=95:5 (v/v)于95 ℃水浴30 min,在550 nm测定吸光值,用来表示由无色花色素向花色素转变的量,取同量的酶提液沸水浴10 min为对照。
1.4 统计方法数据用DPS软件进行统计分析,并将不同时期测定的酶活性平均值进行相关分析并建立回归模型。
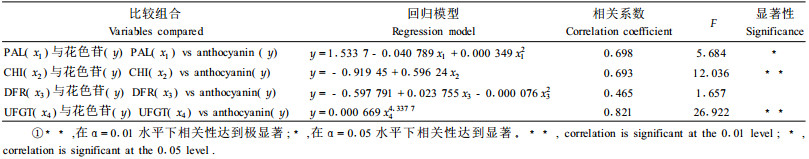
2 结果与分析 2.1 紫叶稠李与稠李不同部位叶片中花色苷含量变化观察证实,5月中旬到7月是紫叶稠李叶片由绿色到紫红色的转变期,枝条基部、中部、梢部叶片分别呈现紫红色、紫色、淡紫色的颜色变化。图 1表明,紫叶稠李叶片花色苷的含量在时空变化上均表现出了显著差异(α=0.05)。基部老叶5月23日—6月3日10 d中花色苷含量增加最快,6月中旬以后花色苷含量略有下降;中部叶片花色苷的含量从5月到6月逐渐上升,6月23日之后迅速增加;梢部叶片花色苷的含量在6月23日以后有增加的趋势。5月后,紫叶稠李3个部位叶片中花色苷的含量均增加,基部、中部、梢部叶片中花色苷的含量至7月分别增加了219.40%、666.63%、76.81%,3个部位叶片中花色苷合成的差异导致了新梢叶色层次的不同,相应部位的叶色呈现出了由深紫到浅绿的色差。而稠李叶片花色苷的含量均维持较低水平,时空差异均不显著(图 2)。
|
图 1 不同时期不同部位叶片花色苷含量变化 Figure 1 Changes of anthocyanin content in the leaves at different positions in different periods RT, RM, RB分别表示稠李梢、中、基部叶片;VT, VM, VB分别表示紫叶稠李梢、中、基部叶片。RT, RM, RB mean leaves at the top, middle and base of branches in P. resemosa respectively; VT, VM, VB mean leaves at the top, middle and base of branches in P. virginiana 'Schubert' respectively.下同。The same below. |
|
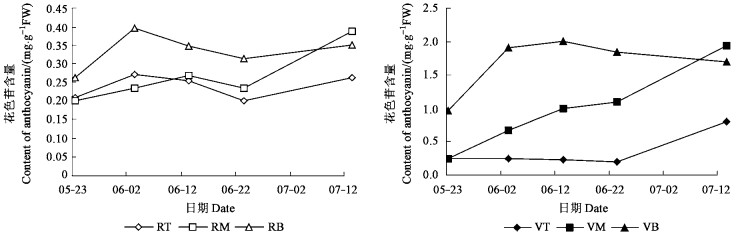
图 2 紫叶稠李叶片颜色变化与色素组成(2006-07-07) Figure 2 Changes of leaf colors and pigment composition in P. virginiana 'Schubert'(2006-07-07) |
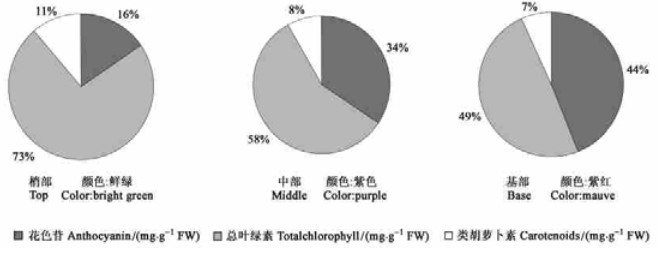
如图 3所示,在2个树种中均检测到了4种酶的活性,紫叶稠李叶片中PAL、CHI、DFR、UFGT的活性在特定时期均显著高于稠李叶片中相应酶的活性,这一规律在PAL、CHI、UFGT中表现尤为明显。不同时期不同叶位紫叶稠李叶片中各种酶的活性变化存在很大差异:PAL的活性在紫叶稠李新梢各部位叶片中均是从5月23到6月3日先降低,这时紫叶稠李叶片中PAL活性甚至低于稠李,6月3日之后逐渐上升,6月23日后在较高的水平相对稳定,紫叶稠李基部和中部叶片中的PAL活性相近,无显著差异,但显著高于梢部叶片。5月到7月,CHI活性在中部、基部叶片中逐渐升高,同时在梢部叶片中逐渐降低;DFR的活性在3个部位叶片中的变化规律一致,均是在6月3日有一个活性高峰,此期中部叶片中花色苷的含量也迅速增加,之后DFR的活性逐渐降低;紫叶稠李叶片中UFGT活性一直维持较高水平,且变化规律与花色苷的积累规律一致,酶活性平均值较稠李叶片高2倍以上。对照稠李叶片中4种酶的活性均稳定维持较低水平,这与其叶片中花色苷含量一直维持较低水平相吻合。
|
图 3 不同时期不同部位叶片中PAL、CHI、DFR、UFGT活性变化 Figure 3 Changes of PAL, CHI, DFR and UFGT activities in the leaves at different positions in different periods |
综合图 3的结果,紫叶稠李叶片中4个花色苷合成相关酶的活性与花色苷的积累存在不同的相关关系。相关分析结果(表 1)表明:PAL活性与花色苷的含量呈显著的二次曲线关系,当PAL活性大于60 U·g-1FW时,花色苷的含量随着PAL活性的增加而增加,由此可见,花色苷的含量增加与PAL的活性提高不尽一致,但在花色苷的大量合成期,PAL的活性较高。CHI的活性与花色苷的含量呈极显著的线性关系,花色苷的含量随着CHI活性的升高而增加。DFR与花色苷的含量也呈二次曲线关系,当DFR活性在50~150 U·g-1FW的范围内,随着酶活性的升高花色苷的含量增加。UFGT活性与花色苷含量呈极显著的幂函数关系,因此,推断UFGT活性的提高可能显著增加叶片中花色苷的含量。
|
|
PAL活性与花色苷积累的关系一直存在争议。许多报道如Arakawa(1988)的研究表明,PAL是花色苷合成的关键酶;Lister等(1996)指出:只有在果皮变红时PAL活性才与花色苷的合成密切相关;王惠聪等(2004)在荔枝上的试验结果认为,PAL活性与荔枝果皮中的花色苷合成无关。本研究中,紫叶稠李梢部、中部叶片中PAL的活性在6月3日前降低,6月3日后上升(图 3),花色苷大量合成时期PAL活性迅速增加,此结果与Lister等(1996)的研究结果一致,后期特别是中、基部叶片中PAL活性升高,可能是因为花色苷的大量合成消耗PAL产物肉桂酸。
孟繁静(2000)研究表明,缺乏CHI的玉米(Zea mays)突变体,因查儿酮的积累玉米籽粒呈古铜色,无法合成花色苷;Besseau等(2007)指出在苯丙氨酸的代谢中, CHI与上游的CHS(查尔酮合成酶)一起促进花色苷的合成,反之则底物进入木质素的合成;Lister等(1996)的研究表明,苹果的整个发育过程中CHI一直保持较高的活性,CHI在果皮变红时与花色苷的积累显著相关。本研究结果与Lister等的研究结果类似,在紫叶稠李叶色变化过程中,CHI的活性变化与花色苷的积累呈显著的线性关系(表 1),紫叶稠李中、基部叶片中花色苷含量随着CHI活性的增加而增加。
据Murray等(1991)报道,在幼年阶段,常春藤(Hedera helix)DFR的活性较高,茎和叶柄中有花色苷的积累,而在成熟阶段,虽然植物体内积累较多的栎精,但DFR却没有活性,也没有花色苷的积累,并从这一角度指出,DFR活性的缺乏会限制花色苷的积累。王惠聪等(2004)在荔枝中的研究认为DFR与荔枝果皮中花色苷的合成无密切关系。本研究则表明,紫叶稠李叶片中DFR在6月3日左右活性较高(图 3),而在叶片花色苷积累的过程中,DFR的活性逐渐降低。DFR与花色苷含量的相关关系分析表明两者有相关,当DFR活性在50~150 U·g-1FW范围内,随着酶活性的升高花色苷的含量增加。由花色苷含量与DFR活性的变化趋势以及两者的相关关系分析可见,DFR对花色苷的合成可能起到启动作用。
从表 1可见,紫叶稠李叶片中UFGT活性与花色苷积累呈极显著的幂函数关系。由此可以判断,UFGT对紫叶稠李叶片花色苷积累起到极显著的促进作用。与本研究结果类似的研究,如王惠聪等(2004)在荔枝的研究中认为,果实着色过程中花色苷的积累与UFGT活性的增加一致,套袋处理强烈抑制果皮中UFGT活性的增加和花色苷的积累,解袋后UFGT活性和花色苷含量急剧增加,抑制UFGT活性的处理均能抑制花色苷的合成,相反提高UFGT活性的处理均能促进花色苷的合成。另外,Kobayashi等(2001)和Ashraf等(2002)用分子方法在葡萄上的研究也证明,UFGT对花色苷合成很重要。
综上所述,PAL、CHI、DFR、UFGT 4个花色苷合成关键酶在紫叶稠李叶片花色苷合成过程中发挥着不同影响。花色苷的合成过程由DFR启动,CHI对花色苷合成起促进作用,可能导致PAL活性的提高,UFGT起到糖基转移的作用,它的作用提高了花色苷稳定性,是花色苷合成过程的延续,促进了花色苷的大量积累。由此可见,紫叶稠李叶片中花色苷的合成是4种酶共同作用的结果,不同时期由不同的酶起关键作用。
另外,叶片和果实花色苷的合成过程中存在争议较大的是DFR活性对花色苷合成的影响,在果实花色苷合成的研究中多认为其活性与花色苷的合成关系不密切,但本文以及Murray等(1991)对叶片花色苷合成的研究认为,DFR活性在花色苷合成过程中起着重要作用。因此,不同植物或器官中花色苷积累过程中起关键作用的酶的种类和动态,值得进一步研究(Mano et al., 2007)。
胡位荣, 张昭其, 季作梁, 等. 2004. 酸处理对采后荔枝果皮色泽与生理活性的影响. 食品科学, 25(7): 176-180. DOI:10.3321/j.issn:1002-6630.2004.07.042 |
孟繁静. 2000. 植物花发育的分子生物学. 北京: 中国农业出版社, 225-256.
|
仝月澳, 周厚基. 1982. 果树营养诊断法. 北京: 农业出版社, 112-115.
|
王惠聪, 黄旭明, 胡桂兵, 等. 2004. 荔枝果皮花青苷合成与相关酶的关系研究. 中国农业科学, 37(12): 2028-2032. DOI:10.3321/j.issn:0578-1752.2004.12.043 |
周爱琴, 祝军, 生吉萍, 等. 1997. 苹果花青素形成与PAL活性及蛋白质含量的关系. 中国农业大学学报, 2(3): 97-99. DOI:10.3321/j.issn:1007-4333.1997.03.022 |
Arakawa O. 1988. Photoregulation of anthocyanin synthesis in apple fruit under UV-B and red light. Plant Cell Physiol, 29: 1385-1389. |
Ashraf E I K, Christian C, Jean-Mare S, et al. 2002. Ethanol triggers grape gene expression leading to anthocyanin accumulation during berry ripening. Plant Scince, 163: 449-454. DOI:10.1016/S0168-9452(02)00142-5 |
Awad M A, Jager A D E, Plas L H W, et al. 2001. Flavonoid and chlorogenic acid changes in skin of Elstar and Jonagole apples during development and ripening. Scientia Horticulture, 90(1/2): 69-83. |
Besseau S, Hoffmann L, Geoffroy P, et al. 2007. Flavonoid accumulation in Arabidopsis repressed in lignin synthesis affects auxin transport and plant growth. Plant Cell, 19(1): 148-162. DOI:10.1105/tpc.106.044495 |
Bogs J, Jaffe F W, Takos A M, et al. 2007. The grapevine transcription factor VvMYBPAl regulates proanthocyanidin synthesis during fruit development. Plant Physiology, 143(3): 1347-1361. DOI:10.1104/pp.106.093203 |
Kobayashi S, Ishimaru M, Ding C K, et al. 2001. Comparison of UDP-gucose: flavonoid 3-O-glucosyltransferase (UFGT) gene suquences between white grapes (Vitis vinifera) and their sports with red skin. Plant Science, 160: 543-550. DOI:10.1016/S0168-9452(00)00425-8 |
Lister C E, Lancaster J E. 1996. Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivars. Journal Science of Food Agriculture, 71: 313-320. DOI:10.1002/(ISSN)1097-0010 |
Mano H, Ogasawara F, Sato K, et al. 2007. Isolation of a regulatory gene of anthocyanin biosynthesis in tuberous roots of purple-fleshed sweet potato. Plant Physiology, 143(3): 1252-1268. DOI:10.1104/pp.106.094425 |
Murray J R, Hackett W P. 1991. Dihydroflavonol reductase activity in relation to differential anthocyanin accumulation in juvenile and mature phase Hedera helix L. Plant Physiology, 97: 343-351. DOI:10.1104/pp.97.1.343 |
Stafford H A, Lester H H. 1982. Enzymic and nonenzymic reduction of (+) dihydroquercetion to its 3, 4-diol. Plant Physiology, 70: 695-698. DOI:10.1104/pp.70.3.695 |
Stafford H A, Lester H H. 1984. Flavan 3-ol biosynthesis the conversion of (+) dihydroquercetion and flavan-3, 4-cis-diol (leuocyanidin) to (+) catechin by reductases extracted from cell suspension cultures of Douglas fir. Plant Physiology, 76: 184-186. DOI:10.1104/pp.76.1.184 |
Sweeney M T, Thomson M J, Pfeil B E, et al. 2006. Caught redhanded: Rc encodes abasic helix-loop-helix protein conditioning red pericap in rice. Plant Cell, 18: 283-294. DOI:10.1105/tpc.105.038430 |
Takos A M, Jaffe F W, Jacob S R, et al. 2006. Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples. Plant Physiology, 142(3): 1216-1232. DOI:10.1104/pp.106.088104 |
 2008, Vol. 44
2008, Vol. 44