文章信息
- 张劲松, 孟平, 王鹤松, 高峻, 任庆福, 贾长荣, 任迎丰.
- Zhang Jinsong, Meng Ping, Wang Hesong, Gao Jun, Ren Qingfu, Jia Changrong, Ren Yingfeng.
- 华北石质山区刺槐人工林的土壤呼吸
- Soil Respiration of Robinia pseudoacacia Plantation in the Rocky Mountainous Area of North China
- 林业科学, 2008, 44(2): 8-14.
- Scientia Silvae Sinicae, 2008, 44(2): 8-14.
-
文章历史
- 收稿日期:2007-09-03
-
作者相关文章
2. 河南省济源市国有大沟河林场 济源 454650
2. Dagouhe National Forest Farm of Jiyuan, Henan Province Jiyuan 454650
工业革命以来,由人类各种活动造成的CO2等温室气体的大气含量显著上升是全球气候变暖的主要原因。土壤是陆地生态系统中最主要的碳库,占生物圈陆地总碳贮量的比例超过2/3。全球土壤碳贮量是大气的2倍,是植物的3倍(Lohila et al., 2003)。森林土壤的碳贮量占全球土壤的73%(Post et al., 1982; Alvarez et al., 2001),故森林碳收支状况很大程度上决定了陆地生物圈是碳源还是碳汇(周玉荣等,2000)。土壤呼吸是土壤碳库输出的主要途径及全球碳循环的主要方式,主要来自于土壤微生物、植物的根系(Mathes et al., 1985)和土壤动物的呼吸(Richardson et al., 1986)。每年土壤呼吸释放到大气中的CO2是化石燃料燃烧释放的10倍以上(Raich et al., 1995)。土壤呼吸即便发生较小的变化,也会显著地影响大气中CO2浓度(Schlesinger et al., 2000; Burton et al., 2003),并影响森林贮存碳的能力(Dixon et al., 1994),进而影响全球气候的变化。因此,森林土壤呼吸是当前陆地生态系统碳循环和全球变化研究的一个重要内容。
华北石质山区是华北平原的重要生态屏障,一直是我国林业生态建设的重点区域。对该地区人工林生态系统土壤碳通量研究,将有助于评估退耕还林等林业生态工程的生态效益。目前,国内关于森林土壤呼吸的研究区域多集中在温带、亚热带森林生态区(蒋延玲等,2005;易志刚等,2003a;陈光水等,2005;房秋兰等,2006;张连举等,2007),对华北石质山区暖温带人工林土壤呼吸的研究仅有少量报道(刘绍辉等,1998;马钦彦等,2000;孙向阳等,1995),缺少系统研究。
土壤呼吸的测定方法有多种,每种方法都有各自的优缺点、适用条件及范围。其中,动态红外气室法能较好地反映土壤呼吸的真实速率(崔骁勇等,2001),是目前较为理想的一种测定方法(马秀梅等,2004)。但我国受仪器条件的限制,已有有关土壤呼吸研究大都采用静态气室法,该类方法因静态暗箱的使用而改变了被测地表的物理环境,最终会影响观测精度。
刺槐(Robinia pseudoacacia)是华北石质山区主要造林树种之一,广泛分布于我国北方地区。但国内对刺槐林地土壤呼吸的研究还未见报道。本研究以刺槐林为例,采用以动态红外分析法为原理的Li-8100土壤呼吸自动观测系统,观测土壤呼吸速率,结合同步观测得到的土壤温度与湿度数据,分析华北石质山区人工林生态系统土壤呼吸速率的时间变化规律及其影响机制,旨在进一步丰富暖温带山地人工林生态系统碳通量观测数据,为精确计算华北石质山区人工林生态系统土壤呼吸总量提供科学依据,为进一步评价该地区林业生态工程对碳循环和气候变化的影响提供理论依据。
1 试验区概况试验地位于黄河小浪底森林生态系统定位研究站(35°01′ N,112°28′ E)站区内。该定位研究站隶属于中国森林生态系统定位研究网络(CFERN),地处河南省济源市境内的太行山南段与黄河流域的交接处,定位站中心地区海拔410 m。属暖温带大陆性季风气候,年均气温12.4~14.3 ℃,年日照时数2 367.7 h,年日照率54%,年均降水量641.7 mm,其中,6—9月为438.0 mm。试验区林分以人工林为主,刺槐为代表性树种之一。本研究所选取的刺槐林样地为半阳坡中部的退耕还林地。土壤类型为褐土。刺槐林龄为35年,林分密度1 905株·hm-2,平均株高8.3 m,平均胸径10.8 cm,郁闭度0.9,平均土层厚度60 cm。
2 试验方法 2.1 土壤呼吸速率测定采用基于红外动态分析法的Li-8100土壤呼吸自动测量系统(美国,Li-cor)观测刺槐林地土壤呼吸速率。共2个样地,每样地内选取5个样点,每个样点的PVC环半径为4.5 cm、高度为9 cm,露出地面1 cm与气室紧密接触。于每天12:00(大雨雪天气除外)观测各样点的土壤呼吸速率,取各样点平均观测值作为该日的土壤呼吸速率(Eric et al., 1998; Luitgard et al., 2003)。选择与平均观测值最接近的样点,每旬连续测量3 d,每小时观测1次。观测时间:2006年全年。
2.2 土壤温度与湿度测定采用土壤温湿度自动观测系统测定0~20 cm土层内土壤含水量以及表层、5、10、15和20 cm深度处土壤温度。数据采集时间间隔均为30 min。土壤温度与土壤含水量传感器分别为A107(美国,YSI)和ECH2O(美国,Decagon),数据采集器为AR5-8A-SE(美国,Pace scientific)。观测时间:2006年全年。
2.3 数据分析采用Office excel 2003,SPSS 11.5等软件处理数据,并完成数据的多元统计回归分析。
3 结果与分析 3.1 土壤呼吸时间变化特征 3.1.1 日内变化特征对刺槐林非主要生长季(1—3月、11—12月)和主要生长季(4—10月)各观测日对应时刻的土壤呼吸速率(SRR)观测值分别进行平均计算,分析SRR的变化特征。结果表明(图 1):SRR日内变化不显著, 其标准差在主要生长季节及非主要生长季节分别为0.079、0.038。但主要生长季SRR明显高于非主要生长季,平均约高294%。这是由于非主要生长季刺槐大都处于休眠状态且土壤温度低,加之降水较少使土壤含水量较低,造成非生长季土壤呼吸一直处于较低的水平,且差异不明显。
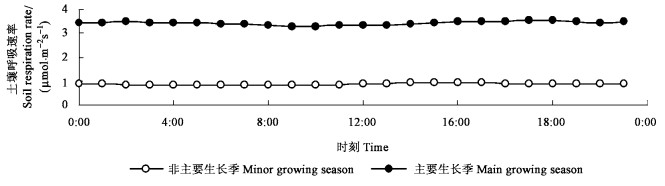
|
图 1 土壤呼吸日变化 Figure 1 Diurnal variation of soil respiration rate |
为进一步了解刺槐林SRR在全年的昼夜变化情况,在春夏秋冬4个季节各选取一个典型日进行分析,结果表明(图 2):在夏季6月23日和秋季10月25日的SRR大于春季2月23日和冬季12月17日,与图 1中平均值变化趋势基本一致。6月23日、10月25日、12月17日和2月23日SRR日变化的标准差分别是0.367 7,0.046 0、0.044 4、0.025,均小于1,说明了该4日SRR日变化特征都不显著,只不过由于其土壤温度以及土壤内部微生物和根系活动在个别日变化特征相对明显,使得该日SRR昼夜变化表现出了波动的特征,如6月23日正值刺槐林盛夏时期或生长旺季,对比其他3日,因其气温及土壤温度日变化特征相对较为明显,使得SRR日内波动特征也相对显著。
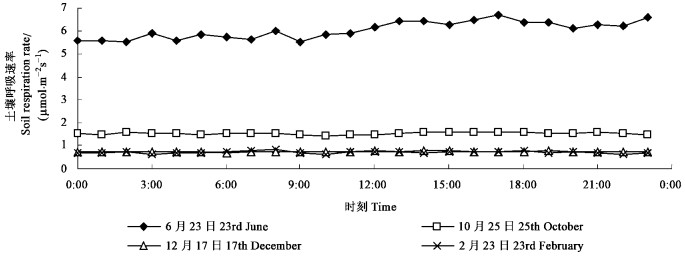
|
图 2 典型日土壤呼吸速率日变化 Figure 2 Diurnal variation of soil respiration rate in typical day |
从图 3可知,SRR呈现出明显的日际及季节变化特征,全年呈现出单峰变化趋势, 且SRR季节变化与其土壤温度的季节变化基本一致,但由于土壤湿度及刺槐自身生理变化,SRR表现出了波动特征。1—3月,SRR较低,日际波动不显著。随着气温、土壤温度迅速回升以及刺槐叶片和根系的生长,SRR于4月开始逐渐增加,至7月达到最大值,而后开始逐渐下降,直至11月约降低至1—3月时的水平,并保持到12月。计算表明:刺槐全年SRR的平均值为2.50 μmol·m-2s-1,其中,非主要生长季(1—3月、11—12月)平均值为0.90 μmol·m-2s-1,主要生长季(4—10月)为3.63 μmol·m-2s-1,后者明显高于前者。最低值为2月8日的0.55 μmol·m-2s-1,最高值为7月12日的8.69 μmol·m-2s-1。
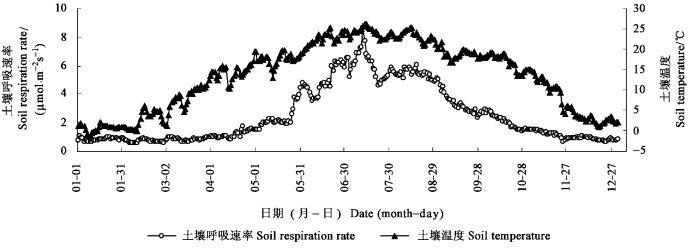
|
图 3 土壤呼吸季节变化 Figure 3 Daily variation of soil respiration rate |
为分析刺槐林土壤呼吸与土壤温度的关系,将刺槐各日SRR与不同深度处土壤温度进行回归分析, 结果表明(图 4):各深度土壤温度(Ts)与SRR间都存在极显著的指数相关关系(p<0.01),Ts与SRR的相关性随深度的增加而略有增加,与20 cm深度处土壤温度相关性最好。这是由于土壤呼吸主要是由根系呼吸和微生物呼吸共同来决定的,刺槐样地土层较厚,刺槐根系主要分布在20 cm深度附近处,这一深度处土壤微生物也较为活跃,使得根系和微生物呼吸速率在20 cm深度附近处达到最大。因此,SRR的变化趋势与20 cm深度处土壤温度的变化趋势最为接近,其回归方程可表示为
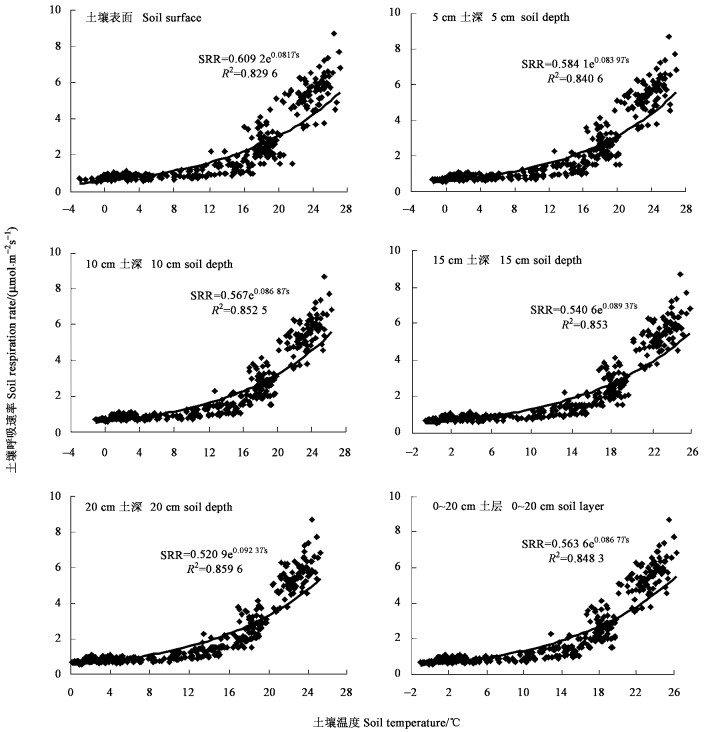
|
图 4 土壤呼吸速率(SRR)与土壤温度(Ts)的关系 Figure 4 Relationship between soil respiration rate (SRR) and soil temperature (Ts) |
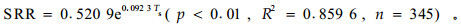
|
(1) |
式中:SRR为土壤呼吸速率(μmol·m-2s-1),Ts为土壤温度(℃)。由于雨雪天气影响,全年共中断观测20 d,因此有效统计天数为345 d。
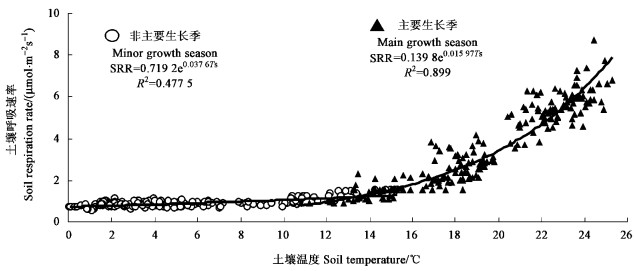
将SRR按照主要生长季节和非主要生长季节,分别与20 cm深度处土壤温度进行相关分析(图 5),结果表明:在非主要生长季节,SRR与土壤温度相关性较低,而主要生长季节则较高。Q10值表示温度每升高10 ℃时土壤呼吸的变化比率,长期以来,研究者使用Q10值来描述土壤呼吸与温度之间的关系(王小国等,2007)。本研究刺槐林的Q10值从表层(0 cm)至地下20 cm依次为:2.25、2.31、2.38、2.45和2.52。说明刺槐林Q10值随土层的加深而增大。非主要生长季节的Q10值为1.46,主要生长季节则为4.94,说明主要生长季节土壤呼吸对温度的变化更加敏感。
|
图 5 土壤呼吸与20 cm深度处土壤温度的关系 Figure 5 Relationship between soil respiration rate and soil temperature at 20 cm soil depth |
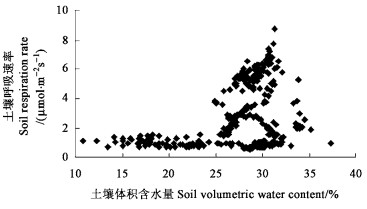
由图 6可知,0~20 cm土层土壤含水量与SRR的相关关系不明显,这主要是由于刺槐样地郁闭度较大,土壤终年潮湿,土壤水分充足(全年的土壤含水量大多在20%以上),保证了刺槐生长对水分的需求。可见土壤水分没有成为刺槐林土壤呼吸的限制因子。
|
图 6 土壤呼吸与土壤含水量的关系 Figure 6 Relationship between soil respiration rate and soil water content |
华北石质山区刺槐林在主要生长季的土壤呼吸速率明显大于非主要生长季,且全年日变化都不明显,但呈现出显著的日际或季节变化特征,全年表现出单峰波动趋势。最高值出现在7月份。土壤呼吸的季节变化趋势与土壤温度基本一致,但由于土壤含水量及刺槐自身生理过程的影响,表现出了较小的波动特征。
刺槐林土壤呼吸与0、5、10、15、20 cm深度处土壤温度都有较高的相关性,都通过了0.01水平上的显著性检验。且刺槐林在主要生长季的土壤呼吸速率与土壤温度的相关性高于非主要生长季。由于刺槐林全年土壤含水量较高,土壤水分在大多数时段内不是土壤呼吸的限制因子,土壤含水量与刺槐土壤呼吸速率的相关性不明显,因此影响刺槐林土壤呼吸的主要因素为土壤温度。
刺槐林Q10并非一个固定值,其值随着时间和空间的变化而变化。具体表现为:Q10值在0~20 cm范围内随土层的加深而增大,且生长季的Q10值高于非生长季。
一般认为,土壤温度与土壤呼吸关系密切(王淼等,2004;刘颖等, 2005;孙轶等,2005;Guan et al., 2006;杜颖等,2007)。本研究回归分析全年逐日的土壤呼吸值与土壤温度的关系,同样表明了土壤温度对土壤呼吸有较高的相关性。鉴于土壤温度更易于连续观测,且观测仪器成本更低,故在同一气候区、同一树种条件下的更大空间尺度上,可采用土壤温度模型来估算土壤呼吸总量。
土壤呼吸测定方法较多,选择合适的测定方法是准确计量土壤呼吸速率、顺利开展相关研究的重要工作基础。静态气室法与动态红外气室法是直接测定土壤呼吸的2类主要方法。我国有关土壤呼吸的研究大都采用静态气室法,包括静态碱液吸收法、静态箱-红外分析法、静态箱-气相色谱法,其主要缺点在于:气体采集所采用的静态暗箱改变了被测地表的物理环境,箱内大量的CO2可能限制土壤中CO2的释放(Ewel et al., 1987; Freijer et al., 1991)。其中,碱液吸收法还存在较大的误差(Jensen et al., 1996;马秀梅等,2004)。动态红外气室法对土壤表面物理环境扰动较小,且分析器精度较高,能较好地反映土壤呼吸的真实速率(崔骁勇等,2001),并可连续测量土壤呼吸的变化过程,是土壤呼吸测量的主导方向(易志刚等,2003b)。本研究采用动态气室法逐日观测了土壤呼吸速率,保证了数据的真实性与连续性。
本文为深入评价暖温带山地人工林对生态系统碳循环的影响提供了重要的科学依据,但仅分析了一种林分结构土壤呼吸变化特征。为更全面评价试验区所在地营造刺槐林对生态系统碳循环的影响,有待进一步研究不同林龄、不同密度等林分结构条件下的刺槐林土壤呼吸问题。
陈光水, 杨玉盛, 王小国, 等. 2005. 格氏栲天然林与人工林根系呼吸季节动态及影响因素. 生态学报, 25(8): 1941-1947. DOI:10.3321/j.issn:1000-0933.2005.08.016 |
崔骁勇, 陈佐忠, 陈四清. 2001. 草地土壤呼吸研究进展. 生态学报, 21(2): 315-325. |
杜颖, 关德新, 殷红, 等. 2007. 长白山阔叶红松林的温度效应. 生态学杂志, 26(6): 787-792. DOI:10.3321/j.issn:1000-4890.2007.06.003 |
房秋兰, 沙丽清. 2006. 西双版纳热带季节雨林与橡胶林土壤呼吸. 植物生态学报, 30(1): 97-103. DOI:10.3321/j.issn:1005-264X.2006.01.014 |
蒋延玲, 周广胜, 赵敏, 等. 2005. 长白山阔叶红松林生态系统土壤呼吸作用研究. 植物生态学报, 29(3): 411-414. DOI:10.3321/j.issn:1005-264X.2005.03.010 |
刘绍辉, 方精云, 清田信. 1998. 北京山地温带森林的土壤呼吸. 植物生态学报, 22(2): 119-126. |
刘颖, 韩士杰, 胡艳玲, 等. 2005. 土壤温度和湿度对长白松林土壤呼吸速率的影响. 应用生态学报, 16(9): 1581-1585. DOI:10.3321/j.issn:1001-9332.2005.09.001 |
马钦彦, 张学培, 韩海荣, 等. 2000. 山西太岳山森林土壤夏日CO2释放速率的研究. 北京林业大学学报, 22(4): 89-91. DOI:10.3321/j.issn:1000-1522.2000.04.015 |
马秀梅, 朱波, 韩广轩, 等. 2004. 土壤呼吸研究进展. 地球科学进展, 19(增): 291-295. |
孙向阳, 郭青俊. 1995. 妙峰山林地CO2释放量的初步研究. 北京林业大学学报, 17(4): 22-28. |
孙轶, 魏晶, 吴钢, 等. 2005. 长白山高山冻原土壤呼吸及其影响因子分析. 生态学杂志, 24(6): 603-606. DOI:10.3321/j.issn:1000-4890.2005.06.004 |
王淼, 韩士杰, 王跃思. 2004. 影响阔叶红松林土壤CO2排放的主要因素. 生态学杂志, 23(5): 24-29. DOI:10.3321/j.issn:1000-4890.2004.05.005 |
王小国, 朱波, 王艳强, 等. 2007. 不同土地利用方式下土壤呼吸及其温度敏感性. 生态学报, 27(5): 1960-1968. DOI:10.3321/j.issn:1000-0933.2007.05.036 |
易志刚, 蚁伟民, 周国逸, 等. 2003a. 鼎湖山三种主要植被类型土壤碳释放研究. 生态学报, 23(8): 1673-1678. |
易志刚, 蚁伟民. 2003b. 森林生态系统中土壤呼吸研究进展. 生态环境, 12(3): 361-365. |
张连举, 王兵, 刘苑秋, 等. 2007. 大岗山四种林型夏秋季土壤呼吸研究. 江西农业大学学报, 29(1): 72-76, 84. |
周玉荣, 于振良, 赵士栋. 2000. 我国主要森林生态系统碳储量与碳平衡. 植物生态学报, 24(5): 518-522. DOI:10.3321/j.issn:1005-264X.2000.05.002 |
Alvarez R, Alvarez C R. 2001. Temperature regulation of soil carbon dioxide production in the Humid Pampaod Aregentina: estimation of carbon fluxes under climate change. Biology and Fertility of Soils, 34: 282-285. DOI:10.1007/s003740100408 |
Burton A J, Pregitzer K S. 2003. Field measurements of root respiration indicate little to no seasonal temperature acclimation for sugar maple and red pine. Tree Physiology, 23: 273-280. DOI:10.1093/treephys/23.4.273 |
Dixon R K, Brown S, Houghton R A, et al. 1994. Carbon pools and flux of global forest ecosystems. Science, 263: 185-190. DOI:10.1126/science.263.5144.185 |
Eric B, Elizabeth B, Richard B. 1998. Soil water content and temperature as independent or confounded factors controlling soil respiration in a temperature mixed hardwood forest. Global Change Biology, 4: 217-227. DOI:10.1046/j.1365-2486.1998.00128.x |
Ewel K C, Cropper W P, Gholz H L. 1987. Soil CO2 evolution in Florida slash pine plantations. Ⅰ. changes through time. Canadian Journal of Forest Research, 17: 325-329. DOI:10.1139/x87-054 |
Freijer J I, Bouten W. 1991. A comparison of field methods for measuring soil carbon dioxide evolution: experiments and simulation. Plant Soil, 135: 133-142. DOI:10.1007/BF00014786 |
Guan D X, Wu J B, Zhao X S, et al. 2006. CO2 fluxes over an old, temperate mixed forest in northeastern China. Agricultural and Forest Meteorology, 137: 138-149. DOI:10.1016/j.agrformet.2006.02.003 |
Jensen L S, Mueller T, Tate K R, et al. 1996. Soil surface CO2 flux as an index of soil respiration in situ: a comparison of two chamber methods. Soil Biology and Biochemistry, 28(10/11): 1297-1306. |
Lohila A, Aurela M, Regina K, et al. 2003. Soil and total ecosystem respiration in agricultural fields: Effect of soil and crop type. Plant and Soil, 251: 303-317. DOI:10.1023/A:1023004205844 |
Luitgard S, Edzo V, Tania B, et al. 2003. Spatial and temporal variation in soil CO2 efflux in an old-growth neotropical rain forest, La Selva, Costa Rica. Biogeochemistry, 64: 111-128. DOI:10.1023/A:1024941614919 |
Mathes K, Schricfer T. 1985. Soil respiration during secondary succession: Influence of temperature and moisture. Soil Biology and Biochemistry, 17: 205-211. DOI:10.1016/0038-0717(85)90116-6 |
Post W M, Emanuel W R, Zinke P J, et al. 1982. Soil pool and world life zones. Nature, 298: 156-159. DOI:10.1038/298156a0 |
Raich J W, Potter C S. 1995. Global patterns of carbon dioxide emissions from soils. Global Biogeochemistry Cycles, 9: 23-36. DOI:10.1029/94GB02723 |
Richardson A M M, Morton H P. 1986. Terrestrial amphipods(Crustacea, Amphipoda, f. Talitridae) and soil respiration. Soil Biology and Biochemistry, 18: 197-200. DOI:10.1016/0038-0717(86)90027-1 |
Schlesinger W H, Andrews J A. 2000. Soil respiration and the global carbon cycle. Biogeochemistry, 48: 7-20. DOI:10.1023/A:1006247623877 |
 2008, Vol. 44
2008, Vol. 44
