2. 四川省医学科学院四川省人民医院器官移植研究所,成都 610072
2. Institute of Organ Transplantation, Sichuan Academy of Medical Science & Sichuan Provincial People's Hospital, Chengdu 610072, China
自1997年体细胞克隆羊“多莉”诞生以来,诸如小鼠、大鼠、牛、猪、狗等哺乳动物的体细胞克隆相继获得成功,但与人类相近的灵长类动物的体细胞克隆一直未能突破。2017年11月27日,世界上首个体细胞克隆猴“中中”在中国科学院神经科学研究所非人灵长类研究平台诞生,12月5日第2只克隆猴“华华”诞生(图 1)。2018年1月25日,中国科学院上海神经科学研究所孙强、蒲慕明领导的研究团队在《Cell》上发表了《Cloning of Macaque Monkeys by Somatic Cell Nuclear Transfer》的重要成果,在国际上首次报道利用体细胞核移植技术培育了克隆猴。美国俄勒冈灵长类研究中心著名科学家Shoukhrat Mitalipov随即在《Nature》高度评价了这项突破[1-2]。
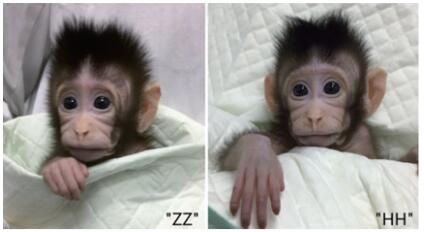 | 图 1 克隆猴“中中”和“华华”(图片来源:《Cell》) |
体细胞克隆猴技术率先被中国科学家孙强率领的团队突破,诞生了世界首批体细胞克隆猴。中国的克隆技术从跟跑到并跑到领跑,是国家对科技投入持续增加带来的重大进步,也是国家战略决策与机遇的必然结果。
1 体细胞克隆猴技术及难点此次体细胞克隆食蟹猴(
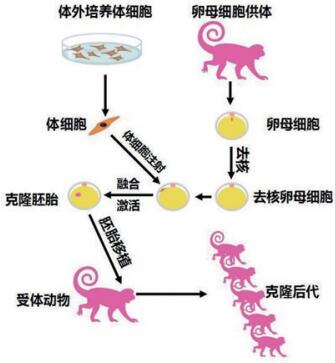 | 图 2 克隆猴技术流程(图片来源:《Cell》) |
体细胞克隆猴难点主要在3个方面。
一是不同物种之间卵子成熟、胚胎发育条件都不一样,需要摸索很多试验条件。猴子是灵长类动物,资源有限,母猴需要4~5年性成熟后才能超排取卵。试验时需要大量的母猴超排取卵,也需要大量母猴做代孕。
二是需要熟练的核移植技术人员、手术冲卵和胚胎移植技术人员。本次克隆猴核移植技术人员熟练使用纺锤体偏振光示踪核物质一次快速去核技术(图 3),虽然不是新的技术,但对于数目有限的珍贵猴卵母细胞,确保每个卵母细胞都去除了核物质至关重要。而经常在克隆猪试验中使用的盲吸去核法去核率仅有40%~80%,紫外线(UV)示踪去核法对胚胎的发育有一定的损伤。因此,本研究使用纺锤体偏振光示踪去核对试验成功有重要帮助。
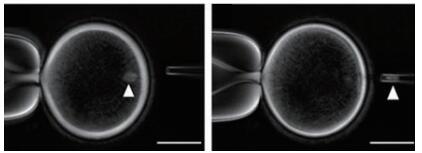 | 图 3 纺锤体偏振光去核(图片来源:《Cell》) |
三是猴的体细胞克隆胚胎发育差。克隆胚胎发育到囊胚(着床前)效率低,优质囊胚比例更低,是猴胚胎发育的内在问题,在其供体细胞核的基因组里存在着重编程抗性区(RRRs)。RRRs的存在阻碍了具有多分化潜能调控功能的基因表达,使得SCNT技术中的重构胚胎发育受阻,这也是灵长类动物克隆一直无法成功的最大障碍。研究人员发现,向卵细胞导入组蛋白H3三甲基化赖氨酸9(H3K9me3)的去甲基化酶Kdm4和组蛋白乙酰化酶抑制剂曲古抑菌素A(TSA),改善SCNT胚胎的囊胚发育和妊娠率。使用猴成纤维细胞的SCNT实验中,21只代孕母猴中的6只成功怀孕,最终生下2只健康的猴子“中中”和“华华”。
2 体细胞克隆动物简史及克隆猴的回顾体细胞克隆的历史要追溯到1952年,Robert Briggs和Thomas King开始进行青蛙克隆的试验,他们将青蛙受精卵的细胞核移植到卵细胞中并发育出胚胎,成长为蝌蚪,这是人类第1次用细胞核移植技术成功发育出胚胎。那么成熟的体细胞核能否移植并发育产生克隆动物呢?1958年,英国牛津大学的科学家John Gurdon成功地将蝌蚪肠上皮细胞的细胞核移植到青蛙卵细胞里,并发育出胚胎,2012年获得诺贝尔生理学奖。哺乳动物的首次体细胞克隆是在1996年由Keith Campbell和Ian Wilmut实现的,他们采用已经分化的成熟的体细胞核(乳腺细胞)通过核移植技术克隆出了“多莉”羊。克隆羊“多莉”是体细胞克隆技术里程碑式的进展,由此之后,小鼠(1998)、牛(1998)、猪(2000)、马(2003)、大鼠(2003)、狗(2005)等哺乳动物的体细胞相继成功实现克隆(图 4)。克隆技术已复制了20多种哺乳动物,然而灵长类体细胞核移植的研究似乎并不顺利。国内外多个实验室曾经努力开展克隆猴的相关研究,但均未成功获得活体。
 | 图 4 克隆动物时间年表(图片来源:《Nature》) |
谈到克隆猴,最早可以追溯到1997年,美国俄勒冈灵长类动物研究中心孟励博士作为第1作者报道了通过胚胎卵裂球核移植技术获得的第1只克隆猴[3]。2002年,俄勒冈灵长类研究中心研究人员利用猴的体细胞进行核移植试验,但是没有进行胚胎移植[4]。2003年,美国匹兹堡大学研究人员进行了克隆猴胚胎的移植,但没有检测到妊娠。之后又有多个研究团队尝试对猴进行体细胞克隆,最接近成功的有两次。2004年,新加坡国立大学研究人员将猴卵丘细胞和成纤维细胞核移植到去核的卵母细胞,获得93枚猴克隆胚胎,移植到31只代孕母猴体内,检测到7只怀孕,但是最终没有1只妊娠超过60天[5]。2010年,美国俄勒冈灵长类研究中心再次进行克隆猴的尝试,将67枚猴克隆胚胎移植到10只受体猴体内,有5只检测到怀孕,其中只有1只是活胎,可惜在81天时流产[6]。该项目负责人、克隆猴领域曾经的领跑者、曾被科学界认为最可能第1个克隆出猴子的著名科学家Shoukhrat Mitalipov甚至认为,现有技术无法获得体细胞克隆猴。2006—2007年期间,中国科学家季维智和周琪等合作开展了克隆猴胚胎的基础研究,发现克隆胚胎的DNA甲基化水平较高[7-8]。
非人灵长类体细胞克隆主要在美国和中国等国家的不到10家实验室开展了研究(图 5)。克隆的核心在于,如何让已经高度分化的体细胞重新变回分化前的状态,这种类似“时光逆转”的反自然过程被称为“重编程”。克隆猴的成功,一个关键因素是他们在体细胞核移植体系中充分利用了近年来体细胞重编程的化学手段TSA和Kdm4d的表观修饰作用,解决了猴体细胞重编程过程中去甲基化、乙酰化的障碍。2014年华裔科学家、美国哈佛医学院教授张毅实验室研究发现,在体细胞核移植实验中,组蛋白H3K9me3的修饰所介导的转录沉默是阻挡细胞重编程进行的“屏障”,加入去甲基化酶Kdm4d可以使得重编程效率大大增加[9]。2016年,同济大学高绍荣团队也发现,联合使用去甲基化酶Kdm4b和Kdm5b能极大提高小鼠克隆胚胎的囊胚率及出生率[10]。而早在2006年,日本理化学研究所RIKEN的Wakayama团队则发现乙酰化酶抑制剂TSA能提高小鼠克隆效率[11]。因此,“中中”和“华华”的诞生是克隆领域近几年发展的一项集成,离不开科学家们长期以来对克隆胚胎重编程机制的研究。
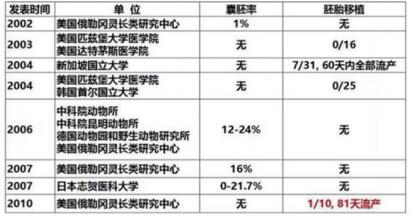 | 图 5 非人灵长类体细胞克隆主要进展(图片来源:孙强课题组) |
虽然此次体细胞成功克隆了“中中”和“华华”,但目前来看,采用SCNT技术克隆食蟹猴的成功率很低,克隆猴的健康状况还有待观察,对短时间内批量化克隆猴持有谨慎乐观的态度。
3 体细胞克隆猴的应用及克隆技术的应用现状猴和人类非常相似,灵长类动物做疾病模型优势巨大。目前,常用小鼠作为模型进行人类相关基础研究,已有大量实践表明小鼠与人差距较大。克隆猴的成功,将推动中国率先发展出基于非人灵长类疾病动物模型的全新医药研发产业链,促进针对阿尔茨海默病、自闭症等脑疾病以及肿瘤的新药研发进程。目前很多疾病的分析方法还没有在灵长类模型上成熟应用,主要是时间和经费的问题,猴作为灵长类动物,资源有限,世代间隔长,试验成本高。
猪作为大型动物,资源丰富,繁殖周期短,多胎,饲养成本低,已广泛应用于人类疾病模型研究,特别是心血管疾病和代谢研究。猪的器官大小和解剖结构与人类相似,是人类异种器官移植的理想供体。克隆猪技术比较成熟,自2000年克隆猪突破后,全世界多个国家获得了克隆猪,基因敲除克隆猪、转基因克隆猪的妊娠率目前可达70%~80%。利用克隆猪技术,美国、德国、中国、澳大利亚、韩国、日本等培育了大量的基因修饰猪,美国联合治疗公司在异种器官移植猪方面处于国际领先,将在2019年进行异种器官的临床试验。
猴和猪是人类转化医学研究的良好大动物模型,小鼠、猪、猴等模型对人类研究的参考价值如图 6所示。
 | 图 6 小鼠、猪、猴模型与人类研究的等级关系 |
体细胞克隆猴的突破,归结于中国科学家早在十多年前提出发展大动物(猴、猪)模型战略的机遇,在中国科学院先导项目专项经费的资助下,孙强团队在体细胞猴领域历时5年多终于取得重要突破。其他实验室也进行了大量探索,并尝试了表观遗传修饰手段但没有成功,由此看来专注和坚持非常重要,同时也要有一点运气。
体细胞克隆技术诞生20多年以来,克隆效率还很低,一些克隆动物发育异常的问题也没有得到显著改善,如胎儿畸形、器官发育不全、易流产等,克隆重编程机理还不是很清楚。此次克隆猴成功地使用了表观修饰的化学方法促进体细胞重编程,科学家对“克隆”的干预找到方向,一定程度上提高了猴克隆胚胎效率。同时,非常让人惊喜的是,克隆胚胎移植后的妊娠率很高,说明中国克隆猴团队已建立了一套高效克隆猴技术体系。
中国克隆猴成功后,国内外会有更多实验室跟上,利用更多的资源和人力,进一步优化重编程方法及其他技术环节,再经过一段时间会有更多的实验室获得克隆猴。此次成纤维细胞克隆猴的成功,让我们有理由期待,今后可以在成纤维细胞基础上进行基因编辑,利用克隆技术培育具有重要研究价值的疾病模型猴。
| [1] | Zhen L, Cai Y, Yan W, et al. Cloning of macaque monkeys by somatic cell nuclear transfer[J]. Cell, 2018, 172(4):1-7. |
| [2] | David Cyranoski. Monkeys cloned in China[J]. Nature, 2018, 553:387-388. |
| [3] | Meng L, Ely J J, Stouffer R L, et al. Rhesus monkeys produced by nuclear transfer.[J]. Biology of Reproduction, 1997, 57(2):454-459. |
| [4] | Mitalipov S M, Yeoman R R, Nusser K D, et al. Rhesus monkey embryos produced by nuclear transfer from embryonic blastomeres or somatic cells[J]. Biology of Reproduction, 2002, 66(5):1367-1373. |
| [5] | Ng S C, Chen N, Yip W Y, et al. The first cell cycle after transfer of somatic cell nuclei in a non-human primate[J]. Development, 2004, 131(10):2475-2484. |
| [6] | Michelle L S, Masahito T, Shoukhrat M M. Cloning of non-human primates:the road "less traveled by"[J]. International Journal of Developmental Biology, 2010, 54(11-12):1671-1678. |
| [7] | Mitalipov S M, Zhou Q, Byrne J A, et al. Reprogramming following somatic cell nuclear transfer in primates is dependent upon nuclear remodeling[J]. Human Reproduction, 2007, 22(8):2232-2242. |
| [8] | Yang J, Yang S, Beaujean N, et al. Epigenetic marks in cloned rhesus monkey embryos:Comparison with counterparts produced in vitro.[J]. Biology of Reproduction, 2007, 76(1):36-42. |
| [9] | Matoba S, Liu Y, Lu F, et al. Embryonic development following somatic cell nuclear transfer impeded by persisting histone methylation[J]. Cell, 2014, 159(4):884-895. |
| [10] | Liu W, Liu X, Wang C, et al. Identification of key factors conquering developmental arrest of somatic cell cloned embryos by combining embryo biopsy and single-cell sequencing[J]. Cell Discovery, 2016, 2:16010. |
| [11] | Kishigami S, Mizutani E, Ohta H, et al. Significant improvement of mouse cloning technique by treatment with trichostatin A after somatic nuclear transfer[J]. Biochemical & Biophysical Research Communications, 2006, 340(1):183-189. |