2. 天津市滨海新区疾病预防控制中心
高氯酸盐是一种有毒的无机化学物质,其在自然界中天然存在,也可人工合成制备[1]。溶解后的高氯酸盐离子性质稳定,在自然水环境中可以稳定存在几十年[2]。Stetson等[3]对一系列常见水样中的高氯酸盐离子的稳定性实验表明高氯酸根离子可稳定存在于所储存的水样中,常见的强还原剂很难将其还原,是一种持久性污染物[4]。目前,我国尚未有饮用水中高氯酸盐的卫生标准限值,也没有相应的标准检验方法。开发一种具有较强推广性和可操作性的饮用水中高氯酸盐的检测方法对我国饮用水中高氯酸盐的监测及健康风险评估是十分必要的。本实验方法参考美国EPA发布的《离子色谱检测饮用水中高氯酸盐》(US EPA Method 314.0)[5],在此基础上,对原有实验方法进行了优化和改进,利用新型号的IonPac AS20离子色谱柱,消除了对氯苯磺酸与高氯酸盐的共淋洗问题[6],调整了淋洗液浓度等实验条件,缩短了高氯酸盐的保留时间,进样量选择500 μL大体积进样,提高了检测方法的灵敏度。
1 材料与方法 1.1 仪器与试剂DionexICS-2100型离子色谱仪(Dionex,美国),附电导检测器、ECGⅢ型KOH淋洗液自动发生器、AERS 500(4 mm)型自动再生抑制器、AS-AP自动进样器、Chromeleon色谱工作站,IonPacAS20(250 mm×4 mm)型分析柱、IonPacAG20型保护柱(50 mm×4 mm)。
0.22 μm水系针筒式聚醚砜微孔滤膜过滤器,MilliQ超纯水系统(Millipore,美国):纯化过的超纯水(电阻率≥18.2 MΩ ·cm),高氯酸盐标准品采用高氯酸钠水合物(NaClO4 ·H2O):纯度>98%,CAS号:7791-07-3(Sigma-Aldrich,美国)。
1.2 色谱条件与分析方法色谱分析柱的选择对实验结果有十分重要的影响,由于高氯酸盐具有较强亲水性,在利用离子色谱测定时,需要选择高度亲水性的阴离子交换柱,而IonPac AS20色谱柱是一种具有强亲水性和高容量的阴离子交换柱,该柱克服了高氯酸盐亲水性和极化性强造成的强保留和峰型差的缺陷,同时,该柱对OH-离子具有高选择性,非常适合水中高氯酸盐的检测分析。所以本实验采用IonPac AS20色谱柱分析高氯酸盐。
研究使用了AERS 500(4 mm)型抑制器,该抑制器是连续自动再生抑制器,操作简单,对于淋洗液抑制所需的H+离子和OH-离子通过电解水连续提供,根据不同的淋洗液浓度来设定不同的抑制器电流值,无需额外的化学试剂和再生液。抑制器开机后平衡快,且抑制容量大,基线漂移小,背景电导值低,可显著提高高氯酸盐的检测灵敏度。
分析方法采用OH-型淋洗液,淋洗液经抑制器后转变为H2O,负峰小,背景电导噪声低,检测灵敏度高,可实现大体积进样。为提高方法的灵敏度,实验选择500 μL为进样体积。因淋洗液浓度会对高氯酸盐的保留时间、峰宽和峰面积造成影响,本研究试验了10.0 μg/L的高氯酸盐标准溶液在30.0、35.0、40.0、45.0和50.0 mmol/L淋洗液浓度时的保留时间、峰宽、峰面积(表 1)。在保持淋洗液流速1.00 mL/min、检测池温度35.0 ℃、柱温30.0 ℃、抑制器电流112 mA、进样量500 μL时,淋洗液浓度选择为45.0 mmol/L时,可在20.0 min内将全部离子洗脱,高氯酸盐可完成出峰且峰型理想,无其他杂质峰的干扰,因此,方法选择的KOH淋洗液浓度为45.0 mmol/L。
| 淋洗液浓度/ (mmol/L) |
保留时间/ min |
峰高/ μS |
峰宽/ min |
峰面积/ (μS·min) |
| 30.0 | 16.8 | 0.027 2 | 0.801 | 0.013 5 |
| 35.0 | 14.8 | 0.030 3 | 0.713 | 0.013 4 |
| 40.0 | 13.4 | 0.032 3 | 0.652 | 0.013 5 |
| 45.0 | 12.3 | 0.034 2 | 0.603 | 0.013 5 |
| 50.0 | 11.4 | 0.037 4 | 0.548 | 0.013 0 |
研究中采用等梯度淋洗,淋洗液氢氧化钾(KOH)浓度:45.0 mmol/L;淋洗液流速:1.00 mL/min;进样量:500 μL;检测池温度:35.0 ℃;柱温:30.0 ℃;抑制器电流:112 mA;数据采集时间:20 min。
1.3 高氯酸盐标准液的配制高氯酸盐标准储备液:准确称取NaClO4 ·H2O标准品0.141 2 g,定容于100 mL超纯水中,配制成1.00 mg/mL标准储备溶液。储存于棕色玻璃瓶中,4 ℃冰箱中保存备用。高氯酸盐标准系列:将标准储备液进行稀释,配制成5.00、10.0、20.0、30.0、50.0、70.0、90.0、110和140 μg/L的标准使用溶液。使用2.2中的条件进行测定,绘制以浓度(μg/L)为横坐标,峰面积(μS ·min)为纵坐标的标准曲线。
1.4 样品的采集、保存及预处理水样采集自A市、B市、C市3个地区,样品采样体积500 mL,采样瓶使用白色聚丙烯瓶,样品采集后保存于事先放入冷冻冰排的恒温采样箱中,送实验室上机测定,样品上机前用0.22 μm水系针筒式聚醚砜微孔滤膜过滤器进行过滤。每个地区选择3个水厂,采集出厂水和末梢水水样各1份。
1.5 结果计算以保留时间定性、峰面积定量,通过标准曲线确定样品中高氯酸盐含量。
2 结果 2.1 方法线性范围、回归方程与检出限确定色谱分析条件后,使用1.3中配制的高氯酸盐标准使用溶液在1.2的色谱条件下,按从低至高浓度顺序依次进行检测。使用外标法进行定量,以高氯酸盐浓度为横坐标,峰面积为纵坐标,绘制标准曲线。结果显示,在(5.00 ~140)μg/L范围内,具有良好的线性,相关系数r=0.999 9,回归方程为y=0.001 6x- 0.002 7,以3倍信噪比(S/N=3)估算检出限,逐级稀释标准溶液上机检测,确定方法检出限为2.00 μg/L,以10倍信噪比(S/N=10)估算定量限,逐级稀释标准溶液上机检测,确定方法定量限为5.00 μg/L。70.0 μg/L浓度高氯酸盐标准溶液的色谱图见图 1,实际样品及其加标70.0 μg/L高氯酸盐的色谱图见图 2。
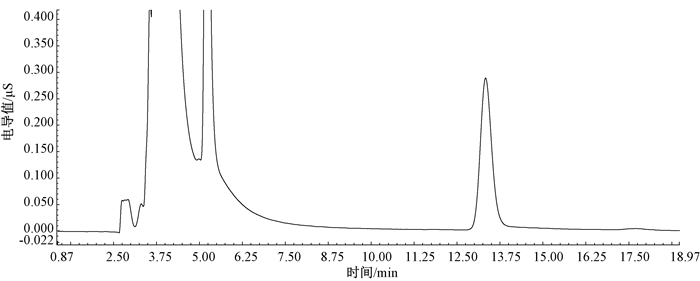
|
| 图 1 高氯酸盐离子色谱图(高氯酸盐标准溶液,浓度70.0 μg/L) |
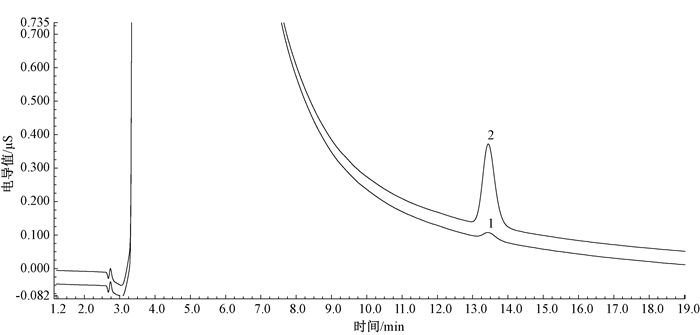
|
| 注:1水样;2加标70.0 μg/L后水样 图 2 水样及加标70.0 μg/L后的水样色谱图 |
2.2 方法精密度与准确度
实验采用相对标准偏差(RSD)和加标回收率分别考察精密度和准确度。使用某地实际饮用水样品,分别加入5.00、70.0和130 μg/L高氯酸盐标准溶液,加标前后每个水样均重复测定6次,经计算,加标回收率为86.2%~97.2%,RSD为1.21%~2.29%(表 2)。
2.3 实际水样分析分别在A市、B市和C市采集3个水厂的出厂水和末梢水,共18份水样,出厂水和末梢水各9份。水样经0.22 μm聚醚砜微孔滤膜过滤后直接上机检测,使用2.3中的标准曲线测定水样中的高氯酸盐浓度,每份水样测定3次,取平均值。在每个城市的第3个水厂的出厂水中加入高氯酸盐标准溶液进行加标回收试验,以评估方法准确性,加标浓度均为70.0 μg/L。结果显示,出厂水和末梢水中高氯酸盐的检出率均为44.4%,浓度范围分别为(8.25~ 10.1)和(8.13~10.1)μg/L;加标回收率为90.5%~91.7%(表 3)。
| 样品编号 | 水源类型 | 出厂水检测值 /(μg/L) |
末梢水检测值 /(μg/L) |
出厂水加标样品测定浓度/(μg/L) | 回收率 /% |
| A市1# | 地表水 | 10.1 | 10.1 | / | / |
| A市2# | 地表水 | 9.66 | 9.65 | / | / |
| A市3# | 地表水 | ND | ND | 63.5 | 90.7 |
| B市1# | 地表水 | ND | ND | / | / |
| B市2# | 地表水 | ND | ND | / | / |
| B市3# | 地下水 | ND | ND | 64.2 | 91.7 |
| C市1# | 地表水 | 8.80 | 8.42 | / | / |
| C市2# | 地表水 | 8.25 | 8.13 | / | / |
| C市3# | 地下水 | ND | ND | 63.4 | 90.6 |
| 注:“/”为未进行检测 | |||||
2.4 样品保存条件试验
为有效控制长距离运输对水样中待测物浓度造成的影响,本研究针对采样瓶材质、样品保存温度等开展了样品保存条件试验。分别使用两组聚丙烯瓶(PP瓶)和聚乙烯瓶(PE瓶),一组于室温条件下保存,一组于4 ℃低温条件下保存。每组采样瓶中均以某地末梢水为本底样品,分别加入5.00、70.0、130 μg/L高氯酸盐标准溶液,对本底样品及加标样品均连续测定28 d。试验结果见表 4和表 5。
| 测试时间 | PE瓶(室温) | PE瓶(4 ℃) | |||||||
| 本底 | 加标5.00 | 加标70.0 | 加标130 | 本底 | 加标5.00 | 加标70.0 | 加标130 | ||
| 第1天 | 7.17 | 12.0 | 69.1 | 127 | 6.93 | 11.4 | 72.6 | 126 | |
| 第2天 | 7.04 | 11.8 | 66.6 | 129 | 6.97 | 10.9 | 66.0 | 121 | |
| 第3天 | 6.65 | 11.0 | 65.7 | 120 | 6.96 | 10.9 | 65.7 | 120 | |
| 第4天 | 6.64 | 11.0 | 65.8 | 121 | 6.87 | 11.2 | 65.5 | 120 | |
| 第5天 | 6.71 | 11.6 | 65.1 | 120 | 6.75 | 10.7 | 65.1 | 120 | |
| 第14天 | 6.71 | 10.8 | 65.5 | 120 | 6.64 | 11.4 | 65.2 | 120 | |
| 第21天 | 6.77 | 10.9 | 64.6 | 120 | 6.80 | 10.7 | 64.5 | 119 | |
| 第28天 | 6.57 | 10.9 | 65.0 | 119 | 6.55 | 10.6 | 64.3 | 119 | |
| 测试时间 | PP瓶(室温) | PP瓶(4 ℃) | |||||||
| 本底 | 加标5.00 | 加标70.0 | 加标130 | 本底 | 加标5.00 | 加标70.0 | 加标130 | ||
| 第1天 | 6.88 | 11.2 | 68.6 | 124 | 6.84 | 11.5 | 66.7 | 127 | |
| 第2天 | 7.02 | 11.3 | 66.2 | 122 | 6.80 | 11.1 | 66.0 | 122 | |
| 第3天 | 6.67 | 11.0 | 64.9 | 121 | 6.72 | 11.0 | 66.9 | 121 | |
| 第4天 | 6.57 | 11.0 | 65.7 | 120 | 6.82 | 11.2 | 65.6 | 120 | |
| 第5天 | 6.41 | 11.0 | 65.3 | 120 | 6.67 | 11.1 | 64.8 | 120 | |
| 第14天 | 6.57 | 108 | 65.5 | 120 | 6.79 | 10.9 | 64.9 | 120 | |
| 第21天 | 6.69 | 10.8 | 64.7 | 119 | 6.58 | 10.7 | 64.5 | 119 | |
| 第28天 | 6.61 | 10.6 | 64.4 | 119 | 6.44 | 10.7 | 64.8 | 119 | |
由结果可见,在不同温度的保存条件下,使用聚乙烯瓶(PE瓶)保存的样品中高氯酸盐降解率为-0.580%~11.4%,使用聚丙烯瓶(PP瓶)保存的样品中高氯酸盐降解率为-2.03%~6.94%,使用聚丙烯瓶(PP瓶)保存的样品中高氯酸盐的降解率略优于聚乙烯瓶(PE瓶);温度条件对实验结果影响不大。因此本研究在实际样品运输中选择聚丙烯瓶作为采样容器,同时采用了冰排控温的运输方式,采样后快递送达实验室进行检测。
2.5 共淋洗干扰物质去除验证实验为考察对氯苯磺酸在检测分析时对高氯酸盐的共淋洗干扰作用的去除效果,本研究采用超纯水配制了500 μg/L的对氯苯磺酸标准溶液和100 μg/L的对氯苯磺酸与高氯酸盐混合标准溶液,使用本方法设置的色谱条件对两种标准溶液分别进行检测。通过500 μg/L的对氯苯磺酸标准溶液对该物质进行峰定位后,再与100 μg/L的对氯苯磺酸与高氯酸盐混合标准溶液检测图形进行比较,色谱比对图见图 3。
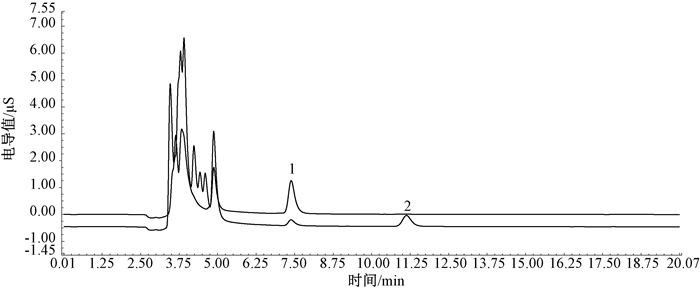
|
| 注:1对氯苯磺酸标准溶液(500 μg/L);2对氯苯磺酸与高氯酸盐混合标准溶液(100 μg/L) 图 3 对氯苯磺酸标准溶液(500 μg/L)与对氯苯磺酸和高氯酸盐混合标准溶液(100 μg/L)比对谱图 |
由图可见,对氯苯磺酸与高氯酸盐两峰之间的分离度R=8.17,通常采用R=1.50作为判断相邻两组分已完全分离的标志,因此认为在本方法条件下对氯苯磺酸与高氯酸盐在实际检测时已实现完全分离。
3 讨论研究中使用的IonPac AS20色谱分析柱具有亲水性强,高柱容量等特点,与美国EPA314.0中推荐使用的IonPac AS16分析柱相比较,该柱可去除对氯苯磺酸对高氯酸盐的干扰作用;以45.0 mmol/L浓度的KOH为淋洗液进行等度洗脱,实现了高氯酸盐与其他离子的完全分离;选择500 μL大体积进样,提高了检测灵敏度。研究建立的离子色谱法具有灵敏度高,分离度好,操作简单等优点,适用于饮用水中的高氯酸盐的检测。
方法的检出限为2.00 μg/L,定量限为5.00 μg/L,线性范围(5.00 ~140)μg/L条件下,r为0.999 9,满足饮用水中高氯酸盐的检测需求。
利用该方法对3个地区的实际样品进行了检测,出厂水和末梢水中高氯酸盐检出率均为44.4%,检出范围分别为(8.25~10.1)μg/L和(8.13~10.1)μg/L;抽样加标回收率为90.5%~91.7%。在我国部分地区饮用水中检出高氯酸盐,提示可能存在高氯酸盐污染,建议在全国范围特别是存在高氯酸盐污染风险的地区开展饮用水中高氯酸盐浓度水平的调查与健康风险评估。
| [1] |
陈桂葵, 孟凡静, 骆世明, 等. 高氯酸盐环境行为与生态毒理研究进展[J]. 生态环境, 2008, 17(6): 2503-2510. (In English: Chen GK, Meng FJ, Luo SM, et al. Research advance in environmental behavior and ecotoxicologicai effects of perchlorate[J]. Ecol Environ, 2008, 17(6): 2503-2510. DOI:10.3969/j.issn.1674-5906.2008.06.072) |
| [2] |
于佳, 唐玄乐, 宋建平, 等. 高氯酸盐的急性毒性和遗传毒性研究[J]. 毒理学杂志, 2007, 21(4): 267-269. (In English: Yu J, Tang XL, Song JP, et al. The study of Perchlorate on acute and genotoxic toxicity[J]. J Toxicol, 2007, 21(4): 267-269. DOI:10.3969/j.issn.1002-3127.2007.04.008) |
| [3] |
Stetson SJ, Wanty RB, Helsel DR, et al. Stability of low levels of perchlorate in drinking water and natural water samples[J]. Anal Chim Acta, 2006, 567(1): 108-113. DOI:10.1016/j.aca.2006.03.030 |
| [4] |
王荣. 高氯酸盐在环境介质中的污染水平研究进展[J]. 四川化工, 2016, 19(6): 39-42. (In English: Wang R. Pollution levels of perchlorate in environmental medium[J]. Sichuan Chem Ind, 2016, 19(6): 39-42. DOI:10.3969/j.issn.1672-4887.2016.06.011) |
| [5] |
Jackson PE, Gokhale S, Streib T, et al. Improved method for the determination of trace perchlorate in ground and drinking waters by ion chromatography[J]. Journal of Chromatography A, 2000. |
| [6] |
方黎, 吴杰, 苏宇亮. 离子色谱法测定水中的高氯酸盐[J]. 广东微量元素科学, 2008, 15(12): 61-63. (In English: Fang L, Wu J, Su YL. Determination of perchlorate in drinking water using ion chromatography[J]. Guangdong Trace Elements Sci, 2008, 15(12): 61-63. DOI:10.3969/j.issn.1006-446X.2008.12.013) |



