肝癌是我国高发的一种恶性消化系统肿瘤,其死亡率排位第二,2018年世界癌症报告显示肝癌患者五年生存率仅有10%左右[1-2],因此科研人员一直在努力探索新的治疗药物。布雷菲尔德菌素A(Brefeldin A,BFA)是一种能够引起蛋白质转运可逆抑制的大环内酯类抗生素[3-6],分子量为280.36,分子式为C16H24O4。近年来也发现其具有一定的直接抑癌作用[7],并且能通过抑制肿瘤细胞分泌基质金属蛋白酶9(MMP-9)的方式而抑制结直肠肿瘤的侵袭转移[8]。另据报道BFA可通过肌醇需求蛋白1α-X盒结合蛋白1(IRE1-XBP1)通路相关的内质网应激途径促进顺铂对肺癌GLC-82细胞的凋亡诱导作用[9-10]。BFA对肝癌细胞是否也具有一定的作用,其机制如何?为了解决这一问题,本研究观察了BFA对体外培养的肝癌细胞HepG2的囊泡转运相关、内质网应激蛋白的表达,探讨其治疗肝癌的可能性,为其机制研究提供线索。
1 材料和方法 1.1 细胞株人肝癌细胞株HepG2(中国科学院上海细胞生物研究所细胞库)。
1.2 仪器CO2培养箱Galaxy170S(New Brunswick Eppendorf公司);Spectra MAX340型酶标分析仪(美国Molecular Devices公司);UV-2450型紫外分光光度仪(日本岛津);Line Gene9600荧光定量PCR仪(杭州博日科技有限公司(BIOER);垂直蛋白电泳槽和电泳仪(北京六一仪器厂)。
1.3 试剂MTT试剂盒:包括5 mg/mL噻唑蓝染液[3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐溶液,3-(4, 5-Dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide,MTT染液]和Formazan溶解液(武汉博士德公司);蛋白酶抑制剂(普通/磷酸化),BCA蛋白定量试剂盒(武汉博士德公司);DMEM高糖培养基(Dulbecco's Modification of Eagles Medium,DMEM;美国Hyclone公司);小牛血清(杭州四季青生物工程材料有限公司);RNA提取试剂RNAiso Plus、反转录试剂盒Primer Script RT MASTER Mix、部分PCR引物、SYBR Premix Ex TaqTMⅡ(2×conc.)溶液(1 mL/支)(TaKaRa公司);所有引物由生工生物工程(上海)公司合成。兔抗人免疫球蛋白重链结合蛋白[immunoglobulin heavy chain binding protein,BiP(GRP78)],兔抗人钙联结蛋白(calnexin),单磷酸腺苷活化蛋白激酶α(AMP-activated protein kinase-α,AMPKα)和第172位苏氨酸磷酸化的腺苷酸活化蛋白激酶[(Phosphorylation alpha-AMP-activated protein kinase(Thr 172),p-AMPKα(Thr 172)](美国Cell Signaling Technology公司); 兔抗人p53、磷酸化-p53(Phospho-p53,p-p53)(Protein tech公司)。辣根过氧化物酶标记的羊抗鼠或羊抗兔抗体(武汉博士德或Abcam公司);ECL化学发光液(美国Pierce公司)。注射用青霉素钠[0.48 g/瓶(80万U/瓶),中诺药业(石家庄)有限公司];链霉素[8万U/支,2 mL/支,马鞍山丰原制药有限公司]。
BFA(上海Beyotime Biotechnology公司)。二甲基亚砜(Dimethyl sulfoxide,DMSO):纯度> 99.7%,液体(美国sigma公司)。BFA染毒液:于5 mL DMSO溶液中加入5 mg BFA配制成1 mg/mL的BFA原液,染毒时以高糖培养基稀释成BFA浓度分别为0.000 1、0.001、0.01、0.1、2.5和12.5 μg/mL的BFA染毒液。磷酸盐缓冲液(phosphate buffered saline,PBS)储备液:向800 mL双蒸水中加入80 g NaCl、1.44 g Na2HPO4、2 g KCl和2.4 g KH2PO4,涡旋混匀后用浓盐酸调节pH至7.4,最后加入双蒸水定容至1 000 mL。PBS使用液:取PBS储备液100 mL,加入双蒸水定容至1 000 mL。磷酸盐吐温缓冲液[Diethyl 2, 5-di(thiophen-2-yl)terephthalate, PBST]:取PBS储备液100 mL,加入双蒸水定容至1 000 mL,再加入0.5 mL Tween-20,涡旋混匀备用。胰蛋白酶(25 g,美国sigma公司)。0.25 %胰蛋白酶使用液(用灭菌烧杯):在100 mL的PBS使用液中加入0.25 g的胰蛋白酶,混匀,将pH调至7.2,无菌抽滤后分装,-20 ℃保存。油酸(oleic acid,OA,纯度>99%,美国sigma公司)。牛血清白蛋白(bovine serum albumin,BSA):购自武汉博士德公司。OA染毒液:称取0.68 g BSA粉末溶于10 mL PBS中得浓度为10 mmol/L BSA溶液,备用;取316 μL油酸原液加入到9.684 mL灭菌水中,配制成浓度为100 mmol/L的OA溶液,并用NaOH调pH至7.2,备用;取1.65 mL 100 mmol/L OA溶液,加入3 mL 10 mmol/L BSA溶液,加入5.35 mL PBS使用液,混匀作为OA-BSA混合液,备用;染毒时取121 μL OA-BSA混合液,加入1 879 μL高糖培养基混匀,配制成OA浓度为1 mmol/L的OA染毒液。高蛋白脱脂高钙奶粉(400 g,内蒙古伊利实业集团股份有限公司)。封闭液:2.5 g脱脂奶粉加入到50 mL PBST中混匀。
1.4 方法 1.4.1 细胞培养将HepG2细胞培养于含有10%小牛血清,100 U/mL青霉素和100 U/mL链霉素的DMEM高糖培养基中。置于5% CO2、37 ℃培养箱中培养,选取对数生长期的细胞进行实验。
1.4.2 细胞毒性试验(MTT法)选取对数生长期HepG2细胞,用0.25%的胰蛋白酶消化成单细胞悬液接种于96孔板中,每孔100 μL,于5% CO2、37 ℃培养箱中培养,待其贴壁后弃去原培养基再分别加入100 μL浓度为0.000 1、0.001、0.01、0.1、2.5和12.5 μg/mL的BFA染毒液,作为BFA实验组。同时设置阴性对照组(含新鲜培养基和HepG2细胞,无BFA)和空白对照组(仅有新鲜培养基,无HepG2细胞,无BFA),每组设置6个平行。染毒24 h和48 h后,更换100 μL新鲜培养基,每孔加入10 μL MTT染液,继续培养4 h后,每孔加入100 μL Formazan溶解液,置于培养基中继续培养4 h左右,直至显微镜下观察发现紫色结晶全部溶解,于570 nm波长处,测吸光度(OD),按下式计算细胞存活率。
| $ 细胞存活率/\% = \left( {O{D_{实验组}} - O{D_{空白组}}} \right)/\left( {O{D_{阴性对照组}} - O{D_{空白组}}} \right) \times 100\% $ | (1) |
式中:OD—吸光度
1.4.3 定量荧光PCR试验qRT-PCR法检测细胞内外壳蛋白复合物Ⅰ(coat protein complex Ⅰ,COPⅠ)、二磷酸腺苷核糖基化因子-1(adenosine diphosphate ribosylation factor-1,Arf1)、外壳蛋白复合物Ⅱ(coat protein complex Ⅱ,COPⅡ)、Sar1b(secretion-associated and Ras-related)、BiP(GRP78)和calnexin等基因的表达水平。将细胞接种于6孔板培养,分3个剂量组,每组2个平行,重复3次实验。第1组加入2 mL新鲜培养液,为阴性对照组;第2组加入2 mL OA染毒液(OA浓度为1 mmol/L),因为OA是诱导肝细胞脂质变性常用的诱导剂,所以将其作为阳性对照组;第3组加入2 mL BFA染毒液(BFA浓度为2.5 μg/mL),为BFA处理组。分别处理细胞24 h和48 h后,弃去上清液并用PBS使用液洗涤一次,加入RNAiso Plus裂解细胞提取总RNA,UV-2 450分光光度仪检测RNA的纯度和浓度,读取RNA在260 nm和280 nm处的OD,计算出两者的吸光度比值R(R=OD260/OD280,纯度较高的RNA其R值范围为1.8~2.2),RNA浓度=OD260×稀释倍数×0.04 μg/μL。按照反转录试剂盒说明,将500 ng的RNA反转录为cDNA,于-20 ℃冰箱保存备用。引物设计及合成均委托TaKaRa或生工生物工程(上海)公司,各基因引物序列如表 1所示。
| 基因 | 碱基序列 | 扩增产物大小/bp |
| actin-F | 5′-TGGCACCCAGCACAATGAA-3′ | 186 |
| actin-R | 5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′ | |
| COPⅠ-F | 5′-CAGATGTGGGCCGAATTTGA-3′ | 153 |
| COPⅠ-R | 5′-TGCCATAAAGCCACAGTAACCAGA-3′ | |
| Arf1-F | 5′- CGGGCTCTATGAAGGACTGG-3′ | 94 |
| Arf1-R | 5′- AGCAGAGGGCAAGAGGAGTG-3′ | |
| COPⅡ-F | 5′-GGTGGTCCACAGTAGTTACGACGA-3′ | 194 |
| COPⅡ-R | 5′-GTGGCCCACTTGGGTAATTCA-3′ | |
| Sar1b-F | 5′-CCATTGCTGGCATGACGTTTAC-3′ | 119 |
| Sar1b-R | 5′-GTCTGCACAATCCACCAGAAATACA-3′ | |
| BiP(GRP78)-F | 5′- GGTATTGAAACTGTGGGAGGTG-3′ | 157 |
| BiP(GRP78)-R | 5′- GATTGTCTTTTGTCAGGGGTCT-3′ | |
| calnexin-F | 5′-CGTACCTGATCCAGACGCAGAG-3′ | 115 |
| calnexin-R | 5′-GACACCACATCCAGGAGCTGAC-3′ |
PCR扩增体系(25 μL)包括12.5 μL SYBR Premix Ex TaqTMⅡ(2× conc.)溶液,10 μmol/L的上、下游引物各1 μL,双蒸水8.5 μL,cDNA 2 μL。PCR反应条件为预变性95 ℃ 30 s、变性95 ℃ 30 s、退火延伸60 ℃ 30 s,40个循环。加样时,每一样品和基因做3个复孔,反应结束后确认扩增曲线及融解曲线,试验重复3次取其平均值。各基因的相对表达量按下列公式计算:
| $ 基因的相对表达量 = {2^{ - \Delta \Delta Ct}}; $ | (2) |
| $ \Delta \Delta Ct = \left( {C{t_{实验组目的基因}} - C{t_{实验组内参基因}}} \right) - \left( {C{t_{对照组目的基因}} - C{t_{对照组内参基因}}} \right) $ | (3) |
式中:Ct—qPCR扩增过程中,扩增产物的荧光信号达到设定的荧光阈值时所对应的扩增循环数。
1.4.4 蛋白杂交实验选取对数生长期的细胞,用0.25%的胰蛋白酶消化成单细胞悬液接种于6孔板中,每孔3 000 μL,于5% CO2、37 ℃培养箱中培养。分3个剂量组,每组2个平行,重复3次实验。第1组加入2 mL新鲜培养液,为阴性对照组;第2组加入2 mL OA染毒液(OA浓度为1 mmol/L),为阳性对照组;第3组加入2 mL BFA染毒液(BFA浓度为2.5 μg/mL),为BFA处理组。处理HepG2细胞24 h和48 h后,根据所分析蛋白性质加入不同的细胞裂解液和蛋白酶抑制剂,收集蛋白并定量。蛋白样品上样量为20 μg;80 V电压电泳90 min;用湿转移法将凝胶中的蛋白转至硝酸纤维素膜上;放于封闭液中室温孵育60 min,分别加入一抗(1 :1 000)4 ℃过夜;PBST室温漂洗3次,每次10 min;加入辣根过氧化物酶标记的二抗(1 :5 000)室温孵育60 min,PBST漂洗3次,每次10 min;加ECL发光液作用3 min,胶片于暗室曝光后显影、定影。胶片用扫描仪扫描记录条带,用Image-Pro Plus 6.0图像分析软件进行蛋白表达的半定量分析。
1.5 统计学分析实验所得数据均使用SPSS 22.0软件包进行统计分析,结果用x±s表示。多组间比较采用方差齐性检验和单因素方差分析。细胞毒性试验结果方差不齐,采用Kruskal-Wallis H检验进行组间差异比较。HepG2细胞内COPⅡ、Sar1b、COPⅠ、Arf1、BiP(GRP78)和calnexin基因表达水平的结果方差齐,采用方差分析进行比较,两两比较采用SNK法。以α=0.05为检验水准(双侧),P<0.05判定差异有统计学意义。
2 结果 2.1 BFA对HepG2细胞存活率的影响为了确定BFA对肝癌细胞的致死效应和选择合适的剂量进行抑癌机制探讨,本项目进行了细胞毒性的经典方法MTT法,该方法可以反应药物对细胞琥珀酸脱氢酶的抑制作用,也可在一定程度上表征细胞的存活情况。在一定剂量范围内,随着BFA剂量增加和处理时间的延长,肝细胞活性逐渐降低(表 2)。当0.1 μg/mL BFA作用于HepG2细胞24 h后,存活率明显降低,约为阴性对照组的65.8%(H=45.7,P < 0.05);染毒48 h后,存活率进一步降低,约为阴性对照组的35.8%(H=45.9,P < 0.05)。说明BFA对肝癌细胞具有明显的毒性作用。当染毒浓度达到2.5 μg/mL时,BFA对肝癌细胞活性的抑制作用不再随着剂量的增加而明显增加,但随着时间的延长,其作用更加明显。因此在进行BFA抗癌机制探讨时,采用染毒剂量为2.5 μg/mL。
| 组别 | 24 h | 48 h | |||||
| OD | 细胞存活率/% | OD | 细胞存活率/% | ||||
| 阴性对照组 | 1.19±0.159 | 100 | 1.12±0.092 | 100 | |||
| 0.000 1 | 1.11±0.104 | 91.9 | 1.08±0.140 | 96.7 | |||
| 0.001 | 1.09±0.177 | 90.8 | 1.06±0.062 | 94.0 | |||
| 0.01 | 1.08±0.160 | 89.4 | 1.02±0.043 | 90.1 | |||
| BFA实验组 /(μg/mL) |
0.1 | 0.828±0.078 | 65.8* | 0.465±0.094 | 35.8* | ||
| 0.5 | 0.600±0.082 | 42.4* | 0.364±0.045 | 25.7* | |||
| 1.0 | 0.500±0.025 | 35.0* | 0.341±0.033 | 23.4* | |||
| 2.5 | 0.500±0.042 | 35.0* | 0.297±0.013 | 19.2* | |||
| 5.0 | 0.484±0.068 | 33.5* | 0.321±0.017 | 21.5* | |||
| 空白对照组 | 0.127±0.006 | - | 0.103±0.007 | - | |||
| 注:“*”与阴性对照组比较,P < 0.01;阴性对照组:包括新鲜培养基和HepG2细胞,无BFA;BFA实验组:包括新鲜培养基、HepG2细胞、BFA(浓度范围:0.000 1 μg/mL~5.0 μg/mL);空白对照组:包含新鲜培养基,无HepG2细胞,无BFA;“-”表示无数据 | |||||||
2.2 BFA对HepG2囊泡转运相关基因表达的影响
定量荧光PCR试验结果显示,BFA处理组(包括新鲜培养基、HepG2细胞和BFA)分别处理HepG2细胞24 h和48 h后,COPⅡ的基因表达水平分别为阴性对照组的17(20.4/1.16)倍和14(14.2/1.01)倍,Sar1b基因表达分别为阴性对照组的14(17.6/1.28)倍和10(10.8/1.06)倍;COPⅡ和Sar1b基因表达均显著升高(24 h实验组的F值分别为107和134,48 h实验组的F值分别为49.8和170, P < 0.01;表 3)。阳性对照组(包括新鲜培养基、HepG2细胞和OA)分别处理HepG2细胞24 h和48 h后,COPⅡ和Sar1b基因表达与阴性对照组相比无明显变化。COPⅡ蛋白是COPⅡ有被囊泡的外被蛋白,由粗面内质网产生,COPⅡ有被囊泡主要负责介导从内质网到高尔基复合体的物质转运。Sar1蛋白一种小的GTP结合蛋白,Sar1b是Sar1蛋白的亚基,它可通过与GTP或GDP的结合,调节膜泡外被的装配与去装配。研究结果显示BFA能够显著抑制肝癌细胞内从内质网到高尔基复合体的物质转运,反馈性引起基因表达增加。
| 基因 | 染毒时间/h | 阴性对照组 | 阳性对照组 | BFA处理组 |
| COPⅡ基因 | 24 | 1.16± 0.125 | 1.27± 0.284 | 20.4± 2.60* |
| 48 | 1.01± 0.095 | 1.11± 0.212 | 14.2± 2.62** | |
| Sar1b基因 | 24 | 1.28± 0.198 | 1.45± 0.122 | 17.6± 1.96* |
| 48 | 1.06± 0.096 | 1.14± 0.143 | 10.8± 1.04* | |
| COPⅠ基因 | 24 | 1.08± 0.083 | 1.70± 0.190 | 19.5± 3.00* |
| 48 | 0.974± 0.151 | 1.21± 0.079 | 13.9± 2.17* | |
| Arf1基因 | 24 | 1.25± 0.25 | 1.42± 0.063 | 13.8± 2.74* |
| 48 | 0.953± 0.077 | 0.987± 0.049 | 6.76± 1.14* | |
| 注:“*”表示与阴性对照组比较差异有统计学意义,P < 0.05;阴性对照组:仅含新鲜培养基和HepG2细胞;阳性对照组:含新鲜培养基、HepG2细胞和OA;BFA处理组:含新鲜培养基、HepG2细胞和BFA | ||||
BFA处理组(包括新鲜培养基、HepG2细胞和BFA)处理HepG2细胞24 h和48 h后,COPⅠ的基因表达水平分别为阴性对照组的18(19.5/1.08)倍和14(13.9/0.974)倍,Arf1基因表达水平分别为阴性对照组的11(13.8/1.25)倍和7(6.76/0.953)倍,COPⅠ和Arf1基因表达均显著升高(24 h实验组的F值分别为72.5和41.4,P < 0.01;48 h实验组的F值分别为69.2和51.4, P < 0.01;表 3)。阳性对照组(包括新鲜培养基、HepG2细胞和OA)处理HepG2细胞24 h和48 h后,COPⅠ和Arf1基因表达与阴性对照组相比无明显变化。COPⅠ有被囊泡主要介导蛋白质从高尔基体运回内质网,包括从外侧高尔基体运向内侧高尔基体以及将蛋白质从内侧高尔基体运回内质网。COPⅠ蛋白是COPⅠ有被囊泡的外被蛋白。Arf1蛋白类似于COPⅡ中Sar1b蛋白亚基,即作为一种GTP结合蛋白,调节控制外被蛋白复合物的聚合、装配及膜泡的转运。本研究结果显示BFA可以显著抑制肝癌细胞的蛋白质逆向转运,油酸对肝癌细胞的顺向转运和逆向转运都无明显影响。
2.3 BFA对HepG2肝癌细胞内质网应激相关基因和蛋白表达影响内质网应激是指细胞遭遇缺血缺氧、营养物质缺乏、外源性毒物和药物等因素刺激时,内质网折叠能力不能满足新合成未折叠蛋白的需求而出现的应激状态。目前发现内质网应激参与了药物对肿瘤的杀伤过程。研究结果显示,BFA处理组(含新鲜培养液、HepG2细胞和BFA)处理HepG2细胞24 h和48 h后,calnexin基因表达水平分别为阴性对照组的10(10.1/1.04)倍和5(5.08/1.17)倍,BiP(GRP78)基因表达水平分别为阴性对照组的46(46.2/1.01)倍和36(33.2/0.910)倍(表 4)。calnexin和BiP(GRP78)基因表达水平明显升高,BiP(GRP78)上升幅度远高于calnexin基因。
| 基因 | 染毒时间/h | 阴性对照组 | 阳性对照组 | BFA处理组 |
| BiP(GRP78)基因 | 24 | 1.01±0.027 | 1.29±0.215 | 46.2±2.85* |
| 48 | 0.910±0.071 | 0.694±0.224 | 33.2±6.32* | |
| calnexin基因 | 24 | 1.04±0.043 | 1.11±0.154 | 10.1±0.271* |
| 48 | 1.17±0.128 | 0.712±0.230 | 5.08±1.82* | |
| 注:“*”表示与阴性对照组比较差异有统计学意义,P < 0.05;阴性对照组:仅含新鲜培养基和HepG2细胞;阳性对照组:包括新鲜培养基、HepG2细胞和OA;BFA处理组:包括新鲜培养基、HepG2细胞和BFA | ||||
不同处理组BiP(GRP78)和calnexin的蛋白杂交电泳图显示BFA处理组可引起HepG2细胞中BiP(GRP78)蛋白表达水平明显升高(图 1a),半定量分析结果显示处理组蛋白表达量约为阴性对照组2倍,提示BFA能够引起HepG2明显的内质网应激反应;BFA处理组可引起内质网分子伴娘calnexin蛋白表达水平剧烈变化,甚至无法检出(图 1b),提示BFA能够引起calnexin蛋白的降解。油酸对肝细胞BiP(GRP78)和calnexin蛋白表达无明显影响。
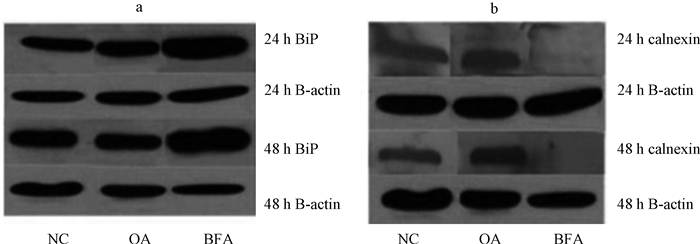
|
| 注:a为BiP(GRP78)蛋白表达变化;b为calnexin蛋白表达变化;NC为阴性对照组,仅含新鲜培养基和HepG2细胞;OA为阳性对照组,包括新鲜培养基、HepG2细胞和OA;BFA为BFA处理组,包括新鲜培养基、HepG2细胞和BFA 图 1 不同处理组BiP(GRP78)和calnexin的蛋白杂交电泳图 |
2.4 BFA对HepG2细胞AMPKα和p53蛋白表达的影响
内质网是细胞内蛋白质合成和质量控制场所,强烈的内质网应激可能会导致能量生成相关蛋白的合成不足,引起细胞内ATP含量降低。而能量不足,可能引起p53依赖的细胞凋亡或坏死。BFA或许能经此途径造成肝癌细胞的死亡,为了验证此项假设,进行了不同处理组的细胞内AMPKα和p53蛋白表达水平的检测和分析。AMPK蛋白是一种细胞能量感受器,AMP/ATP比例升高,能够激活AMPK。当细胞内ATP减少,AMPK蛋白的磷酸化水平会相应增加。AMPKα是AMPK蛋白的一个亚基,本文用AMPKα蛋白来反映AMPK蛋白的表达情况。当细胞发生p53依赖的细胞凋亡或坏死时,p53蛋白的表达增加,或者其磷酸化水平增加。BFA处理24 h和48 h后,HepG2细胞内p-AMPKα(Thr 172)显著表达(图 2a),阴性对照组和阳性对照组却几乎没有表达,而总的AMPKα表达水平却没有明显变化。这说明BFA可能会抑制肝细胞ATP的合成过程,导致AMP/ATP或者ADP/ATP升高。同时还可以观察到BFA处理24 h后(图 2b),细胞内p-p53表达水平明显增加,而总p53蛋白水平无明显变化,提示BFA可能引起肝癌细胞p53依赖的细胞死亡。
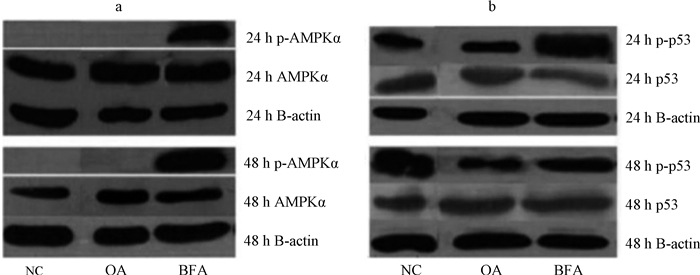
|
| 注:a为p-AMPKα蛋白表达变化;b为p53蛋白表达变化;NC为阴性对照组,仅含新鲜培养基和HepG2细胞;OA为阳性对照组,含新鲜培养液、HepG2细胞和OA;BFA为BFA处理组,含新鲜培养液、HepG2细胞和BFA 图 2 不同处理组p-AMPKα和p53蛋白杂交电泳图 |
3 讨论
据2018年世界癌症报告,全世界范围内肿瘤的发病率持续上升。中国作为发展中国家,新发病例约占全球新发病例的23.7%,死亡病例约占30%[2]。在男性中,肝癌是死亡率第二的肿瘤。肝癌的五年生存期只有10%左右,即一旦发现,病情进展极快,预后很差,因此迫切需要寻找更为有效的药物加以治疗。
研究发现BFA能够特异性的抑制蛋白转运之后[11],又被发现可能具有一定的肿瘤治疗功能[7],这些研究主要集中于其对直肠癌治疗方面。本文尝试探讨其对肝癌细胞的杀伤作用,并对其可能的机制进行初步分析。细胞毒性试验结果显示,随着BFA浓度的增加,HepG2的存活率呈剂量依赖性降低。这就证实了BFA在较低的浓度(0.1μg/mL)下即可以杀死肿瘤细胞,说明其可能作为一种肝癌治疗的药物。
BFA蛋白质转运抑制作用,主要是通过干扰顺向转运囊泡包被蛋白(COPⅡ有被囊泡)有效装配,从而抑制蛋白质的分泌过程[11-12]。研究发现用2.5 μg/mL的BFA处理后肝癌细胞内COPⅠ、Arf1、COPⅡ和Sar1b基因表达水平均显著升高,这提示BFA可同时明显阻滞COPⅠ和COPⅡ有被囊泡的组装,引起蛋白质分泌或转运缺陷,抑制肿瘤细胞的生长。存活的肝癌细胞为了应对这种不利局面,显著上调相关基因的表达,这与既往研究结果一致[13]。
研究发现BFA显著上调calnexin的基因表达,却明显抑制calnexin蛋白的表达,说明BFA可以特异性的降解calnexin蛋白。calnexin是位于内质网中的分子伴娘,是内质网质控系统的重要组成部分,帮助各种蛋白分子完成三级和四级结构的形成,其中包括膜蛋白和分泌蛋白[14-15]。由于calnexin的表达减少,或缺失,可能导致错误折叠的糖蛋白在内质网的聚集,从而导致内质网应激。错误折叠的蛋白会导致静息状态的BiP(GRP78)从PERK、IRE1α和ATF6等分子的绑定结合状态中分离出来发挥作用,因此BiP(GRP78)的表达水平也增加。本次实验观察到BFA处理后肝癌细胞内BiP(GRP78)蛋白的表达明显上升,且其基因的表达也显著上升,在24 h和48 h分别达到阴性对照组的46和36倍,进一步说明BFA可引起肝癌细胞强烈的内质网应激反应[16]。BiP(GRP78)既是一个存在于内质网中的分子伴娘,也是细胞膜表面分子,具有多种生物学作用,与不同配体结合之后可引起细胞凋亡和细胞增殖等不同的生物学过程。而内质网应激本身是一种通过非折叠反应促进细胞恢复稳态的反应,只有长时间强度高的内质网应激才是导致细胞死亡的重要原因[17-19]。本次研究观察到BFA处理肝癌细胞24 h即出现明显的BiP(GRP78)基因和蛋白表达的上升,且一直持续到48 h后,强度高而且持续时间长,因此可以推测BFA引起肝癌细胞死亡的机制应该与其引起内质网应激是紧密相关的。但是细胞内BiP(GRP78)的基因与蛋白表达水平改变的程度并不一致,蛋白表达水平(为阴性对照组的2倍)的增加明显低于基因表达水平增加(为阴性对照组的46倍),提示BFA能特异性的促进BiP(GRP78)蛋白分解。
研究发现BFA可以引起p-AMPKα(Thr 172)蛋白的表达明显上升,提示BFA能够抑制细胞ATP的产生过程。因为AMPK是细胞能量的感受器,能感受AMP与ATP比值的变化。当然细胞能量的变化还有其他的酶能够感受到[20-23]。推测BFA引起肝细胞p-AMPKα(Thr 172)表达明显升高与ATP含量减少有关,而ATP减少则可能与calnexin蛋白降解有关。因为calnexin是内质网内负责糖蛋白正确折叠的分子伴娘,该分子的缺失很可能会导致线粒体上与ATP生成相关的酶蛋白不能正确折叠而引起ATP含量减少。本研究发现2.5 μg/mL BFA处理HepG2细胞一定时间后,细胞内p53总蛋白的表达水平没有明显变化,p-p53蛋白水平明显升高。p53表达升高可通过多种途径诱导细胞凋亡或坏死,有文献报道[24]p53可诱导RRAD(Ras-related associated with diabetes)表达,后者则抑制葡萄糖转运子1的细胞膜定位,从而抑制糖酵解。另外的研究[25]发现p53的下游效应分子mdm2是磷酸甘油酸变位酶的泛素连接酶,能够介导PGAM的泛素化降解,从而抑制葡萄糖的无氧酵解。此外p53还可诱导调控TP53诱导糖酵解和凋亡调节因子,从而降低细胞内的果糖-1, 6-二磷酸水平,导致糖酵解的抑制,进而引起细胞凋亡[26]。p53还可以诱导热应激引起的小鼠精子细胞坏死[27]。综上所述,BFA可通过抑制蛋白质的正常转运过程,引起肝癌细胞发生长久而强烈的内质网应激,进而干扰细胞内的能量产生,导致肝癌细胞发生p53依赖性死亡,可能对肝癌的治疗有一定的作用,今后可进行更深入研究。
| [1] |
Zeng HM, Zheng RS, Guo YM, et al. Cancer survival in China, 2003-2005:a population-based study[J]. Int J Cancer, 2015, 136(8): 1921-1930. |
| [2] |
曹毛毛, 陈万青. 中国恶性肿瘤流行情况及防控现状[J]. 中国肿瘤临床, 2019, 46(3): 145-149. (In English: Cao MM, Chen WQ. Epidemiology of cancer in China and the current status of prevention and control[J]. Chin J Clin Oncol, 2019, 46(3): 145-149.) |
| [3] |
Misumi Y, Misumi Y, Miki K, et al. Novel blockade by brefeldin A of intracellular transport of secretory proteins in cultured rat hepatocytes[J]. J Biol Chem, 1986, 261(24): 11398-11403. |
| [4] |
Wyrozumska P, Ashley JW, Ramanadham S, et al. Novel effects of Brefeldin A (BFA) in signaling through the insulin receptor (IR) pathway and regulating FoxO1-mediated transcription[J]. Cell Logist, 2014, 4(1): e27732. |
| [5] |
Citterio C, Vichi A, Pacheco-Rodriguez G, et al. Unfolded protein response and cell death after depletion of brefeldin A-inhibited guanine nucleotide-exchange protein GBF1[J]. Proc Natl Acad Sci USA, 2008, 105(8): 2877-2882. |
| [6] |
Bobrovnikova-Marjon E, Pytel D, Riese MJ, et al. PERK utilizes intrinsic lipid kinase activity to generate phosphatidic acid, mediate Akt activation, and promote adipocyte differentiation[J]. Mol Cell Biol, 2012, 32(12): 2268-2278. |
| [7] |
Zhu XL, Huang L, Gong J, et al. NF-κB pathway link with ER stress-induced autophagy and apoptosis in cervical tumor cells[J]. Cell Death Discov, 2017, 3: 17059. DOI:10.1038/cddiscovery.2017.59 |
| [8] |
Tseng CN, Huang CF, Cho CL, et al. Brefeldin a effectively inhibits cancer stem cell-like properties and mmp-9 activity in human colorectal cancer colo 205 cells[J]. Molecules, 2013, 18(9): 10242-10253. |
| [9] |
吴明松, 郑翔, 耿娜娜, 等. 布雷菲德菌素A通过激活IRE1-XBP1信号通路增强顺铂诱导的人肺癌GLC-82细胞凋亡[J]. 中国生物化学与分子生物学报, 2016, 32(6): 672-677. (In English: Wu MS, Zheng X, Geng NN, et al. Brefeldin a enhances cisplatin-induced apoptosis of human lung cancer GLC-82 cells by activating ⅡER1-XBP1 signaling[J]. Chin J Biochem Mol Biol, 2016, 32(6): 672-677.) |
| [10] |
de Galarreta MR, Navarro A, Ansorena E, et al. Unfolded protein response induced by Brefeldin A increases collagen type Ⅰ levels in hepatic stellate cells through an IRE1α, p38 MAPK and Smad-dependent pathway[J]. Biochim Biophys Acta, 2016, 1863(8): 2115-2123. DOI:10.1016/j.bbamcr.2016.05.002 |
| [11] |
Kitakura S, Adamowski M, Matsuura Y, et al. BEN3/BIG2 ARF GEF is involved in brefeldin a-sensitive trafficking at the trans-Golgi network/early endosome in Arabidopsis thaliana[J]. Plant Cell Physiol, 2017, 58(10): 1801-1811. |
| [12] |
de Figueiredo P, Brown WJ. Clofibrate inhibits membrane trafficking to the Golgi complex and induces its retrograde movement to the endoplasmic reticulum[J]. Cell Biol Toxicol, 1999, 15(5): 311-323. |
| [13] |
Benabdi S, Peurois F, Nawrotek A, et al. Family-wide analysis of the inhibition of arf guanine nucleotide exchange factors with small molecules:evidence of unique inhibitory profiles[J]. Biochemistry, 2017, 56(38): 5125-5133. |
| [14] |
Chevet E, Smirle J, Cameron PH, et al. Calnexin phosphorylation:Linking cytoplasmic signalling to endoplasmic reticulum lumenal functions[J]. Semin Cell Dev Biol, 2010, 21(5): 486-490. |
| [15] |
Ellgaard L, Frickel EM. Calnexin, calreticulin, and ERp57:teammates in glycoprotein folding[J]. Cheminform, 2004, 35(16): 223-247. |
| [16] |
Gonzalez-Gronow M, Gomez CF, de Ridder GG, et al. Binding of tissue-type plasminogen activator to the glucose-regulated protein 78(GRP78) modulates plasminogen activation and promotes human neuroblastoma cell proliferation in vitro[J]. J Biol Chem, 2014, 289(36): 25166-25176. |
| [17] |
Guzel E, Arlier S, Guzeloglu-Kayisli O, et al. Endoplasmic reticulum stress and homeostasis in reproductive physiology and pathology[J]. Int J Mol Sci, 2017, 18(4): 792. |
| [18] |
Garg AD, Maes H, van Vliet AR, et al. Targeting the hallmarks of cancer with therapy-induced endoplasmic reticulum (ER) stress[J]. Mol Cell Oncol, 2015, 2(1): e975089. |
| [19] |
Woehlbier U, Hetz C. Modulating stress responses by the UPRosome:a matter of life and death[J]. Trends Biochem Sci, 2011, 36(6): 329-337. |
| [20] |
Hardie DG. AMP-activated protein kinase-an energy sensor that regulates all aspects of cell function[J]. Genes Dev, 2011, 25(18): 1895-1908. |
| [21] |
Qi DK, Young LH. AMPK:energy sensor and survival mechanism in the ischemic heart[J]. Trends Endocrinol Metab, 2015, 26(8): 422-429. |
| [22] |
Oligschlaeger Y, Miglianico M, Chanda D, et al. The recruitment of AMP-activated protein kinase to glycogen is regulated by autophosphorylation[J]. J Biol Chem, 2015, 290(18): 11715-11728. |
| [23] |
Dasgupta B, Chhipa RR. Evolving lessons on the complex role of AMPK in normal physiology and cancer[J]. Trends Pharmacol Sci, 2016, 37(3): 192-206. |
| [24] |
Zhang C, Liu J, Wu R, et al. Tumor suppressor p53 negatively regulates glycolysis stimulated by hypoxia through its target RRAD[J]. Oncotarget, 2014, 5(14): 5535-5546. |
| [25] |
Mikawa T, Maruyama T, Okamoto K, et al. Senescence-inducing stress promotes proteolysis of phosphoglycerate mutase via ubiquitin ligase Mdm2[J]. J Cell Biol, 2014, 204(5): 729-745. |
| [26] |
Bensaad K, Tsuruta A, Selak MA, et al. TIGAR, a p53-inducible regulator of glycolysis and apoptosis[J]. Cell, 2006, 126(1): 107-120. |
| [27] |
Napoletano F, Gibert B, Yacobi-Sharon K, et al. p53-dependent programmed necrosis controls germ cell homeostasis during spermatogenesis[J]. PLoS Genet, 2017, 13(9): e1007024. |



