2. 中国疾病预防控制中心职业卫生与中毒控制所;
3. 中国医学科学院基础医学研究所/北京协和医学院基础学院流行病与卫生统计学系;
4. 首都医科大学
慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease,COPD)作为全球第三大死因[1]的呼吸系统常见疾病,其死亡率[2-4]、患病率[2]和发病率[5]易受到细颗粒物(PM2.5)的影响,COPD患者也被认为是PM2.5的易感人群[6]。不少重复测量研究已经发现短期暴露PM2.5可引起COPD患者用力肺活量(FVC)、第一秒用力呼气量(FEV1)或呼气流量峰值(PEF)的显著性改变[7-9]。其中部分研究所用PM2.5暴露数据主要来自监测站点,距离受试者生活区域较远,并不能反映受试者真实的环境PM2.5暴露浓度。部分研究评估模型中调整的影响肺功能的混杂因素较少,缺乏生活方式等因素。此外,这些研究的受试者均通过医院招募,用药及其他干预措施均会改善肺功能,从而对研究结果产生影响。而人群中仍存在一定比例的“未确诊COPD人群”[10],国内相关研究称之为“无症状COPD患者”[11-12]。该人群因症状不明显对疾病几乎没有任何关注[13],也未主动就医,故没有接受过医疗干预,保健意识薄弱[14],也不注重对重污染天气的防护。而目前尚无空气污染对未确诊COPD人群健康影响的研究。因此,本次研究拟在中老年人群中通过肺功能检测筛选出未确诊COPD人群,采用重复测量方法,监测受试者环境空气中PM2.5质量浓度,并检测不同PM2.5质量浓度下受试者肺功能的变化情况,研究PM2.5短期暴露与肺功能变化在调整受试者人口学信息、生活方式等混杂因素后的关联性,为此类人群对空气污染的防护提供科学依据。
1 对象与方法 1.1 研究对象本研究采用分层抽样方法,首先在北京市16个市辖区中采用简单随机抽样方法抽取朝阳区、密云区、大兴区和房山区四个市区,随后从每个市区内简单随机抽取(1~2)个社区,从社区中招募受试者。纳入标准:40岁以上,在社区内居住3 a以上,未确诊患有呼吸系统疾病。排除标准:目前仍吸烟者(连续或累积吸烟6个月或以上者[15]);一年内住宅装修过。
1.2 重复测量分别于2018年1、3、8和10月,4个时间段对受试者开展肺功能和受试者生活区大气环境中PM2.5质量浓度测量。
1.2.1 未确诊COPD人群判定标准本次研究判定未确诊COPD人群的标准为:本次测量前从未经卫生专业人员对肺功能开展过测量,使用支气管扩张剂后一秒率 < 0.7[12],且未因慢性呼吸系统疾病而就医。
1.2.2 问卷调查问卷调查内容主要包括姓名、性别、身高体重指数(BMI)、教育程度、是否吸烟、调查前7天及调查期间是否感冒、住房距离主干道距离、生活习惯(运动、做饭频率、开窗和体力劳动强度等)等内容。第一次测量时对调查问卷全部内容进行调查,剩余三次仅调查BMI和生活习惯。
1.2.3 肺功能测量由培训合格的调查员对受检者进行肺功能检测,指标包括:FVC、FEV1、FEV1/FVC(1秒率)、MEFV(最大呼气流量-容积曲线,包括25%肺活量最大呼气流量,MEF25;50%肺活量最大呼气流量,MEF50;75%肺活量最大呼气流量,MEF75)、PEF、外推容量。检测时间为9:00~11:00。
1.2.4 PM2.5监测采用中流量颗粒物采样器(TH-150型,武汉天虹仪器仪表有限公司),设置采样流量100 L/min,使用石英滤膜,到所选社区选取监测高度15 m左右,周围无障碍物或污染源的位置,每日采样24 h,从肺功能测量前(96~120) h开始连续采样至肺功能检测前0 h~24 h,对应滞后天数为lag4(肺功能测量前96~120 h)~lag0(肺功能测量前0~24 h)。检测时同时记录当天温度。
1.3 统计分析本次使用R 3.6.4(R统计基金会维也纳,奥地利)软件进行统计分析。
用单因素方差分析和卡方检验分析四次重复测量结果之间的差异。
首先通过R软件的“phtest”包,对PM2.5浓度,外推容量,受试者的年龄、性别、温度、BMI、教育程度、住房到主干道距离、是否使用空气净化器、开窗习惯、每天做饭频率和体力劳动强度,共12个变量,进行hausman检验,检验结果显示chisq=3.1862,df=9,P=0.9565,判定这12个变量均为固定效应。
随后,用混合效应模型,以肺功能为应变量,自变量中以上述12个变量为固定效应,以受试者编号为随机效应,分析PM2.5与肺功能的关联性。单日滞后效应按照滞后天数lag0~lag4的PM2.5浓度代入模型,滑动平均滞后效应按照lag01~lag04代入模型。
1.4 质量控制问卷调查:对调查员进行统一培训;问卷当天检查是否有漏项,及时补问;数据库进行双录入。
肺功能检测:每次测量前对设备进行标准流速-容量定标;测量时呼气时间必须≥6 s;测量结果要求外推容积<0.15 L。
PM2.5采样:每次滤膜称量均恒温(25℃)恒湿(50%)24 h以上;每次采样前,均对采样泵的采样流量、温度和气压示值进行检查和校准;采样结束后,将滤膜放入滤膜夹,避光,尽快送回实验室-20℃保存。
1.5 伦理审查本研究通过了中国医学科学院基础医学研究所伦理审查委员会的批准(029-2015),调查对象均签署了知情同意书。
2 结果 2.1 基本情况本研究共对北京市4个区的176人开展了肺功能检测和问卷调查,筛查出28名未确诊COPD受试者,分别于2018年1、3、8和10月4个时间段对受试者开展了肺功能和受试者生活区大气环境中PM2.5浓度重复测量。受试者平均年龄68岁,最小年龄为49岁,最大为84岁;BMI指数显示整体超重;男性多于女性;主要为小学和初中学历;住房到主干道距离多大于150 m。受试者的基本情况见表 1。
| 信息指标 | 人数(构成比/%) | |
| 性别 | 男 | 17(60.70) |
| 女 | 11(39.30) | |
| 教育程度 | 文盲 | 5(17.90) |
| 小学 | 7(25.00) | |
| 初中 | 10(35.70) | |
| 大学 | 6(21.40) | |
| 住房到主干道距离 | < 50 m | 10(35.70) |
| (50~150) m | 3(10.70) | |
| >150 m | 15(53.60) | |
问卷调查结果见表 2。由于1和3月,8和10月,时间分别较接近,问卷调查结果一致,因此分别将1和3月结果合并计算,8和10月结果合并计算。由表 2可知,1和3月与8和10月,受试者生活方式变化较大,在1和3月每天做饭次数增多、体力劳动强度减轻,在8和10月开窗通风增多。
| 信息指标 | 1和3月 | 8和10月 | P值 | ||
| 人数(构成比/%) | 人数(构成比/%) | ||||
| 每天做饭次数 | 1 | 15(53.57) | 23(82.14) | 0.009 | |
| 2 | 11(39.29) | 5(17.86) | |||
| 3 | 2(7.14) | 0(0.00) | |||
| 每天是否开窗通风 | 否 | 6(21.43) | 1(3.57) | 0.004 | |
| 是 | 22(78.57) | 27(96.43) | |||
| 是否使用空气净化器 | 否 | 2(7.14) | 11(39.29) | 0.000 | |
| 是 | 26(92.86) | 17(60.71) | |||
| 体力劳动强度 | 轻度 | 27(96.43) | 19(67.86) | 0.000 | |
| 中度 | 1(3.57) | 9(32.14) |
2.2 PM2.5质量浓度暴露情况
表 3和图 1显示了4次重复测量的PM2.5质量浓度检测结果,可知4次重复测量值之间PM2.5质量浓度差异显著,其中PM2.5质量浓度最高值250.46 μg/m3出现在1月,3月最高值为225.28 μg/m3。
| μg/m3 | |||||
| 月 | n | PM2.5质量浓度 | |||
| 均数 | 标准差 | 最大值 | 最小值 | ||
| 1 | 20 | 74.20 | 52.41 | 250.47 | 23.70 |
| 3 | 20 | 79.77 | 55.62 | 225.29 | 21.09 |
| 8 | 20 | 39.38 | 16.81 | 74.96 | 14.00 |
| 10 | 20 | 30.43 | 25.94 | 81.58 | 2.02 |
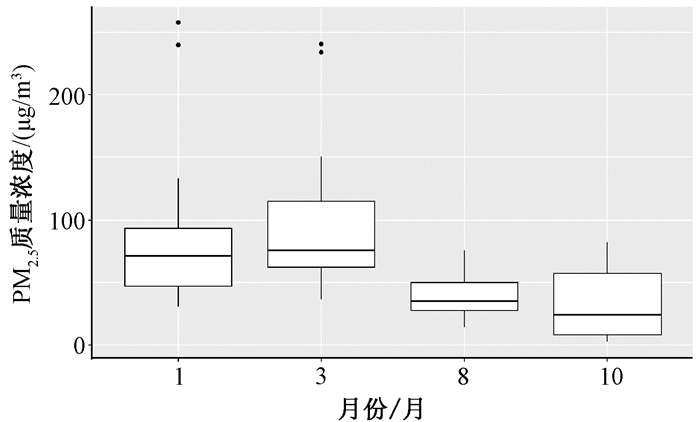
|
| 图 1 4次重复测量PM2.5质量浓度均值分布图 |
2.3 肺功能检测情况
本研究4次肺功能检测结果见表 4。可以看出一秒率4次测量之间的差异显著。其它各指标在4次测量之间的差异不显著,但FVC、PEF、MEF25、MEF50和MEF75的数值在PM2.5质量浓度较高的1和3月,低于PM2.5质量浓度较低的8和10月,显示出这几个指标对PM2.5有一定的敏感性。
| 信息指标 | 1月 | 3月 | 8月 | 10月 | P值 | |||||||
| 均数 | 标准差 | 均数 | 标准差 | 均数 | 标准差 | 均数 | 标准差 | |||||
| FVC/L | 1.98 | 0.71 | 2.01 | 0.61 | 2.22 | 0.62 | 2.12 | 0.54 | 0.841 | |||
| FEV1/L | 3.32 | 0.88 | 3.44 | 0.89 | 3.46 | 0.86 | 3.29 | 0.84 | 0.453 | |||
| 一秒率/% | 59.06 | 11.61 | 58.78 | 9.88 | 64.31 | 9.07 | 64.67 | 6.73 | 0.025 | |||
| PEF/(L/s) | 3.5 | 2.26 | 4.3 | 2.35 | 4.68 | 2.21 | 4.52 | 2.29 | 0.226 | |||
| MEF25/(L/s) | 0.49 | 0.28 | 0.49 | 0.26 | 0.52 | 0.23 | 0.55 | 0.3 | 0.809 | |||
| MEF50/(L/s) | 1.54 | 0.86 | 1.51 | 0.73 | 1.81 | 0.83 | 1.78 | 0.67 | 0.345 | |||
| MEF75/(L/s) | 2.66 | 1.72 | 3.15 | 1.57 | 3.45 | 1.61 | 3.27 | 1.48 | 0.291 | |||
2.4 混合效应模型分析结果
混合效应模型分析结果见表 5。
| 滞后天数 | FEV1 | FVC | MEF25 | MEF50 | MEF75 | PEF | 一秒率 | |
| 单日 | Lag0 | -0.001 | -0.001 | -0.001 | -0.003 | 0.001 | 0.003 | -0.002 |
| Lag1 | -0.005** | -0.001 | -0.003** | -0.010** | -0.008 | -0.002 | -0.109** | |
| Lag2 | -0.0002 | 0.001 | 0.001 | 0.004 | -0.002 | -0.008 | -0.027 | |
| Lag3 | -0.0004 | -0.00004 | -0.0002 | 0.0004 | -0.0004 | -0.001 | -0.011 | |
| Lag4 | -0.0005 | -0.0001 | -0.0001 | 0.0004 | 0.001 | 0.001 | -0.006 | |
| 滑动平均 | Lag01 | -0.003 | -0.002 | -0.002 | -0.007* | -0.003 | 0.002 | -0.044 |
| Lag02 | -0.004 | -0.002 | -0.001 | -0.006 | -0.005 | -0.002 | -0.064 | |
| Lag03 | -0.003 | 0.001 | -0.002 | -0.002 | -0.001 | 0.002 | -0.071 | |
| Lag04 | -0.001 | 0.001 | -0.001 | -0.0002 | 0.003 | 0.004 | -0.032 | |
| 注:*P < 0.1,**P < 0.05 | ||||||||
单日滞后效应结果中,FEV1、MEF25、MEF50和一秒率与PM2.5的质量浓度在lag1有显著的关联性。PM2.5质量浓度每升高10 μg/m3,FEV1下降0.05 L,MEF25下降0.03 L/s,MEF50下降0.10 L/s,一秒率下降1.09%。FVC、MEF75和PEF与PM2.5无关联。
滑动平均滞后效应结果中,仅MEF50与PM2.5质量浓度在lag01有一定显著关联性(P < 0.1)。PM2.5质量浓度每升高10 μg/m3,MEF50下降0.07 L/s。
3 讨论 3.1 PM2.5与肺功能本次发现PM2.5对FEV1、MEF25、MEF50和一秒率等肺功能指标的影响存在显著性,与其它同类人群的重复测量研究结果基本一致[7-9, 16],不同之处在于,本研究未发现FVC和PEF与PM2.5的短期暴露存在显著性关联。此外由于这些研究描述肺功能改变的单位并不是绝对值,而是预测值百分比,研究结果无法与本研究结果进行定量对比。还有其它一些同类主题研究的受试者人群与本研究不同,如健康妇女[17]、卡车司机[18]、办公室职员[18]、大学生[19]或普通城市居民[20]等非COPD人群,或采用空气质量指数而非绝对值作为PM2.5暴露水平度量[21],或研究主题为PM2.5对肺功能的长期影响(PM2.5质量浓度每升高10 μg/m3,FEV1下降0.068 L)[20],因此也没有进一步与本研究结果展开比较。
3.2 滞后效应本研究发现FEV1、MEF25、MEF50和一秒率与lag1和lag01的PM2.5质量浓度关联性显著,其中,单日滞后效应与其它类似研究的结果基本一致,如有研究发现lag1[7-8]或lag01 [9]就有显著性关联(PM2.5质量浓度最高值100~393 μg/m3),但更多的研究发现滞后效应主要出现在lag2~lag5(PM2.5质量浓度最高值>257 μg/m3)[9, 22-23]。然而在细胞因子和肺功能与PM2.5短期暴露关联性的研究发现:对于非吸烟健康人群暴露PM2.5(最高值251.60 μg/m3)3 h后FEV1就会出现下降[16]。这些研究之间的差异性可能是由于PM2.5质量浓度以及PM2.5的成分不同而导致的。此外,各研究对混杂因素种类和数量的控制条件不同也可能导致研究间的差异:如有的[7]仅考虑了温度、湿度,有的[17]考虑了病情分期、最低温度和检测日期,有的[8]则考虑了年龄、性别、BMI、吸烟、温度和湿度等更多效应,而本研究除上述因素还考虑了教育程度、住房至主干道距离、生活习惯(是否使用空气净化器、运动、做饭频率、开窗和体力劳动强度等)等因素。而开展肺功能检测的时间和检测质量不同同样会导致的研究结果的差异。因此需要更多的研究,或通过Meta分析来发现其中原因,从而更加科学的阐述PM2.5与肺功能的关联性。
3.3 PM2.5对小气道通气功能的影响本次研究发现小气道通气功能指标MEF25、MEF50与PM2.5关联显著。目前相关的研究不多,仅在健康人群未调整混杂因素的情况下[24]或者在另一易感人群学龄儿童[25]中,两者显示出阳性关联。直径小于2 mm的小气道是COPD的主要阻塞部位[26],小气道病变在COPD早期就已出现[27],而且PM2.5主要沉积部位也在小气道[28],因此PM2.5很可能最先影响小气道。空气污染对小气道的影响更值得关注。
3.4 本次研究的创新与不足本次研究选择了未确诊COPD人群这个隐藏在正常人群中的空气污染敏感人群,利用重复测量的方法开展研究,通过这一人群尚未就医的特点排除了医疗策略可能对肺功能造成的影响,发现了PM2.5的短期暴露可以导致该人群肺功能指标的下降,滞后效应为1 d。本研究发现一秒率、FEV1、MEF25和MEF50这四个肺功能指标对PM2.5的影响最敏感。该人群由于无症状,可能忽略在重污染天气的呼吸道防护,从而导致COPD病情加重或出现急性恶化。
本次研究存在以下不足:①由于本研究的受试者为即将退休或已退休人群,其在室内停留时间较长,但本研究没有结合室内浓度评估受试者的室内外PM2.5暴露水平;②鉴于北京市大部分时间的首要污染物为PM2.5,本次研究并没有关注其它污染物。然而夏季的主要污染物还包含臭氧,在后续的研究中应加以考虑。
通过本次研究,建议40岁以上普通人群及时开展肺功能检测以筛查出未确诊COPD人群。对未确诊COPD人群,应开展健康促进,普及雾霾的危害,提高其防护意识。
| [1] |
WHO. The top 10 causes of death[EB/OL]. (2018-05-24). http://www.who.int/en/news-room/fact-sheets/detail/the-top-10-causes-of-death, 2018.
|
| [2] |
Miri M, Derakhshan Z, Allahabadi A, et al. Mortality and morbidity due to exposure to outdoor air pollution in mashhad metropolis, iran. The airq model approach[J]. Environ Res, 2016, 151: 451-457. DOI:10.1016/j.envres.2016.07.039 |
| [3] |
DeVries R, Kriebel D, Sama S. Outdoor air pollution and copd-related emergency department visits, hospital admissions, and mortality:A meta-analysis[J]. Copd, 2016, 14(1): 113-121. |
| [4] |
Pinault LL, Weichenthal S, Crouse DL, et al. Associations between fine particulate matter and mortality in the 2001 canadian census health and environment cohort[J]. Environ Res, 2017, 159: 406-415. DOI:10.1016/j.envres.2017.08.037 |
| [5] |
Weichenthal S, Bai L, Hatzopoulou M, et al. Long-term exposure to ambient ultrafine particles and respiratory disease incidence in in toronto, canada:A cohort study[J]. EnvironHealth, 2017, 16: 64. |
| [6] |
Liu LJS, Box M, Kalman D, et al. Exposure assessment of particulate matter for susceptible populations in seattle[J]. Environ Health Perspect, 2003, 111(7): 909-918. DOI:10.1289/ehp.6011 |
| [7] |
Lagorio S, Forastiere F, Pistelli R, et al. Air pollution and lung function among susceptible adult subjects:A panel study[J]. Environ Health, 2006, 5: 11. DOI:10.1186/1476-069X-5-11 |
| [8] |
Ni Y, Wu SW, Ji WJ, et al. The exposure metric choices have significant impact on the association between short-term exposure to outdoor particulate matter and changes in lung function:Findings from a panel study in chronic obstructive pulmonary disease patients[J]. Sci Total Environ, 2016, 542: 264-270. DOI:10.1016/j.scitotenv.2015.10.114 |
| [9] |
Cortez-Lugo M, Ramírez-Aguilar M, Pérez-Padilla R, et al. Effect of personal exposure to PM2.5 on respiratory health in a mexican panel of patients with copd[J]. Int J Environ Res Public Health, 2015, 12(9): 10635-10647. DOI:10.3390/ijerph120910635 |
| [10] |
Lamprecht B, Soriano JB, Studnicka M, et al. Determinants of underdiagnosis of copd in national and international surveys[J]. Chest, 2015, 148(4): 971-985. DOI:10.1378/chest.14-2535 |
| [11] |
张锋英, 杭晶卿, 李晓峰, 等. 未诊断呼吸系疾病人群中慢性阻塞性肺疾病患病率调查[J]. 临床肺科杂志, 2007, 12(11): 1174-1175. (In English: Zhang FY, Hang JQ, Li XF, et al. Prevalence of chronic obstructive pulmonary disease in the population not previously diagnosed with respiratory disease[J]. J Clin Pulmonary Med, 2007, 12(11): 1174-1175. DOI:10.3969/j.issn.1009-6663.2007.11.007) |
| [12] |
姚婉贞, 朱红, 沈宁, 等. 无症状慢性阻塞性肺疾病患者特点分析[J]. 中华结核和呼吸杂志, 2005, 28(8): 513-515. (In English: Yao WZ, Zhu H, Shen N, et al. Characteristics of non-symptomatic chronic obstructive pulmonary disease patients[J]. Chin J Tubercul Respirat Dis, 2005, 28(8): 513-515. DOI:10.3760/j:issn:1001-0939.2005.08.003) |
| [13] |
陆育钿, 陈文翰, 张乃锦, 等. 无症状慢性阻塞性肺疾病患者早期干预的临床研究[J]. 临床医学工程, 2018, 25(9): 1191-1192. (In English: Li YD, Chen WH, Zhang NJ, et al. Clinical study on early intervention in patients with asymptomatic chronic obstructive pulmonary disease[J]. Clin Med Eng, 2018, 25(9): 1191-1192. DOI:10.3969/j.issn.1674-4659.2018.09.1191) |
| [14] |
陈思. 无症状慢性阻塞性肺疾病患者特点分析[J]. 临床医学, 2013, 33(2): 23-25. (In English: Chen S. Characteristics of non-symptomatic chronic obstructive pulmonary disease[J]. Clin Med, 2013, 33(2): 23-25. DOI:10.3969/j.issn.1003-3548.2013.02.012) |
| [15] |
何权瀛, 高莹慧. 关于吸烟问题若干名词定义[J]. 中华结核和呼吸杂志, 2009, 32(1): 56. DOI:10.3760/cma.j.issn.1001-0939.2009.01.008 |
| [16] |
Wang CC, Cai J, Chen RJ, et al. Personal exposure to fine particulate matter, lung function and serum club cell secretory protein (clara)[J]. Environ Pollut, 2017, 225: 450-455. DOI:10.1016/j.envpol.2017.02.068 |
| [17] |
Naeher LP, Holford TR, Beckett WS, et al. Healthy women's pef variations with ambient summer concentrations of PM10, PM2.5, SO42-, H+, and O3[J]. Am J Respirat Crit Care Med, 1999, 160(1): 117-125. |
| [18] |
Baccarelli AA, Zheng YN, Zhang X, et al. Air pollution exposure and lung function in highly exposed subjects in Beijing, China:A repeated-measure study[J]. Particle Fibre Toxicol, 2014, 11: 51. DOI:10.1186/s12989-014-0051-7 |
| [19] |
李娇元, 马露, 刘历志, 等. 武汉市秋冬季空气颗粒物暴露对大学生肺功能的短期影响[J]. 中华预防医学杂志, 2013, 47(2): 155-159. (In English: Li JY, Ma L, Liu LZ, et al. The short-term effects of particulate matter on lung function of college students in autumn and winter in wuhan[J]. Chin J Prev Med, 2013, 47(2): 155-159. DOI:10.3760/cma.j.issn.0253-9624.2013.02.013) |
| [20] |
Rice MB, Ljungman PL, Wilker EH, et al. Long-term exposure to traffic emissions and fine particulate matter and lung function decline in the framingham heart study[J]. Am J Respirat Crit Care Med, 2015, 191(6): 656-664. DOI:10.1164/rccm.201410-1875OC |
| [21] |
Rice MB, Ljungman PL, Wilker EH, et al. Short-term exposure to air pollution and lung function in the framingham heart study[J]. Am J Respirat Crit Care Med, 2013, 188(11): 1351-1357. DOI:10.1164/rccm.201308-1414OC |
| [22] |
韩建彪.太原市PM2.5对哮喘患者肺功能和生物指标影响的panel研究[D].太原: 山西医科大学, 2014. (In English: In English: Han JB. A panel study of effects of PM2.5 in Taiyuan on asthma patients pulmonary function and biomarker[D]. Taiyuan: Shanxi Medical University, 2014.) http://cdmd.cnki.com.cn/Article/CDMD-10114-1014327324.htm
|
| [23] |
史传见. PM2.5对慢性阻塞性肺疾病患者血清TNF-α、IL-6、IL-8和生活质量影响的panel研究[D].新乡: 新乡医学院, 2017. (In English: In English: Shi CJ. The effect of PM2.5 on serum levels of TNF-α, IL-6, IL-8 and quality of life in patdents mith chrongc obstructive pulmonary disease by panel study[D]. Xinxiang: Xinxiang Medical University, 2017.) http://cdmd.cnki.com.cn/Article/CDMD-10472-1018179126.htm
|
| [24] |
Soppa VJ, Schins RP, Hennig F, et al. Respiratory effects of fine and ultrafine particles from indoor sources——a randomized sham-controlled exposure study of healthy volunteers[J]. Int J EnvironRes Public Health, 2014, 11(7): 6871-6889. DOI:10.3390/ijerph110706871 |
| [25] |
Hwang BF, Chen YH, Lin YT, et al. Relationship between exposure to fine particulates and ozone and reduced lung function in children[J]. Environ Res, 2015, 137: 382-390. DOI:10.1016/j.envres.2015.01.009 |
| [26] |
Hogg JC, Macklem PT, Thurlbeck WM. Site and nature of airway obstruction in chronic obstructive lung disease[J]. N Engl J Med, 1968, 278(25): 1355-1360. DOI:10.1056/NEJM196806202782501 |
| [27] |
Singh D. Small airway disease in patients with chronic obstructive pulmonary disease[J]. Tubercul Respirat Dis, 2017, 80(4): 317-324. DOI:10.4046/trd.2017.0080 |
| [28] |
Churg A, Brauer M. Human lung parenchyma retains PM2.5[J]. Am J Respirat Crit Care Med, 1997, 155(6): 2109-2111. DOI:10.1164/ajrccm.155.6.9196123 |



