空气污染近年来已经成为中国的城市病,其中雾霾的有害影响也跃居我国城市居民最关注的问题之一。雾霾的主要组成包括硫氧化物、氮氧化物和大气细颗粒物(PM2.5),而可吸入颗粒物是造成雾霾天气污染的首要因素。PM2.5的成分主要包含多环芳烃(PAHs)、金属阳离子以及无机阴离子[1-2]。其中,环境中的多环芳烃(PAHs)是煤,石油,木材,烟草,有机高分子化合物等有机物不完全燃烧时产生的挥发性碳氢化合物。迄今为止,有400余种PAHs被发现和报道,而且大部分PAHs具有致癌性,1979年美国环保局将16种存在显著致畸、致癌、致突变作用的PAHs列为优先控制污染物[3],我国现将其中7种列为优先污染物。近些年的研究表明,这些以苯并(a)芘为代表的多环芳烃含量也与PM2.5的致癌活性相关[4]。
大气中多环芳烃大多以气态方式存在或吸附在水滴或PM2.5上。四环以下的多环芳烃主要以气态方式存在,比如菲、蒽、荧蒽和芘等;而五环以上的多环芳烃则大部分被吸附在PM2.5上,以大气飘尘形式存在[5]。
对于多环芳烃的分离和检测,传统上采用纸层析和薄层析等技术分离PAHs,再联合UV-vis和荧光等进行检测。随着高效液相色谱、气相色谱、质谱等技术日趋成熟,现阶段分离和检测多环芳烃比较常用的方法包括HPLC、GC、LC-MS和GC-MS等[6]。即使采用现代化的分析仪器,传统的纸层析和薄层析等仍是极为重要的纯化分离方法,用于对成分比较复杂的样品预处理。但是,常用传统的前处理方法均存在一些缺陷和不足,比如操作繁琐、有机试剂消耗过大以及处理时间较长等,故此,本研究通过对提取方法、净化方式以及检测技术等进行比对,最终得到了最优化方法。相比现有方法,该方法不仅提取效率和净化效果显著改善,分析的灵敏度也得到提高,因此,可作为潜在的PAHs标准检测方法。
1 材料与方法 1.1 仪器与试剂玻璃纤维滤膜(直径90 mm,GE Whatman);Milli-Q A10超纯水设备(美国Millipore);0.22 μm尼龙66针式过滤器(天津津腾);LC-20 A高效液相色谱串联SPD-M20 A二极管紫外阵列检测器和RF-20 A荧光检测器(日本岛津);SB25-12D超声波清洗机(宁波新芝);Oasis HLB SPE柱(6 mL, 500 mg美国Waters);Bond Elut ENV SPE柱(6 mL, 500 mg美国Agilent);Bond Elut Florisil SPE柱(6 mL, 500 mg,美国Agilent);甲醇、正己烷、乙腈、二氯甲烷(GR级,德国Merck)。
1.2 标准溶液的配制用乙腈将16种PAHs混合标准品配制成浓度为10 mg/L的混合标准储备液,于-20℃下保存,使用时,再用乙腈将混合标准储备液稀释,制备标准系列溶液时选用了0.00、0.05、0.1、0.50、1.00、2.00和5.00 μg/mL 7个浓度,绘制标准曲线的线性相关系数均≥0.999 9(表 1)。
| 编号 | 名称 | CAS号 | 浓度/(mg/mL) |
| 1 | 萘 | 91-20-3 | 0.2 |
| 2 | 苊烯 | 208-96-8 | 0.2 |
| 3 | 苊 | 83-32-9 | 0.2 |
| 4 | 芴 | 86-73-7 | 0.2 |
| 5 | 菲 | 85-01-8 | 0.2 |
| 6 | 蒽 | 120-12-7 | 0.2 |
| 7 | 荧蒽 | 206-44-0 | 0.2 |
| 8 | 芘 | 129-00-0 | 0.2 |
| 9 | 苯并(a)蒽 | 56-55-3 | 0.2 |
| 10 | 䓛 | 218-01-9 | 0.2 |
| 11 | 苯并(b)荧蒽 | 205-99-2 | 0.2 |
| 12 | 苯并(k)荧蒽 | 207-08-9 | 0.2 |
| 13 | 苯并(a)芘 | 50-32-8 | 0.2 |
| 14 | 二苯并[a, h]蒽 | 53-70-3 | 0.2 |
| 15 | 苯并[g, h, i]芘 | 191-24-2 | 0.2 |
| 16 | 茚并(1, 2, 3-cd)芘 | 193-39-5 | 0.2 |
1.3 液相色谱条件
色谱柱:Agilent ZORBAX Eclipse PAH,250 mm×4.6 mm,5 μm;流动相为水和乙腈;流动相流量为1.2 mL/min;柱温为30℃;梯度洗脱程序设定为:65%乙腈+35%水,保持27 min,以5%乙腈/min的增量至100%乙腈,直至出峰完毕。
1.4 样品处理将直径为90 mm的采样滤膜四等分,取四分之一剪碎,置于10 mL玻璃离心管底部,并向管中加入2.5 mL乙腈,使样品浸泡完全,封盖后水浴中超声60 min。
浓缩:将提取液转移至浓缩瓶中,加入(5~10)mL正己烷,用浓缩装置温度控制45℃以下浓缩,重复此浓缩过程3次,将溶剂完全转换为正己烷,最后浓缩至1.0 mL,待净化。
净化:使用ENV柱固相萃取柱净化:将其固定在固相萃取净化装置上。先用4 mL二氯甲烷冲洗净化柱,再用10 mL正己烷平衡净化柱,待柱内充满正己烷后关闭流速控制阀浸润5 min,打开控制阀,弃去流出液。在溶剂流干之前,将浓缩后的样品提取液加入到柱内,再用约3 mL正己烷分3次洗涤装样品的浓缩瓶,将洗涤液一并加到柱上,用10 mL二氯甲烷/正己烷洗脱液洗涤吸附有样品的净化柱,待洗脱液流过净化柱后关闭流速控制阀,浸润5 min,再打开控制阀,继续接收洗脱液至完全流出,浓缩至(0.5~1.0) mL,加入3 mL乙腈,再浓缩至1 mL以下,最后准确定容到1.0 mL,用孔径为0.22 μm的尼龙66(有机系)针式过滤器过滤,得到澄清溶液待上机检测。
2 结果与讨论 2.1 测定方法的优化16种PAHs的紫外和荧光信号分析表明,苊烯的荧光强度较紫外信号弱,其余15种化合物的荧光信号均远强于各自的紫外吸收强度,因此这15种PAHs采用荧光光谱检测,依据其液相色谱出峰时间的差异,以及荧光信号的不同,荧光检测器波长设定为:开始时,激发波长280 nm,发射波长340 nm;20 min后,激发波长350 nm,发射波长400、450和500 nm。对于苊烯,采用紫外吸收光谱检测,根据其最大吸收波长,设定检测波长为230 nm,这与邓樱花[7]报道的254 nm有所不同。16种PAHs标准溶液的液相色谱结果如下图 1(a)和图 1(b)。
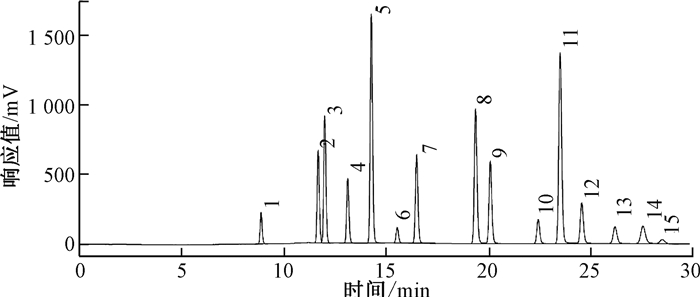
|
| 注:1萘、2苊烯、3苊、4芴、5菲、6蒽、7荧蒽、8芘、9䓛、10苯并[a]蒽、11苯并[b]荧蒽、12苯并[k]荧蒽、13苯并[a]芘、14茚并[1, 2, 3-c, d]芘、15二苯并[a, h]蒽、16苯并[g, h, i]苝 图 1 (a) 15种多环芳烃荧光检测色谱图 |
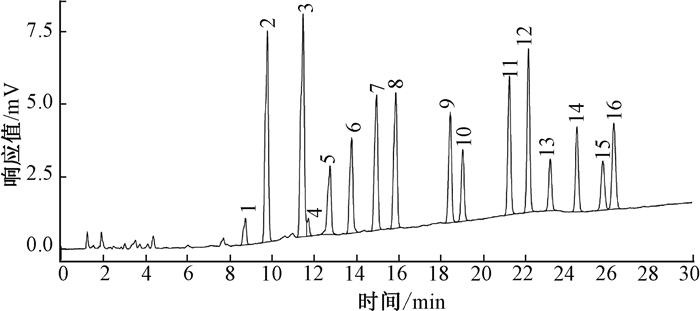
|
| 注:1萘、2苊、3芴、4菲、5蒽、6荧蒽、7芘、8䓛、9苯并[a]蒽、10苯并[b]荧蒽、11苯并[k]荧蒽、12苯并[a]芘、13茚并[1, 2, 3-c, d]芘、14二苯并[a, h]蒽、15苯并[g, h, i]苝 图 1 (b) 16种多环芳烃紫外检测色谱图 |
2.2 前处理方式的优化 2.2.1 提取溶剂的选择
本实验中对比了甲醇、正己烷、乙腈三种溶剂的提取效果,结果表明,使用乙腈作为提取溶剂效率明显优于其他两种提取剂(甲醇提取效率30%~60%,正己烷提取效率70%~80%,乙腈提取效率90%~98%)(图 2)。有相关文献[8]在综合考虑PAHs的性质后, 选用正己烷、甲苯、乙腈3种低、中低、中高极性溶剂进行筛选,结果表示采用正己烷和甲苯提取, 不同目标物的回收率差异较大(在12.8%~90.6%之间), 而乙腈极性中等偏大, 能够很好兼顾多个目标物的性质, 待测物质的提取回收率均达80%以上,与我们的实验结果相似;李春欣[9]在对大气颗粒物中16种多环芳烃和15种硝基多环芳烃分析方法的研究中比较了单独使用正己烷、二氯甲烷和丙酮以及他们的混合物作为超声提取溶剂的效果,结果表明因为正己烷极性弱,所以单独使用正己烷的提取效果较差。在本实验三种提取溶剂中乙腈极性最大,且粘度系数较小,因此对16种PAHs均有较好的提取效率且平行性较好,又因为实验中流动相用的也是乙腈,所以选择乙腈作为提取溶剂最合适。
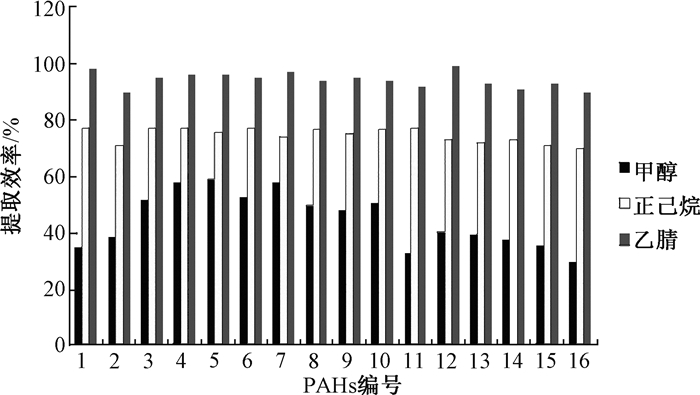
|
| 注:1萘;2苊烯;3苊;4芴;5菲;6蒽;7荧蒽;8芘;9屈;10苯并[a]蒽;11苯并[b]荧蒽;12苯并[k]荧蒽;13苯并[a]芘;14茚并[1,2,3-c, d]芘;15二苯并[a, h]蒽;16苯并[g, h, i]芘 图 2 甲醇、正己烷、乙腈对16种PAHs的提取效率对比 |
2.2.2 提取方法的选择
现发展起来的对PAHs的提取方法有很多,包括固相微萃取法[10]、加速溶剂萃取法[11]、索氏提取法[12]和超声提取法等。本实验对比了索氏提取法和超声提取法的提取效率,图 3结果表示,索氏提取法的提取效率约在90%~95%,超声提取法为85%~95%,索氏提取法的提取效率和提取效果的稳定性都略优于超声提取法,与王君瑞[13]的实验结果一致。但其实验也表明由于索氏提取法操作繁琐,需要经过几次浓缩、提取时间长、萃取剂的耗费量大,对人员操作方面的要求比较高,所以实验中的不确定因素较多,会影响实验的稳定性。且谷晓琳[14]的实验还表明索氏提取法对小环化合物的提取率偏低,而超声提取法对各化合物提取率均很高。再者,滤膜上的细颗粒物较易提取,因此具有操作简单、方便、用时少、成本低等优点的超声波萃取法便成了替代索氏提取法进行前处理的最佳方式[15]。因此,本研究对样品的前处理采用超声水浴萃取法。有文献记载,使用超声提取法萃取PM2.5中的多环芳烃时,会因为萃取容器的形状、体积及萃取液体积对萃取效果产生影响,导致有时会出现萃取率偏低或不稳定的现象[16],而本实验在超声提取时用的是加盖的玻璃离心管,尖底的容器以及加入2.5 mL的提取溶液可以避免这种现象的发生。
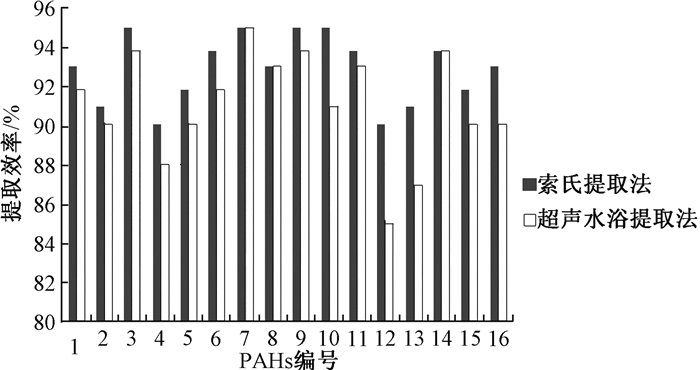
|
| 注:1萘;2苊烯;3苊;4芴;5菲;6蒽;7荧蒽;8芘;9屈;10苯并[a]蒽;11苯并[b]荧蒽;12苯并[k]荧蒽;13苯并[a]芘;14茚并[1,2,3-c, d]芘;15二苯并[a, h]蒽;16苯并[g, h, i]芘 图 3 索氏提取法和超声提取法对16种PAHs的提取效率对比 |
2.3 净化方法的选择
滤膜经过超声提取后的溶液中含有较多杂质,直接进液相色谱会极大降低色谱柱的分辨率,甚至有可能堵塞色谱柱,减少柱子寿命,因此进样前需要经过初步净化程序[17]。在评估净化效果时,本实验考察了检测多环芳烃时常用的3种固相萃取柱HLB、ENV和Florisil,结果显示HLB小柱的回收率为45%~70%,Florisil小柱为80%~90%,ENV柱净化回收率最高,为92%~100%(图 4)。ENV小柱具有高流通量,能高效洗脱等优点,且该小柱专为萃取极性有机物残留设计所以本实验选择ENV小柱进行上机前净化[18]。
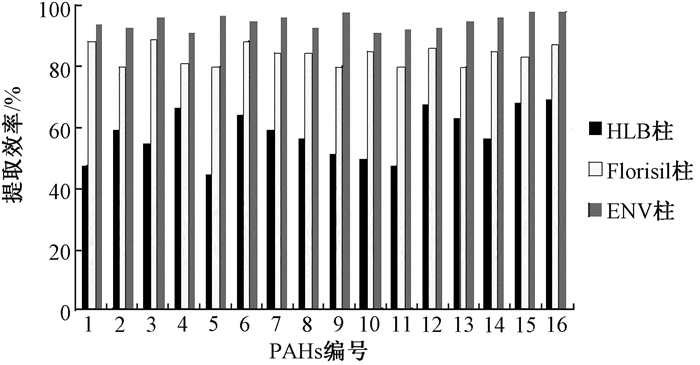
|
| 注:1萘;2苊烯;3苊;4芴;5菲;6蒽;7荧蒽;8芘;9屈;10苯并[a]蒽;11苯并[b]荧蒽;12苯并[k]荧蒽;13苯并[a]芘;14茚并[1,2,3-c, d]芘;15二苯并[a, h]蒽;16苯并[g, h, i]芘 图 4 HLB小柱、Florisil小柱和ENV小柱对超声提取液的回收率对比 |
由于洗脱液二氯甲烷/正己烷混合溶液的使用会造成环境的污染和成本的增加,因此,实验考察了洗脱液用量对目标物回收率的影响,对比2+3(V/V)、4+4(V/V)、5+5(V/V)二氯甲烷/正己烷的实验显示,洗脱液对目标化合物的提取和净化效果影响不大,本实验在保证回收率和净化效果的前提下采用最少洗脱液用量,即用2+3(V/V)二氯甲烷/正己烷混合溶液进行洗脱。该前处理策略与刁春燕等[19]在2010年报道的净化方法相比,尽管回收效果相当,但本方法更加简便方便,且试剂消耗量小。
2.4 线性范围和检出限配制浓度为0.00、0.05、0.10、0.50、1.00、2.00和5.00 μg/mL的系列标准溶液,优化仪器条件,开始进行分析。以各组分的浓度为横坐标,峰面积为纵坐标,测得16种PAHs标准曲线的线性方程(表 2)。各组分在线性范围内线性关系良好,相关系数达到0.999 9。以3倍信噪比(S/N)为检出限,检出限范围为(0.04~0.26) ng/m3,各组分的检出限见表 2。
| 多环芳烃 | 线性范围/(ng/m3) | 线性方程 | 相关系数r | 检出限/(ng/m3) |
| 萘 | 0.10~1 000 | y=10 944.3x+18.45 | 0.999 9 | 0.26 |
| 苊烯 | 0.10~1 000 | y=84 927.3x-255.38 | 0.999 9 | 0.13 |
| 苊 | 0.05~1 000 | y=10 680.0x-429.95 | 0.999 9 | 0.06 |
| 芴 | 0.10~1 000 | y=38 863.8x+15.34 | 0.999 9 | 0.10 |
| 菲 | 0.10~1 000 | y=30 179.2x-393.99 | 0.999 9 | 0.12 |
| 蒽 | 0.05~1 000 | y=39 638.8x-440.77 | 0.999 9 | 0.07 |
| 荧蒽 | 0.10~1 000 | y=61 866.0x-423.70 | 0.999 9 | 0.10 |
| 芘 | 0.05~1 000 | y=60 443.0x-348.82 | 0.999 9 | 0.06 |
| 苯并(a)蒽 | 0.05~1 000 | y=43 334.6x-447.06 | 0.999 9 | 0.07 |
| 䓛 | 0.05~1 000 | y=27 169.5x-381.57 | 0.999 9 | 0.05 |
| 苯并(b)荧蒽 | 0.05~1 000 | y=52 254.5x-397.04 | 0.999 9 | 0.06 |
| 苯并(k)荧蒽 | 0.01~1 000 | y=61 059.1x-139.10 | 0.999 9 | 0.04 |
| 苯并(a)芘 | 0.05~1 000 | y=17 869.1x-105.70 | 0.999 9 | 0.05 |
| 茚并(1, 2, 3-cd)芘 | 0.05~1 000 | y=32 206.3x-297.30 | 0.999 9 | 0.05 |
| 二苯并[a, h]蒽 | 0.05~1 000 | y=22 336.4x-505.80 | 0.999 9 | 0.09 |
| 苯并[g, h, i]芘 | 0.05~1 000 | y=42 969.2x-391.30 | 0.999 9 | 0.07 |
2.5 精密度和加标回收试验
在样品中添加16种PAHs的混合标准溶液进行加标回收试验,以检验方法的准确性。16种PAHs的平均回收率为85%~114.1%,说明方法准确性好。每个加标浓度同时设置5个平行,计算相对标准偏差(RSD)来考察方法的精密度。各组分RSD均小于8.0%,表明方法稳定性好(表 3)。
| 多环芳烃 | 本底值/ (ng/m3) |
不同添加浓度的回收率 | ||||||
| 5/(ng/m3) | 10/(ng/m3) | |||||||
| 实测值/ (ng/m3) |
回收率/ % |
RSD/% | 实测值/ (ng/m3) |
回收率/ % |
RSD/ % |
|||
| 萘 | 8.80 | 13.80 | 100.0 | 7.1 | 19.33 | 102.8 | 4.3 | |
| 苊烯 | - | 4.53 | 90.6 | 5.4 | 8.77 | 87.7 | 6.2 | |
| 苊 | 0.50 | 4.80 | 87.3 | 4.3 | 9.29 | 88.5 | 5.1 | |
| 芴 | 3.24 | 9.37 | 113.7 | 3.8 | 15.11 | 114.1 | 3.7 | |
| 菲 | 1.85 | 6.77 | 98.8 | 7.9 | 12.44 | 105.0 | 2.5 | |
| 蒽 | 2.99 | 8.03 | 100.5 | 3.6 | 11.15 | 85.8 | 7.3 | |
| 荧蒽 | 0.39 | 5.05 | 93.7 | 2.1 | 10.88 | 104.7 | 1.2 | |
| 芘 | - | 4.96 | 99.2 | 3.5 | 11.05 | 110.5 | 0.7 | |
| 苯并(a)蒽 | - | 4.25 | 85.0 | 6.9 | 8.07 | 80.7 | 6.7 | |
| 䓛 | 4.33 | 8.46 | 90.7 | 5.2 | 13.68 | 95.5 | 7.8 | |
| 苯并(b)荧蒽 | 1.01 | 6.11 | 101.7 | 5.7 | 12.13 | 110.2 | 5.4 | |
| 苯并(k)荧蒽 | - | 4.75 | 95.0 | 4.7 | 8.54 | 85.4 | 3.2 | |
| 苯并(a)芘 | 1.72 | 7.20 | 107.1 | 1.1 | 10.24 | 87.4 | 4.5 | |
| 茚并(1, 2, 3-cd)芘 | - | 4.43 | 88.6 | 0.7 | 8.52 | 85.2 | 2.8 | |
| 二苯并[a, h]蒽 | - | 5.08 | 101.6 | 2.4 | 9.08 | 90.8 | 6.6 | |
| 苯并[g, h, i]芘 | - | 4.37 | 87.4 | 4.1 | 9.22 | 92.2 | 6.5 | |
| 注:“-”为低于检出限 | ||||||||
3 结论
本项目利用16种具有显著致畸、致癌、致突变作用的PAHs的特定荧光和紫外光谱特征,建立了高效液相色谱—荧光—紫外串联同时测定PM2.5中16种PAHs的方法。采用乙腈—超声水浴的提取方式大大提高了检测效率;最佳的检测波长以及串联使用荧光—紫外两种检测器提高了该方法的灵敏度;因为ENV固相萃取柱对极性生物分子出色的萃取能力,所以实验有较高的回收率。本方法为开展大气安全风险监测工作提供了便捷、精确的方法基础。
| [1] |
郭杰, 肖纯凌. PM2.5对人群健康影响的流行病学研究进展[J]. 环境卫生学杂志, 2017, 7(2): 164-169. (In English: Guo J, Xiao CL. Progress on epidemiological study of PM2.5 effect to human health[J]. J Environ Hyg, 2017, 7(2): 164-169.) |
| [2] |
蒋彬. PM2.5中有机物分子组成高分辨质谱分析[D].北京: 中国石油大学(北京), 2016. (In English: In English: Jiang B. Molecular characterization of organic compounds in PM2.5by high resolution mass spectrometry[D]. Beijing: China University of Petroleum (Beijing), 2016.) http://cdmd.cnki.com.cn/Article/CDMD-11414-1018700101.htm
|
| [3] |
张艳, 冯翠霞, 陈剑刚. 超高效液相色谱法测定大气PM2.5中16种多环芳烃[J]. 环境与职业医学, 2017, 34(9): 836-839. (In English: Zhang Y, Feng CX, Chen JG. Determination of polycyclic aromatic hydrocarbons in PM2.5 by ultrasensitive performance liquid chromatography[J]. J Environ Occup Med, 2017, 34(9): 836-839.) |
| [4] |
王峰, 张志杰, 林慧, 等. 高效液相色谱-二极管阵列检测器-荧光检测器法测定植物油中的18种多环芳烃[J]. 食品科学, 2014, 35(6): 142-145. (In English: Wang F, Zhang ZJ, Lin H, et al. Determination of 18 polycyclic aromatic hydrocarbons in vegetable oil by high performance liquid chromatography with diodearry detector and fluorescence detector[J]. Food Sci, 2014, 35(6): 142-145.) |
| [5] |
孟川平.室内环境大气细颗粒物(PM2.5)中多环芳烃污染组成及其粒径分布特征研究[D].济南: 山东大学, 2013. (In English: In English: Meng CP. PAHs pollution compositions and size distribution characteristics of atmospheric fine partcles (PM2.5) in indoor environment[D]. Jinan: Shandong University, 2013.) http://cdmd.cnki.com.cn/Article/CDMD-10422-1013221518.htm
|
| [6] |
蒲彦利, 张春玲, 薛渊, 等. PM2.5中16种多环芳烃的高效液相色谱测定法[J]. 职业与健康, 2016, 32(24): 3349-3352, 3358. (In English: Pu YL, Zhang CL, Xue Y, et al. Determination of 16 polycyclic aromatic hydrocarbons in PM2.5 by HPLC[J]. Occup Health, 2016, 32(24): 3349-3352, 3358.) |
| [7] |
邓樱花, 孙敏, 侯汉娜, 等. 高效液相色谱法检测土壤中的5种多环芳烃[J]. 湖北大学学报(自然科学版), 2010, 32(4): 454-457. (In English: Deng YH, Sun M, Hou HN, et al. Determination of five polycyclic aromatic hydrocarbons in soil by high performance liquid chromatography[J]. J Hubei Univ (Nat Sci), 2010, 32(4): 454-457. DOI:10.3969/j.issn.1000-2375.2010.04.027) |
| [8] |
汪晨霞, 张瑞瑞, 寻知庆, 等. 分散固相萃取净化/高效液相色谱法测定婴幼儿奶粉与米粉中15种多环芳烃[J]. 分析测试学报, 2018, 37(4): 459-463. (In English: Wang CL, Zhang RR, Xun ZQ, et al. Determination of polycyclic aromatic hydrocarbons in infant formula and rice by high performance liquid chromatography with dispersive solid phase extraction purification[J]. J Instrum Anal, 2018, 37(4): 459-463. DOI:10.3969/j.issn.1004-4957.2018.04.012) |
| [9] |
李春欣.大气颗粒物及茶叶中多环芳烃类分析方法的研究及应用[D].北京: 北京化工大学, 2017. (In English: In English: Li CX. Studies on the analysis methods and application of polycyclic aromatic hydrocarbons in air particulate matter and tea samples[D]. Beijing: Beijing University of Chemical Technology, 2017.) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3221648
|
| [10] |
王统艳, 邓晓燕. 水体中多环芳烃的前处理技术与分析方法[J]. 分析仪器, 2012(1): 6-12. (In English: Wang TY, Deng XY. Sample pretreatment techniques and analytical methods for polycyclic aromatic hydrocarbons in water[J]. Anal Instrum, 2012(1): 6-12. DOI:10.3969/j.issn.1001-232X.2012.01.002) |
| [11] |
王娜. 加速溶剂萃取-固相萃取净化-色谱法测定土壤中的多环芳烃和有机氯[J]. 环境化学, 2013, 32(3): 524-525. DOI:10.7524/j.issn.0254-6108.2013.03.030 |
| [12] |
林玉君, 贾静, 吴建刚, 等. 索氏提取-气相色谱三重四极杆串联质谱联用法测定空气中的多环芳烃[J]. 福建分析测试, 2015, 24(3): 31-34. (In English: Lin YJ, Jia J, Wu JG, et al. Determination of polycyclic aromatic hydrocarbons in ambient air by Soxhlet extraction-gas chromatography-triple quadrupole mass spectrometry[J]. Fujian Anal Test, 2015, 24(3): 31-34. DOI:10.3969/j.issn.1009-8143.2015.03.07) |
| [13] |
常君瑞, 李娜, 徐春雨, 等. 索氏与超声法提取PM2.5中多环芳烃的比较[J]. 环境卫生学杂志, 2015, 5(2): 160-164. (In English: Chang JR, Li N, Xu CY, et al. Comparison of Soxhlet and ultrasonic method for extraction polycyclic aromatic hydrocarbons in PM2.5[J]. J Environ Hyg, 2015, 5(2): 160-164.) |
| [14] |
谷晓琳, 李迎梅, 孙晓红, 等. GC-MS/MS法测定大气细颗粒物(PM2.5)中多环芳烃提取方法比较[J]. 中国卫生标准管理, 2016, 7(1): 14-16. (In English: Gu XL, Li YM, Sun XH, et al. Comparison of the method for extraction polycyclic aromatic hydrocarbons in PM2.5 by GC-MS/MS[J]. China Health Stand Manag, 2016, 7(1): 14-16.) |
| [15] |
杨帆, 翟毓秀, 任丹丹, 等. 高效液相色谱-荧光/紫外串联测定海洋沉积物中16种多环芳烃[J]. 渔业科学进展, 2013, 34(5): 104-111. (In English: Yang F, Zhai YX, Ren DD, et al. Determination of sixteen polycyclic aromatic hydrocarbons in marine sediments by high performance liquid chromatography with fluorescence and ultraviolet detection[J]. Prog Fishery Sci, 2013, 34(5): 104-111. DOI:10.3969/j.issn.1000-7075.2013.05.016) |
| [16] |
常君瑞, 李娜, 徐春雨, 等. 超声提取-高效液相色谱法测定PM2.5中的多环芳烃[J]. 实用预防医学, 2016, 23(3): 267-270. (In English: Chang JR, Li N, Xu CY, et al. Determination of polycyclic aromatic hydrocarbons from PM2.5 by ultrasonic extraction coupled with high performance liquid chromatography[J]. Pract Prev Med, 2016, 23(3): 267-270. DOI:10.3969/j.issn.1006-3110.2016.03.004) |
| [17] |
史纯珍, 屈瑶, 毛旭. 大气细颗粒物(PM2.5)中多环芳烃的分析测定与污染特征[J]. 环境化学, 2015, 34(8): 1417-1423. (In English: Shi CZ, Qu Y, Mao X. Analysis and pollution characteristics of polycyclic aromatic hydrocarbons(PAHs) in PM2.5[J]. Environ Chem, 2015, 34(8): 1417-1423.) |
| [18] |
何强, 孔祥虹, 李建华, 等. 采用新型固相萃取柱快速测定食用植物油中苯并[a]芘[J]. 分析测试学报, 2012, 31(6): 710-714. (In English: He Q, Kong XH, Li JH, et al. Rapid determination of Benzo[a]pyrene in edible vegetable oil using a new type of solid phase extraction column[J]. J Instrum Anal, 2012, 31(6): 710-714. DOI:10.3969/j.issn.1004-4957.2012.06.015) |
| [19] |
刁春燕, 周启星, 周俊良, 等. 土壤、沉积物和植物样品中多环芳烃(PAHs)不同提取与净化方法比较[J]. 农业环境科学学报, 2011, 30(12): 2399-2407. (In English: Diao CY, Zhou QX, Zhou JL, et al. Comparison of extraction and purification methods for polycyclic aromatic hydrocarbons(PAHs) in soil, sediment and plant samples[J]. J Agro-Environ Sci, 2011, 30(12): 2399-2407.) |

