2. 广州医科大学附属第一医院广州呼吸疾病研究所
与机体内部因素不同,环境因素作为一种患病的危险因素,并不是使机体产生病理状态的直接原因,更多情况是属于激发、诱导的角色,因此,通过对环境因素的控制可以减轻易受环境影响疾病的恶化程度,这也是人类控制疾病发生发展的有效途径。
近年来流行病学调查显示,过敏性疾病的发生率不断增高,特别是工业化国家的发病率增高尤为明显,这可能与工业化国家发展时所产生的环境污染有关[1-4]。过敏性疾病包括过敏性鼻炎 (allergic rhinitis,AR),支气管哮喘 (bronchial asthma,BA),食物过敏 (food allergy,FA) 等。以BA为例,他是由多种细胞和细胞组分参与的气道慢性炎症性疾病,环境中的花粉、尘螨、室内粉尘、真菌、动物羽毛或皮毛等的过敏原与其发病密切相关,反复多次接触环境中的过敏原可出现发作的喘息、气促、胸闷和 (或) 咳嗽等症状,给患者带来严重的生活和社会压力[5-9]。环境因素是过敏性疾病发病的重要危险因素之一。
过敏性疾病的发生会使人体内的氧化与抗氧化平衡系统发生紊乱。研究表明,体内的氧化应激 (oxidative stress,OS) 水平受到自由基的干扰[10-11]。自由基的来源可以是体内或者体外,不良的环境因素即是自由基的体外来源,体内自由基过多会使氧化应激水平升高,进而造成体内氧化/抗氧化系统失衡,引发过敏性疾病。在此过程中,多环芳香烃 (polycyclic aromatic hydrocarbons,PAHs) 是体内外自由基的主要来源。PAHs是通过自然和人为来源释放到环境中的,由两个或者更多稠合苯环组成的一类有机化合物,是广泛存在的环境污染物。环境对过敏性疾病的影响与体内氧化应激水平的高低有密切联系,因而与环境中的PAHs密切相关。
病理情况下,比如患有过敏性疾病时,体内过剩的自由基得不到及时处理,对机体造成很多的损伤,如果此时空气中的PAHs增加,随之摄入体内的PAHs也会增加,这是外源自由基的来源,他们会强制性地增加人体抗氧化系统的压力[12-13]。
PAHs的产生既有自然来源,也有人为来源。自然来源包括陆地和水生植物、森林草原的天然火灾和火山活动以及细菌活动[14]。人为来源则是由各种矿物燃料 (煤、石油和天然气等)、木材以及其他碳氢化合物的不完全燃烧或在还原气氛下的热解所产生[15]。PAHs能在环境中持久存在,在各种环境介质 (大气、水和生物体等) 中进行长距离迁移并且易于在生物体脂类中富集浓缩[16],被列入典型持久性有机污染物 (persistent organic pollutants,POPs)。PAHs进入环境后通过环境蓄积、生物蓄积、生物转化或化学反应等方式损害健康和环境[17-19]。毒理学证据表明,苯并芘 (benzopyrene,BAP) 是空气中含量最丰富的一类PAHs,几乎在所有的PAHs混合物中都有相当高的比例 (2%~10%)[20-22]。
由于人体对PAHs的暴露包括呼吸道、消化道和皮肤接触等多种途径,他们是体内外自由基的来源。BAP除少部分以原形随粪便排出外,一部分经肝、肺细胞微粒体中混合功能氧化酶激活而转化为包括羟基化合物或醌类等数十种代谢产物,表现为解毒反应;一部分转化为7,8-环氧化物等环氧化物,则是表现为活化反应。
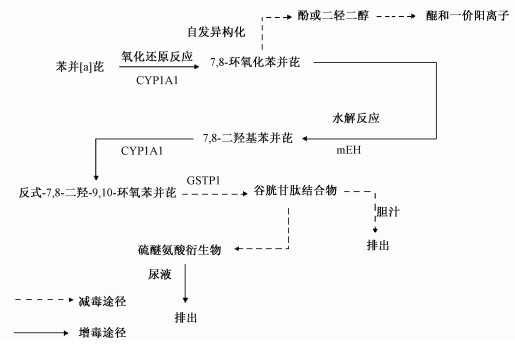
1 PAH参与人体代谢的基本方式 1.1 多环芳烃以分子形式参与人体代谢当环境中的PAHs增多时,人体摄入的量也会增加,对PAHs进入人体全程代谢反应会起到正向促进的作用,代谢步骤见图 1。
|
| 图 1 多环芳烃在人体内的代谢 (以苯并芘为例) |
尿液中的硫醚氨酸衍生物可作为人体暴露在多环芳烃环境的指标。另外,反应过程中激活了谷胱甘肽巯基转移酶P1 (glutathione-s-transferase,GSTP1),GSTP1可与许多卤代化合物和环氧化合物结合,生成谷胱甘肽 (glutathione,GSH) 的结合物。生成的谷胱甘肽结合物主要随胆汁排出,也可以经由肾脏,在γ-谷氨酰转移酶以及其他酶的协助下,将谷胱甘肽化合物转化为硫醚氨酸,间接随尿排出体外。因而,当人体摄入PAHs过多时,体内的GSH会减少。GSH是由谷氨酸、半胱氨酸及甘氨酸组成的一种三肽,参与体内三羧酸循环,在使人体获得足量ATP的同时能激活多种酶。如巯基酶—辅酶等,进而促进糖类、脂肪及蛋白质代谢。在糖代谢的过程中,多环芳烃中芘类的主要代谢产物是1-羟基芘 (1-OHP),尿中1-羟基芘的浓度可以反映人体接触环境中多环芳烃的水平,他不仅与环境空气中芘的浓度有良好的正相关,而且也与苯并 (a) 芘有很好的正相关,因此人尿中1-羟基芘是多环芳烃的一个灵敏有效的生物监测指标[23-25]。该反应中产生的反式-7,8-二羟-9,10-环氧苯并芘,属于强致癌物,虽然代谢过程中既有增毒步骤也有减毒步骤,但人体的自我调节也有一定的限度,环境中过多的多环芳烃最终会打破人体的平衡。这是环境中的PAHs进入人体直接发生代谢的反应。
1.2 多环芳烃以自由基形式参与人体代谢煤、石油和木材等有机物不完全燃烧[26]及香烟产生的烟雾和焦油[27]等外源性环境因素会产生多种自由基 (free radical,FR),FR是一些具有不配对电子的分子、原子或原子团,他们在外层轨道上缺少电子,因而高度活化,具有很强的氧化反应能力,总是企图夺取其他原子或分子的电子,而氧自由基是由氧经过单电子还原生成的。人体内也无时无刻不在进行着自由基反应,比如人体的免疫系统,产生FR较多的为活化单核细胞、巨噬细胞和中性粒细胞。嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞在受到免疫、非免疫刺激后会产生FR。具体过程如下:嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞等免疫细胞在吞噬细菌或者在炎症刺激物的刺激下,由NADPH氧化酶介导生成的O2经歧化反应生成H2O2,H2O2可以生成羟自由基 (·OH),也可以在氯离子 (Cl-) 存在的情况下,经髓过氧化物酶 (myeloperoxidase,MPO) 作用生成活性更强的次氯酸 (HOCl) 和单态氧 (singlet oxygen,1O2),1O2是分子氧的激发态形式,是一种亲电子性的强氧化剂 。次氯酸易分解,新产生的氧自由基具有超强氧化性;单态氧虽然不属于自由基,但反应活性比普通氧高 (图 2)。

|
| 图 2 在MPO的作用下人体内产生自由基的反应 |
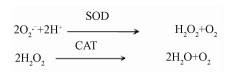
人体本身就会进行一系列自由基的反应,在生物体内正常生理条件下,自由基基本处于平衡状态,既不断产生也不断被清除,因此处于平衡状态的自由基浓度很低,这部分自由基不仅不损伤机体,反而对机体有独特的生理作用。最主要是吞噬细胞所产生的活性氧和活性氮有助于其杀灭侵入机体的微生物;其次是前列腺素、凝血酶原的生物合成过程需要氧自由基来促进其羟化反应。在病理情况下,物理因素或外源性化学物质等环境因素直接或间接诱导产生的FR,若得不到及时地清除,或内源性FR的产生和清除失去了正常平衡,常常会造成FR对机体的损伤。如:超氧阴离子 (O2·-) 可以引起细胞畸变,具有很高的细胞毒性,还可以在超氧化物歧化酶 (superoxide Dismutase, SOD) 催化下自发歧化生H2O2,H2O2具有较强的氧化性,对细胞也有一定的毒害作用,因而此时机体内的过氧化氢酶 (catalase, CAT) 的产生会增加,减少过氧化氢给机体带来的危害[30-31]。SOD与CAT的作用步骤如图 3。
|
| 图 3 SOD与CAT的抗氧化作用 |
环境中过多的PAHs会以自由基的形式进入人体,打破自由基的产生与消除的平衡,脂质过氧化反应则是自由基反应中最明显且常见的一类反应。脂质过氧化反应是活性氧攻击生物膜磷脂中的多不饱和脂肪酸 (polyunsaturated fatty acid, PUFA) 引发的一种自由基链式反应,产生脂质过氧化物的反应。活性氧的来源有两个方面,一是机体自身生化反应产生的,二是人体吸入过量的多环芳烃在人体经一系列反应产生的。在自由基的作用下,PUFA脂质分子 (LH) 脱去1个氢原子形成脂质自由基 (L·),L·与氧反应形成脂质过氧自由基 (LOO·),LOO·再进攻其他的脂质分子夺取其氢原子,形成新的自由基和LOOH,此反应可反复进行,从而导致PUFA分子的不断消耗和脂质羧酸物 (LOOH) 的大量生成。
细胞膜和细胞器膜发生脂质过氧化除了会使膜结构改变,流动性、通透性离子转运及屏障功能受损,还会引起溶酶体中酶的释放、线粒体膨胀及酶失活等,造成多种细胞损伤,如:红细胞膜发生脂质过氧化会导致溶血,微粒体发生脂质过氧化则会导致多聚核糖体的解聚甚至抑制蛋白质的合成。而LOOH会进一步产生各种醛类,进一步影响机体各种功能,如丙二醛 (malondialdehyde, MDA) 会与蛋白质、核酸及脑磷脂等发生反应,使其交联聚合[32]。因此,当体内产生或进入体内的自由基增多时,会促进体内氧化应激的产生,使体内的MDA增加,MDA可作为衡量体内氧化应激水平的指标[33-34]。
除了对人体细胞的细胞膜会有不良的影响,过多的自由基对人体组织及细胞中的核酸、染色体和蛋白质也都有不同程度的危害。外界进入人体内的多环芳烃是机体产生自由基的来源之一,而体内的自由基既可与碱基作用生成碱基自由基,也可与脱氧核糖反应形成自由基,造成DNA严重损伤,使遗传信息改变,最后导致细胞死亡。8-羟化脱氧鸟苷是敏感的DNA损伤标记物,因一个氢氧基接在鸟嘌呤的第八个碳上而形成的,由氧化应激过程中产生的羟自由基诱导形成[35]。此外,自由基可以直接作用于蛋白质,与其临近的氨基酸发生过氧化;也可通过LOOH间接作用于蛋白质。蛋白质过氧化会表现为蛋白质的多肽链断裂、与氨基酸发生氧化反应以及与其他蛋白质交联等,最终导致细胞功能紊乱。
2 PAHs对吸入性过敏性疾病的影响机制过敏性疾病患者从初次接触过敏原开始,体内已经存在致敏的巨噬细胞和嗜碱性粒细胞,当再次接触过敏原时,能产生组胺、白三烯、5-羟色胺、前列腺素D、血小板活化因子等生物活性介质,引起平滑肌收缩、毛细血管扩张和通透性增强、腺体分泌物增多等生理反应,这是过敏反应的主要表现症状。
当空气中的PAHs通过自由基形式进入人体后,自由基及其氧化应激的产物MDA等会对细胞膜以及细胞内的核酸、蛋白质等有机分子造成氧化损伤。鼻粘膜和肺部黏膜组织存在大量的肥大细胞和嗜碱性粒细胞,摄入人体内未经及时处理的自由基会破坏巨噬细胞和嗜碱性粒细胞的细胞膜,细胞膜变性后,细胞的稳定性下降,因此这类巨噬细胞和嗜碱性粒细胞对过敏原的敏感性更高,导致机体产生更剧烈的过敏反应,平滑肌收缩、毛细血管扩张,同时通透性增强、粘液分泌及组织损伤加剧,表现为吸入性过敏性疾病的恶化。
3 其他环境因素与过敏性疾病外界环境对过敏性疾病患者的影响比对正常人的影响尤为敏感,BA患者常具有对某些物质过敏的特应性体质,吸入冷空气、花粉和尘螨等,容易导致体内的氧化/抗氧化系统失衡,而环境中存在的PAHs过多地进入人体后又会增加人体内的氧化应激水平,造成更为严重的氧化损伤,因此不良的环境因素对过敏性疾病来说是一个潜在的危险因子,长期暴露容易使过敏性疾病患者病情恶化。相比较于不可避免的遗传因素,环境因素属于外界因素,可以尽量避免暴露在其中,降低影响。
空气中的PAHs是体内过剩自由基的主要来源,过剩的自由基在体内能造成不可逆的氧化损伤,过度的氧化损伤是导致疾病症状恶化的关键因素,特别是对外界环境敏感的过敏性疾病。因此,控制环境中的PAHs是防止过敏性疾病等疾病恶化的出发点。了解空气中的多环芳烃对机体的影响途径和影响程度,对于实施合理的环境干预手段预防和避免疾病恶化以及在机制上从机体内部采取合理措施抵抗环境因素的干扰具有重要的指导意义。
| [1] | Isolauri E, Arvola T, Sütas Y, et al. Probiotics in the management of atopic eczema[J]. Clin Exp Allergy, 2000, 30(11): 1605–1610. doi: 10.1046/j.1365-2222.2000.00943.x |
| [2] | Jenerowicz D, Silny W, Danczak-Pazdrowska A, et al. Environmental factors and allergic diseases[J]. Ann Agric Environ Med, 2012, 19(3): 475–481. |
| [3] | Deng Q, Lu C, Li Y, et al. Exposure to outdoor air pollution during trimesters of pregnancy and childhood asthma, allergic rhinitis, and eczema[J]. Environ Res, 2016, 150: 119–127. doi: 10.1016/j.envres.2016.05.050 |
| [4] | Dunlop J, Matsui E, Sharma HP. Allergic rhinitis: environmental determinants[J]. Immunol Allergy Clin North Am, 2016, 36(2): 367–377. doi: 10.1016/j.iac.2015.12.012 |
| [5] | 李盛, 王金玉, 王宇红, 等. 大气污染对兰州市城关区小学生肺通气功能的影响[J]. 环境与健康杂志, 2015, 32(6): 498–500. Li S, Wang JY, Wang YH, et al. Effects of air pollution on pulmonary ventilation function of school children in Chengguan district, Lanzhou[J]. J Environ Health, 2015, 32(6): 498–500. (in Chinese). |
| [6] | Begum M, Lewison G, Wright JS, et al. European non-communicable respiratory disease research, 2002-13: bibliometric study of outputs and funding[J]. PLoS One, 2016, 11(4): e0154197. doi: 10.1371/journal.pone.0154197 |
| [7] | Ehteshami-Afshar S, FitzGerald JM, Doyle-Waters MM, et al. The global economic burden of asthma and chronic obstructive pulmonary disease[J]. Int J Tuberc Lung Dis, 2016, 20(1): 11–23. doi: 10.5588/ijtld.15.0472 |
| [8] | Sharifi L, Pourpak Z, Fazlollahi MR, et al. Asthma economic costs in adult asthmatic patients in Tehran, Iran[J]. Iran J Public Health, 2015, 44(9): 1212–1218. |
| [9] | 冯文如, 刘世强, 黄勇, 等. 广州市PM2.5浓度与人群每日死亡风险的空间分布特征[J]. 环境卫生学杂志, 2015, 5(6): 512–519. Feng WR, Liu SQ, Huang Y, et al. Spatial distribution characteristics of PM2.5 in air and daily mortality in Guangzhou[J]. J Environ Hygiene, 2015, 5(6): 512–519. (in Chinese). |
| [10] | Freitas F, Brucker N, Durgante J, et al. Urinary 1-hydroxypyrene is associated with oxidative stress and inflammatory biomarkers in acute myocardial infarction[J]. Int J Environ Res Public Health, 2014, 11(9): 9024–9037. doi: 10.3390/ijerph110909024 |
| [11] | Polonikov AV, Ivanov VP, Bogomazov AD, et al. Genetic and biochemical mechanisms of involvement of antioxidant defense enzymes in the development of bronchial asthma[J]. Biomed Khim, 2015, 61(4): 427–439. doi: 10.18097/pbmc20156104427 |
| [12] | 魏静. 过氧化物酶体氧化应激与肿瘤关系的研究进展[J]. 医学综述, 2013, 19(24): 4453–4455. doi: 10.3969/j.issn.1006-2084.2013.24.013 Wei J. The research progress of oxidative stress in peroxisome and its relation with cancer[J]. Med Recapit, 2013, 19(24): 4453–4455. doi: 10.3969/j.issn.1006-2084.2013.24.013 (in Chinese). |
| [13] | Lu SY, Li YX, Zhang JQ, et al. Association between polycyclic aromatic hydrocarbon (PAH) exposure and oxidative stress in people living near e-waste recycling facilities in China[J]. Environ Int, 2016, 94: 161–169. doi: 10.1016/j.envint.2016.05.021 |
| [14] | Kim KH, Jahan SA, Kabir E, et al. A review of airborne polycyclic aromatic hydrocarbons (PAHs) and their human health effects[J]. Environ Int, 2013, 10(60): 71–80. |
| [15] | 赵峰, 刘迎春, 蔡嘉旖, 等. 交通来源污染物的暴露评价研究进展[J]. 环境卫生学杂志, 2016, 6(1): 68–75. Zhao F, Liu YC, Cai JN, et al. Progress on exposure assessment from traffic-related pollution[J]. J Environ Hygiene, 2016, 6(1): 68–75. (in Chinese). |
| [16] | 刘世荣. 微生物在多环芳烃降解应用中的机理及其研究趋势[J]. 现代商贸工业, 2008(8): 379–380. |
| [17] | Li J, Fan R, Lu S, et al. Exposure to polycyclic aromatic hydrocarbons could cause their oxidative DNA damage: a case study for college students in Guangzhou, China[J]. Environ Sci Pollut Res Int, 2015, 22(3): 1770–1777. doi: 10.1007/s11356-014-2769-z |
| [18] | Kamal A, Qamar K, Gulfraz M, et al. PAH exposure and oxidative stress indicators of human cohorts exposed to traffic pollution in Lahore city (Pakistan)[J]. Chemosphere, 2015, 120: 59–67. doi: 10.1016/j.chemosphere.2014.05.021 |
| [19] | Levine H, Berman T, Goldsmith R, et al. Urinary concentrations of polycyclic aromatic hydrocarbons in Israeli adults: demographic and life-style predictors[J]. Int J Hyg Environ Health, 2015, 218(1): 123–131. doi: 10.1016/j.ijheh.2014.09.004 |
| [20] | 于林杰. 多环芳烃对环境的污染分析研究[J]. 环境科学与管理, 2014, 39(7): 73–75. Yu LJ. Analysis on environmental pollution characteristics of polycyclic aromatic hydrocarbons[J]. Environ Sci Manag, 2014, 39(7): 73–75. (in Chinese). |
| [21] | Fang GC, Chang KF, Lu C, et al. Estimation of PAHs dry deposition and BaP toxic equivalency factors (TEFs) study at Urban, Industry Park and rural sampling sites in central Taiwan, Taichung[J]. Chemosphere, 2004, 55(6): 787–796. doi: 10.1016/j.chemosphere.2003.12.012 |
| [22] | 樊曙光, 黄红丽, 顾凯华, 等. 雾过程对大气气溶胶PM10中多环芳烃粒径分布的影响[J]. 高等学校化学学报, 2010, 31(12): 2375–2382. Fan SG, Huang HL, Gu KH, et al. Effect of fog process on the size distribution of polycyclic aromatic hydrocarbons in the atmospheric aerosol PM10[J]. Chem J Chin Univ, 2010, 31(12): 2375–2382. (in Chinese). |
| [23] | Demetriou CA, Raaschou-Nielsen O, Loft S, et al. Biomarkers of ambient air pollution and lung cancer: a systematic review[J]. Occup Environ Med, 2012, 69(9): 619–627. doi: 10.1136/oemed-2011-100566 |
| [24] | Barbeau D, Lutier S, Bonneterre V, et al. Occupational exposure to polycyclic aromatic hydrocarbons: relations between atmospheric mixtures, urinary metabolites and sampling times[J]. Int Arch Occup Environ Health, 2015, 88(8): 1119–1129. doi: 10.1007/s00420-015-1042-1 |
| [25] | Bae S, Pan XC, Kim SY, et al. Exposure to particulate matter and polycyclic aromatic hydrocarbons and oxidative stress in schoolchildren[J]. Environ Health Perspect, 2010, 118(4): 579–583. |
| [26] | 徐建军, 张志红, 耿红, 等. 不同工作环境人群PM2.5暴露水平与肺功能的研究[J]. 环境与健康杂志, 2013, 30(1): 1–4. Xu JJ, Zhang ZH, Geng H, et al. Relationship between PM2.5 exposure and pulmonary function in different working environments[J]. J Environ Health, 2013, 30(1): 1–4. (in Chinese). |
| [27] | 杜向阳. 父母居室内吸烟对儿童呼吸系统疾病和症状的影响研究[J]. 环境与健康杂志, 2015, 32(6): 501–504. Du XY. Affacts of parents smoking indoor on respiratory symptoms and disease among school-aged children[J]. J Environ Health, 2015, 32(6): 501–504. (in Chinese). |
| [28] | Aitken RJ, Smith TB, Jobling MS, et al. Oxidative stress and male reproductive health[J]. Asian J Androl, 2014, 16(1): 31–38. doi: 10.4103/1008-682X.122203 |
| [29] | Marseqlia L, D'Angelo G, Manti S, et al. Oxidative stress-mediated aging during the fetal and perinatal periods[J]. Oxid Med Cell Longev, 2014, 2014: 358–375. |
| [30] | Xu J, Duan X, Yang J, et al. Enhanced reactive oxygen species scavenging by overproduction of superoxide dismutase and catalase delays postharvest physiological deterioration of cassava storage roots[J]. Plant Physiol, 2013, 161(3): 1517–1528. doi: 10.1104/pp.112.212803 |
| [31] | Celik M, Tuncer A, Soyer OU, et al. Oxidative stress in the airways of children with asthma and allergic rhinitis[J]. Pediatric Allergy Immunol, 2012, 23(6): 556–561. doi: 10.1111/pai.2012.23.issue-6 |
| [32] | Wang CY, Chen JK, Wu YT, et al. Reduction in antioxidant enzyme expression and sustained inflammation enhance tissue damage in the subacute phase of spinal cord contusive injury[J]. J Biomed Sci, 2011, 18: 13. doi: 10.1186/1423-0127-18-13 |
| [33] | Chen SJ, Yen CH, Huang YC, et al. Relationship between inflammation, adiponectin, and oxidative stress in metabolic syndrome[J]. PLoS One, 2012, 7(9): e45693. doi: 10.1371/journal.pone.0045693 |
| [34] | Dut R, Dizdar EA, Birben E, et al. Oxidative stress and its de-terminants in the airways of children with asthma[J]. Allergy, 2008, 63(12): 1605–1609. doi: 10.1111/all.2008.63.issue-12 |
| [35] | 高玉楠, 杨靖, 宋沁馨, 等. 8-羟基脱氧鸟苷作为DNA氧化损伤标志物在疾病诊断中的应用[J]. 药学与临床研究, 2012, 20(3): 223–228. Gao YN, Yang J, Song QX, et al. Application of 8-hydroxydeoxyguanosine as a biomarker of oxidative damage in diagnosis[J]. Pharm Clin Res, 2012, 20(3): 223–228. (in Chinese). |



