2. 苏州大学医学部实验中心;
3. 苏州大学医学部公共卫生学院卫生毒理学教研室
壬基酚 (nonylpheol,NP) 是化学工业制造中的重要原料和中间体,广泛运用于各种乳化剂、润滑剂、抗氧化剂等化工材料的制造[1]。近年来,随着化工产业的快速发展,越来越多的壬基酚进入环境[2],同时大量的实验研究也证实了壬基酚具有雌激素样效应,会干扰机体多个系统的内分泌过程,造成生殖能力下降、内分泌失调、免疫力下降等[3-4]。目前,国内外的研究主要集中于壬基酚的生殖毒性[5]及免疫毒性[6],对胰腺影响的报道较少,而且由于染毒时间、剂量的不同,研究结果也不尽一致[7-9],尚需更多研究确认其效应。本文采用壬基酚亚慢性染毒,探讨壬基酚对胰腺的毒性作用。
1 材料和方法 1.1 材料 1.1.1 实验动物32只6周龄清洁级SD雄性大鼠,体重200 g~230 g,购自上海斯莱克实验动物有限公司,实验动物批号为0157305,许可证为SCXK (沪)2012-0002。
1.1.2 主要试剂壬基酚 (分析纯,纯度≥99%,Adamas公司),玉米油 (金龙鱼),碘[125I]胰岛素放射免疫分析药盒、碘[125I]胰高血糖素放射免疫分析药盒 (北京北方生物技术研究所),一抗 (Insulin)、一抗 (Glucagon)(武汉谷歌生物科技有限公司),V型胶原酶 (美国Sigma公司),肝/肌糖原测定试剂盒 (南京建成生物工程研究所),4-羟乙基哌嗪乙磺酸 (HEPES) 缓冲液 (美国HyClone)。
1.1.3 主要仪器罗康全 (整合型) 血糖仪 (德国罗氏诊断有限公司),GC-1200γ放射免疫计数器 (上海五久自动化设备有限公司),BX5型电子显微镜 (日本Olympus公司),T10 Basic匀浆机 (日本IKA公司),YP202N电子天平 (上海精密科学仪器厂),多功能酶标仪 (美国Molecucar Devices公司),266 MP自动石蜡包埋仪 (美国Fisher Model公司),RM215石蜡切片机 (美国Leica公司)。
1.1.4 主要试剂及其配制壬基酚溶液:根据大鼠体重准确称量壬基酚后溶于玉米油中制成相应浓度的壬基酚溶液。Krebs-Ringer碳酸氢盐-4-羟乙基哌嗪乙磺酸缓冲液 (KRB-HEPES) 液:20 mL的A液 (34.7 g NaCl,1.77 g KCl,0.808 g KH2PO4,1.412 g MgSO4,1.412 g CaCl2溶于1 L蒸馏水),16 mL的B液 (2.625 g NaHCO3,5.347 g NaCl溶于1 L蒸馏水),1 mL的HEPES液,58 mL蒸馏水配制而成。盐酸乙醇溶液:0.18 mol/L盐酸与无水乙醇按照1:3的体积比例配制。
1.2 方法 1.2.1 实验动物处理大鼠适应性饲养一周后,将32只大鼠随机分为4组,每组8只。对照组 (0) 用1 mL玉米油灌胃,其余三组用1 mL分别溶有20 mg/kg、60 mg/kg和180 mg/kg壬基酚进行灌胃。每天灌胃染毒,连续90 d。
1.2.2 空腹血糖检测染毒90 d后,大鼠空腹12 h,割尾取血,血糖仪检测血糖。
1.2.3 血清胰岛素及胰高血糖素检测染毒结束后大鼠用10%水合氯醛麻醉,腹主动脉采血,室温放置30 min后离心取血清,分装后-80℃冻存。血清胰岛素、胰高血糖素采用放射免疫法测定。胰岛素浓度以μIU/mL表示,胰高血糖素浓度以pg/mL表示。
1.2.4 胰岛分泌胰岛素能力的检测根据Claes B Wollheim[10]分离胰岛的方法,对胰腺进行消化,随机选取30个胰岛培养于500 μL含16.7 mmol/L葡萄糖的KRB-HEPES液中,37℃,5%CO2培养2 h后,取100 μL上清作为待测液,采用放射免疫法测定胰岛素含量。
1.2.5 胰腺组织中胰岛素的检测取胰腺尾部组织 (100 mg~200 mg),生理盐水漂洗后用滤纸吸干。采用酸乙醇法提取胰腺组织中的胰岛素,按6 mL/g胰腺组织的量加入盐酸乙醇,匀浆机20 500 r/min匀浆30 s,4℃萃取过夜。匀浆液10 000 r/min离心半径为7 cm, 离心10 min,取上清液于-80℃保存。采用免疫放射法测定胰岛素含量。
1.2.6 肝糖原检测取75 mg左右的肝脏组织用生理盐水漂洗,滤纸吸干,按照糖原测试盒进行肝糖原的测定。肝糖原浓度以mg/g表示。
1.2.7 免疫组化检测取部分新鲜胰腺组织固定于10%的中性甲醛中,自动石蜡包埋机包埋,石蜡切片机进行切片,采用免疫组织化学的方法染色,用Image pro-plus 6.0软件分析单个胰岛面积、胰岛β细胞相对容积 (胰岛素平均阳性表达面积/平均胰岛面积)、胰岛α细胞相对容积 (胰高血糖素平均阳性表达面积/平均胰岛面积) 以及β细胞与α细胞的比率 (胰岛素平均阳性颗粒面积/胰高血糖素平均阳性颗粒面积)。
1.3 统计学方法大鼠各项数据均以x±s表示。采用SAS 9.21软件进行统计学分析。多组间比较采用方差齐性检验和单因素方差分析 (One Way ANOVA),进一步进行组间两两比较时,采用SNK法进行检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 壬基酚染毒对大鼠体重的影响染毒期间各组大鼠体重随时间增加。从染毒30 d开始至90 d染毒结束,180 mg/kg染毒组与对照组 (0) 比较大鼠体重明显下降 (P < 0.05;表 1)。
| 染毒剂量/(mg/kg) | 染毒前 | 染毒30 d | 染毒60 d | 染毒90 d |
| 0(对照组) | 227.63±12.36 | 399.25±22.68 | 467.88±34.00 | 520.13±33.17 |
| 20 | 231.56±9.08 | 410.25±22.28 | 479.63±25.44 | 525.19±41.00 |
| 60 | 228.31±6.46 | 394.50±13.83 | 463.63±17.63 | 494.88±22.67 |
| 180 | 227.31±9.29 | 360.63±18.62* | 419.50±14.05* | 451.38±35.08* |
| 注:与对照组比较,*P < 0.05 | ||||
2.2 壬基酚染毒对大鼠血糖、胰岛素、胰高血糖素水平的影响
90 d染毒后,各组大鼠空腹血糖无明显差异,180 mg/kg染毒组血清胰岛素水平显著低于对照组 (P < 0.05),胰高血糖素水平呈现先升高后回落至正常水平,仅60 mg/kg染毒组胰高血糖素显著高于对照组 (P < 0.05;表 2)。
| 染毒剂量/ (mg/kg) |
空腹血糖/ (mmol/L) |
胰岛素/ (μIU/mL) |
胰高血糖素/ (pg/mL) |
| 0(对照组) | 5.29±0.29 | 32.77±3.90 | 101.48±24.94 |
| 20 | 4.91±0.38 | 33.72±7.32 | 109.40±28.74 |
| 60 | 4.91±0.49 | 29.97±4.05 | 134.67±12.45* |
| 180 | 5.28±0.39 | 25.53±3.38* | 114.44±5.41 |
| 注:与对照组比较,*P < 0.05 | |||
2.3 壬基酚染毒对胰岛分泌胰岛素的影响
壬基酚染毒后胰岛分泌胰岛素水平见图 1。随着染毒剂量的增加,胰岛分泌胰岛素水平先升高后降低,仅180 mg/kg染毒组的胰岛素分泌水平下降明显 (P < 0.05)。
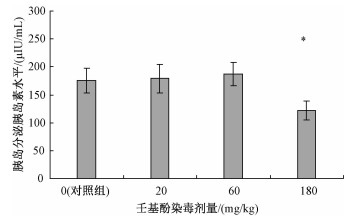
|
| 注:与对照组比较,*P < 0.05 图 1 壬基酚染毒后胰岛分泌胰岛素的水平 |
2.4 壬基酚染毒对胰腺组织中胰岛素和肝脏中肝糖原的影响
90 d染毒结束后,随着染毒剂量的增加,胰腺中的胰岛素水平先升高后下降,仅60 mg/kg染毒组胰腺组织中的胰岛素水平升高明显 (P < 0.05)。肝糖原水平也随着染毒剂量增加先上升后下降,60 mg/kg染毒组肝糖原水平升高明显 (P < 0.05),并且180 mg/kg染毒组肝脏中的肝糖原明显低于对照组 (P < 0.05;表 3)。
| 染毒剂量/ (mg/kg) |
胰腺组织中胰岛素/ (μIU/mL) |
肝脏肝糖原/ (mg/g) |
| 0(对照组) | 56.37±3.07 | 2.31±0.24 |
| 20 | 58.71±3.40 | 2.67±0.35 |
| 60 | 64.93±7.91* | 3.68±0.33* |
| 180 | 54.06±6.58 | 1.70±0.40* |
| 注:与对照组比较,*P < 0.05 | ||
2.5 壬基酚染毒对大鼠胰岛形态结构的影响
采用免疫组化分析,在Image pro-plus 6.0软件下可以观察到胰腺中胰岛素免疫反应阳性颗粒为暗褐色,颜色较深,分布在胰岛各个部位,而胰高血糖素阳性颗粒颜色较淡,多分布在胰岛四周,呈带状或小团块状 (图 2)。随着染毒剂量的增加,胰岛面积呈现逐步减小的趋势,180 mg/kg染毒组胰岛面积显著低于对照组 (P < 0.05),但胰岛β细胞相对容积与对照组比较显著升高 (P < 0.05)。α细胞相对容积先升高后下降,β细胞与α细胞比率先下降后上升,但与对照组比较均无显著差异 (表 4)。
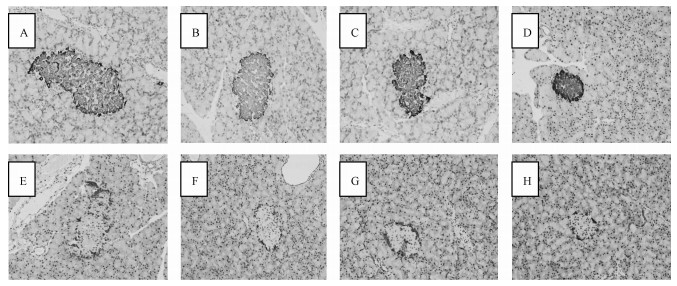
|
| 注:A和E为对照组;B和F为20 mg/kg染毒组;C和G为60 mg/kg染毒组;D和H为180 mg/kg染毒组。其中A-D为胰岛素免疫组化染色,E-H为胰高血糖素免疫组化染色 图 2 胰岛免疫组化染色 (×200) |
| 染毒剂量/(mg/kg) | 胰岛面积/(μm2) | 胰岛β细胞相对容积/% | 胰岛α细胞相对容积/% | β细胞与α细胞比率/(β/α) |
| 0 | 25 675±11682 | 49.94±8.18 | 6.60±2.96 | 8.52±2.95 |
| 20 | 22 909±10216 | 45.80±8.79 | 10.18±4.38 | 5.40±3.04 |
| 60 | 15 697±7598 | 44.00±6.72 | 8.99±2.18 | 5.06±1.11 |
| 180 | 8 699±3147* | 60.76±4.66* | 4.79±0.30 | 12.74±1.43 |
| 注:与对照组比较,*P < 0.05 | ||||
3 讨论
胰腺是机体重要的内分泌器官,胰岛β细胞分泌的胰岛素和胰岛α细胞分泌的胰高血糖素对机体维持内环境稳态具有重要作用。本研究表明,壬基酚亚慢性染毒对大鼠胰腺形态与功能产生了一定影响。
动物体重是一项能灵敏反映动物健康状况的重要指标,同时也是毒性试验研究中最常用的指标,糖代谢与动物体重的变化有着直接的关联。经90 d壬基酚亚慢性染毒,20 mg/kg和60 mg/kg染毒剂量并未对大鼠体重造成明显影响,而180 mg/kg染毒组从30 d开始大鼠体重出现明显下降,且伴随每日饮水量增加,提示壬基酚干扰了大鼠正常的糖代谢和机体整体的生长发育情况。
胰岛素是胰岛β细胞受到各种内源性或外源性刺激分泌的蛋白质激素,是机体唯一能降低血糖浓度的激素。胰岛素和胰岛素受体结合后,能够促进葡萄糖进入细胞内,增加血液中葡萄糖的利用率,在促进糖原、蛋白质、脂肪合成的同时,抑制非糖物质的转化,从而降低血糖浓度。壬基酚对血糖和胰岛素水平的影响较为复杂。单伟等[7]的研究表明,短期 (15 d) 壬基酚染毒能够增加血糖和胰岛素浓度。Jubendradass等[8-9]的实验则观察到采用1.5 mg/kg、15 mg/kg和150 mg/kg壬基酚染毒剂量染毒7 d会增加胰岛素水平、降低血糖浓度,但45 d壬基酚染毒则会同时提高血糖和胰岛素浓度,表明壬基酚与其他环境内分泌干扰物,如双酚A、辛基酚一样具有相同的“高胰岛效应”,即低浓度刺激胰岛素分泌[11-13],但随着染毒时间的增加或者浓度的提高,过度刺激胰岛信号传递,导致β细胞出现胰岛素抵抗的现象,分泌减少[13-14]。本研究发现,180 mg/kg染毒组血清胰岛素水平明显降低,胰腺组织中的胰岛素和胰岛分泌胰岛素实验也显示β细胞分泌能力先升高后下降,其可能机制为:在低浓度暴露下壬基酚能够结合ERα,从而激活ERK1/2信号传递,通过非经典ERα受体途径调节胰岛素分泌,同时改变细胞内Ca2+浓度,激活pdx1基因的表达[15-16],促进胰岛素分泌。而在高浓度暴露下,壬基酚能够抑制胰岛素酪氨酸磷酸化,阻碍胰岛素受体信号的传递,同时降低GLUT mRNA的表达,从而抑制β细胞分泌胰岛素[17]。另一方面,高浓度壬基酚可能诱导β细胞产生炎症因子以及ROS,降低线粒体膜电位,导致供能障碍,可直接诱导β细胞凋亡[18]。各染毒组胰高血糖素水平较对照组均出现不同程度的升高,并且呈先上升后下降的变化,提示壬基酚对α细胞具有相同的刺激作用。
与糖代谢有关的另一个重要组织是肝脏,其中肝糖原的合成与分解与血液中胰岛素浓度密切相关。当血糖水平较高时,刺激β细胞产生胰岛素,同时促进肝糖原的合成,共同降低血糖;而当血糖水平较低时,抑制胰岛素的分泌,同时肝糖原分解,使血糖升高[19]。本研究表明,随着染毒剂量的升高,肝糖原水平先升高后下降,并且60 mg/kg染毒组显著高于对照,180 mg/kg染毒组显著低于对照组,但血糖水平并没有出现明显的变化,可能由于低剂量壬基酚暴露使血糖升高,刺激β细胞分泌胰岛素促进了肝糖原的合成,起到降糖效应。而高剂量壬基酚在抑制胰岛素分泌的同时使胰岛素受体底物减少,降低葡萄糖转运能力,抑制肝糖原的合成[20],使血糖恢复到正常水平。
免疫组化结果表明,随着壬基酚染毒剂量的增加,胰岛面积明显减小,可能壬基酚对细胞产生氧化应激损伤,致使细胞线粒体膜电位降低,钙离子稳态失调,造成细胞损伤,抑制细胞的增殖[21]。180 mg/kg染毒组壬基酚β细胞相对容积增加,可能由于长时间暴露于高浓度壬基酚,导致胰岛β细胞损伤,分泌胰岛素水平下降,机体为了代偿,增加了β细胞的比率,进而改变了胰岛内部的结构。研究结果表明壬基酚能够改变胰岛形态结构,影响胰腺的正常分泌功能。
| [1] | Soares A, Guieysse B, Jefferson B, et al. Nonylphenol in the environment:a critical review on occurrence, fate, toxicity and treatment in wastewaters[J]. Environ Int, 2008, 34(7): 1033–1049. doi: 10.1016/j.envint.2008.01.004 |
| [2] | 黄超, 吴文铸, 单正军, 等. 壬基酚在土壤中的吸附和淋溶特性[J]. 生态环境学报, 2015, 24 (12): 2062–2067. |
| [3] | Uguz C, Varisli O, Agca C, et al. Effects of nonylphenol on motility and subcellular elements of epididymal rat sperm[J]. Reprod Toxicol, 2009, 28(4): 542–549. doi: 10.1016/j.reprotox.2009.06.007 |
| [4] | 谢明勇, 刘晓珍, 陈泱杰. 壬基酚在食品中的污染现状及其生物毒性概述[J]. 食品科学技术学报, 2014, 32 (1): 1–7. |
| [5] | Duan P, Hu C, Butler HJ, et al. 4-Nonylphenol induces disruption of spermatogenesis associated with oxidative stress-related apoptosis by targeting p53-Bcl-2/Bax-Fas/FasL signaling[J]. Environ Toxicol, 2016(4). doi: 10.1002/TOX.22274 |
| [6] | Iwata M, Eshima Y, Kagechika H, et al. The endocrine disruptors nonylphenol and octylphenol exert direct effects on T cells to suppress Th1 development and enhance Th2 development[J]. Immunol Lett, 2004, 94(1-2): 135–139. doi: 10.1016/j.imlet.2004.04.013 |
| [7] | 单伟, 秦书俭, 李德华. 壬基酚对大鼠胰腺内分泌功能的影响[J]. 毒理学杂志, 2010, 24 (5): 405–408. |
| [8] | Jubendradass R, D'Cruz SC, Mathur PP. Short-term exposure to nonylphenol induces pancreatic oxidative stress and alters liver glucose metabolism in adult female rats[J]. J Biochem Mol Toxicol, 2011, 25(2): 77–83. doi: 10.1002/jbt.v25.2 |
| [9] | Jubendradass R, D'Cruz SC, Mathur PP. Long-term exposure to nonylphenol affects insulin signaling in the liver of adult male rats[J]. Hum Exp Toxicol, 2012, 31(9): 868–876. doi: 10.1177/0960327111426587 |
| [10] | Wollheim CB, Meda P, Halban PA. [J]. Methods Enzymol, 1990, 192: 188–223. doi: 10.1016/0076-6879(90)92071-K |
| [11] | 韩绍伦, 李剑, 王子健. 环境内分泌干扰化合物干扰胰岛素分泌潜在作用机理[J]. 生态毒理学报, 2014, 9 (2): 181–189. |
| [12] | Nadal A, Alonso-Magdalena P, Soriano S, et al. The pancreatic β-cell as a target of estrogens and xenoestrogens:implications for blood glucose homeostasis and diabetes[J]. Mol Cell Endocrinol, 2009, 304(1-2): 63–68. doi: 10.1016/j.mce.2009.02.016 |
| [13] | Batista TM, Alonso-magdalena P, Vieira E, et al. Short-term treatment with bisphenol-a leads to metabolic abnormalities in adult male mice[J]. PLoS One, 2012, 7(3): e33814. doi: 10.1371/journal.pone.0033814 |
| [14] | Livingstone C, Collison M. Sex steroids and insulin resistance[J]. Clin Sci, 2002, 102(2): 151–166. doi: 10.1042/cs1020151 |
| [15] | Wong WPS, Tiano JP, Liu SH, et al. Extranuclear estrogen receptor-α stimulates NeuroD1 binding to the insulin promoter and favors insulin synthesis[J]. Proc Natl Acad Sci U S A, 2010, 107(29): 13057–13062. doi: 10.1073/pnas.0914501107 |
| [16] | Wei J, Lin Y, Li YY, et al. Perinatal exposure to bisphenol a at reference dose predisposes offspring to metabolic syndrome in adult rats on a high-fat diet[J]. Endocrinology, 2011, 152(8): 3049–3061. doi: 10.1210/en.2011-0045 |
| [17] | 邵建华, 高妍, 袁振芳, 等. 游离脂肪酸抑制大鼠肝细胞胰岛素受体和胰岛素受体底物-1酪氨酸磷酸化[J]. 中华内分泌代谢杂志, 1999, 15 (6): 342–345. |
| [18] | Lu WC, Wang AQ, Chen XL, et al. 90d exposure to nonylphenol has adverse effects on the spermatogenesis and sperm maturation of adult male rats[J]. Biomed Environ Sci, 2014, 27(11): 907–911. |
| [19] | Meshkani R, Adeli K. Hepatic insulin resistance, metabolic syndrome and cardiovascular disease[J]. Clin Biochem, 2009, 42(13-14): 1331–1346. doi: 10.1016/j.clinbiochem.2009.05.018 |
| [20] | Higuchi N, Kato M, Miyazaki M, et al. Potential role of branched-chain amino acids in glucose metabolism through the accelerated induction of the glucose-sensing apparatus in the liver[J]. J Cell Biochem, 2011, 112(1): 30–38. doi: 10.1002/jcb.22688 |
| [21] | Song L, Xia W, Zhou Z, et al. Low-level phenolic estrogen pollutants impair islet morphology and β-cell function in isolated rat islets[J]. J Endocrinol, 2012, 215(2): 303–311. doi: 10.1530/JOE-12-0219 |



