大肠菌群是37℃培养24 h (48 h能发酵乳糖、产酸产气的革兰氏阴性无芽孢杆菌,来自人、蓄粪便,可在污水和自然水体中检出,可以用作评价水处理效果、输配水系统清洁度等的指示菌,是水质卫生学评价的重要微生物指标之一[1]。我国村镇集中式供水以小型集中供水为主,且较分散,水 处理能力、水质检测能力相对薄弱[2]。在日常监测和应急处置农村饮用水卫生突发事件时,亟需简单、快速、适合村镇集中供水单位特点的检测方法。《生活饮用水标准检验方法》(GB/T 5750.12-2006)[3] 中检测大肠菌群的滤膜法,需要进行滤膜培养及特征菌落的确证实验来判断结果,酶底物法是利用大肠菌群产生β-半乳糖苷酶特异性的分解底物使培养基产生颜色变化的特性,来判断大肠菌群检出及数量,无需确证实验,检测时间较短[3-4]。近年来将酶底物技术与滤膜法结合的酶底物滤膜法逐渐得到应用,而此种方法与国标方法之间比较的报道很少[5-7],本文对酶底物滤膜法和国标滤膜法用于水中大肠菌群的检测结果进行了比较。
1 材料与方法 1.1 仪器生物安全柜(Ⅱ级A2型,美国LABCONCO);恒温培养箱(MIR-262,日本SANY);加样器(Midi Plus,德国Sartorius);振荡器(MS2,德国IKA);天平(TE612-L型,德国Sartorius)。
1.2 试剂灭菌水;品红亚硫酸钠培养基、伊红美蓝平板、革兰染液 (北京陆桥技术股份有限公司) ;蛋白胨、牛肉膏、乳糖、氯化钠(青岛海博生物技术有限公司),酶底物滤膜培养基(广东环凯微生物科技有限公司);大肠杆菌(8099,中国食品药品检定研究院保存)。
1.3 实验对象实验室加标水样:将大肠杆菌(8099)肉汤培养液用灭菌生理盐水进行10倍梯度稀释,取稀释液(稀释度10-1~10-8)作为加标试验水样。
地表水样:采集地表水水样用灭菌生理盐水进行10倍梯度稀释,以稀释液(稀释度10-1~10-6)作为试验水样。
1.4 试验方法 1.4.1 国标滤膜法参照《生活饮用水标准检验方法》(GB/T 5750.12-2006)[3]中的滤膜法,用0.45 μm滤膜过滤100 mL水样,将滤膜的细菌截留面朝上贴于品红亚硫酸钠培养基上,于37℃下培养24 h,挑取特征菌落进行革兰染色镜检和证实试验。凡革兰染色为阴性的无芽孢杆菌,接种于乳糖蛋白胨培养液复发酵,于37℃下培养24 h,有产酸产气者则判定大肠菌群阳性,结果以CFU/100 mL表示。
1.4.2 酶底物滤膜法采用基于酶底物技术的选择性培养基,大肠菌群产生的β-半乳糖苷酶可分解培养基中的色原底物,使大肠菌群菌落显示蓝绿色,操作方法与国标滤膜法相同,用0.45 μm滤膜过滤100 mL水样,将滤膜的细菌截留面朝上贴于酶底物培养基上,于37℃下培养24 h,观察产生蓝绿色的菌落并计数,结果以CFU/100 mL表示。
1.4.3 结果对比对加标水样和地表水样品分别使用两种方法进行大肠菌群的检测,比较结果的一致性。
1.4.4 空白对照每批试验需用灭菌水做空白对照。
1.5 数据统计使用Excel 2007和SPSS 18.0对数据进行汇总整理,对数据采用配对 t 检验进行比较,检验水准为α<0.05。
2 结果 2.1 加标水样试验结果用灭菌生理盐水将大肠杆菌(8099)肉汤培养液稀释至10-1~10-8,使用国标滤膜法和酶底物滤膜法分别对加标水样进行检测,剔除难以计数及菌落数为零的结果,选择在合适区间可以准确计数的数据进行统计分析。将2组检测结果进行配对t检验,t=0.148,P=0.885,表明国标滤膜法和酶底物滤膜法对标准菌株的检测结果没有统计学差异。
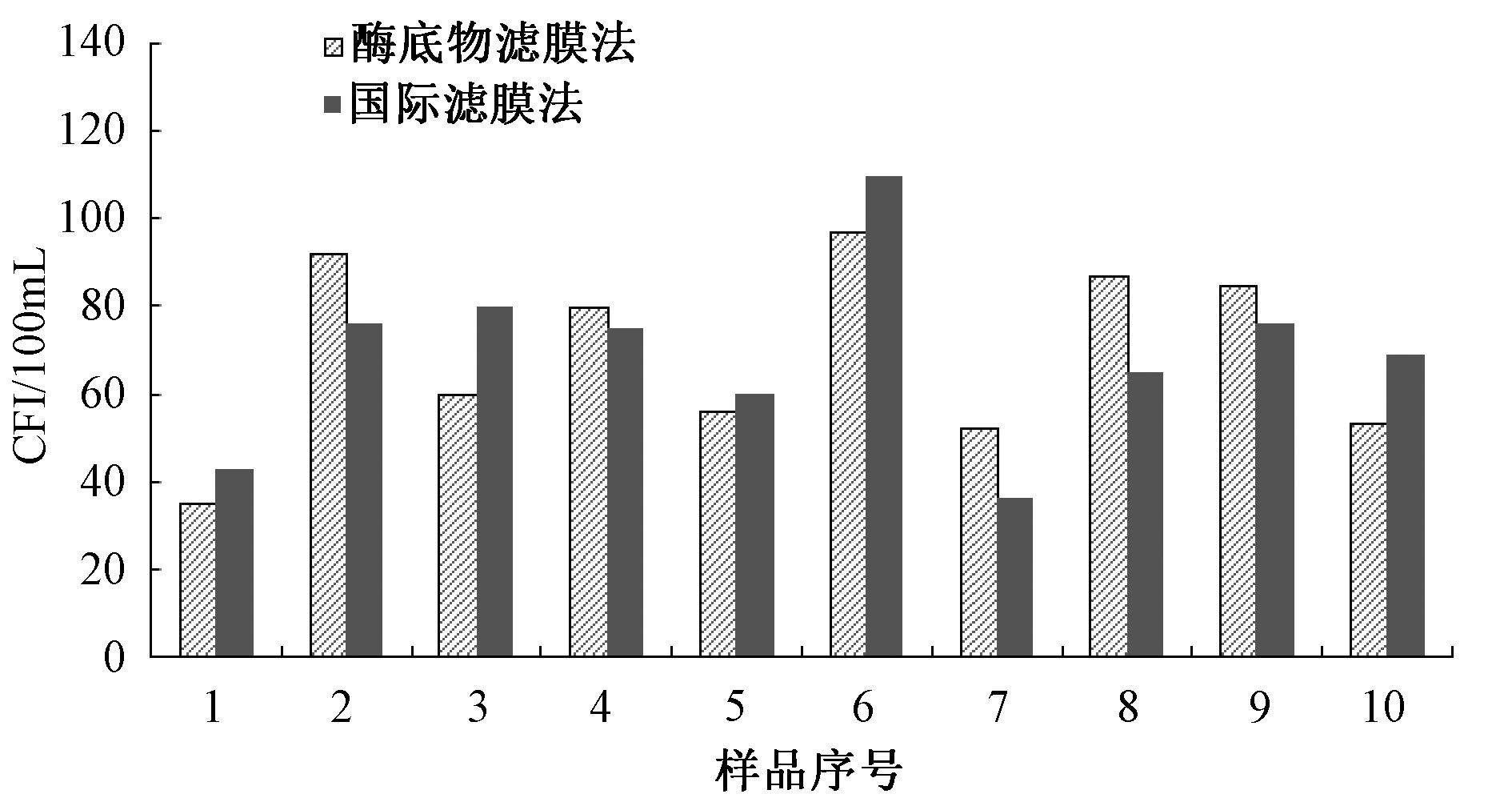
|
| 图 1 加标水样试验结果比较 |
2.2 地表水水样试验结果
以灭菌生理盐水将采集的地表水样稀释至10-1~10-6,作为试验水样。使用国标滤膜法和酶底物滤膜法分别对试验水样进行检测,选择在合适区间可以准确计数的数据进行统计分析。将2组结果进行配对t检验,t=0.668,P=0.510,表明国标滤膜法和酶底物滤膜法对地表水水样的检测结果没有统计学差异。
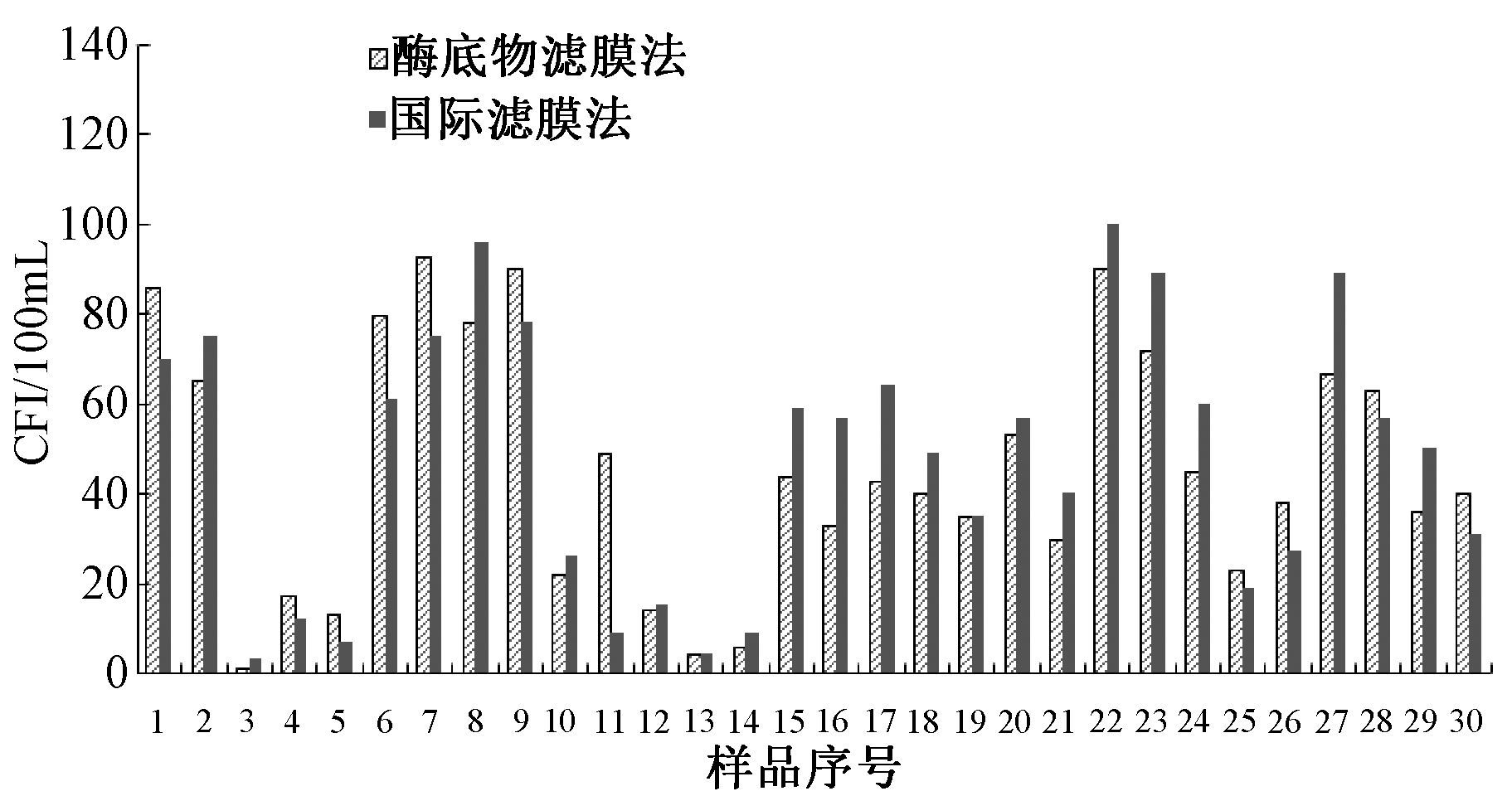
|
| 图 2 地表水水样试验结果比较 |
2.3 相关性分析
对加标水样和地表水样用两种方法检测得到的结果分别进行相关性分析,计算两组数据的Spearman相关系数。加标水样组的相关系数(tr)为0.760,在置信度(双测)为0.05时,P=0.011,相关性具有统计学意义,可认为在检测加标水样时酶底物滤膜法和国标滤膜法的结果之间有相关关系。地表水水样组的相关系数(tr)为0.884,在置信度(双测)为0.05时,P=0.000,相关性同样具有统计学意义,认为在检测地表水水样时酶底物滤膜法和国标滤膜法的结果之间也有相关关系。
3 讨论通过酶底物滤膜法和国标滤膜法对实验室加标水样、地表水水样的大肠菌群检测比较,两种方法对一系列稀释度试验水样的检测结果趋势一致,剔除难以计数、菌落数过少或没有菌落生长的结果,选择可以准确计数的部分数据进行统计分析,结果均无统计学差异。标准滤膜法需要经过滤膜培养、革兰氏染色镜检和乳糖复发酵三个步骤才能确定大肠菌群结果,步骤较复杂,经过两次培养,检测过程需要时间48 h以上;酶底物技术与滤膜技术相结合的酶底物滤膜法,不需要染色镜检和复发酵的确证试验,只需一次24 h的培养过程,即可计数特征性颜色的菌落并得出结果,为大肠菌群的检测提供了可在现场应用的简便快速方法。
《村镇供水单位资质标准》(SL 308-2004)[10]中规定对细菌学指标出厂水要每日进行检测,水源水要每周进行检测。近几年文献报道,在全国各地农村饮水工程的水质调查和检测中微生物指标不达标率较高[8-9];在自然灾害中,水质容易受到微生物污染,需要村镇供水单位加强对水质微生物指标的监测,及时发现水质的微生物风险,而我国村镇供水单位的水质检测能力相对较弱,亟需提供在现场即可进行操作的方便快捷的微生物检测方法。酶底物滤膜法,集合了两种技术的优势,检测大肠菌群所需步骤少、时间短、操作简单,减少了染色镜检等对检测人员与设备较高的程序,适合村镇集中式供水单位,水质日常监测及应急水质评价工作中大肠菌群检测的应用。
| [1] | 金银龙. GB 5749-2006《生活饮用水卫生标准》释义[M]. 北京: 中国标准出版社, 2007 . |
| [2] | 鲁波, 邢方潇, 陈钰, 等. 透视窗式乳糖胆盐发酵培养基管检测饮水中大肠菌群[J]. 环境卫生学杂志,2015, 5 (6) : 545 –546. |
| Click to display the text | |
| [3] | 中华人民共和国卫生部.GB/T 5750.12-2006生活饮用水标准检验方法微生物指标[S].北京:中国标准出版社,2007. |
| Click to display the text | |
| [4] | 孙宗科, 吴榕, 丁培, 等. 水中大肠菌群快速检测方法-酶底物法与多管发酵法的比较[J]. 卫生研究,2006, 35 (4) : 497 –498. |
| Click to display the text | |
| [5] | 刘京梅, 张凌, 赵君, 等. 饮用水中大肠菌群检测技术的研究进展[J]. 国外医学卫生学分册,2006, 33 (2) : 117 –121. |
| Click to display the text | |
| [6] | 逯南南, 宋武昌, 褚福敏, 等. 酶底物法检测水中总大肠菌群/大肠埃希氏菌的影响因素[J]. 中国给水排水,2014, 30 (24) : 147 –150. |
| Click to display the text | |
| [7] | 杨虹, 刘金冠, 郭玉敏. 酶底物法与多管发酵法测定水中粪大肠菌群的对比分析[J]. 资源与环境科学,2015 (20) : 162,176 . |
| Click to display the text | |
| [8] | 唐晓蕾. 重庆市大足区农村集中式供水水质监测结果分析[J]. 大家健康,2015, 9 (20) : 307 . |
| Click to display the text | |
| [9] | 郑建刚, 王东海, 李秋娟, 等. 农村饮水安全工程微生物超标影响因素分析[J]. 中国公共卫生,2013, 29 (12) : 1772 –1774. |
| Click to display the text | |
| [10] | 中国人民共和国水利部SL 308-2004《村镇供水单位资质标准》[S].北京:中国水利水电出版社,2005. |
| Click to display the text |



