随着科技的发展城市化进程的加快, 健康成为人类越来越关注的问题。我国肿瘤死亡率已居世界高水平, 肺癌已经取代肝癌成为我国恶性肿瘤死亡的第一大原因[1]。研究表明, 大气颗粒物是我国城市空气中的主要污染物, 是肺癌的主要危险因素。PM2.5是空气动力学直径小于等于2.5 μm的大气颗粒物, 虽然PM2.5只是地球大气污染中含量很少的组分, 但对空气质量和能见度等有重要的影响[2]。PM2.5易吸附空气中有毒物质, 如一些重金属、细菌等。PM2.5直径小, 比表面积大, 在大气中的停留时间长, 容易吸附许多有毒有害物质, 如多环芳烃(PAHs)、重金属等有毒有害物质, 容易进入呼吸道的深部, 到达支气管甚至肺泡, 诱发肺炎、哮喘、支气管炎等肺部疾病, 是空气中危害人体健康最为严重的一类污染物[3]。
PAHs是指具有两个或两个以上苯的一类有机化合物, 包括萘、蒽、菲、芘等150余种化合物, 目前确定的PAHs主要受限制的物质有16种, 世界各主要贸易国针对PAHS的限制按16种常见限制物质检测。德国GS认证的产品都需要通过PAHs测试, GS认证中要求的PAHs测试项目为16项。美国环保署(USEPA)对皮肤接触30 s以下的消费品要求16种PAHs总量小于200 mg/kg, 对皮肤接触30 s以上的消费品要求16种PAHs总量小于10 mg/kg, 对食品、玩具、儿童护理产品及可能会被放入口中的产品要求16种PAHs总量小于1 mg/kg[4-5]。大量研究表明, PAHs是PM2.5中主要的有害成分之一, 已被国际癌症研究署(IARC)作为优先控制的有毒有害物, 具有致癌、致畸、致突变等毒性, 且在环境中广泛分布[6-7]。PM2.5中的PAHs主要来源于汽车尾气排放、煤的燃烧、工业燃料的不完全燃烧等, 其中在城市的交通要道采集的PM2.5, 称为"traffic-related PM2.5", 人们称为交通相关的PM2.5, 简称为交通PM2.5, 主要来源于汽车尾气排放、煤等工业染料的不完全燃烧[8]。
在PM2.5诱发的肺部疾病中, 肺部炎症反应占了很大比例。IL-1β是最重要的炎症细胞因子之一, 他介导炎症的重要过程, 在支气管哮喘和肺炎中发挥重要的作用[9-10]。
探索PM2.5诱发肺炎、哮喘和支气管炎等肺部炎症疾病的分子机制, 为预防和治疗PM2.5诱发的肺部炎症疾病提供科学依据。本实验采集了广州、武汉、上海、北京、成都、湛江6个城市的PM2.5, 研究不同城市的PM2.5对肺癌A549细胞炎症因子IL-1β表达的影响, 探讨PM2.5成分和IL-1β表达之间的关系。
1 材料与方法 1.1 主要仪器与试剂QJS-120F智能中流量多级颗粒采样器(锦州利诚); QJS-100中流量多级颗粒切割器(锦州利诚); 石英滤膜(锦州利诚); CO2培养箱(美国Thermo公司); 酶标仪(美国Thermo); FACSCalibur流式细胞仪(美国BD公司); 荧光定量PCR仪(瑞士ROCHE); X射线荧光光谱仪(美国Thermo公司); 气相质谱联用仪(美国Thermo公司)。
A549细胞(美国ATCC); DMEM高糖(hyclone); 胎牛血清(杭州四季青); TRIzol Reagent(美国Life Technologies); PrimeScriptTM RT reagent Kit (中国TAKARA); SYBRR Premix Ex TaqTM Ⅱ(中国TAKARA)。
1.2 不同城市PM2.5的采集和制备配置QJS-100中流量多级颗粒物切割器, PM2.5切割器切割粒径:D50=2.5±0.2 μm; 工作流量:100 L/min±5%, 石英滤膜有效直径:80 mm, 使用QJS-120F中流量多级颗粒采样器采集空气中PM2.5。在全国选择东南西北中部等富有代表性的6个不同城市采集PM2.5, 采样地点均设在繁华路段的公交站台, 采样时间为2012年下半年, 采样相对湿度均为40%~70%, 具体时间为8—9月份采集广州、武汉和上海, 11—12月份采集北京、成都和湛江。采样地点分别为广州的天河区珠吉路口公交站、武汉的武昌区街道口公交站、上海的浦东新区张江高科技园公交站、北京的海淀区中关村南公交站、成都的武侯区致民路西公交站和湛江的霞山区附属医院公交站。采样流量100 L/min, 各点连续采集48 h。将载有PM2.5样品的纤维滤膜放入超纯水中, 超声振荡15 min以洗脱颗粒物, 然后将样品真空冷冻干燥24 h, 称重, 加入一定量PBS配制成储备液, 高压灭菌, 4℃保存, 用于人肺癌细胞染毒实验, 临用前震荡混匀。
1.3 PM2.5成分分析[11-12]收集不同城市PM2.5, 将载有PM2.5样品的纤维滤膜密封之后于4℃暂时保存, 一周内送往广州检测中心进行成分分析, X-Ray Fluorescence Spectroscopy检测PM2.5中过渡金属元素的含量, GC-MS检测PM2.5中16种多环芳烃的含量, 空白纤维膜做对照样品。
1.4 细胞培养及染毒人肺癌细胞(A549细胞)用含10%胎牛血清的DMEM高糖培养液, 于37℃、5%CO2条件下培养, 细胞融合80%时用0.25%胰蛋白酶消化传代或用于实验。
取对数生长期的人肺癌A549细胞, 以1×105个/mL密度的细胞悬液接种至6孔培养板, 于37℃、5%CO2条件下培养24 h, 弃上清液, 加入用PBS配制的PM2.5储备液, 配制成终浓度为100 μg/mL的培养液, 染毒培养24 h。
1.5 荧光定量PCR检测细胞内炎症基因表达水平胰酶消化后离心收集PM2.5染毒的细胞, Trizol法提取细胞的总RNA, 检测RNA的纯度之后按照PrimeScriptTM RT reagent Kit逆转录试剂盒操作步骤对RNA进行逆转录, 荧光定量PCR检测IL-1β基因的相对表达量, 比较不同城市PM2.5对细胞内IL-1β基因表达水平的影响。
1.6 统计分析及相关性分析采用SPSS 15.0软件对实验数据进行统计分析, 样品成分分析、细胞的染毒培养和荧光定量PCR检测实验均重复3次, 统计结果用标准差表示, 采用计数资料t检验, 进行两两比较分析, 以P < 0.05为显著性差异的检测标准, 分析不同PM2.5对A549细胞IL-1β表达的影响。通过线性回归和相关性分析研究PM2.5成分和细胞炎症因子IL-1β之间的关系, 通过相关性分析得出相关系数, 通过线性回归分析得出回归方程。研究PM2.5不同成分对IL-1β的影响时用多元相关性分析, 在分析某一组分含量与IL-1β表达的关系时, 通过将其他变量作为协变量来控制其他组分的影响。
2 结果 2.1 PM2.5成分分析研究6个不同城市PM2.5主要成分的差异, 测定不同城市PM2.5样品中的16类PAHs和几种常见金属元素的含量。表 1列举了6个不同城市PM2.5中的USEPA规定的16种优先控制PAHs的含量, 从测量结果中可以看出, 6个城市的PM2.5中均含有高浓度的PAHs, 特别是广州、武汉和上海3个城市的16种PAHs含量均达到900 pg/μg左右, 明显高于其他3个城市, 是其他3个城市的两倍左右。
| pg/μg | ||||||
| 名称 | 湛江 | 广州 | 武汉 | 上海 | 北京 | 成都 |
| NAP | 23.11 | 107.86 | 90.00 | 75.33 | 73.91 | 37.62 |
| ANY | 26.67 | 50.29 | 64.67 | 48.67 | 34.70 | 32.38 |
| ACY | 25.00 | 54.00 | 58.33 | 43.00 | 29.57 | 35.43 |
| FLU | 42.22 | 60.00 | 63.17 | 48.17 | 28.26 | 34.19 |
| PHE | 26.89 | 50.00 | 70.00 | 63.33 | 40.87 | 39.33 |
| ANT | 20.33 | 46.00 | 38.83 | 66.50 | 9.91 | 23.81 |
| FLT | 28.00 | 53.14 | 59.33 | 68.67 | 24.78 | 36.67 |
| PYE | 36.11 | 68.57 | 53.33 | 50.17 | 26.87 | 36.10 |
| BaA | 23.33 | 35.71 | 64.00 | 41.67 | 28.26 | 29.33 |
| CHR | 27.78 | 72.43 | 40.67 | 41.17 | 46.96 | 45.05 |
| BbF | 61.56 | 60.00 | 63.33 | 64.17 | 33.48 | 24.00 |
| BkF | 35.00 | 41.29 | 43.17 | 56.67 | 24.26 | 33.33 |
| BaP | 17.22 | 55.29 | 70.00 | 81.00 | 51.30 | 35.71 |
| IPY | 24.44 | 40.00 | 50.00 | 48.17 | 31.04 | 18.00 |
| DBA | 30.56 | 50.00 | 46.50 | 45.83 | 39.91 | 16.67 |
| BPE | 11.33 | 49.29 | 43.17 | 63.33 | 27.13 | 33.33 |
| PAHs | 459.56 | 893.86 | 918.50 | 905.83 | 551.22 | 510.95 |
表 2中列举了6个不同城市PM2.5中金属元素的含量, 除了检测Na、K、Mg、Ca等4种常见的金属元素外, 还检测了对PM2.5毒性影响较大的Fe、Cu等过渡金属元素。检测结果表明6个城市的PM2.5样品中都含有非常高浓度的过渡金属元素, 尤其是Fe、Cu和Ni这三种过渡金属元素, 在6个城市PM2.5样品中的浓度均较高。
| pg/μg | ||||||
| 名称 | 湛江 | 广州 | 武汉 | 上海 | 北京 | 成都 |
| Na | 12.44 | 35.71 | 29.83 | 46.67 | 20.43 | 18.95 |
| K | 19.44 | 38.57 | 20.83 | 36.67 | 12.17 | 10.95 |
| Mg | 4.67 | 8.43 | 5.33 | 6.50 | 7.39 | 2.67 |
| Ca | 3.89 | 8.57 | 5.00 | 3.83 | 5.04 | 2.57 |
| Fe | 3.00 | 8.14 | 2.42 | 1.75 | 5.30 | 1.67 |
| Cu | <0.1 | 1.14 | 1.00 | 1.00 | 1.09 | 0.38 |
| Cr | 0.11 | 0.64 | 0.42 | 0.25 | 0.43 | 0.14 |
| Co | <0.1 | 0.21 | <0.1 | <0.1 | <0.1 | <0.1 |
| V | <0.1 | <0.1 | <0.1 | 0.17 | <0.1 | <0.1 |
| Ni | 0.72 | 1.29 | 0.92 | 1.25 | 0.48 | 0.33 |
| Cd | <0.1 | 1.14 | 0.50 | <0.1 | <0.1 | <0.1 |
| As | <0.1 | 0.86 | <0.1 | 0.75 | 0.35 | <0.1 |
2.2 PM2.5对A549细胞IL-1β基因诱导表达的影响
为了探索不同城市PM2.5对A549细胞炎症因子的影响, 通过Q-PCR检测了不同城市PM2.5染毒后A549细胞IL-1β基因的表达水平, 研究结果表明, 与PBS处理的空白组相比, 6城市的PM2.5均能显著升高A549细胞IL-1β基因的表达水平(P < 0.01;图 1)。
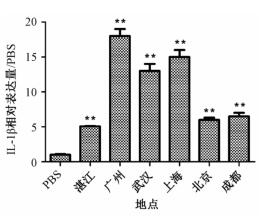
|
| 注:**与PBS比较, P < 0.01 图 1 PM2.5对A549细胞炎症因子IL-1β基因表达的影响 |
2.3 PM2.5中PAHs和Ni含量对IL-1β表达的影响
进一步探索PM2.5诱导细胞炎症因子IL-1β升高的作用机制, 通过线性回归和多元相关性分析研究PM2.5成分(PAHs、Fe、Cu、Ni)和细胞炎症因子IL-1β之间的关系, 分析结果表明, PM2.5中PAHs的含量与IL-1β基因的表达水平呈显著正相关(P < 0.05;图 2A), 线性回归方程为:y=33.0x+336.9。PM2.5中过渡金属元素Ni与IL-1β基因的表达水平也呈显著正相关(P < 0.05), 线性回归方程为:y=0.0615x+0.1586。Fe、Cu和Cr与IL-1β基因的表达水平相关性不显著(P>0.05;图 2B)。
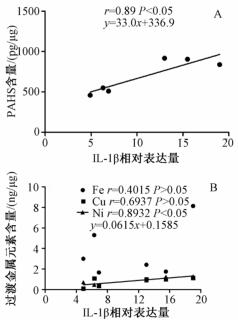
|
| 注:A, PAHs和IL-1β表达量之间的相关性; B, Fe, Cu, Ni三种过渡金属元素和IL-1β表达量之间的相关性 图 2 PM2.5成分和A549细胞炎症因子IL-1β表达量之间的相关性 |
3 讨论
随着城市工业的发展, 大气污染越来越严重, 作为空气质量最重要的指标, PM2.5指数已经在全国各大城市实行了实时监测。大量的研究结果表明, PAHs和过渡金属是PM2.5中主要的毒性成分, 能诱导引发多种肺部疾病[13-14]。本研究选取了全国东南西北中部富有代表性的6个城市进行PM2.5采集, 并检测了PM2.5中16种PAHs和10种金属元素的含量, 检测结果表明6个城市PM2.5中均还有高浓度的PAHs和过渡金属元素。广州、武汉、上海的PM2.5样品中PAHs含量高达900 pg/μg, 明显高于其他三个城市, 广州、武汉、上海的PM2.5采集于8—9月, 北京、成都、湛江的PM2.5样品采集于11—12月, PM2.5中成分可能和采样季节更相关, 这与之前的研究报道一致[15-16]。研究发现Ni元素在6个城市PM2.5中含量都较高, 有研究表明Ni元素和癌症相关, 在前列腺癌患者中Ni元素呈现高表达状态[17]。
IL-1β是最重要的炎症细胞因子之一, 在神经系统、骨髓干细胞中发挥调节作用[18-20]。研究发现6个城市的PM2.5均能显著升高A549细胞IL-1β基因的表达水平, 通过相关性分析研究发现, Ni元素和炎症因子IL-1β基因的表达水平呈显著相关, 证明了Ni元素在PM2.5诱导肺部炎症时的重要作用, Ni元素应该被定为PM2.5毒性程度的一项重要指标。研究表明PAHs具有高度致癌作用[21], 特别是苯并芘(Bap)和患肺癌风险有显著相关性[22]。大多数国家都对食品包装、玩具等产品中的PAHs含量进行了严格的限定, 例如德国GS标准中一类产品(与食物接触的材料或3岁以下孩童会放入口中的玩具)Bap不得检出( < 0.2 mg/kg), 16项PAHs总和不得检出( < 0.2 mg/kg)。本文的检测结果表明6个城市PM2.5样品中Bap和PAHs均高于这些标准, 高浓度的Bap和PAHs可能与城市的工业污染相关, 例如武汉的Bap和PAHs高于其他城市, 提示可能与武汉武钢的焦化工业污染有关。研究发现PAHs和IL-1β基因的表达水平呈显著相关, 表明PAHs的致癌作用可能与其上调IL-1β的表达有关。
PM2.5中Ni元素、PAHs与炎症因子IL-1β的上调有关, 为预防和治疗PM2.5诱发的肺部炎症疾病提供实验依据, 但Ni元素、PAHs上调IL-1β的分子机制还需要进一步的研究。Ni元素可能成为PM2.5毒性程度的一项重要指标, IL-1β可能成为PM2.5导致的肺部炎症疾病的一个治疗靶点。
| [1] | Liu Q, Zhou Q. The challenges of lung cancer in China[J]. J Cancer Res, 2013, Ther 9 Suppl 2: S65–66. |
| [2] | Kumar R, Joseph AE. Air pollution concentrations of PM2.5, PM10 and NO2 at ambient and Kerbsite and their correlation in metro city-Mumbai[J]. Environ Monit Assess, 2006, 119(1-3): 191–199. doi: 10.1007/s10661-005-9022-7 |
| [3] | Woodruff TJ, Parker JD, Schoendorf KC, et al. Fine particulate matter (PM2.5) air pollution and selected causes of postneonatal infant mortality in California[J]. Environ Health Perspect, 2006, 114(5): 786–790. doi: 10.1289/ehp.8484 |
| [4] | Poster DL, Schantz MM, Sander LC, et al. Analysis of polycyclic aromatic hydrocarbons (PAHs) in environmental samples:a critical review of gas chromatographic (GC) methods[J]. Anal Bioanal Chem, 2006, 386(4): 859–881. doi: 10.1007/s00216-006-0771-0 |
| [5] | Pointet K, A Milliet. PAHs analysis of fish whole gall bladders and livers from the Natural Reserve of Camargue by GC/MS[J]. Chemosphere, 2000, 40(3): 293–299. doi: 10.1016/S0045-6535(99)00258-1 |
| [6] | Villar-Vidal M, Lertxundi A, Ayerdi M, et al. Air polycyclic aromatic hydrocarbons (PAHs) associated with PM2.5 in a North Cantabric coast urban environment[J]. Chemosphere, 2014, 99(3): 233–238. |
| [7] | Yang L, Liu G, Lin Z, et al.Pro-inflammatory response and oxidative stress induced by specific components in ambient particulate matter in human bronchial epithelial cells[EB/OL].(2014-12-23).[2015-03-19].http://www.ncbi.nlm.nih.gov/pubmed/25533354. |
| [8] | Tong G, Zhang Z, Han J, et al. Traffic-related PM2.5 regulates IL-2 releasing in Jurkat T cells by calcium signaling pathway[J]. J of Hyg Res, 2013, 42(5): 822–827. |
| [9] | Yalcin AD, Cilli A, Bisgin A, et al. Omalizumab is effective in treating severe asthma in patients with severe cardiovascular complications and its effects on sCD200, d-dimer, CXCL8, 25-hydroxyvitamin D and IL-1beta levels[J]. Expert Opin Biol Ther, 2013, 13(9): 1335–1341. doi: 10.1517/14712598.2013.819338 |
| [10] | Wei XH, Qin X, Zhu W, et al. Therapeutic potential of anti-IL-1beta IgY in guinea pigs with allergic asthma induced by ovalbumin[J]. Mol Immunol, 2014, 58(1): 139–149. doi: 10.1016/j.molimm.2013.11.006 |
| [11] | Gutknecht W, Flanagan J, McWilliams A, et al. Harmonization of uncertainties of X-ray fluorescence data for PM2.5 air filter analysis[J]. J Air Waste Manag Assoc, 2010, 60(2): 184–194. doi: 10.3155/1047-3289.60.2.184 |
| [12] | Masiol M, Centanni E, Squizzato S, et al. GC-MS analyses and chemometric processing to discriminate the local and long-distance sources of PAHs associated to atmospheric PM2.5[J]. Environ Sci Pollut Res Int, 2012, 19(8): 3142–3151. doi: 10.1007/s11356-012-0858-4 |
| [13] | Wang W, Jariyasopit N, Schrlau J, et al. Concentration and photochemistry of PAHs, NPAHs, and OPAHs and toxicity of PM2.5 during the Beijing Olympic Games[J]. Environ Sci Technol, 2011, 45(16): 6887–6895. doi: 10.1021/es201443z |
| [14] | Pongpiachan S, Tipmanee D, Khumsup C, et al. Assessing risks to adults and preschool children posed by PM2.5-bound polycyclic aromatic hydrocarbons (PAHs) during a biomass burning episode in Northern Thailand[J]. Sci Total Environ, 2015, 508(3): 435–444. |
| [15] | Cao JJ, Shen ZX, Chow JC, et al. Winter and summer PM2.5 chemical compositions in fourteen Chinese cities[J]. J Air Waste Manag Assoc, 2012, 62(10): 1214–1226. doi: 10.1080/10962247.2012.701193 |
| [16] | Zeng J, Wang ME, Zhang HX, et al. Correlation between atmospheric PM2.5 concentration and meteorological factors during summer and autumn in Beijing, China[J]. Chin J APPI Ecol, 2014, 25(9): 2695–2699. |
| [17] | Ozmen H, Erulas FA, Karatas F, et al. Comparison of the concentration of trace metals (Ni, Zn, Co, Cu and Se), Fe, vitamins A, C and E, and lipid peroxidation in patients with prostate cancer[J]. Clin Chem Lab Med, 2006, 44(2): 175–179. |
| [18] | Wong ML, Bongiorno PB, Rettori V, et al. Interleukin (IL) 1beta, IL-1 receptor antagonist, IL-10, and IL-13 gene expression in the central nervous system and anterior pituitary during systemic inflammation:pathophysiological implications[J]. Proc Natl Acad Sci U S A, 1997, 94(1): 227–232. doi: 10.1073/pnas.94.1.227 |
| [19] | Wieczorek M. Various aspects of IL-1 biological activity.II.IL-1 beta in diseases and the Central Nervous System[J]. Wiad Parazytol, 2009, 55(2): 115–124. |
| [20] | Cortez M, Carmo LS, Rogero MM, et al. A high-fat diet increases IL-1, IL-6, and TNF-alpha production by increasing NF-kappaB and attenuating PPAR-gamma expression in bone marrow mesenchymal stem cells[J]. Inflammation, 2013, 36(2): 379–386. doi: 10.1007/s10753-012-9557-z |
| [21] | Obiri S, Cobbina SJ, Armah FA, et al. Assessment of cancer and noncancer health risks from exposure to PAHs in street dust in the Tamale Metropolis, Ghana[J]. J Environ Sci Health A Tox Hazard Subst Environ Eng, 2013, 48(4): 408–416. doi: 10.1080/10934529.2013.728914 |
| [22] | Liao CM, Chio CP, Chen WY, et al. Lung cancer risk in relation to traffic-related nano/ultrafine particle-bound PAHs exposure:a preliminary probabilistic assessment[J]. J Hazard Mater, 2011, 190(1-3): 150–158. doi: 10.1016/j.jhazmat.2011.03.017 |



