盐酸氨基葡萄糖是一种天然的氨基单糖,可以刺激软骨细胞产生正常多聚体结构的蛋白多糖,提高软骨细胞的修复能力,抑制产生损伤软骨的酶,促进软骨基质的修复和重建,可延缓骨关节疼痛的病理过程和疾病的进程[1]。氨基葡萄糖是甲壳素降解后生成的一种还原单糖,极性较大,在反相色谱柱中几乎不保留,与溶剂峰难以分离;且只有紫外末端吸收,用国标方法《硫酸软骨素和盐酸氨基葡萄糖含量的测定液相色谱法》 (GB/T 20365—2006)[2]无法对它进行准确定量。
一般测定盐酸氨基葡萄糖的含量有以下几种方法:分光光度法[3]、高效液相色谱—紫外检测法[4]和柱前衍生化[5]蒸发光散射法[6]。其中分光光度法经历了多个步骤,方法繁琐费时、而且人为操作误差较大;高效液相色谱法要对目标物进行衍生化处理,衍生化试剂的选择和衍生方式都需要选择,方法较麻烦;采用高效液相色谱蒸发光散色检测器方法,此过程虽无需衍生步骤,但方法的稳定性和重复性,不如紫外检测法。英美药典里记载的方法也存在目标物不保留的问题[7],所以仍需要开发新的检测方法以适应现代分析化学的快速、简便、高效、灵敏的要求。本文利用亲水作用较强的色谱柱,其强极性固定相对在反相色谱中保留性较差的强极性物质保留行为有较好的改善,且改变流动相的组成,保留时间可控,杂质峰较少;前处理简单,适合盐酸氨基葡萄糖含量的测定。
1 材料与方法 1.1 仪器与试剂 1.1.1 仪器Waters 2695高效液相色谱仪 (ACQU ITY Waters公司);Waters 2996二极管阵列检测器 (ACQU ITY Waters公司),配有自动进样装置 (可控温);hilic色谱柱Zorbax Rx-Sil (2.1 mm×150 mm,5 μm);CW-2000超声波萃取仪 (北京恒奥德仪器仪表有限公司)。
1.1.2 试剂盐酸氨基葡萄糖、硫酸软骨素标准品 (购自Fluka公司,纯度≥99.0%);超纯水 (18.2 MΩ·cm,Milipore);实际检测样品由某保健品药厂提供,乙腈 (色谱纯,Fisher),其他所用到的试剂均为分析纯。
1.2 标准配制 1.2.1 氨基葡萄糖标准储备溶液精确称取1.092gD-盐酸氨基葡萄糖标准物质,用流动相溶解稀释并定容至100 mL容量瓶中,所配标准储备溶液浓度为10.0 mg/mL。4℃冷藏保存备用。临用前稀释。
1.2.2 盐酸氨基葡萄糖标准应用溶液分别取上述浓度为10 mg/mL标准储备溶液各5 mL,用流动相稀释至25和50 mL,配制成2和1 mg/mL标准应用溶液。
1.2.3 盐酸氨基葡萄糖和硫酸软骨素标准溶液移取上述1 mg/mL盐酸氨基葡萄糖标准应用溶液25 mL,称取25 mg硫酸软骨素加入其中,配制成盐酸氨基葡萄糖和硫酸软骨素混合标准溶液各1 mg/mL,以备做硫酸软骨素的干扰试验用。
1.2.4 盐酸氨基葡萄糖标准曲线准确吸取浓度为1 mg/mL盐酸氨基葡萄糖标准应用液各0、2.0、4.0、6.0、8.0 mL,用流动相定容至10 mL,此标准系列浓度分别为0、0.2、0.4、0.6、0.8、1.0 mg/mL,各进样10 μL,绘制盐酸氨基葡萄糖的标准曲线。
1.3 分析方法 1.3.1 色谱条件hilic色谱柱Zorbax Rx-Sil (2.1 mm×150 mm,5 μm);流动相:10 mmoL乙酸铵及乙腈溶液 (Ⅴ/Ⅴ=12/88);流速:0.7 mL/min;进样量:10 μL; 检测波长195 nm;柱温32℃。
1.3.2 样品制备准确称取0.2 g样品于100 mL容量瓶中,加流动相超声提取30 min,静置待冷却至室温时加流动相至刻度,取上清液过0.45 μm滤膜后上机测试。
1.3.3 样品采集和分析取上述经0.45 μm滤膜过滤的滤液10.0 μL注入液相色谱系统,分别用优化过的色谱条件测定样品中氨基葡萄糖的峰面积或者峰高,与标准物质的峰面积或者峰高进行比较,得出测定液中氨基葡萄糖的含量。
1.3.4 按公式 (1) 计算盐酸氨基葡萄糖的含量:| $W = \frac{{\rho \times v \times 1000}}{m}$ | (1) |
式中:W—待测样品中氨基盐酸氨基葡萄糖含量,mg/kg;
ρ—从表中曲线计算出的样品溶液中盐酸氨基葡萄糖的浓度,mg/mL;
v—样品处理液最后定容体积,mL;
m—测定用样品的质量,g。
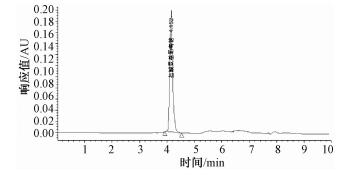
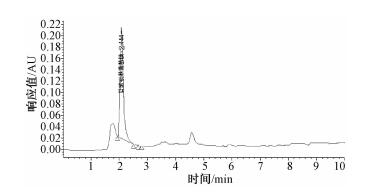
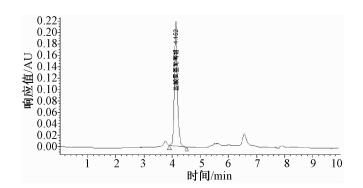
2 结果与讨论 2.1 仪器条件的选择对分析物质极性由大到小的四种色谱柱Zorbax Rx-Sil、氨基柱、C8和C18柱进行了比较。由于氨基葡萄糖的极性较大,在C18系列色谱柱中几乎不保留流出,出峰较早,与溶剂峰及杂质峰难以分开,国标中方法为反相C18柱,按原理不适宜分离极性较大的化合物,所以目标峰在2 min左右出现,且样品中若含有硫酸软骨素则难以达到分离效果。采用强极性固定相,结合高比例有机相/低比例水相组成流动相,可以控制氨基在色谱柱中的保留时间,如图 1所示,采用亲水色谱柱Zorbax Rx-Si,有机相/水相=73/27,保留时间推后至4.152 min。对极性稍弱的色谱柱,如氨基柱和C8柱的分离效果也与Zorbax Rx-Sil进行了比较,两者都不如Zorbax Rx-Sil的分离效果好,图 2、3分别是用氨基柱和Zorbax Rx-Sil柱进样所得色谱图,图 2是采用氨基柱Hypersil NH2(4.6 mm×250 mm,5 μm);流动相:乙腈/0.35%磷酸盐缓冲溶液=73/27(pH=7);流速:0.8 mL/min。图 3是色谱柱改为Zorbax Rx-Sil (2.1 mm×150 mm,5 μm); 流动相:10 mmoL乙酸铵/乙腈 (12/88);流速:0.7 mL/min,可看出图 3分离效果明显优于图 2。使用Zorbax Rx-Sil色谱柱,其色谱图中杂质峰与目标峰分离良好 (图 1和图 3)。
|
| 图 1 Zorbax Rx-Sil色谱柱条件下氨基葡萄糖标准色谱图 |
|
| 图 2 氨基柱色谱柱条件下样品溶液色谱图 |
|
| 图 3 Zorbax Rx-Sil色谱柱条件下样品溶液色谱图 |
2.2 目标峰中杂质的验证
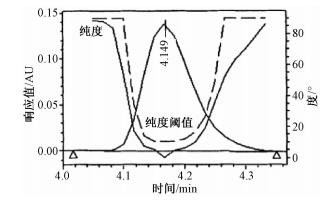
待测样品按1.3.1色谱条件进样,所得色谱图用二极管阵列检测器扫描 (图 4),对色谱图纯度进行验证,结果显示目标峰的纯度角度﹤纯度阈值,说明纯度复合要求。
|
| 注:纯度角度,11.265;纯度阈值,17.815;实线,纯度;虚线,自动阈值 图 4 样品溶液的纯度图 |
2.3 线性关系和检出限
取标准物质适量,加流动相稀释并制成1 mg/mL的储备液。分别取储备液适量,用流动相稀释并制成质量浓度分别为0.2、0.4、0.8、1.0 mg/mL的标准使用液。进样10 μL,以测定的峰面积Y对浓质量度X进行线性回归,得回归方程为Y=-1.78×103X+3.23×104(r=0.9994)。质量浓度为0.2~1.0 mg/mL时,盐酸氨基葡萄糖的质量浓度与峰面积线性关系良好。以标准样品最低浓度0.2 mg/mL无限稀释测定检测限,3倍的信噪比时两者的检出浓度同为0.088 mg/mL,方法检出限为0.088 mg/mL。
2.4 硫酸软骨素的干扰试验取硫酸软骨素和盐酸氨基葡萄糖标准品10 μL进样后,色谱图显示两峰分离度较好 (R>1.5)。在此条件下,硫酸软骨素对氨基葡萄糖的测定无影响。
2.5 回收率和精密度为了研究方法的准确度,向已测典型样品试样中加入已知量的各分析物,每个分析物分别加入3个不同质量40、80和100 mg,加流动相溶解并稀释至100 mL,按上述方法 (1.3.3) 进行测定,每个样品连续测定6次,根据加标量与检出量计算回收率和精密度 (表 1)。各物质的回收率为94.2%~96.3%,精密度为1.21%~2.10%,达到分析方法的要求。
2.6 样品测定
取3批样品 (批号:20141106、20141107、20141108),按1.3.2制备溶液,并取1.2.4项下0.6 mg/mL的标准溶液,按1.3.1项下色谱条件进样测定,利用保留时间定性,峰面积定量计算。结果3批样品的含量分别为企标量的101. 9%、97.5%和96.9%(盐酸氨基葡萄糖应为企标标示量的90.0%~110.0%),结果均符合规定,表明测定盐酸氨基葡萄糖的条件较稳定。
3 结论由于盐酸氨基葡萄糖为两性化合物,极性较大,特别是其结构中含有氨基,极可能与检测池壁产生相互作用,伴随吸附与解吸附的过程,影响检测光路而产生了负峰和杂质峰[1],加入乙酸铵抑制了负峰和拖尾的出现。利用hilic色谱柱可以调控目标峰的保留时间。
| [1] | 王培, 黄哲苏, 李海生. 盐酸氨基葡萄糖胶囊含量测定条件的改进[J]. 天津药学, 2008, 26(3): 318–340. |
| [2] | 中华人民共和国卫生部, 中国国家标准化管理委员会. GB/T 20365-2006硫酸软骨素和盐酸氨基葡萄糖含量的测定液相色谱法[S]. 北京: 中国标准出版社, 2012. |
| [3] | 廖栩, 王淑君, 佟岩. 柱前衍生化法测定盐酸氨基葡萄糖软膏的含量[J]. 沈阳药科大学学报, 2011(5): 380–383. |
| [4] | Shao Y, Alluri R, Mummert MA. Stability indicating HPLC method for the determination of glucosaminein pharmaceutical formulations[J]. Pharm Biomed Anal, 2004, 35(3): 625–631. doi: 10.1016/j.jpba.2004.01.021 |
| [5] | 郑家概, 王飞, 农云军.氨基葡萄糖盐酸盐含量的HPLC柱前衍生法测定[J].2009, 28(9):1081-1083. |
| [6] | Karlsson G, Winge S, Sandberg H. Separation of monosaccharides by hydrophilic interaction chromatography with evaporative light scattering detection[J]. J Chromatogr A, 2005, 1092(22): 246–249. |
| [7] | Tekko Ismaiel A, Bonner Michael C. An optimized reverse-phase high performance liquid chromatographic method for evaluating percutaneous absorpion of glucosamine hydrochloride[J]. J of Pharmaceutical and Biomedical Analysis, 2006, 41(2): 385–392. doi: 10.1016/j.jpba.2005.11.044 |

