随着经济社会的发展,我国正逐步从化妆品产品的消费大国成长为全球化妆品生产大国。全国化妆品生产企业达到3 100多家,化妆品品种达到2.5万余种,2009年化妆品生产销售额达1 400亿元人民币[1]。严格控制化妆品原料的种类和质量是确保化妆品产品质量的关键[2],化妆品原料的管理制度和框架是以危害识别和风险评估为基础[3]。我国现行《化妆品卫生规范》(2007版)[4]规定了化妆品原料及其产品安全性评价的毒理学检测要求。目前国内利用该规范对化妆品原料进行的毒理学安全性评价方兴未艾,且多为注重结果的常规检验,并非带有严谨设计的科学研究,因而国内评价方法的实践探讨较少见诸期刊文献。本研究选取两种化妆品原料(1号原料为植物中提取补骨脂有效成分,2号原料为间苯二酚类衍生物),采用皮肤刺激性、眼刺激性、光毒性、体外CHO细胞染色体畸变试验等方法,对其进行短期毒理学安全性评价,并探讨测试与评价方法中需要注意的问题,为化妆品原料的毒理学测试与评价方法的完善提供部分实验依据。
1 材料与方法 1.1 材料成年大耳白家兔、成年白化豚鼠,均为普通级,(北京科宇动物养殖中心提供,许可证号:SCXK(京) 2007-0003)。中国仓鼠卵巢上皮细胞(CHO,中国协和医科大学基础研究所细胞库)。DMEM培养液、胎牛血清、青、链霉素、胰蛋白酶(均购自Gibico公司)。1号原料为植物中提取补骨脂有效成分,棕色粘稠液体;2号原料为间苯二酚衍生物,白色粉末。其余试剂均为国产分析纯。UV光源为黑光灯管(美国GE公司,直径38 mm,功率40 W,波长350~400 nm。)
1.2 方法动物实验中,动物房环境与动物饲养条件均符合国标相关规定;实验过程中符合《实验动物管理条例》中要求,遵守动物保护、实验动物福利与伦理方面的要求。
1.2.1 多次皮肤刺激性试验1号原料直接使用原液,2号原料取适量原粉用适量无水乙醇溶解。对两个原料的试验均分别使用成年大耳白家兔4只,雌雄各半。详细试验方法、评分与结果判定均按照《化妆品卫生规范》(2007版)[4]中相关描述。
1.2.2 家兔眼刺激性试验1号、2号原料分别取原液0.1 mL或原粉0.1 g进行眼刺激性试验(不冲洗)。1号原料后续以原液0.1 mL进行眼刺激性试验(30 s冲洗),而后以溶剂Vit E油稀释为20%(v/v)、0.5%(v/v)稀释液,取0.1 mL进行眼刺激试验(不冲洗)。对两个原料的试验均分别使用成年大耳白家兔3只,雌雄不限。依据《化妆品卫生规范》(2007版)[4]进行评分和判定。
1.2.3 皮肤光毒性试验仅对2号原料进行。刺激性预试中使用成年白化豚鼠3只,雌雄不限。预试验中2号原料原粉在丙酮中的最高可溶解浓度为50%(w/v),该浓度下对3只豚鼠背部去毛皮肤涂敷试验未观察到豚鼠皮肤刺激反应,故配制2号原料原粉的50%丙酮溶液用于测试。光毒性试验使用成年白化豚鼠6只,雌雄各半。试验时,将该配制物约0.2 mL涂在豚鼠背部去毛区1、2号区域。涂受试物30 min后将左侧去毛1、3区用铝箔纸覆盖,右侧2、4区用UVA光源进行照射。平均照射强度为2.63 mW/cm2,照射时间63 min。照射结束后分别于1、24、48和72 h观察皮肤反应,根据《化妆品卫生规范》(2007版)[4]进行评分和判定。
1.2.4 体外细胞染色体畸变试验 1.2.4.1 受试物的配制仅对2号原料进行。原粉以DMSO配制为50.0 mg/mL的储备液,试验时吸取一定体积的该储备液,分别以适量不含血清的DMEM培养液(作用时间3 h,加入或不加入代谢活化系统的试验条件下)或者以含10%胎牛血清的DMEM培养液(作用时间24 h,无代谢活化系统的试验条件下),稀释为不同浓度梯度后用于试验。DMSO在测试系统中最高浓度为0.5%。
1.2.4.2 细胞准备取对数增殖期细胞,调整细胞密度为1×106个/mL,于37℃、5%二氧化碳培养箱中培养24 h。
1.2.4.3 染毒设受试物组、阴性对照组和阳性对照组。根据预试验中细胞毒性结果确定试验时受试物的最高终浓度。3 h试验受试物组的终浓度设定为20.0、10.0和5.0 μg/mL(-S9),及62.5、31.3和15.6 μg/mL(+S9)。作用3 h后换液。24 h试验受试物组的终浓度设定为40.0、20.0和10.0 μg/mL(-S9),作用24 h后换液。换液后均继续培养24 h收获细胞。
1.2.4.4 收获、制片、镜下分析收获前4 h加入秋水仙素,终浓度为1.0 μg/mL。按常规方法消化、低渗、固定、制片、Giemsa染色。对各受试物组、空白对照组、溶剂对照组(DMSO对照)选取200个分散良好的中期分裂相细胞、阳性对照组选取100个分散良好的中期分裂相细胞,进行染色体畸变分析。记录染色体结构畸变的类型和数目,并计算染色体畸变率。
1.3 统计学分析用χ2检验将各受试物组细胞的染色体畸变率与溶剂对照组(DMSO对照组)进行比较,确定是否有显著性差异。
2 结果 2.1 1号原料 2.1.1 多次皮肤刺激性试验结果原液在观察第1 d出现轻微红斑,第2 d出现轻微红斑与轻微水肿,第3~7 d逐步发展为中至重度红斑,同时伴有轻微至轻度水肿,在第7~8 d达到最高值。此后红斑与水肿程度有所减轻,并持续至试验观察期14 d结束。计算可得皮肤刺激每天每只动物平均积分为3.23,为中刺激性。
2.1.2 眼刺激试验结果原液眼刺激试验(不冲洗与30 s冲洗)中受试侧眼均出现结膜充血水肿、虹膜充血、角膜散在浑浊,持续观察至21 d仍有2只动物角膜损伤未完全恢复,眼刺激分级为不可逆眼损伤。将原液以Vit E油稀释为20%(v/v)、0.5%(v/v)稀释液进行眼刺激试验(不冲洗)结果显示,家兔受试一侧眼结膜出现不同程度的充血和水肿,但在观察期7 d内完全恢复。眼刺激反应分级判定为可逆眼损伤2A级(轻刺激性)。溶剂Vit E油的眼刺激试验(不冲洗)结果为可逆眼损伤2A级(轻刺激性)。
2.2 2号原料 2.2.1 多次皮肤刺激性试验结果作用后家兔皮肤出现轻微红斑,红斑持续至试验观察期14 d结束。计算可得皮肤刺激每天每只动物积分均值为0.77,为轻刺激性。
2.2.2 眼刺激试验结果原粉于染毒后1、24、48和72 h,第4 d和7 d观察,家兔受试一侧眼结膜出现不同程度的充血和水肿。截止到观察期第7 d,上述症状完全消失。试验中未见角膜和虹膜损伤。眼刺激反应分级判定为可逆眼损伤2A级(轻刺激性)。
2.2.3 光毒性试验结果观察1、24、48 h和72 h动物均未出现红斑或水肿等皮肤反应症状。
2.2.4 CHO细胞染色体畸变试验结果作用3 h,+/-S9条件下,以及作用24 h,-S9条件下,2号原料各剂量组与溶剂对照组和阴性对照组之间比较均无显著性差异。阳性对照组细胞染色体畸变率高于各试验组细胞染色体畸变率(P<0.01;表 1,表 2;图 1a~1j)。
| 组别 | -S9(μg/mL) | +S9(μg/mL) | |||||||
| 20.0 | 10.0 | 5.0 | 1.6 | 62.5 | 31.3 | 15.6 | 15.0 | ||
| 2号原料 | 0.5(1/200) | 2.5(5/200) | 1.5(3/200) | — | 1.5(3/200) | 0(0/200) | 0.5(1/200) | — | |
| 阳性对照1 | — | — | — | 24.0*(24/100) | — | — | — | 22.0*(22/100) | |
| 溶剂对照2 | 1.5(3/200) | 1.0(2/200) | |||||||
| 空白对照 | 0.5(1/200) | 1.0(2/200) | |||||||
| 注:1阳性对照组分别为丝裂霉素C(-S9)和环磷酰胺(+S9);2溶剂对照为终浓度0.5%的DMSO; *与空白对照及溶剂对照相比,P<0.01;DMSO对照组与空白对照组比较无显著性差异 | |||||||||
| 组别 | -S9(μg/mL) | |||
| 40.0 | 20.0 | 10.0 | 1.6 | |
| 2号原料 | 4.5(9/200) | 2.5(5/200) | 0.5(1/200) | — |
| 阳性对照 | — | — | — | 30.0*(30/100) |
| 溶剂对照2 | 1.5(3/200) | |||
| 空白对照 | 2.0(4/200) | |||
| 注:1阳性对照组分别为丝裂霉素C(-S9)和环磷酰胺(+S9);2溶剂对照为终浓度0.5%的DMSO; *与空白对照及溶剂对照相比,P<0.01;DMSO对照组与空白对照组比较无显著性差异 | ||||
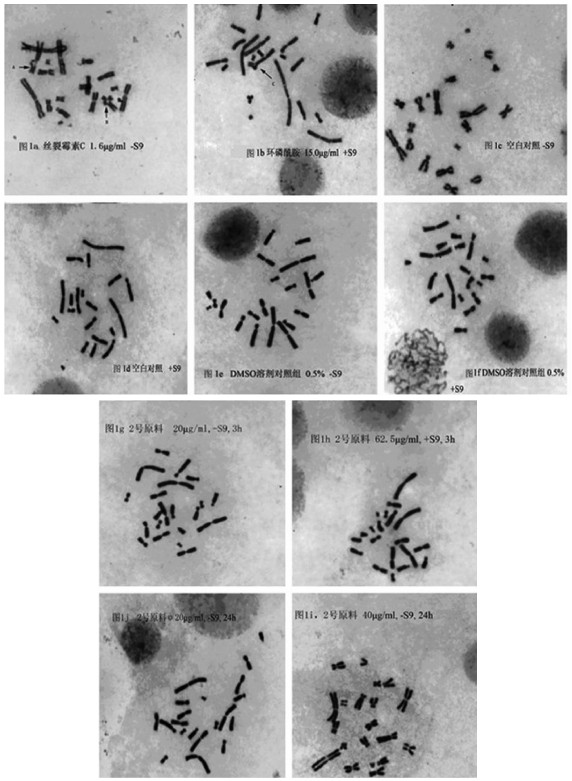
|
| 注:图 1a、1b阳性对照组染色体结构畸变,A,C:三射体;B:四射体;图 1c~1f对照组未发生结构畸变;图 1a~1j体外哺乳动物细胞染色体畸变结果 图 1g~1j 2号原料染毒组染色体未发生结构畸变 |
3 讨论 3.1 两种原料的毒理学安全性初步评估
1号原料系通过植物萃取补骨脂得到,其有效成分为补骨脂酚。补骨脂酚具有弱雌激素作用[5]、抗菌[6]等药理作用,因而常用作祛痘类化妆品的原料之一。1981年用昆明小鼠观察到补骨脂酚体内肾毒性,补骨脂酚0.125、0.25、0.5和1.0 mL/kg灌胃,连续7 d,对小鼠肾脏有选择性毒性,且恢复较慢[7]。国外文献报道,补骨脂酚对小鼠经口LD50为2 650 mg/kg,大鼠皮下注射LD50>1 000 mg/kg[8]。2号原料为间苯二酚类衍生物,常用作局部皮肤调色剂,使用限量为2%。化妆品原料评价(cosmetic ingredient review,CIR)专家组于1986年对间苯二酚与2-甲基间苯二酚进行了安全性评价,并于2006年对该两种原料进行了再次评价。CIR资料显示[9],5%间苯二酚可对小鼠皮肤产生刺激性而不对兔皮肤产生刺激性。10%间苯二酚溶液未对豚鼠产生皮肤刺激性。2.5%的2-甲基间苯二酚对兔不具有眼刺激性,5%的2-甲基间苯二酚在不冲洗条件下对家兔具有眼刺激性。间苯二酚与2-甲基间苯二酚在微生物与组织培养的致突变分析结果均为非致突变物。2-甲基间苯二酚浓度为3%时对人体无刺激性与致敏性。根据动物实验与临床资料,专家组认为在当前实际使用条件下,当使用浓度为1%~5%时,间苯二酚与2-甲基间苯二酚作为化妆品原料是安全的[9]。2006年CIR比较了1986年、2006年间苯二酚与2-甲基间苯二酚使用浓度及用于化妆品的产品类型,认为该两种原料的使用情况无变化,在当前使用条件下仍是安全的[10]。本研究中涉及的补骨脂酚与间苯二酚衍生物均为限制使用的化妆品原料[11],国内对其毒性研究较少,尤其在拟用作化妆品原料时的毒性资料和评价方法文献报道较少。
短期试验测试表明1号原料原液的多次皮肤刺激性试验为中刺激,不冲洗或30 s冲洗条件下的眼刺激试验均导致不可逆眼损伤,有潜在的急性刺激性危害。对1号原料稀释至其在化妆品产品中常用的两个浓度后,在不冲洗条件下进行眼刺激试验结果均为轻刺激性,具有一定的可接受性。2号原料皮肤刺激、眼刺激、光毒性、体外细胞畸变试验结果均为阴性,提示其具有一定的使用安全性。本研究短期毒性测试结果仅为毒理学安全性评价的一部分,研究结果必然具有片面性。对该两种化妆品原料的毒理学安全性的全面评价,尚须补充亚慢性、慢性试验、致癌试验资料、毒物代谢及动力学试验,以及根据原料的特性和用途所选择的其它必要的试验结果与资料。
3.2 测试与评价实践中的注意事项皮肤多次刺激试验中1号原料为粘稠液体,为模拟人体误用情况,测试时直接使用原液涂抹皮肤;考虑到紧急处理时清洗剂的可获得性,每次观察前1 h使用温水清除残留受试物,尽可能清除干净。14 d观察期内可观察到可逆刺激作用的全过程。2号原料为粉末,以最小体积的无水乙醇为溶剂进行溶解后涂抹皮肤有利于透皮吸收,但实际情况需要补充透皮吸收试验来加以验证和优化。
《化妆品卫生规范》(2007版)[4]中,眼刺激性反应分级表对化妆品原料与产品均分为可逆与不可逆眼损伤。由于原料多为化学物,受试物首选原液或原粉,通常会出现眼刺激反应,故对原料评价表中并未给出无刺激性的分级。对原料进行分级时,无论眼损伤是否可逆,均需要计算每只动物刺激积分均值,并要求2/3动物(即3只动物中有2只动物)刺激反应积分均值达到规定分值,并结合刺激反应积分在规定时间内是否完全恢复来对原料的眼刺激性进行分级。而对于化妆品产品,仅在出现不可逆眼损伤(腐蚀性)时才要求2/3动物刺激反应积分均值达到规定分值。
皮肤光毒性试验仅在原料具有紫外线吸收特性时需要选做。通过预实验确定溶剂的种类和用量,确定不引起皮肤刺激反应的测试涂抹浓度、以及将UV光源中的UVB剂量控制在不超过0.1 J/cm2对结果的准确性有较大影响。
在对2号原料进行体外哺乳动物细胞染色体畸变试验时,在加入与不加入S9mix的条件下受试物与细胞作用3 h均获得阴性结果。由于受试物为化妆品原料,按《化妆品卫生规范》(2007版)[4]中规定,需要补加试验,即在不加S9 mix的条件下将染毒时间延长至24 h。只有在以上3种测试条件下受试物各染毒剂量组染色体畸变分析结果均为阴性,方能判定该原料在试验条件下未引起CHO细胞染色体结构畸变[12-13]。
染色体畸变预实验中发现,如果染毒24 h时试验系统中不添加血清,将导致各试验组CHO细胞24 h后出现细胞活力下降,影响后续制片效果。本试验条件下,染毒时试验系统中选择添加10%胎牛血清,24 h非代谢条件下,阳性对照组(丝裂霉素C)细胞畸变率与阴性对照组比较有显著性差异。DMSO溶剂对照组与空白对照组比较,细胞染色体畸变率无显著性差异,验证了DMSO终浓度小于等于0.5%时不对体系造成影响。
畸变分析时,对于阳性对照选择100个细胞的依据在于:当有大量畸变细胞出现、且被测试物已明确为阳性物的条件下,可适当减少分析的中期相细胞数。目前《化妆品卫生规范》(2007)[4]中对化妆品产品选择100个中期相细胞,对化妆品原料选择200个细胞进行染色体畸变分析。最新修订的OECD TG473中提出至少选择300个中期相细胞进行分析,其目的在于有助于提高统计学分析的效能,且基本能避免因为出现畸变率为零的结果而导致χ2检验时出现检验效能不足的问题[14]。
| [1] | 孙波, 耿莉, 王艳, 等. 化妆品标准体系的探讨[J]. 环境卫生学杂志, 2012, 2(2): 85–87. |
| [2] | 秦钰慧. 国外化妆品法规与管理[J]. 中国卫生监督杂志, 1995, 2(1): 21–22. |
| [3] | 冯晓. 化妆品原料安全管理对策研究[J]. 上海食品药品监管情报研究, 2014, 4(127): 29–36. |
| [4] | 原中华人民共和国卫生部. 化妆品卫生规范[S]. 北京: 军事医学科学出版社, 2007. |
| [5] | 寿清耀, 杨荣平, 王宾豪, 等. 补骨脂雌激素样作用的有效成分研究[J]. 中药新药与临床药理, 2007, 18(6): 425–427. |
| [6] | Newton SM, Lau C, Gurcha SS, et al. The evaluation of forty-three plant species for in vitro antimycobacterial activities; isolation of active constituents from Psoralea corylifolia and Sanguinaria canadensis[J]. J Ethnopharmacol, 2002, 79(1): 57–67. doi: 10.1016/S0378-8741(01)00350-6 |
| [7] | 张玉顺, 刘玉琦, 吴子伦, 等. 补骨脂酚对小鼠肾脏毒害作用的研究[J]. 中国中药杂志, 1981(3): 30–32. |
| [8] | Prikhod'ko VA, Bondarenko AS, Mishenkova EL. ntimicrobial activity and toxicity of the antibiotic, bakuchiol[J]. Mikrobiol Zh, 1980, 42(5): 646–650. |
| [9] | CIR Expert Panel. Final report on the safety assessment of 2-methylresorcinol and resorcinol[J]. Journal of the American College of Toxicology, 1986, 5(3): 167–203. |
| [10] | CIR Expert Panel. Annual review of cosmetic ingredient safety assessments:2005/2006[J]. International Journal of Toxicology, 2008, 27(Suppl.1): 114–117. |
| [11] | OECD. Consolidated version of cosmetics directive 76/768/EEC(1976L0768-EN-24.04.2008-021.0021)[S]. 24 April, 2008. |
| [12] | Ramsey MJ, Moore DH 2nd, Briner JF, et al. The effects of age and lifestyle factors on the accumulation of cytogenetic damage as measured by chromosome painting[J]. Mutation Research, 1995, 338(1-6): 95–106. doi: 10.1016/0921-8734(95)00015-X |
| [13] | Matsuoka A, Hayashi M, Ishidate MJ. Chromosomal aberration tests on 29 chemicals combined with S9 mix in vitro[J]. Mutation Research/Genetic Toxicology, 1979, 66(3): 277–290. doi: 10.1016/0165-1218(79)90089-2 |
| [14] | OECD. In vitro mammalian chromosomal aberration test(TG473). OECD guideline for the testing of chemicals, section 4[S]. Adopted:26 September, 2014. |



