砷可以通过胎盘屏障或血脑屏障在脑组织中蓄积,从而影响儿童脑发育和神经递质合成和分泌,对儿童智力及神经系统的正常发育产生不良影响[1],其中一个主要表现就是学习记忆减退[2],但其毒性作用机制仍处于研究阶段。由德国神经生物学家Barde于猪脑中发现的脑源性神经营养因子(brain derived neurotrophic factor,BDNF)主要分布在大脑皮质、海马组织等部位,对学习记忆有促进作用[3]。本研究通过观察砷暴露后大鼠海马区BDNF的表达,初步探索砷致学习记忆损害的可能机制,为预防和治疗砷神经毒性引起的中毒提供理论依据。
1 材料与方法 1.1 主要仪器与试剂Real-Time PCR检测系统(杭州博日科技有限公司)、紫外分光光度仪(日本Shimadzu公司)、凝胶成像系统(法国Mat公司)、微波消解仪(ETHOS A)、电感耦合等离子体发射光谱仪(VISTA-MPS SPECTROME)。
亚砷酸钠(分析纯,上海晶纯试剂有限公司)、砷标准应用液(1 000 μg/L,国家标准物质研究中心)、SYBR Premix Ex Taq试剂盒(Takara公司)、TriZol试剂盒(美国Invitrogen公司)、M-MLV试剂盒(杭州沃森生物技术有限公司)、考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所)、脑源性神经营养因子酶联免疫分析(ELISA)试剂盒(南京建成生物工程研究所)。
1.2 动物分组及处理选择健康清洁级4—6周龄SD大鼠40只,雌雄各半,体重在100 + 20 g(由贵阳医学院动物实验中心提供,实验设施合格证编号为SYXK(黔)2012-001,动物合格证编号为SCXK(黔)2012-001,实验经贵阳医学院伦理委员会批准实施,编号为:1307003),适应性饲养1周后,将大鼠按体重随机分为4组,分别为对照组(蒸馏水)和2.4、12和60 mg/L亚砷酸钠溶液暴露组,即低、中、高剂量组,每组10只大鼠,雌雄各半,每笼5只,分笼饲养。采用自由饮水的方式连续染毒100 d。饲养环境温度为20℃~25℃,湿度为60%~65%。
1.3 样品收集乙醚麻醉大鼠,颈椎脱臼处死大鼠,断头后迅速取出脑组织,称重,放入装有冰浴生理盐水的培养皿中漂洗,并沿大脑纵裂垂直切为左右两个半球,游离并取出海马组织,称重后分装,储存于-70℃冰箱,备用。
1.4 脑砷含量测定称取脑组织0.3 g,加入6 mL硝酸和2 mL过氧化氢,放置过夜,次日放入微波消解仪中消解。每次至少有1个样品空白。消解后用去离子水定容至25 mL。采用电感耦合等离子体发射光谱法(ICP -AES)[4]测定标准系列和样品的光度值,以标准曲线计算样品中砷的含量。同时消化生物成分分析标准物质茶叶(GBW 10016) 和杨树叶成分分析标准物质(GBW 07604)[5],控制消化条件,保证回收率在90%~110%范围内。
1.5 大鼠海马组织BDNF mRNA表达的测定 1.5.1 RNA的提取及逆转录合成CDNA按TriZol试剂盒进行RNA的提取,按M-MLV试剂盒进行逆转录合成cDNA。
1.5.2 引物设计使用Primer Express 2.0软件设计引物,以β-actin作为RT-PCR的内参标准。实验引物由北京鼎国昌盛生物科技有限责任公司合成,引物序列见表 1。
| 基因名称 | 引物 | 序列 | 长度(bp) |
| BDNF | Primer F | 5’-GGGGTTAGGAGAAGTCAAGC-3’ | 570 |
| Primer R | 5’-CAGTGGGACTCCAGAAGACA-3’ | ||
| β-actin | Primer F | 5’-TCCTCCTGAGCGCAAGTACTCT-3’ | 126 |
| Primer R | 5’-GCTCAGTAACAGTCCGCCTAGAA-3’ |
1.5.3 实时荧光定量RT-PCR检测
按Takara公司的SYBR Premix Ex Taq试剂盒进行。PCR反应检测采用BIOER(杭州博日科技有限公司)公司的Real-Time PCR检测系统,PCR反应条件为95℃预变性10 min,95℃变性15 s,60℃退火1 min,40个循环。采用相对定量法比较染毒组与对照组BDNF mRNA表达水平,样品中目的基因相对于内参照基因的拷贝数为2-ΔCt,Δct=ct(目的基因三次循环平均值)-ct(内参基因三次循环平均值);染毒组样品的基因表达相对于对照组的变化倍数为2-ΔΔCt,ΔΔct=Δct染毒组-Δct对照组。
1.6 海马组织BDNF蛋白表达的测定考马斯亮蓝法测定海马组织总蛋白浓度;ELISA法测定海马组织BDNF蛋白的表达。
1.7 统计方法采用SPSS 17.0进行统计分析,以α=0.05为检验水准,实验数据以均值±标准差(x±s)表示,组间比较采用单因素方差分析(one-way-ANOVA),与对照组比较采用LSD法。
2 结果 2.1 脑砷含量变化各染毒组大鼠的脑砷含量均较对照组高,并随染毒剂量的增加而升高(P<0.05;表 1),差异具有统计学意义。
| 组别 | 例数(只) | 脑砷(μg/g) |
| 对照组 | 10 | 1.36±0.81 |
| 低剂量组 | 10 | 2.47±0.78a |
| 中剂量组 | 10 | 3.73±0.90ab |
| 高剂量组 | 10 | 5.00±1.19abc |
| 注:a与对照组比较,P<0.05;b与低剂量组比较,P<0.05;c与中剂量组比较,P<0.05 | ||
2.2 大鼠海马组织BDNF表达的测定 2.2.1 海马组织总RNA纯度及完整性鉴定
提取的总RNA电泳可见3条清晰条带,无基因组DNA污染,完整性良好;紫外光检测RNA的纯度,所有样品A260/A280值均在1.8~2.0之间,符合后续实验对RNA质量的要求(图 1)。
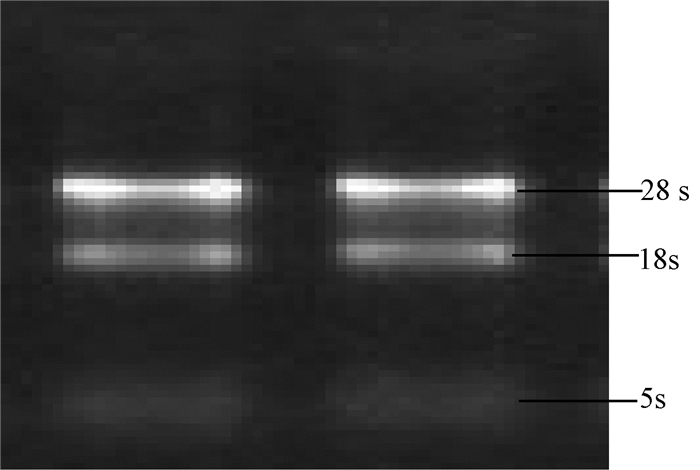
|
| 图 1 海马组织总RNA完整性及纯度鉴定 |
2.2.2 BDNF基因扩增效率
将荧光定量RT-PCR产物进行real time PCR,得到BDNF基因的扩增曲线和溶解曲线(图 2,图 3)。BDNF的扩增曲线呈“S”形,表明各基因的动力学曲线整体平行性较好,曲线拐点清楚,基线平无明显上扬趋势。溶解曲线呈单峰状,表明有特异性扩增产物,无引物二聚体及其他非特异性扩增产物。
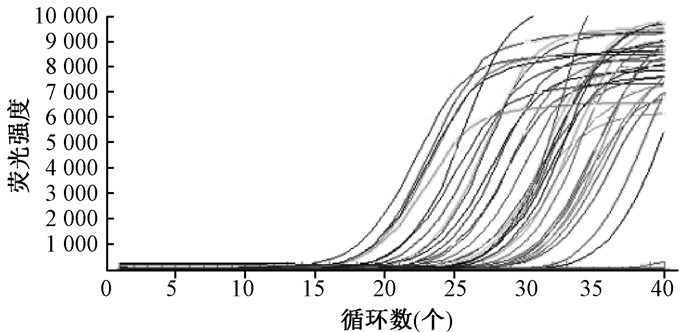
|
| 图 2 BDNF基因扩增曲线 |
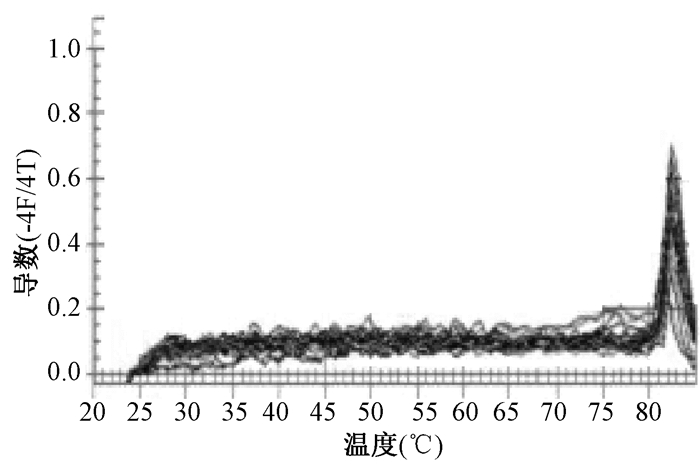
|
| 图 3 BDNF基因熔解曲线 |
2.2.3 大鼠海马组织BDNF的表达水平
染毒组海马BDNF mRNA及其蛋白的表达均低于对照组,差异有统计学意义(P<0.05;表 2)。其中染毒组BDNF mRNA的相对表达量较对照组减少,差异有统计学意义(P<0.05),高剂量组和中剂量组BDNF蛋白表达较对照组、低剂量组低,差异有统计学意义(P<0.05)。
| 组别 | 例数(只) | BDNF蛋白含量(μg/g) | BDNF mRNA(2-ΔΔCt) |
| 对照组 | 6 | 15.97±0.88 | 1.04±0.30 |
| 低剂量组 | 6 | 12.24±2.08ac | 0.16±0.11a |
| 中剂量组 | 6 | 7.65±0.39ab | 0.30±0.17a |
| 高剂量组 | 6 | 8.59±1.18ab | 0.13±0.019a |
| 注:a与对照组比较,P<0.05;b与低剂量组比较,P<0.05;c与中剂量组比较,P<0.05 | |||
3 讨论 3.1 砷暴露量与脑砷的关系
大鼠通过饮水给砷染毒100 d后,脑组织内砷含量增加,并随着染砷浓度增加而增加,这与杨瑞英等[6]研究结果相符,提示砷能通过血脑屏障在脑组织中蓄积。尽管在大脑皮层、海马组织、基底神经节和下丘脑各区含量不同,但呈现明显的剂量关系[7]。
3.2 亚慢性砷暴露对BDNF表达的影响BDNF分子单体是由119个氨基酸残基组成的分泌型成熟多肽,分布在中枢神经系统、周围神经系统、内分泌系统、骨和软骨组织等广泛区域内,但主要是在中枢神经系统内表达,其中海马组织和皮质的含量最高[8]。BDNF作为神经营养因子家族的一员,不仅能够促进神经干细胞的增殖、迁移和分化,促进多种神经元的存活和生长发育,而且能促进突触的可塑性,改变脑内神经元的形态,增加突触终末的密度和促进树突和轴突的生长[9]。近年来BDNF越来越受到关注,他参与可塑性机制和长时程增强效应(LTP)的形成和维持。LTP具有时程长和联合的性质,因此不少研究者把LTP与学习和记忆联系起来,认为他是研究学习、记忆的分子模型。BDNF能通过调节突触后NMDA受体、启动MAPK转导等途径参与LTP的机制,影响学习与记忆功能[10]。宁晓霞等[11]的研究结果表明BDNF及受体TrkB的表达,与学习记忆能力的程度呈平行的线性关系。相关研究也已证实,BDNF能够调节突触传递易化长时程增强效应(LTP),在海马组织的LTP中起关键的作用[12]。这些结果表明海马组织的BDNF的表达对学习记忆能力有重要作用。此外,BDNF还能增加大鼠海马组织胆碱能突触释放乙酰胆碱,BDNF与乙酰胆碱之间存在着正反馈作用,从而对认知功能有保护作用[13],用BDNF处理的低密度培养的胚胎胆碱能神经元ChAT酶活力水平可提高2~3倍[14]。
本研究结果显示,砷暴露组大鼠海马组织BDNF mRNA及蛋白表达均较对照组下降。提示亚慢性砷暴露导致大脑海马组织BDNF表达下调,可能影响大鼠学习记忆能力。本课题组前期研究[15]已表明,砷暴露引起大鼠海马组织AChE活性升高,导致乙酰胆碱含量下降。由此推测BDNF下调也可能通过减少大鼠海马组织胆碱能突触释放乙酰胆碱,从而影响大鼠学习记忆功能。
4 结论综上所述亚慢性砷暴露可致大鼠海马组织BDNF mRNA及其蛋白的表达下调,而海马组织BDNF表达的下降可能是砷致学习记忆能力受损的机制之一。
| [1] | 李昕, 李冰, 郑全美, 等. 燃煤型砷中毒患者甲基化能力与中毒症状间相关性的研究[J]. 中国地方病防治杂志, 2011, 4(2): 81–83. |
| [2] | 唐孝威, 孙达. 学习记忆[M]. 认知科学导论, 2011, 152. |
| [3] | Lu Y, Christian K, Lu B. BDNF:a key regulator for protein synthesis-dependent LTP and long-term memory[J]. Neurobiology of Learning and Memory, 2008, 89(3): 312–323. doi: 10.1016/j.nlm.2007.08.018 |
| [4] | 云南省质量技术监督局. DB 53T 288-2009食品中铅、砷、铁、钙、锌、铝、钠、镁、硼、锰、铜、钡、钛、锶、锡、镉、铬、钒含量的测定[S]. 中华人民共和国地方标准备案公告2009年(第06号)(总第114号), 中国标准化, 2009, 8: 43-48. |
| [5] | 施燕支, 郭雪清, 王艳泽, 等. 微波消解/电感耦合等离子体质谱法测定白芍中的微量元素[J]. 现代科学仪器, 2006(1): 97–98. |
| [6] | 杨瑞英, 李子杰, 林勤, 等. 砷中毒大鼠体内各脏器、组织中砷的分布[J]. 中国地方病学杂志, 2005, 20(5): 260–262. |
| [7] | Biswas U, Sarkar S, Bhowmik MK, et al. Choronic toxicology of arsenic in goats:clinico-biochemical changes, pathormporphology and tissue residues[J]. Small Ruminant Res, 2000, 38(3): 229–235. doi: 10.1016/S0921-4488(00)00162-0 |
| [8] | 符彬莎, 李玲. 脑源性神经营养因子与脑损伤的研究现状[J]. 医学综述, 2011, 17(8): 1140–1142. |
| [9] | Mertz K, Koschenk T, Schilling K. Brain derived neurotrophic factor modulates dendritic rumplalogy of cerebellar basket and stellate cells. Aninviron study[J]. Neur Science, 2000, 97(2): 303–310. |
| [10] | 秦锦标, 周红. 脑源性神经营养因子在长时程增强中的作用[J]. 东南大学学报(医学版), 2007, 26(5): 389–393. |
| [11] | 宁晓霞, 师社会, 邢亮, 等. BDNF、TrkB在大鼠海马CA3区的表达及其与学习记忆的关系[J]. 陕西医学杂志, 2008, 37(9): 1130–1132. |
| [12] | Tongiorgi E. Activity-dependent expression of brain-derived neurotrophic factor in dendrites facts and open questions[J]. Neurosci Res, 2008, 61: 335–346. doi: 10.1016/j.neures.2008.04.013 |
| [13] | Sarah JT, Trevor H, Catherine HH, et al. Hippocampal neurotrophin and trk receptor mRNA levels are altered by local administration of nicotine, carbachol and pilocarpine[J]. Molecular Brain Res, 1999, 67: 124–136. doi: 10.1016/S0169-328X(99)00048-0 |
| [14] | Thoenen. Neurotrophins and neuronal plasticity[J]. Science, 1995, 270(5236): 593. doi: 10.1126/science.270.5236.593 |
| [15] | 周华芳, 余堃, 张华, 等. 亚急性砷中毒对脑海马和皮质AChE、NOS活性影响[J]. 中国公共卫生, 2012, 28(3): 349–350. doi: 10.11847/zgggws2012-28-03-41 |



