大气细颗粒物(PM2.5)是指空气动力学直径小于或等于2.5 μm的颗粒物。在可吸入颗粒物中占有相当大的比重,而且成分复杂,容易富集重金属、有机污染物、酸性氧化物等,可对人体健康尤其是呼吸系统产生危害[1]。多环芳烃(PAHs)为危害最大的持久性有机污染物之一,是指分子中含有两个苯环以上的碳氢化合物,也是我国北方中分布最广的污染物[2]。秸秆燃烧、家庭燃煤以及炼焦工业被认为是中国大气中PAHs的主要来源[3]。PAHs长久存在于环境中,具有强致毒性、致突变和致癌等特性。PAHs不溶于水,溶于有机溶剂。大气悬浮颗粒物中的PAHs可通过呼吸进入人体上呼吸道、支气管以及肺泡等,给人体健康带来很大威胁[4-5]。
目前分离测定PAHs的方法主要有:气相色谱法、气相色谱/质谱法、高效液相色谱法等。气相色谱/质谱法分辨率高,但仪器设备较为贵重,在我国尚未普及,其检测方法难于推广。氢火焰检测器和质谱检测器,在检测过程中破坏/改变了待测物PAHs的组成性质,难以实施对PAHs的接收和制备[6]。HPLC有较高的灵敏度和分辨率[7-9]且不改变PAHs的组成性质,馏分容易接收和制备。本文对HPLC测PAHs的条件进行探讨,通过优化梯度洗脱程序、检测波长程序、流速等一系列色谱条件,能将16种PAHs很好分离。
1 材料与方法 1.1 仪器与试剂 1.1.1 仪器高效液相色谱仪(日本日立):配备L-2130泵,L-2455二极管阵列检测器,L-2200自动进样器,L-2300柱温箱;色谱柱:PAH C18(Waters),250 mm×4.6 mm;超声波清洗机:SB-800-DT(宁波新芝);纯水超纯水组合系统:Milli-Q Integral 5(美国密理博);智能中流量采样器:KC 120-H型(青岛崂山电子仪器总厂)。
1.1.2 试剂多环芳烃标准储备液,200 μg/mL(ANPEL Scientific Instrument Co Ltd),溶剂为乙腈,证书号:221684(表 1)。
| 缩写 | 英文名称 | 中文名称 |
| Nap | Naphthalene | 萘 |
| Ace Y | Acenaphthylene | 苊烯 |
| Ace | Acenaphthlene | 苊 |
| Flu | Fluorine | 芴 |
| PhA | Phenanthrene | 菲 |
| Ant | Anthracene | 蒽 |
| Flu A | Fluoranthene | 荧蒽 |
| Pyr | Pyrene | 芘 |
| Ben | Benzo(a)anthracene | 苯并(a)蒽 |
| Chr | Chrysene | 屈 |
| BbF | Benzo(b)fluoranthene | 苯并(b)荧蒽 |
| BbK | Benzo(k)fluoranthene | 苯并(k)荧蒽 |
| BbA | Benzo(a)pyrene | 苯并(a)芘 |
| DbA | Dibenz[a, h]anthracene | 二苯并(a, h)蒽 |
| BghiP | Benzo[ghi]perylene | 苯并(g, h, i)苝 |
| In[123-cd]P | Indeno[123-cd]pyrene | 茚苯(123-cd)芘 |
多环芳烃标准使用液(10.0 μg/mL):准确移取0.50 mL多环芳烃标准储备液于10 mL容量瓶中,乙腈稀释至刻度,混匀;十氟联苯标准储备液(1 mg/mL):准确称取0.01g十氟联苯标准品(99.90 %,Dr, Ehrenstorfer GmbH)于10 mL容量瓶中,乙腈稀释至刻度,混匀;十氟联苯标准使用液(20.0 μg/mL):准确移取0.20 mL十氟联苯标准储备液于10 mL容量瓶中,乙腈稀释至刻度,混匀;色谱纯乙腈(迪马科技);超纯水。
1.2 样品采集将玻璃纤维膜用铝箔包好,并留有开口,放入马弗炉中400 ℃下加热5 h,待冷却至室温后,放入干燥器中平衡24 h后进行称量,两次称量质量之差不大于0.04 mg,用镊子夹取滤膜,使粗糙面朝上,于采样器滤膜夹上夹紧。使用中流量颗粒物采样器采集大气中的PM2.5颗粒,空气流量为100 L/min,样品采集时间为20 h。采样结束后,用镊子夹取滤膜,尘面向内对折,放入滤膜盒中,密封后放入干燥器内保存。
1.3 空气样品的前处理将采样滤膜用镊子拿出,移入15 mL离心管中,加入5 mL乙腈,盖好盖后在恒温水浴中超声30 min。提取液经0.45 μm滤膜过滤,取1 mL于样品瓶中,待测。
1.4 色谱条件分离柱为C18反相色谱柱,柱温30℃,流速1.0 mL/min,进样量10 μL。二极管阵列检测器波长为220 nm和254 nm。流动相为乙腈(A)和水(B),其梯度洗脱程序见表 2。
| 程序序号 | 时间 (min) |
乙腈 (%) |
水 (%) |
泵(A)流量 (mL/min) |
| 1 | 0 | 50 | 50 | 1 |
| 2 | 5 | 50 | 50 | 1 |
| 3 | 20 | 100 | 0 | 1 |
| 4 | 28 | 100 | 0 | 1 |
| 5 | 32 | 50 | 50 | 1 |
1.5 PAHs标准曲线绘制 1.5.1 标准系列的制备
准确移取多环芳烃标准使用液和十氟联苯标准使用液于乙腈中,制备标准系列,多环芳烃质量浓度分别为0、0.10、0.50、1.00、2.00、5.00 μg/mL,十氟联苯质量浓度分别为0、0.20、0.60、1.00、2.00、5.00 μg/mL,贮存在棕色瓶中,于冷暗处存放(表 3)。
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 乙腈体积(μL) | 1000 | 980 | 920 | 850 | 700 | 250 |
| PAHs混标使用液体积(μL) | 0 | 10 | 50 | 100 | 200 | 500 |
| 十氟联苯标准使用液体积(μL) | 0 | 10 | 30 | 50 | 100 | 250 |
| PAHs质量浓度(μg/mL) | 0 | 0.10 | 0.50 | 1.00 | 2.00 | 5.00 |
| 十氟联苯质量浓度(μg/mL) | 0 | 0.20 | 0.60 | 1.00 | 2.00 | 5.00 |
1.5.2 标准曲线
将标准系列注入液相色谱仪,通过改变色谱条件,如流动相梯度洗脱程序、流速、柱温、检测波长等,使多环芳烃达到最佳分离,得到各不同质量浓度的多环芳烃色谱图,以峰面积为纵坐标,质量浓度为横坐标,绘制标准曲线。
1.6 样品的测定样品注入高效液相色谱仪,测试条件与标准曲线测试条件一致,记录色谱峰的保留时间和峰面积。根据标准曲线及样品峰面积,计算样品质量浓度。
1.7 质量控制每批大约20张玻璃纤维膜取1张进行多环芳烃空白试验,空白中萘、菲<50 ng,其他多环芳烃<10 ng。采样过程配置空白滤膜,空白滤膜与采样滤膜一起进行恒重、称量,并同时运送至采样地点,不采样并保持和采样滤膜相同的时间。
十氟联苯是反映提取效果的替代物,样品中加入十氟联苯,通过回收率可以评价样品前处理对分析结果的影响,回收率的控制范围在50%~125%之间。
2 结果与讨论 2.1 色谱条件的选择和优化 2.1.1 梯度洗脱PAHs为两个苯环以上的化合物,有许多同分异构体,为了使分子结构相差很大的同分异构体在适宜的时间内全部出峰并有效分离,实验中采用流动相梯度洗脱程序,通过反复调节流动相乙腈和水的体积比,对梯度洗脱程序进行了重点优化。梯度洗脱程序1、2、3虽然分离时间短,但萘和苊烯不能完全分离,芴和菲重叠。梯度洗脱程序5虽然能将16种成分完全分离,但分离时间较长,所以选用梯度洗脱程序4,能够使16种成分达到最佳分离效果,并且分离时间短。PAHs的进样质量浓度皆为5.00 μg/mL,进样量为10 μL,出峰顺序依次为萘、苊烯、苊、芴、菲、蒽、荧蒽、芘、苯并(a)蒽、屈、苯并(b)荧蒽、苯并(k)荧蒽、苯并(a)芘、二苯并(a, h)蒽、苯并(g, h, i)苝和茚苯(1, 2, 3-c, d)芘(图 1-图 5)。

|
| 梯度程序:乙腈:65%,8 min;65%-100%,12 min;100%,15 min;100%-65%,3 min;流速:1.0 mL/min。 图 1 程序1的PAHs的HPLC-UVD谱图 |
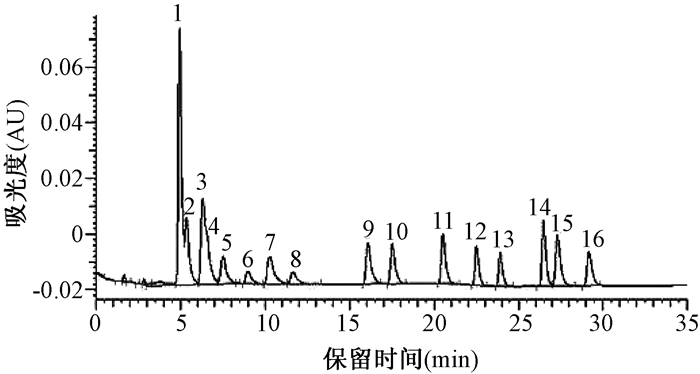
|
| 梯度程序:乙腈:70%,维持5 min;70%-100%,15 min;100%,持续10 min;100%-70%,5 min;流速:1.0 mL/min。 图 2 程序2的PAHs的HPLC-UVD谱图 |
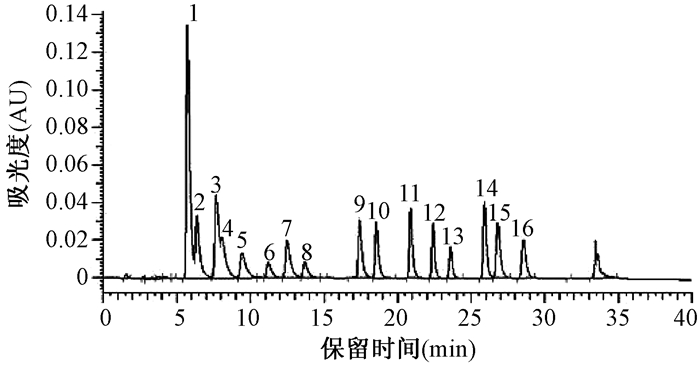
|
| 梯度程序:乙腈:65%,持续5 min;65%-100%,13 min;100%,维持10 min;100%-65%,4 min;流速:1.0 mL/min。 图 3 程序3的PAHs的HPLC-UVD谱图 |

|
| 梯度程序:乙腈:50%,5 min;50%-100%,15 min;100%,持续8 min;100%-50%,4 min;流速:1.0 mL/min。 图 4 程序4的PAHs的HPLC-UVD谱图 |
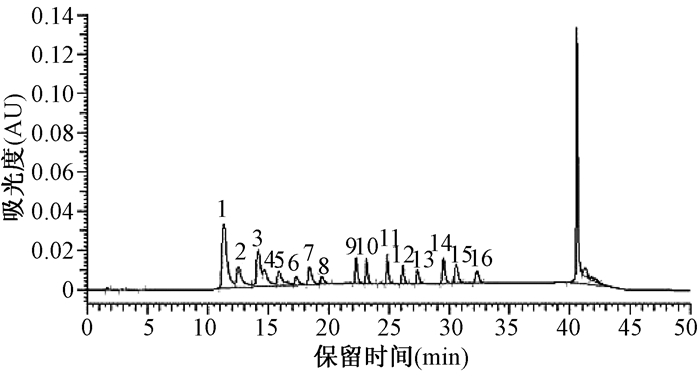
|
| 梯度程序:乙腈:50%,5 min,流速:1.0 mL/min;50%-65%,2 min,流速:1.0 mL/min-0.8 mL/min;65%-100%,13 min,流速:0.8 mL/min;100%,持续1 min,流速:0.8 mL/min-1.0 mL/min。 图 5 程序5的PAHs的HPLC-UVD谱图 |
2.1.2 流速的选择
实验显示,流动相的流速直接影响柱效。采用流速为1.0 mL/min进行恒流洗脱,多环芳烃分离效果良好。采用流速为1.5 mL/min时,苊和芴不能完全分离,并且二苯并(a, h)蒽和苯并(g, h, i)苝分离效果较流速为1.0 mL/min时变差。在5 min与21 min之间降低流速到0.8 mL/min,结果显示苊和芴不能完全分离,并且分析时间延长。故最终采取流速为1.0 mL/min不变恒流洗脱。
2.1.3 柱温的选择柱温低分离效果差且时间长,柱温高缩短了保留时间,可以减少分析周期,同样的梯度洗脱程序和流速下,25℃时二苯并(a, h)蒽、苯并(g, h, i)苝和茚苯(1, 2, 3-c, d)芘的峰形重叠,难以分开,并且这三种物质峰形与溶剂峰重叠,分离效果较差。故选择30℃为最佳柱温。
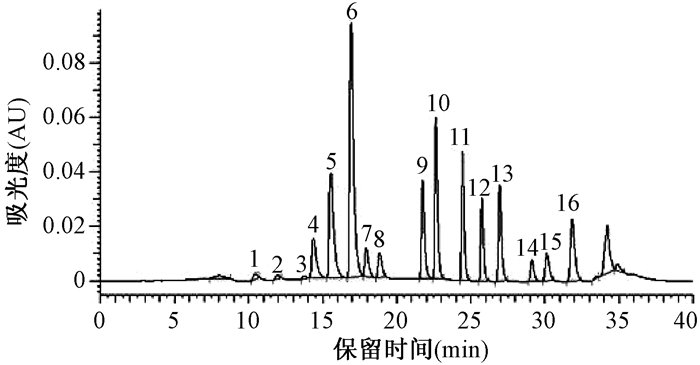
2.1.4 检测波长的选择二极管阵列检测器的检测波长为220 nm和254 nm。经试验证明,萘、苊烯、苊、芴、荧蒽、二苯并(a, h)蒽、苯并(g, h, i)苝在波长为220 nm下比在波长为254 nm下吸收效果好,菲、蒽在波长为254 nm下比在波长为220 nm下吸收效果好,其他物质在两种波长下吸收差别不大(图 6、图 7)。
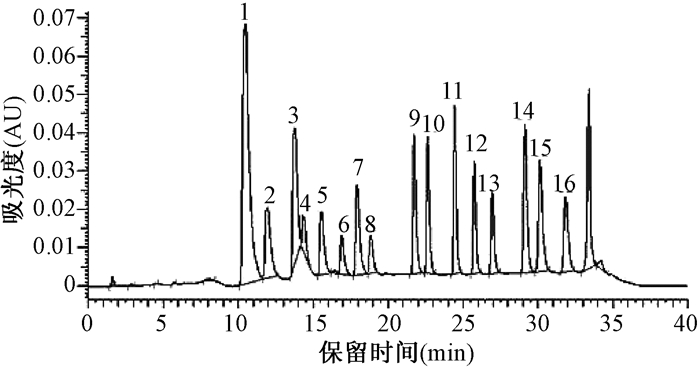
|
| 图 6 检测波长为220 nm的PAHs的HPLC-UVD谱图 |
|
| 图 7 检测波长为254 nm的PAHs的HPLC-UVD谱图 |
2.2 方法的线性关系
将系列浓度的PAHs标准溶液分别进行HPLC测定。用峰面积和各组分的质量浓度作图,计算PAHs各组分的线性回归方程及相关系数r,结果表明PAHs各组分线性关系良好(表 4)。
| PAHs | 相关系数r | 线性回归方程 |
| Nap | 0.9998 | Y=187 438.19x-1 313.072 |
| Ace Y | 0.9993 | Y=42 530.66x-1 209.282 |
| Ace | 0.9998 | Y=68 761.51x+633.003 |
| Flu | 0.9994 | Y=15 146.69x-1.583 |
| PhA | 0.9993 | Y=28 899.01x+356.915 |
| Ant | 0.9995 | Y=15 937.88x-315.301 |
| Flu A | 0.9997 | Y=40 080.38x-489.205 |
| Pyr | 0.9998 | Y=16 080.31x-423.464 |
| Ben | 0.9996 | Y=45 698.83x-450.652 |
| Chr | 0.9998 | Y=41 078.07x-1 194.235 |
| BbF | 0.9997 | Y=47 742.17x-792.617 |
| BbK | 0.9997 | Y=31 592.46x+91.645 |
| BbA | 0.9997 | Y=26 758.70x+271.524 |
| DbA | 0.9996 | Y=54 518.27x-1 216.022 |
| BghiP | 0.9994 | Y=49 260.04x-3 580.395 |
| In[1, 2, 3-cd]P | 0.9995 | Y=34 586.98x-350.676 |
2.3 方法的检出限和检测限
测定10次低质量浓度溶液(0.10 μg/mL),16种多环芳烃组分的检出限(以信噪比S/N=3计)的范围为0.0065~0.017 μg/mL,检测限(以信噪比S/N=10计)为0.022~0.055 μg/mL(表 5)。
| PAHs | 检出限 (μg/mL) |
检测限 (μg/mL) |
相对标准偏差 (%) |
| Nap | 0.0072 | 0.024 | 1.29 |
| Ace Y | 0.0097 | 0.032 | 1.81 |
| Ace | 0.0092 | 0.031 | 1.99 |
| Flu | 0.0096 | 0.032 | 2.38 |
| PhA | 0.0078 | 0.026 | 2.45 |
| Ant | 0.015 | 0.04 | 2.51 |
| Flu A | 0.011 | 0.035 | 2.53 |
| Pyr | 0.011 | 0.036 | 2.57 |
| Ben | 0.008 | 0.027 | 2.82 |
| Chr | 0.0065 | 0.022 | 2.99 |
| BbF | 0.012 | 0.04 | 3.15 |
| BbK | 0.014 | 0.047 | 3.17 |
| BbA | 0.012 | 0.039 | 3.9 |
| DbA | 0.0089 | 0.03 | 4 |
| BghiP | 0.017 | 0.055 | 4.35 |
| In[1, 2, 3-cd]P | 0.012 | 0.039 | 5.08 |
2.4 方法的精密度
6次平行进样(0.10 μg/mL)得到的含量测定值的相对标准偏差(RSD)为1.29%~5.08%(表 5)。该方法的精密度高,重现性好。
2.5 方法的准确度将滤膜分成4等份,取1/4样品滤膜作为本底,其它3个等分膜上分别加入3个不同质量浓度的PAHs标准使用液(0.10、0.50和2.00 μg/mL)和十氟联苯使用液(0.60 μg/mL),按1.3所述进行样品前处理后进行HPLC测定,计算出PAHs样品的加标回收率范围为81.44%~98.02 %(表 6)。
| PAHs | 样品浓度(μg/mL) | 实际添加浓度(μg/mL) | 实际测得浓度(μg/mL) | 加标回收率(%) |
| Nap | 0.0087 | 0.1 | 0.11 | 96.62 |
| 0.0087 | 0.5 | 0.46 | 90.65 | |
| 0.0087 | 2 | 1.74 | 86.4 | |
| Ace Y | 0.031 | 0.1 | 0.12 | 86.46 |
| 0.031 | 0.5 | 0.51 | 95.82 | |
| 0.031 | 2 | 1.76 | 86.39 | |
| Ace | 0.006 | 0.1 | 0.088 | 81.92 |
| 0.006 | 0.5 | 0.48 | 94.14 | |
| 0.006 | 2 | 1.68 | 83.79 | |
| Flu | 0.016 | 0.1 | 0.1 | 86.49 |
| 0.016 | 0.5 | 0.5 | 95.7 | |
| 0.016 | 2 | 1.74 | 86.22 | |
| PhA | 0.011 | 0.1 | 0.094 | 83.26 |
| 0.011 | 0.5 | 0.46 | 90.15 | |
| 0.011 | 2 | 1.74 | 86.56 | |
| Ant | 0.024 | 0.1 | 0.11 | 83.45 |
| 0.024 | 0.5 | 0.45 | 85.51 | |
| 0.024 | 2 | 1.68 | 82.99 | |
| FluA | 0.015 | 0.1 | 0.097 | 82.23 |
| 0.015 | 0.5 | 0.5 | 98.02 | |
| 0.015 | 2 | 1.72 | 85.45 | |
| Pyr | 0.033 | 0.1 | 0.12 | 89.61 |
| 0.033 | 0.5 | 0.48 | 89.35 | |
| 0.033 | 2 | 1.72 | 84.53 | |
| Ben | 0.022 | 0.1 | 0.11 | 89.59 |
| 0.022 | 0.5 | 0.51 | 97.53 | |
| 0.022 | 2 | 1.75 | 86.28 | |
| Chr | 0.033 | 0.1 | 0.11 | 85.08 |
| 0.033 | 0.5 | 0.51 | 93.27 | |
| 0.033 | 2 | 1.75 | 85.65 | |
| BbF | 0.031 | 0.1 | 0.11 | 81.56 |
| 0.031 | 0.5 | 0.49 | 92.13 | |
| 0.031 | 2 | 1.9 | 93.58 | |
| BbK | 0.002 | 0.1 | 0.086 | 83.72 |
| 0.002 | 0.5 | 0.48 | 95.17 | |
| 0.002 | 2 | 1.8 | 90.04 | |
| BbA | 0.0058 | 0.1 | 0.1 | 97.16 |
| 0.0058 | 0.5 | 0.46 | 91.25 | |
| 0.0058 | 2 | 1.63 | 81.44 | |
| DbA | 0.025 | 0.1 | 0.11 | 82.5 |
| 0.025 | 0.5 | 0.51 | 96.92 | |
| 0.025 | 2 | 1.76 | 86.88 | |
| BghiP | 0.078 | 0.1 | 0.16 | 82.5 |
| 0.078 | 0.5 | 0.56 | 96.34 | |
| 0.078 | 2 | 1.83 | 87.47 | |
| In[1, 2, 3-cd]P | 0.02 | 0.1 | 0.1 | 82.43 |
| 0.02 | 0.5 | 0.5 | 95.43 | |
| 0.02 | 2 | 1.79 | 88.39 |
3 结论
本文建立了二极管阵列检测器测定PM2.5多环芳烃的高效液相色谱分析方法,通过优化梯度洗脱程序、流速、柱温、波长及检测器等色谱条件,最终确立了空气中16种多环芳烃检测方法的最佳分离条件。
16种PAHs的回收率均稳定在81.44%~98.02%之间,相对标准偏差在1.29%~5.08%之间,同时方法具有良好线性范围、检出限、精密度和准确度,可满足空气中多环芳烃检测分析的实际要求。
| [1] | 杨洪斌, 邹旭东, 汪宏宇, 等. 大气环境中PM2.5的研究进展与展望[J]. 气象与环境学报, 2012, 28(3): 77–82. |
| [2] | Tao S, Cui YH, Xu FL, et al. Polycyclic aromatic hydrocarbons in agricultural soil and vegetables from Tianjin[J]. Sci Total Environ, 2004, 320: 11–24. doi: 10.1016/S0048-9697(03)00453-4 |
| [3] | Xu SS, Liu WX, Tao S. Emission of polycyclic aromatic hydrocarbons in China[J]. Environmental Science and Technology, 2006, 40: 702–708. doi: 10.1021/es0517062 |
| [4] | 周家斌, 王铁冠, 黄云碧, 等. 北京地区大气可吸入颗粒物中多环芳烃分布特征[J]. 环境科学研究, 2004, 17(5): 10–14. |
| [5] | 王平利, 戴春雷, 张成江. 城市大气中颗粒物的研究现状及健康效应[J]. 中国环境监测, 2005, 21(1): 83–87. |
| [6] | 平立凤, 李振, 赵华, 等. 土壤样品中多环芳烃分析方法研究进展[J]. 土壤通报, 2007, 38(1): 178–184. |
| [7] | 罗世榕. 高效液相色谱荧光法测定土壤中16种多环芳烃[J]. 福建分析测试, 2010, 19(2): 69–72. |
| [8] | 钱薇, 倪进治, 骆永明, 等. 高效液相色谱-荧光检测法测定土壤中的多环芳烃[J]. 色谱, 2007, 25(2): 221–225. |
| [9] | 张德云, 孙成均, 王涛. 高效液相色谱法测定室内空气中13种多环芳烃[J]. 华西医大学报, 2002, 33(1): 140–143. |

