2. 中国科学院地理科学与资源研究所;
3. 华中科技大学同济医学院
微生物在环境中无处不在,过多接触环境中的致病微生物会导致人体感染疾病,对人体健康产生严重威胁[1]。近年来,农村生活饮用水微生物污染所导致人体健康受到威胁的事件时有发生,均与供水设施简陋及卫生条件落后有关[2-3]。因此,寻找安全有效的抗菌材料对防治微生物污染、保障偏远地区饮水卫生具有重要意义[4]。
Cu、Zn等金属具有优异的广谱抗菌特性,被广泛开发为多种金属材料及合金材料,并大量应用于纺织、家电。在我国藏区、新疆、蒙古等地区,也使用铜制容器储存生活用水,用于防止微生物的污染与滋生[5]。目前,多数研究将重点集中于新金属材料的开发及相关金属的抗菌性能分析[6-7],而针对已经大规模生产及使用的铜制容器,开展相关自然环境条件下储水过程的抑菌效果的研究还鲜有报道。本文在已有研究的基础上,对铜制容器储水过程的抑菌效果及金属溶出进行研究,为铜制容器的使用提供科学依据。
1 材料与方法 1.1 实验材料实验中使用的黄铜、红铜和塑料容器均购置于西藏地区;营养琼脂,乳糖蛋白胨培养基购置于中国检验检疫科学院,并按说明书要求进行配制;稀硝酸和医用酒精购置于国药集团,经实验室自行配制后使用。
1.2 菌种及菌液制备大肠杆菌置于中国药品生物制品研究所,经实验室自行分离保存在装有营养琼脂培养基的试管中。用5 mL生理盐水反复冲洗试管至菌液浑浊并制成原菌液,之后将原菌液逐级稀释104~105倍后待用。
1.3 实验设计实验采用黄铜容器、红铜容器作为实验组并接种大肠杆菌。为了排除环境因素对容器水样中总大肠菌群测定的影响,本实验采用塑料容器接种大肠杆菌和使用清水(不接种大肠杆菌)为对照样品。容器采用75%酒精擦拭处理后,向4个容器中加入4 L纯净水,之后立即向3个容器水样内接种4 mL稀释了105倍的菌液,清水对照样品不加菌液,此时计时为0 h。分别于0、4、8、24、48、72、96和168 h各采集水样75 mL。其中60 mL用于总大肠菌群检测,15 mL用于容器金属溶出的测定(加入稀硝酸使pH低于2,4℃保存待测)。上述实验完成后,4种容器做灭菌处理后准备开始第二次实验。在第二次实验中,先按照1.2所述内容制备原菌液并将原菌液用生理盐水逐级稀释104倍,以制成稀释菌液。后再向盛放4 L纯净水的各类容器中加入4 mL稀释菌液,清水对照样品不加菌液。两次实验除变化接种大肠杆菌浓度外,其它实验条件均不变。
1.4 总大肠菌群的测定总大肠菌群的测定方法参考《生活饮用水标准检验方法微生物指标》(GB/T 5750.12-2006)[8]中的多管发酵法。其中,恒温培养箱温度为(36±1)℃,培养时间为24 h。培养结束后,记录产酸产气试管数,根据《生活饮用水标准检验方法微生物指标》(GB/T 5750.12-2006)[8]中的总大肠菌群MPN检索表报告每100 mL水样中的总大肠菌群MPN值。
1.5 金属Cu、Zn溶出的测定Cu、Zn金属的质量浓度使用电感耦合等离子体发射光谱法(ICP-OES)测定,其中仪器条件为射频功率1.3 kw,等离子体流量15 L/min,辅助气体流量0.2 L/min,雾化器速度0.8 L/min。Cu、Zn的测定波长分别为327.393,206.200 nm。
1.6 抑菌率计算记录产酸产气试管数,对照《生活饮用水标准检验方法微生物指标》(GB/T 5750.12-2006)[8]中的总大肠菌群MPN检索表,计算各组的抑菌率。其中抑菌率的公式为:
| $ {\rm{R}} = \frac{{{{\rm{A}}_0} - {{\rm{A}}_{\rm{t}}}}}{{{{\rm{A}}_0}}} \times 100\% $ |
式中:R—抑菌率,%;
A0—实验组0 h MPN值;
At—实验组t h MPN值
1.7 抑菌效果的判定标准抑菌效果的判定标准参照《抗菌金属材料评价方法》(SN/T 2399-2010)[9]。除容器材料不同,其他相同条件下,抑菌率越高,表示该种材料容器对大肠杆菌的抑菌效果越好。
2 实验结果 2.1 抑菌效果评价大肠杆菌暴露在黄铜容器4 h后,其总大肠菌群从0 h的24 MPN/100 mL降低到17 MPN/100 mL,抑菌率为29.2%(表 1)。随着放置时间延长,总大肠菌群浓度继续降低,并在8 h时降至15 MPN/100 mL,此时抑菌率为37.5%。继续放置至24 h,达到总大肠菌群数不能检出,抑菌率为100%。而经红铜容器处理的大肠杆菌,其4、8、24 h的检测浓度分别为9 MPN/100 mL、4 MPN/100 mL和不能检出,对应的抑菌率分别为62.5%、83.3%和100%。塑料容器中总大肠菌群检测结果显示,塑料容器中总大肠菌群的浓度从7 MPN/100 mL升高到最高的920 MPN/100 mL,没有表现出任何抑菌效应。清水对照组中的总大肠菌群始终未能检出。
| 时间 | 低接种浓度 | 高接种浓度 | |||||||
| 黄铜 | 红铜 | 塑料 | 对照 | 黄铜 | 红铜 | 塑料 | 对照 | ||
| 0 | 24 | 24 | 7 | — | 1 600 | 1 600 | 1 600 | — | |
| 4 | 17 | 9 | 12 | — | 1 600 | 84 | 1 600 | — | |
| 8 | 15 | 4 | 180 | — | 1 600 | 8 | 1 600 | — | |
| 24 | — | — | 280 | — | 23 | — | 1 600 | — | |
| 48 | — | — | 920 | — | — | — | 540 | — | |
| 72 | — | — | 280 | — | — | — | 920 | — | |
| 96 | — | — | 46 | — | — | — | 1 600 | — | |
| 168 | — | — | 26 | — | — | — | 1 600 | — | |
| 注:表中检测值为每100 mL水样中的总大肠菌群数;“—”表示未检出 | |||||||||
在大肠杆菌接种高浓度组,0 h时各实验组的总大肠菌群浓度均为1 600 MPN/100 mL。而在此条件下,两种金属容器也表现出了不同的抑菌效果。其中,红铜容器4、8和24 h抑菌率分别达到94.75%、99.5%和100%。而黄铜容器在4、8 h均无明显的抑菌效果,直到24 h才呈现了较强的抑菌效果,其24 h抑菌率为98.6%,并从48 h开始达到总大肠菌群无检出。在塑料容器中接种高浓度大肠杆菌,其MPN值变化不明显。0 h检测浓度为1 600 MPN/100 mL, 168 h时其检测浓度不变。第二次实验的清水对照组中结果与第一次相同,即总大肠菌群始终不能检出。
2.2 金属溶出Cu、Zn在两种铜制容器中的溶出质量浓度变化趋势各不相同。黄铜容器中Cu溶出现象并不明显,其变化范围为0.02~0.04 mg/L,无明显的时间质量浓度变化规律。而在红铜容器中,Cu显著溶出。经168 h放置,其质量浓度从0.015 mg/L升高至0.838 mg/L,并与放置时间呈明显的正相关(图 1)。
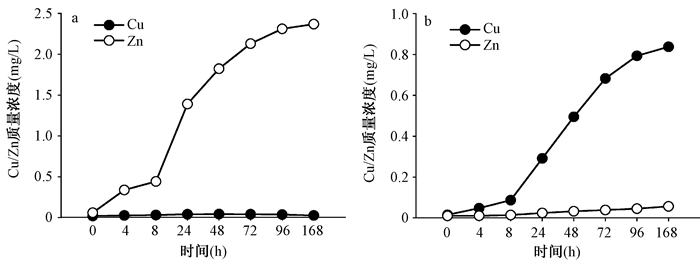
|
| 图 1 大肠杆菌接种低浓度下的铜制容器的金属溶出(a.黄铜容器;b.红铜容器) |
Zn在黄铜容器中的质量浓度随放置时间的延长而逐步增加,从0.06 mg/L升高至2.37 mg/L。而在红铜容器中,Zn质量浓度略有上升,由最初的0.01 mg/L,上升至0.05 mg/L,但与黄铜容器比较,析出并不明显。
Cu溶出现象在高大肠杆菌接种浓度组也无明显规律。在168 h的实验周期内,其浓度变化范围为0.01~0.04 mg/L。而在红铜容器中,Cu的溶出浓度随水样放置时间的延长而呈逐渐升高趋势。经168 h放置,质量从0.004 mg/L升高至0.796 mg/L,并与时间呈现明显的正相关性(图 2a)。Zn在黄铜容器中的溶出质量浓度与放置时间呈正相关关系,168 h后其质量浓度从0.012 mg/L升高至1.459 mg/L。而在红铜容器中,Zn质量浓度变化不太明显,其质量浓度范围为0.01~0.04 mg/L(图 2b)。
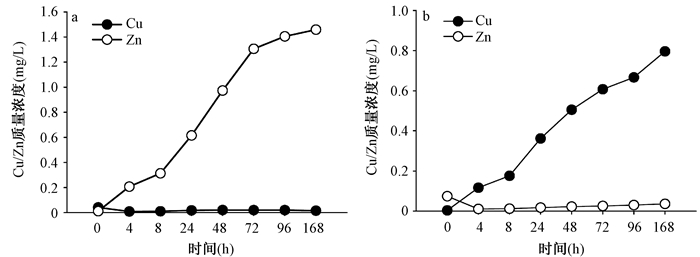
|
| 图 2 大肠杆菌接种高浓度下的铜制容器的金属溶出(a.黄铜容器;b.红铜容器) |
3 讨论
两种铜制容器都有一定的抗菌效果,且在相同的自然条件下,红铜容器对大肠杆菌的抑制效果优于黄铜容器,其原因可能与不同铜制容器的金属溶出种类有关。同时,分析金属溶出数据,认为Zn可能在黄铜容器的抗菌作用中起主导作用,而Cu可能在红铜容器的抗菌作用中起主要作用。该结果也提示针对大肠杆菌,金属Cu可能比金属Zn具备的更好的抗菌效应。目前,虽然已经掌握Cu、Zn金属的抗菌机理,但针对Cu、Zn等金属容器的抗菌效率的评价工作仍有待完善[10]。塑料容器中总大肠菌群的浓度不仅没有出现降低的情况,而且在有的情况下浓度反而增加,表明塑料容器对大肠杆菌没有抑制效果。
在红铜容器中,高接种浓度组4 h的抑菌率(94.75%)显著高于低接种浓度组(62.5%),与Cu的溶出质量浓度呈正相关关系,说明Cu的溶出质量浓度与大肠杆菌抑菌率相关,其溶出浓度越高,其抗菌效果越明显。而在黄铜容器中,低接种浓度组4 h的抑菌率显著高于高接种浓度组,其原因可能与Zn的溶出质量浓度相关,也进一步说明Cu和Zn的抑菌效果具有浓度剂量效应关系。
比较分析两次实验的金属溶出质量浓度,发现红铜容器中Cu金属的溶出质量浓度差异并不明显,说明红铜容器中Cu溶出稳定。而黄铜容器中Zn溶出浓度呈现不同的差异,说明Zn的溶出并不稳定。导致这一现象的主要原因可能是高浓度大肠杆菌影响铜锌合金的氧化还原电位,进而影响Zn的溶出。
由于地理条件和文化因素差异,在我国藏区、新疆、蒙古等地广泛使用铜制容器储存生活用水,所以合理的储水方式对保护当地居民的身体健康至关重要。本实验中,两种容器在低浓度大肠杆菌污染情况下,24 h即可达到100%的抑制率。表明在供水卫生条件较差的地区,铜制容器有利于降低饮用水中由微生物污染而引起的健康风险。
| [1] | 杨靖安, 张俊英, 李春芝. 铜及其氧化物薄膜对大肠杆菌的强抑制作用[J]. 功能材料, 2012, 43(3): 398–400. |
| [2] | 赵瑜. 西藏农村生活饮用水微生物污染状况调查分析[J]. 西藏科技, 2009, 10: 26–28. doi: 10.3969/j.issn.1004-3403.2009.02.009 |
| [3] | 杨斌, 王帅, 符致效, 等. 海南省农村生活饮用水卫生现状调查[J]. 中国公共卫生, 2011, 27(2): 131–133. doi: 10.11847/zgggws2011-27-02-02 |
| [4] | 南黎, 刘永前, 杨伟超, 等. 含铜抗菌不锈钢的抗菌特性研究[J]. 金属学报, 2007, 10: 1065–1070. doi: 10.3321/j.issn:0412-1961.2007.10.011 |
| [5] | 潘力军, 王友斌, 王俊起. 贴膜法评价天然抗菌材料铜抗菌性能的影响因素研究[J]. 中国卫生工程学, 2010(4): 243–245. |
| [6] | 任书霞, 韩海军, 田秀淑, 等. 载铜无机抗菌剂的制备及性能[J]. 硅酸盐通报, 2009, 28(4): 810–813. |
| [7] | 杨伟超, 南黎, 李慧, 等. 含铜抗菌不锈钢的抗菌性能研究[J]. 微生物学杂志, 2009, 3: 1–5. doi: 10.3969/j.issn.1005-7021.2009.01.001 |
| [8] | 中华人民共和国卫生部, 中国国家标准化管理委员会. GB/T 5750. 12-2006生活饮用水标准检验方法微生指标[S]. 北京: 中国标准出版社, 2007. |
| [9] | 中华人民共和国国家质量监督检疫检疫总局. SN/T 2399-2010抗菌金属材料评价方法[S]. 北京: 中国标准出版社, 2010. |
| [10] | 王友斌, 潘力军, 薛金荣, 等. 振荡法评价金属材料抗菌性能研究初探[J]. 中国卫生工程学, 2010, 6: 133–136. |


