2. 内蒙古民族大学生命科学学院
代森锌,又名帕什特(zineb),是一种保护性杀菌剂,属二硫代氨基甲酸盐类农药,代森锌纯品为灰白色粉末,工业品为淡黄色粉末,有硫磺气味。在高温、潮湿、碱性、日光照晒条件下不稳定。对人畜低毒,但对人的鼻、咽喉、皮肤有刺激作用,对植物安全无污染。剂型有60%、65%和80%可湿性粉剂,4%粉剂,主要用于瓜田和菜田作物、葡萄园及果树喷洒[1],防治花生叶斑病、松针枯病[2],抑制西瓜炭疽病[3],对于增加瓜类收获量,防治蔬菜及谷物病虫害具有很好的作用,1947年美国应用的所有杀菌剂中,代森锌占第一位[4]。
目前代森类农药(代森锌、代森锰、代森锰锌等)的广泛使用,已对生态环境造成破坏,且通过食物链对人和动物的健康构成危害。代森锌中毒可导致动物的胃肠道及实质性器官发生变化,也有体内和体外实验证明,代森锌对于包括人在内的温血动物具有致突变性[5],代森锌能够引起大鼠骨髓细胞染色体的畸变[6],其类型主要是断裂和裂隙,并呈现出一定剂量效应。代森类农药在光照、潮湿、有氧等不稳定条件下,分解成乙撑硫脲(ETU),ETU会导致人体甲状腺肿瘤[7]。尤其是在食品加工过程中,食用植物中所含的代森类农药残留物,会因受热而转化成毒性高的乙撑硫脲,因而代森类农药在环境中,尤其在食用作物上的残留动态引起人们的关注[8]。
斑马鱼是一种小型热带鱼,具有以下特点:① 产卵量大、全年可多次产卵;② 早期胚胎发育迅速、孵化时间大约在2~3 d;③ 胚胎通体透明,便于在显微镜下直接观察;④ 已知基因较多,基因组计划已基本完成[9]。
本研究将以斑马鱼早期胚胎作为实验动物模型,探讨代森锌所引起胚胎脊索及其软骨的影响,为食品及环境安全研究提供理论参考。
1 材料与方法 1.1 试剂农药代森锌(zineb,纯度98%),溶媒二甲基亚砜(dimethyl sulfoxide,DMSO,纯度≥ 99.5%)购买于Sigma公司。
1.2 实验动物及暴露方法斑马鱼(AB系)饲养于玻璃缸中,水温控制在28℃,光照周期设定为光暗比为14 h:10 h。实验用鱼采用2:1的雌雄比例配比放置于繁殖鱼缸中,第二日收集鱼卵后在显微镜下挑选发育一致的良好受精卵。受精后3 h(3 hpf),在3 cm的培养皿中染毒。将代森锌溶于DMSO中,染毒时,取3 μL染毒液放入3 mL带有受精卵的培养液中,DMSO的最终浓度为0.1%,置于28.5℃孵化箱内孵化,直至需要的时间,停止孵化,进行形态学观察或抗体染色试验。实验设置8个染毒组以及一个对照组,染毒组最低浓度为0.0025 μmol/L,依次递增为0.005、0.01、0.02、0.03、0.05、0.1和1.0 μmol/L,每个实验组中放置10个优良受精卵,每个染毒浓度以及对照组进行3次平行实验。
1.3 软骨染色基本染色方法与Teraoak等相同[10],用10 %的中性甲醛对斑马鱼胚胎固定30~60 min,然后用自来水冲洗2次,每次30 min。再用Alcian Blue 8GR染色6 h,之后用90 %酒精、70 %酒精、50 %酒精、蒸馏水各浸泡2 h。蒸馏水吸出后,用胰蛋白酶消化液消化20~30 min,再加3 %双氧水+0.5%KOH没过胚胎处理1 h,之后要经常观察,直到完全透明。用水清洗处理后的斑马鱼胚胎,在1mL 70%的甘油溶液中进行保存,第二天摄影。
1.4 抗体染色斑马鱼早期胚胎经过中型甲醛固定(4℃过夜)后,实施脱水包埋以及组织切片。按照Dong等[11]的方法,组织切片经过二甲苯脱蜡以及酒精梯度脱水后,使用流水清洗5~10 min。使用10 μg/mL蛋白酶K消化(37℃,15 min),再次固定清洗后,使用1%马血清没过胚胎封闭60 min。单克隆抗体二型胶原蛋白(collagen 2) 的稀释倍率是1:100,在4℃条件下反应过夜。第二日清洗后加入抗小鼠抗体(第二抗体),在室温条件下反应2 h,之后使用ABC试剂盒(vectar lab)着色,对比染色采用甲基氯染色液。
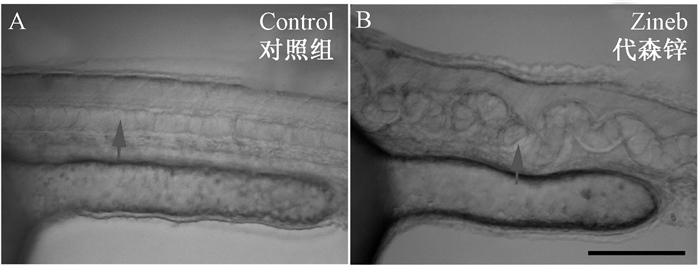
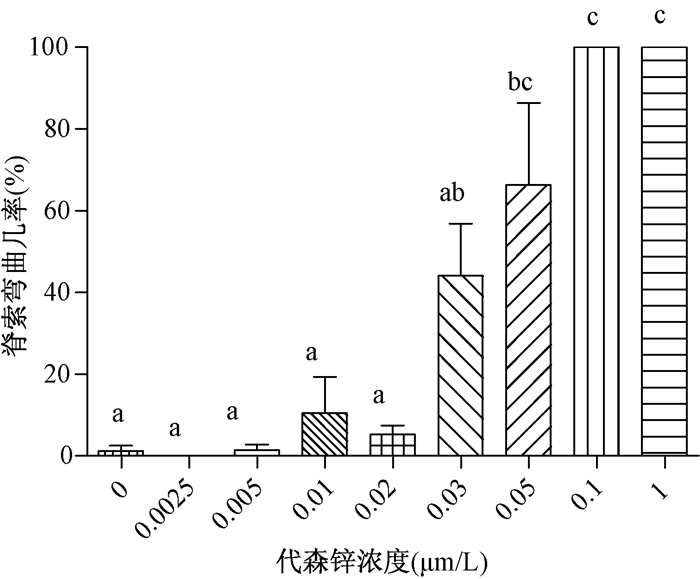
2 结果 2.1 代森锌引起的形态学变化实验设置了0.0025、0.005、0.01、0.02、0.03、0.05、0.1和1.0 μmol/L等8个代森锌染毒组,染毒组引起的死亡率与对照组相比较,差异没有统计学意义(P>0.05)。但其所引起的畸形率(主要是脊索的弯曲)分别是1.42%,10.5%,5.27%,26.25%,44.11%,66.25%,100%和100%。其中0.05,0.1和1 μmol/L代森锌染毒引起体节和脊索的波状弯曲是差异极显著的(图 1和图 2)。代森锌引起的此类变化与农药福美双(秋兰姆)的形态学变化极其类似,但有关毒性机制还有待进一步探讨。
|
| 注:于3 hpf给斑马鱼胚胎实施染毒到24 hpf清洗后进行形态学观察。A是对照组;B是0.05 μmol/L代森锌染毒组;A、B中的箭头表示中部脊索。比例尺为100 μm 图 1 代森锌诱导斑马鱼早期胚胎脊索麻花状弯曲 |
|
| 注:给3 hpf斑马鱼胚胎使用0.0025~1 μmol/L的代森锌染毒在24 hpf水洗计数 图 2 不同摩尔浓度代森锌引起波状弯曲的百分率 |
2.2 软骨染色
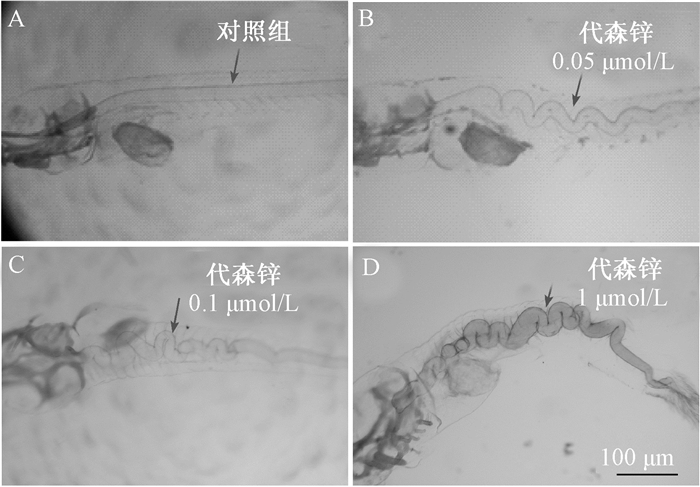
为进一步确认脊索引起的弯曲与变化,实验在3 hpf使用代森锌染毒,在染毒后96 hpf实施软骨染色,结果表明对照组的脊索呈现均一的直线状态,而0.05 μmol/L代森锌染毒引起脊索锯齿状弯曲,随着染毒浓度的增加(0.1和1 μmol/L)软骨的弯曲程也逐渐增大。头部软骨没有明显的变化(图 3)。
|
| 注:给3 hpf斑马鱼胚胎染毒,至24 hpf清洗继续培育到96 hpf后染色观察,A:对照组;B、C、D分别是0.05、0.1和1 μmol/L代森锌染毒组。箭头表示脊索。比例尺为100 μm 图 3 农药代森锌引起斑马鱼早期胚胎软骨发育障碍 |
2.3 代森锌对斑马鱼胚胎二型胶原蛋白的影响
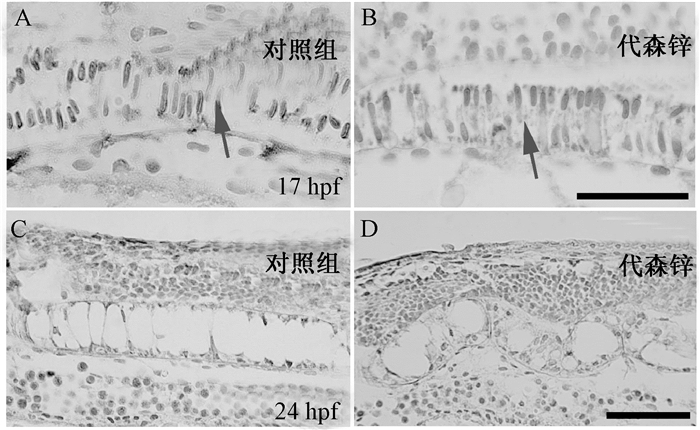
胶原蛋白在软骨发育中有重要地位,在17 hpf发现二型胶原蛋白在脊索部位有表达,0.05 μmol/L代森锌染毒组与对照组进行比较,没有发现明显的变化。而在24 hpf,几乎没有检测出胶原蛋白的表达(图 4)。
|
| 注:A、C是对照组(分别是17 hpf和24 hpf胚胎);B、D是0.05 μmol/L代森锌染毒组(分别是17 hpf和24 hpf胚胎),箭头指示脊索。比例尺为100 μm 图 4 代森锌对斑马鱼初期胚胎二型胶原蛋白表达的影响 |
3 讨论
基于代森锌在水果和谷物病虫害防治中的广泛应用[1-4],农药残留已成为世界各国关注热点,美国和英国均建议减少代森类农药的使用量及使用次数,以达到降低其残留量的目的。2013年7月24日,美国联邦法典修订对农药代森锰锌Mancozeb的残留限量要求,新增对橘子(Tangerine)的限量要求0.1 g/L,胡桃(Walnut)的限量为0.7 x 10-3g/L。澳大利亚规定了包括代森锌、代森锰锌等61种农产品中的最高残留限量(以二硫代氨基甲酸酯计);我国对食品中85种农药残留做出详细规定,并于2012年4月1日实施,其中包括代森锌,每日允许摄入量为0.03 mg/(kg ·bw),在食品中的最大残留量:芦笋为2 mg/kg,马铃薯0.05 mg/kg;前苏联规定,在日常生活用水中,代森锌最高容许浓度为0.03 mg/L。而本实验发现代森锌在0.1 μmol/L(约等于0.0276 mg/L)时,还没有超过饮用水最高浓度(0.03 mg/L),斑马鱼胚胎就已经发生了畸形,并且脊索弯曲率达到100%。通过软骨染色,发现这种弯曲在脊索部位的麻花状卷曲,具有非常明显的可辨别性,这为农药的生物学评价提供了清晰思路,尤其是初期的高通量检测提供了理论基础。而代森锌的毒性机制,本研究并没有发现其引起与软骨发育密切相关的二型胶原蛋白的显著变化,有关毒性机制有待于进一步研究。
通过本次试验得出代森锌染毒引起斑马鱼脊索特异的弯曲,这种弯曲具有清晰的可辨别性,毒性起因与胶原蛋白无明显关联。实验进一步说明使用斑马鱼作为生物学评价模型具有重要理论意义。
4 结论农药代森锌引起斑马鱼早期胚胎脊索麻花状弯曲,这种弯曲的比例与浓度正相关。代森锌(0.05 μmol/L)染毒对斑马鱼初期胚胎二型胶原蛋白水平的表达没有显著的影响。
| [1] | 王艳丽. 代森锰锌及其代谢产物ETU在几种农产品中的残留检测研究[D]. 湖南农业大学, 2011年. http://cdmd.cnki.com.cn/Article/CDMD-10537-1012298463.htm |
| [2] | 聂亚芳. 代森锌在防治松针枯病中的应用[J]. 园林植物保护, 2009(12): 52–54. |
| [3] | 赵杰, 顾贫博. 代森锌和代森锰锌对西瓜炭疽病菌的毒力测定和防效[J]. 上海农业科技, 2008(4): 25. |
| [4] | 姚浩然. 杀菌剂-代森锌的介绍[J]. 农业科学通讯, 1957(11): 655–656. |
| [5] | 孙丽津. 代森锌的残留、代谢和毒性[J]. 农药译丛, 1984, 6(1): 51–53. |
| [6] | 陈玉莉, 张玉芝, 杨洪仁. 农药代森锌对大鼠骨髓细胞染色体的影响[J]. 化工劳动保护, 1987(2): 34–35. |
| [7] | 任铁真, 岳永德. 乙撑硫脲的降解和残留分析研究[J]. 安徽农业大学学报, 2001, 28(3): 242–245. |
| [8] | 莫汉宏, 安凤春, 张连仲. 代森锌杀菌剂在西红柿、茄子和土壤中的残留动态[J]. 环境科学, 1984, 9(4): 41–45. |
| [9] | Teraoka H, Dong W, Hiraga T. Zebrafish as a novel experimental model for developmental toxicology[J]. Congenit Anom Kyoto, 2003, 43: 23–32. |
| [10] | Teraoka H, Dong W, Ogawa S, et al. 2, 3, 7, 8-Tetrachlorodibenzo-p-dioxin toxicity in the zebrafish embryo:altered regional blood flow and impaired lower jaw development[J]. Toxicol Sci, 2002, 65(2): 192–199. doi: 10.1093/toxsci/65.2.192 |
| [11] | Dong W, Hinton DE, Kullman SW. TCDD disrupts hypural skeletogenesis during medaka embryonic development[J]. Toxicol Sci, 2012, 125(1): 91–104. doi: 10.1093/toxsci/kfr284 |



