2. 重庆医科大学体育工作部
随着人们生活水平的不断提高,社会人口老龄化问题逐渐凸显;与老龄化有关的神经退行性疾病如阿尔茨海默病、帕金森综合征等的发病率逐年增加,其主要表现为认知功能障碍、运动功能受损,严重影响患者的生活质量,同时给家庭及社会带来沉重的负担,因其发病机制不明已成为公众及学术界关注的焦点。三甲基氯化锡(trimethyltin chloride, TMT)是一种无铅塑料稳定剂生产过程中伴生的副产物,广泛存在于油漆、农药、杀虫剂、灭菌剂等;TMT是一种神经毒物,目前认为TMT可能与神经退行性疾病的发生有关[1],但具体机制尚不明确。有研究报道,跑台及游泳训练有助于学习记忆能力的增强[2-3],长期游泳能提高衰老大鼠的学习记忆能力[4-5], 运动训练能显著改善记忆能力障碍模型小鼠的学习记忆能力[6]。但运动训练对TMT致记忆障碍模型小鼠学习记忆能力影响的研究鲜见报道,本文就游泳训练对TMT致记忆障碍模型小鼠学习记忆能力的影响及机制进行探讨,为研究适宜运动改善学习记忆能力障碍的作用提供参考。
1 材料与方法 1.1 主要试剂三甲基氯化锡(TMT货号:146498,美国Sigma);生长相关蛋白(GAP-43Ⅰ抗,货号:ab75810,美国Abcam);突触囊泡蛋白(SYPⅠ抗,货号:ab8049,美国Abcam);β-actinⅠ抗(货号:A 2228,美国Sigma);IRDye© 680 RD驴抗兔荧光抗体(红兔Ⅱ抗,货号:926-68073,美国LI-COR);IRDye 800 CW驴抗小鼠荧光抗体(绿鼠Ⅱ抗,货号:926-32212,美国LI-COR)。
1.2 主要仪器Morris水迷宫视频跟踪系统(MT-200,中国成都泰盟);Odyssey红外荧光扫描成像系统(9120,美国LI-COR);多功能酶标仪(Infinite M200,瑞士Tecan)。
1.3 动物及分组60只SPF级6~9周龄雄性BALB/c小鼠(第三军医大学实验动物中心提供,生产许可证:SYXK(渝)2012-0002)。动物饲养温度:(21± 2)℃, 室内光照12 h(光照时间08:00到20:00),动物进食标准基础饲料, 自由进水。实验开始前于实验室适应性喂养1周。随机分为生理盐水组(对照)、TMT组、(生理盐水+训练)组、(TMT+训练)组(前两组各20只,后两组各10只。生理盐水组、TMT组各10只于给药24 h后进行水迷宫试验,即刻处死,用于相关指标的检测(对照试验);生盐水组、TMT组各10只给药后喂养7 d进行水迷宫实验后处死,用于相关指标的检测;生理盐水+训练组、TMT+训练组各10只给药后连续训练7 d,进行水迷宫试验后处死,用于相关指标的检测。TMT组及(TMT+训练)组均给予剂量[7](2.25 mg/kg·BW)的三甲基氯化锡,生理盐水组及(生理盐水+训练)组均给予同体积的生理盐水,各组均1次腹腔注射给药。
1.4 方法 1.4.1 训练方案参照文献[3]的方法略改:玻璃缸游泳池,规格为(180 cm × 60 cm × 80 cm),水深50 cm,水温保持在28~30℃,每日(10:00~12:00;18:00~20:00)训练2次,30 min/次;连续训练7 d。
1.4.2 水迷宫实验Morris水迷宫参照文献[7-8]略改:直径120 cm,平台直径10 cm,水温保持28~30℃,用奶粉使得水变的不透明,平台(直径10 cm)放在任意象限中央(与内圈和外圈相切)并在水下1~2 cm。把小鼠放入水迷宫时将小鼠的头朝水迷宫壁,4个象限的任意1个入水点均可。水迷宫实验前1 d让小鼠在水迷宫中(无平台)自由游1 min/次,共10次,以熟悉水迷宫环境。小鼠最大逃逸潜伏期为60 s,如果在60 s内小鼠没找到并爬上平台则由实验员将其带上平台,并记录时间为60 s,否则记录相应时间xs,每次让小鼠在平台上待15 s。每只小鼠训练的时间间隔为15 min,1 d共完成8次,每次实验结束时将小鼠身上的水擦干并让其在取暖器旁取暖。
1.4.3 Western blot检测参考文献[9]的方法略改:水迷宫实验后,断头处死小鼠,在冰上快速取出海马脑组织,提取总蛋白并测其浓度;经10%SDS-PAGE,80 V恒压分离,用湿转系统将目标蛋白转至NC膜上,电转150 mA;转印结束后,封闭1~3 h;孵育SYPⅠ抗(1:1 000)置于脱色摇床4℃过夜;次日,TBST洗膜5 min×4次,绿鼠Ⅱ抗(1:5 000) 室温下避光孵育1 h,TBST洗膜5 min×4次,同样步骤孵育GAP-43抗体(1:100 000),二抗则为红兔Ⅱ抗(1:5 000);β-actin做内参,β-actin绿鼠Ⅱ抗,Odyssey红外荧光扫描成像系统软件对目标条带荧光光密度比较分析。
1.5 统计分析Morris水迷宫实验逃逸潜伏期和Western blot实验结果,以均数±标准差(x±s)表示,采用SPSS 20.0统计软件进行单因素方差分析或t检验,P<0.05表示有统计学意义。
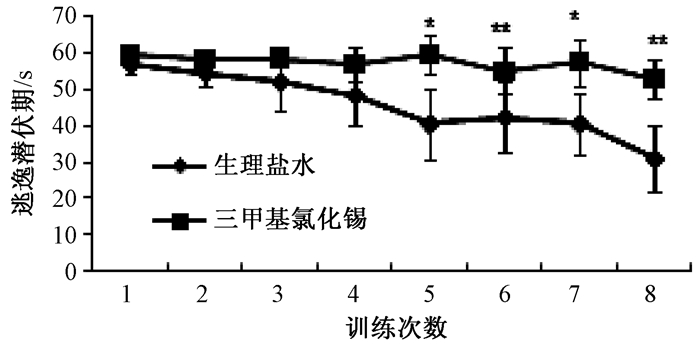
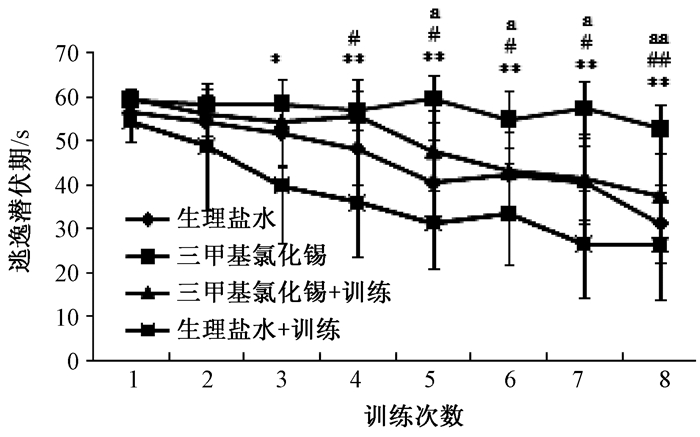
2 结果 2.1 水迷宫实验由图 1可知给药后24 h,水迷宫训练到第5次时起,TMT组的逃逸潜伏期明显较生理盐水组(对照组)显著延长(P<0.05)。连续游泳训练7 d后(图 2),与生理盐水组相比,从水迷宫训练到第4次起,TMT组小鼠逃逸潜伏期明显延长(P<0.05);TMT+训练组较TMT组相比,从水迷宫训练第5次起,前者的逃逸潜伏期逐渐缩短,差异有统计学意义(P<0.05);与生理盐水组及生理盐水+训练组相比,在整个水迷宫训练中,从逃逸潜伏期时间上看TMT+训练组小鼠逃逸潜伏期更长,但差异无统计学意义(P>0.05)。
|
| 注:经单因素方差分析,与三甲基氯化锡组相比,*P<0.05, **P<0.01. 图 1 给药24 h时连续8次训练的逃逸潜伏期结果(x±s, s, n=10) |
|
| 注:经单因素方差分析,三甲基氯化锡组与生理盐水对照组相比#P<0.05, ##P<0.01;三甲基氯化锡组与三甲基氯化锡+训练组相比a P<0.05;三甲基氯化锡组与生理盐水+训练组相比*P<0.05, **P<0.01. 图 2 游泳训练7 d后各组连续8次训练的逃逸潜伏期结果(x±s,s,n=10) |
2.2 Western blot检测
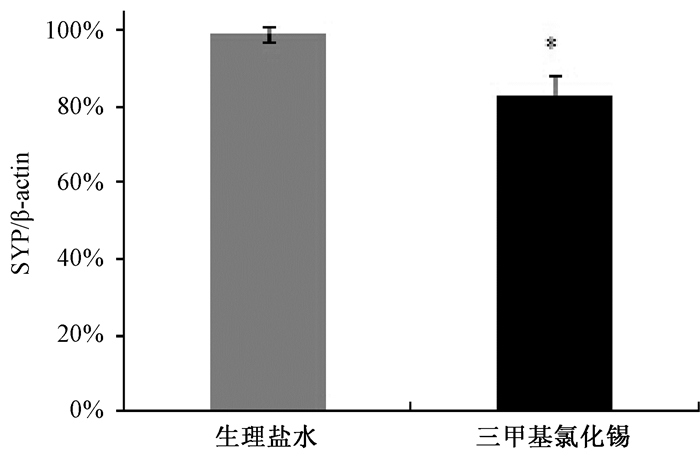
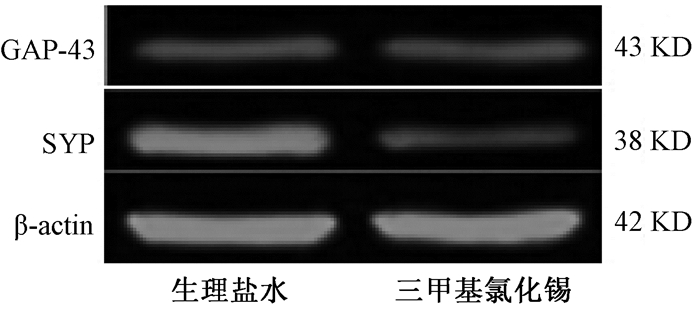
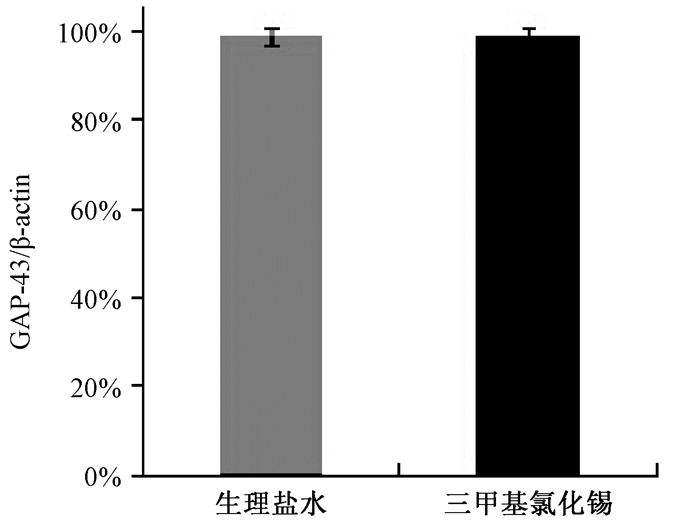
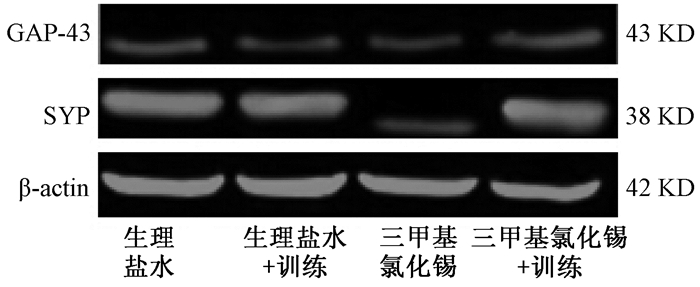
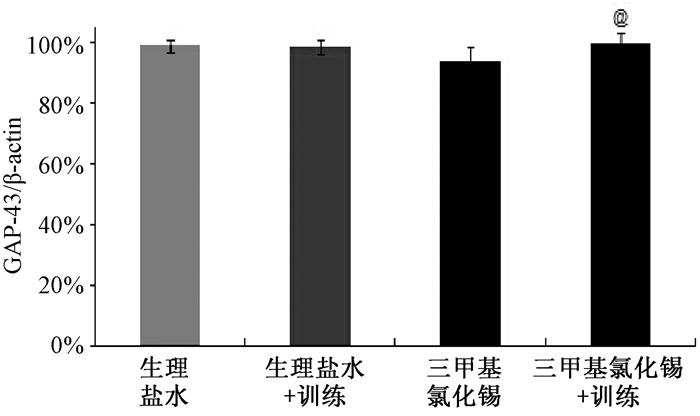
给药后24 h,小鼠海马脑区GAP-43和SYP表达情况(图 3),与生理盐水组相比,TMT组海马脑区SYP表达显著降低(P<0.05),GAP-43表达差异无统计意义(P>0.05;图 3A, B)。给药后第8 d,小鼠海马脑区GAP-43和SYP表达情况(图 4),与TMT组相比,TMT+训练组海马脑区GAP-43表达增加(P<0.05),SYP表达增加(P<0.05;图 4A, 4B);与生理盐水组及生理盐水+训练组相比,TMT+训练组海马脑区的GAP-43表达丰度略大,但差异无统计学意义(P>0.05),TMT+训练组海马脑区的SYP表达差异均无统计学意义(P>0.05)。
|
| 图 3 给药24 h后小鼠海马脑区GAP-43和SYP表达情况 |
|
| 图 3A 给药24 h后小鼠海马脑区GAP-43表达 |
|
| 图 4 游泳训练7 d后各组小鼠海马脑区GAP-43和SYP表达情况 |
|
| 图 4A 经训练7 d后各组小鼠海马脑区GAP-43表达 |
3 讨论
随着社会的不断发展,人们的饮食结构和生活方式逐渐发生改变,与人口老龄化有关的记忆功能或运动功能障碍等神经退行性疾病的发病率逐年升高;学术界对此做了大量研究,但其具体机制尚未定论。TMT是一种神经毒物,可选择性作用于边缘系统,包括与学习记忆能力密切相关的海马脑区,常被用来建立神经退行性疾病模型[10-11]。学习记忆能力作为高等动物的神经行为,其功能障碍的发生与海马等脑区神经元、突触可塑性及相关神经递质的释放过程有关[12];而突触相关蛋白GAP-43及SYP表达与突触可塑性及神经递质的释放过程密切相关,因此这两种蛋白在学习记忆能力增强与功能障碍的过程起重要作用[13],却鲜见这两种重要蛋白在TMT致记忆障碍模型小鼠的作用研究。运动作为抗衰老的重要手段,国内已有大量研究证实适量的运动有助于学习记忆能力的增强[3-5, 14],并且自愿锻炼对TMT损伤海马神经元有保护作用[15];因此,探讨游泳训练在TMT致学习记忆功能障碍中的作用有重要意义。
在本研究中,一次性给予BALB/c小鼠腹腔TMT(2.25 mg/kg)24 h后,水迷宫实验表明:与生理盐水对照组相比,TMT组动物从训练第5次起,其逃逸潜伏期明显延长(P <0.05),表明TMT组小鼠的学习记忆功能发生了障碍,与前期报道[7]一致。TMT中毒多为急性,且经TMT暴露168 h后其逃逸潜伏期较对照组有缩短的趋势[7],与本研究结果不一致,其原因可能与水迷宫逃逸平台大小和训练方式(可见平台和隐藏平台)不同有关。Gabriela等[16]报道一周自动跑圈训练有改善因液压冲击导致脑组织损伤的作用,而这种损伤修复的机理与突触的可塑性及神经元轴突的形态改变有密切关系;Ghiani等[17]将大鼠分别训练3 728 d后,结果提示跑轮训练能减少脊髓损伤后髓磷脂相关糖蛋白表达并有助于正向调节神经生长过程,与学习记忆功能相关的长时程增强密切相关,表明短期训练有改善与学习记忆功能障碍相关的脑损伤作用;本研究探讨TMT暴露致记忆功能障碍小鼠经连续游泳训练7 d后其逃逸潜伏期的变化。连续游泳训练7 d后,与TMT组相比,在相同水迷宫训练次数(TMT+训练)组小鼠的逃逸潜伏期缩短(P<0.05);与生理盐水(对照组)和(生理盐水+训练)组相比,在相同水迷宫训练次数(TMT+训练)组小鼠的逃逸潜伏期在数字上略大,但差异无统计学意义(P>0.05),表明经连续游泳训练后(TMT+训练)组小鼠学习记忆功能有所恢复。
Western blot检测结果表明:一次性腹腔给药TMT(2.25 mg/kg)24 h后,与生理盐水组相比,TMT组海马脑区SYP蛋白表达降低(P <0.05),GAP-43蛋白表达差异无统计学意义(P>0.05);结合水迷宫实验,该时相点TMT组的逃逸潜伏期较生理盐水组显著延长,TMT组小鼠学习记忆功能障碍发生可能与SYP蛋白表达降低有关[18]。经连续游泳训练7 d,与TMT组相比,(TMT+训练)组小鼠海马脑区SYP蛋白表达增加(P <0.05),GAP-43蛋白表达增加;而与生理盐水及生理盐水训练组相比,TMT训练组小鼠海马脑区SYP、GAP-43表达已无显著差异(P>0.05)。表明连续游泳训练7 d后,可以显著提高TMT暴露致海马脑区GAP-43和SYP的表达;结合水迷宫结果,其逃逸潜伏期与生理盐水组相比无统计差异(P>0.05),说明这两种蛋白表达增加与小鼠学习记忆功能恢复有关。与本研究类似的,Ding等[19]用大鼠自愿训练7 d后,发现在大鼠海马脑区脑源性营养因子(BDNF)前体或成熟BDNF表达增加,同时也可以增强纤溶酶原激活物的活性,后者被阻断可直接影响突触相关蛋白GAP-43及SYP的表达。GAP-43表达增高一般出现在神经系统发育期及损伤后的修复期间[20],实验发现与TMT组相比,(TMT+训练)组海马脑区GAP-43表达增高,结合水迷宫实验结果,可以认为TMT训练组小鼠学习记忆能力在恢复。同时出现SYP、GAP-43表达增加表明突触的可塑性发生了变化,可增强学习记忆能力[21]。
本研究结果提示,短时间连续游泳训练可使TMT致记忆障碍模型小鼠恢复其学习记忆能力,并且在海马脑区与学习记忆功能密切相关的蛋白SYP、GAP-43表达增加,这两种重要蛋白表达增加可能是小鼠学习记忆能力恢复的机制之一。
| [1] | Corvino V, Marchese E, Michetti F, et al. Neuroprotective strategies in hippocampal neuro-degeneration induced by the neurotoxicant trimethyltin[J]. Neurochem Res, 2013, 38(2): 240–253. doi: 10.1007/s11064-012-0932-9 |
| [2] | 徐波, 黄涛, 季浏. 跑台训练增强大鼠的学习记忆及其海马BDNF基因表达[J]. 北京体育大学学报, 2011, 34(4): 51–53. |
| [3] | 张春美, 徐波, 杨毅飞. 游泳训练对大鼠空间学习记忆能力及海马、纹状体内c-fos、c-jun mRNA表达的影响[J]. 中国康复医学杂志, 2008, 23(8): 724–728. |
| [4] | 崔建梅, 李小利, 付芳, 等. 游泳运动对衰老大鼠学习记忆、前额叶皮质氨基酸水平及nNOS表达的影响[J]. 吉林大学学报(医学版), 2013, 39(4): 737–742. |
| [5] | 崔建梅, 付芳, 贺继平, 等. 游泳运动对衰老大鼠学习记忆及海马CA1、CA2、DG区nNOS表达的影响[J]. 天津体育学院学报, 2012, 27(6): 529–534. |
| [6] | 赵燕燕, 陈春生, 刘新霞, 等. 运动训练对亚硝酸钠致记忆障碍模型小鼠学习记忆能力的影响[J]. 中国康复医学杂志, 2009, 24(2): 110–112. |
| [7] | Halladay AK, Wilson DT, Wagner GC, et al. Trimethyltin-induced alterations in behavior are linked to changes in PSA-NCAM expression[J]. Neurotoxicology, 2006, 27(2): 137–146. doi: 10.1016/j.neuro.2005.06.005 |
| [8] | Kee N, Teixeira CM, Wang AH, et al. Preferential incorporation of adult-generated granule cells into spatial memory networks in the dentate gyrus[J]. Nat Neurosci, 2007, 10(3): 355–362. doi: 10.1038/nn1847 |
| [9] | Xu ZC, Chen YM, Xu P, et al. Epileptiform discharge upregulates p-ERK1/2, growth-associated protein 43 and synaptophysin in cultured rat hippocampal neurons[J]. Seizure, 2009, 18(10): 680–685. doi: 10.1016/j.seizure.2009.09.004 |
| [10] | Lattanzi W, Corvino V, Di Maria V, et al. Gene expression profiling as a tool to investigate the molecular machinery activated during hippocampal neurodegeneration induced by trimethyltin (TMT) administration[J]. Int J Mol Sci, 2013, 14(8): 16817–16835. doi: 10.3390/ijms140816817 |
| [11] | Corvino V, Marchese E, Giannetti S, et al. The neuroprotective and neurogenic effects of neuropeptide Y administration in an animal model of hippocampal neurodegeneration and temporal lobe epilepsy induced by trimethyltin[J]. J Neurochem, 2012, 122(2): 415–426. doi: 10.1111/jnc.2012.122.issue-2 |
| [12] | Lai KO, Wong AS, Cheung MC, et al. TrkB phosphorylation by Cdk5 is required for activity-dependent structural plasticity and spatial memory[J]. Nat Neurosci, 2012, 15(11): 1506–1515. doi: 10.1038/nn.3237 |
| [13] | Zhao Y, Wang J, Liu C, et al. Progesterone influences postischemic synaptogenesis in the CA1 region of the hippocampus in rats[J]. Synapse, 2011, 65(9): 880–891. doi: 10.1002/syn.v65.9 |
| [14] | 樊振勇, 陈丽娜, 徐琳峰, 等. 运动训练对血管性痴呆大鼠学习记忆能力及大脑皮质区生长相关蛋白-43表达的影响[J]. 中国康复医学杂志, 2010, 25(6): 514–518. |
| [15] | Funk JA, Gohlke J, Kraft AD, et al. Voluntary exercise protects hippocampal neurons from trimethyltin injury: possible role of interleukin-6 to modulate tumor necrosis factor receptor-mediated neurotoxicity[J]. Brain Behav Immun, 2011, 25(6): 1063–1077. doi: 10.1016/j.bbi.2011.03.012 |
| [16] | Chytrova G, Ying Z, Gomez-Pinilla F. Exercise normalizes levels of MAG and Nogo-A growth inhibitors after brain trauma[J]. Eur J Neurosci, 2008, 27(1): 1–11. |
| [17] | Ghiani CA, Ying Z, de Vellis J, et al. Exercise decreases myelin-associated glycoprotein expression in the spinal cord and positively modulates neuronal growth[J]. Glia, 2007, 55(9): 966–975. doi: 10.1002/(ISSN)1098-1136 |
| [18] | Hou Y, Zhou L, Yang QD, et al. Changes in hippocampal synapses and learning-memory abilities in a streptozotocin-treated rat model and intervention by using fasudil hydrochloride[J]. Neuroscience, 2012, 200: 120–129. doi: 10.1016/j.neuroscience.2011.10.030 |
| [19] | Ding Q, Ying Z, Gómez-Pinilla F. Exercise influences hippocampal plasticity by modulating brain-derived neurotrophic factor processing[J]. Neuroscience, 2011, 192: 773–780. doi: 10.1016/j.neuroscience.2011.06.032 |
| [20] | Gerin CG, Madueke IC, Perkins T, et al. Combination strategies for repair, plasticity, and regeneration using regulation of gene expression during the chronic phase after spinal cord injury[J]. Synapse, 2011, 65(12): 1255–1281. doi: 10.1002/syn.v65.12 |
| [21] | Wu DM, Lu J, Zheng YL, et al. Purple sweet potato color repairs d-galactose-induced spatial learning and memory impairment by regulating the expression of synaptic proteins[J]. Neurobiol Learn Mem, 2008, 90(1): 19–27. doi: 10.1016/j.nlm.2008.01.010 |