沙门菌属(salmonella)是一群寄生在人类和动物肠道中, 培养特点、生化特性、抗原结构相似的革兰阴性杆菌, 是世界上最常见的引发食源性和水源性疾病爆发的致病菌[1], 也一直居于我国微生物性食物中毒的首位[2-3], 沙门菌食物中毒的发病率很高, 占总食物中毒的40%~60%, 最高达90%[4]。该菌主要通过污染水和食品引起致病, 摄入沙门菌污染的水和食物后, 可能会出现腹泻、发热和腹部绞痛等症状。
现在沙门菌的检测方法主要有PCR、ELISA和细菌培养技术, 虽然这些方法都能满足检测灵敏度和特异性的需求, 但检测耗时较长, 需要几小时或者几天时间才能得出结果, 不适宜于实时检测。生物传感器的出现, 使得在短时间内对致病菌检测成为可能[5-6]。生物传感器[7]是利用生物识别元件特异识别待测物并提供定量或者半定量分析信息的一种装置, 主要包括两部分:生物识别元件和信号转导元件。生物识别元件是生物传感器的核心元件, 他主要用来识别目标分析物并与之发生生物学反应, 信号转换元件将生物学反应信号通过一系列的转换变成直观可读的电信号, 使用生物传感器可以对低浓度的致病微生物和微量毒素进行检测[8-9]。在水源性和食源性致病菌检测方面, 生物传感器检测方法近年来呈现逐渐上升的趋势[10], 应用比较多的传感器有表面等离子体生物传感器、光纤生物传感器和电化学生物传感器, 检测时间从20 min~2 h[11-13], 其中光纤倏逝波生物传感器具有响应时间短、使用寿命久、操作稳定等优点。本文使用光纤倏逝波生物传感器采用双抗体夹心免疫反应建立沙门菌的快速检测方法, 同时对方法的灵敏度和特异性进行评价, 旨在为建立一种快速、简便、准确的沙门菌的实时检测方法提供基础数据, 同时为其他水源性和食源性致病菌提供一种快速检测技术平台。
1 材料与方法 1.1 仪器与试剂PR610-2光纤倏逝波荧光免疫生物传感器、光纤(美国Research Intelnational公司), 压力蒸汽灭菌锅(日本三洋公司)、Idexx定量程控封口机(美国Biostron)、台式紫外灯(北京博士创有限公司)、磁力搅拌器(金坛白塔仪器厂), 紫外分光光度计(北京普析通用公司), 恒温培养箱(德国MMM公司), 全自动微生物生化鉴定系统VITEK 2(法国梅里埃)。
异丙醇、氯化钠(国药集团化学试剂有限公司), 碳酸钠、磷酸二氢钾、氯化钾(北京化工厂), 碳酸氢钠(中国医药公司), 磷酸氢二钠(北京精求化工有限责任公司), 以上化学试剂均为分析纯。营养琼脂、EC肉汤、伊红美兰琼脂、缓冲蛋白胨水、四硫磺酸钠煌绿增菌液、亚硒酸盐胱氨酸增菌液、木糖赖氨酸脱氧胆盐琼脂、赖氨酸脱羧酶试验培养基(北京路桥技术有限责任公司), 亚硫酸铋琼脂、三糖铁琼脂(美国Oxiod公司)。链霉亲和素、TritonTM X-100、牛血清白蛋白(BSA)、Alexa Fluor 647荧光素抗体标记试剂盒(美国sigma公司), 生物素标记的兔抗沙门菌多克隆抗体(捕获抗体)(英国Abcam公司), 兔抗沙门菌多克隆抗体(检测抗体)(美国Genway公司), 酶底物试剂(美国科立得)。
1.2 实验菌株肠炎沙门菌(CMCC 50041)、鼠伤寒沙门菌(ATCC 14028)、猪霍乱沙门菌(CGMCC1.1859)、山夫登堡沙门菌(环境检出)、纽波特沙门菌(环境检出)、痢疾志贺菌(CMCC 51057)、福氏志贺菌(CMCC 51075)、大肠埃希菌(ATCC 25922)、金黄色葡萄球菌(ATCC25923) 为本实验室保存。德尔卑沙门菌(CMCC 50719)、甲型副伤寒沙门菌(CMCC 50670)、鸭沙门菌(CMCC 50774) 由国家食品安全风险评估中心微生物实验室提供。
1.3 光纤将异丙醇清洗过的光纤置于装有100 μg/mL的链霉亲和素玻璃毛细管内, 4℃过夜, 用生物素标记的捕获抗体继续室温下孵育1 h, 之后放入装有1%BSA封闭液的玻璃毛细管中, 室温下孵育1 h, 4℃保存备用, 处理后的光纤保存3个月不影响其使用。
1.4 实验条件的选择设置捕获抗体与样品的孵育时间为10 min, 抗原抗体反应体系与检测抗体的孵育时间为10 min, 配置浓度为108cfu/mL的肠炎沙门菌液为检测样品。检测抗体浓度20 μg/mL, 捕获抗体浓度为25、50、100、150 μg/mL, 确定实验使用的最佳捕获抗体浓度。当捕获抗体浓度为100 μg/mL, 检测抗体浓度为10、20、30、40、50 μg/mL, 确定实验使用的最佳检测抗体浓度。所有试验重复3次, 结果取其平均值。
1.5 检测结果判定标准检测结果的信号值用SALOD(signal above the limit of detection, 单位为pA)表示, 当样品检测结果SALOD>0同时大于阴性对照的SALOD时, 可确定为阳性结果, 否则为阴性结果[14]。
1.6 灵敏度与特异度实验配制浓度为5.5×100、5.5×101、5.5×102、5.5×103、5.5×104、5.5×105、5.5×106、5.5×107、5.5×108cfu/mL肠炎沙门菌液, 在实验确定的最优检测条件下选择捕获抗体浓度为100 μg/mL, 检测抗体浓度为40 μg/mL, 设置捕获抗体与样品的孵育时间为10 min, 抗原抗体反应体系与检测抗体的孵育时间为10 min, 记录不同浓度菌液的信号值SALOD。配置浓度为107 cfu/mL的大肠埃希菌、福氏志贺菌、痢疾志贺菌和金黄色葡萄球菌菌液, 捕获抗体浓度为100 μg/mL, 检测抗体浓度为40 μg/mL, 设置捕获抗体与样品的孵育时间为10 min, 抗原抗体反应体系与检测抗体的孵育时间为10 min, 记录不同菌株的信号值SALOD。
1.7 代表性沙门菌实验配制甲型副伤寒沙门菌(A型), 德尔卑沙门菌(B型)、鼠伤寒沙门菌(B型)、猪霍乱沙门菌(C型)、纽波特沙门菌(C型)、肠炎沙门菌(D型)、山夫登堡沙门菌(E型)等菌株的高浓度(107cfu/mL)和低浓度菌液(103cfu/mL、102cfu/mL), 设置捕获抗体与样品的孵育时间为10 min, 抗原抗体反应体系与检测抗体的孵育时间为10 min, 记录不同菌株不同浓度的信号值SALOD。
1.8 环境水样加标检测取北京市河水、湖水, 用《生活饮用水标准检验方法》(GB/T 5750.12–2006)[15]和《食品卫生微生物学检验—沙门菌检验》(GB 4789.4–2010)[16]的方法检测水中的菌落总数、总大肠菌群、大肠埃希菌、耐热大肠菌群和沙门菌, 用确定无沙门菌的水样配制103cfu/mL菌液浓度的水样, 按照上述步骤检测样品, 记录信号值SALOD。
2 结果 2.1 最优抗体浓度捕获抗体浓度为25、50、100和150 μg/mL时信号值SALOD的平均值分别为1 181.1、1 644.7、1 950.9、1 913.0 pA, 当捕获抗体浓度为25、50、100 μg/mL时, 信号值随着抗体浓度的增加逐渐上升, 当抗体浓度增加到150 μg/mL时, 信号值增加不明显, 所以本实验捕获抗体最优浓度为100 μg/mL。检测抗体浓度为10、20、30、40、50 μg/mL时信号值SALOD的平均值分别为216.7、727.9、1 204.5、1 950.9、1 282.2 pA, 当检测抗体浓度为40 μg/mL时, 信号值最明显, 继续增加检测抗体浓度, 信号值降低, 所以本实验检测抗体最优浓度为40μg/mL。
2.2 方法的灵敏度与特异度在最优检测条件下, 对5.5×100、5.5×101、5.5×102、5.5×103、5.5×104、5.5×105、5.5×106、5.5×107、5.5×108cfu/mL肠炎沙门菌菌液进行检测, 结果表明不同菌液浓度所对应的SALOD明显不同, 菌液浓度越高, SALOD越高, 当菌液浓度在5.5×103~5.5×108cfu/mL时有明显信号值, 如图 1所示, 本研究所用的PR610-2型生物传感器最大检测信号值为20 000 PA, 当菌液浓度接近109cfu/mL时, 检测过程中信号值会超过20 000 PA, 超过仪器的最大检测范围, 所以在使用本生物传感器检测沙门菌时, 检测范围是5.5×103~5.5×108cfu/mL, 该方法的最低检出限为5.5×103cfu/mL(标准菌液信号值SALOD为198.1±51.9, 对照信号值SALOD为-139.0±59.5)。不同浓度标准菌液信号值SALOD单因素方差分析结果显示随着菌液浓度的提高, 信号值SALOD不同(P<0.001)。
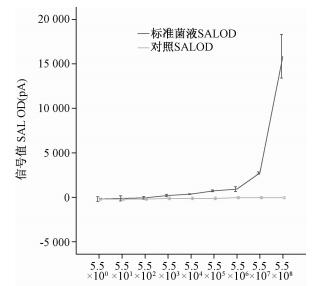
|
| 图 1 沙门菌浓度为5.5×100~5.5×108cfu/mL时的信号值SALOD及其95%CI |
对与沙门菌可能产生交叉反应的大肠埃希菌、福氏志贺菌、痢疾志贺菌和金黄色葡萄球菌检测, 结果如表 1所示。当菌液浓度为107cfu/mL时, 非沙门菌的检测结果SALOD均<0, 均为阴性, 说明此实验方法在检测大肠埃希菌、福氏志贺菌、痢疾志贺菌和金黄色葡萄球菌时无交叉反应, 显示出良好的特异性。
| 细菌名称 | 样品组SALOD(pA) | 对照组SALOD(pA) | 结果 |
| 痢疾志贺菌 | -131.1±66.1 | -25.4 | N |
| 金黄色葡萄球菌 | -407.8±189.9 | -239.4 | N |
| 福氏志贺菌 | -70.9±52.9 | 2.1 | N |
| 大肠埃希菌 | -35.8±45.6 | -9.4 | N |
| 注:N代表阴性结果 | |||
2.3 代表性沙门菌的检测结果
对甲型副伤寒沙门菌(A型), 德尔卑沙门菌(B型)、鼠伤寒沙门菌(B型)、猪霍乱沙门菌(C型)、纽波特沙门菌(C型)、肠炎沙门菌(D型)、山夫登堡沙门菌(E型)等7种代表性沙门菌的高浓度(107cfu/mL)和低浓度菌液(103cfu/mL、102cfu/mL)进行了检测, 用该方法检测沙门菌代表性血清型时, 当菌液浓度为107cfu/mL和103cfu/mL时均能获得明显阳性信号值, 当菌液浓度为102cfu/mL, 甲型副伤寒沙门菌、德尔卑沙门菌得出阳性结果, 其余5种血清型的沙门菌检测结果为阴性(表 2)。由于沙门菌血清型众多, 沙门菌按照共同抗原的不同分为42个群, 对人致病的多为A-E群, 实验结果显示, 本方法适用于沙门菌A-E群致病性血清型的检测。
| 细菌名称 | 107cfu/mL菌液浓度SALOD(pA) | 结果 | 103cfu/mL菌液浓度SALOD(pA) | 结果 | 102cfu/mL菌液浓度SALOD(pA) | 结果 | |||
| 样品 | 对照 | 样品 | 对照 | 样品 | 对照 | ||||
| 肠炎沙门菌 | 2733.0±46.9 | -45.7 | P | 175.8±65.4 | 4.3 | P | -4.5±127.7 | -59 | N |
| 德尔卑沙门菌 | 1173.0±232.6 | -14.8 | P | 210.0±65.9 | 2.3 | P | 64.4±84.5 | -80.7 | P |
| 甲型副伤寒沙门菌 | 2048.1±236.7 | 51.1 | P | 206.1±115.9 | -181.7 | P | 60.9±45.2 | 8.6 | P |
| 纽波特沙门菌 | 246.3±74.9 | 45.2 | P | 18.8±7.4 | -12.5 | P | -13.0±99.7 | -50.7 | N |
| 山夫登堡沙门菌 | 1194.5±223.5 | 5.7 | P | 24.8±20.2 | -38.4 | P | -98.4±62.6 | -69.3 | N |
| 鼠伤寒沙门菌 | 2433.7±159.1 | 50.2 | P | 162.7±53.9 | -50.7 | P | -12.9±21.5 | -21.4 | N |
| 猪霍乱沙门菌 | 2628.2±159.1 | 12.6 | P | 153.7±42.9 | -39.6 | P | -9.3±80.5 | 12.6 | N |
| 注:P代表阳性结果, N代表阴性结果 | |||||||||
2.4 环境水样加标检测
环境水样菌落总数为2.2×102cfu/mL、总大肠菌群为453 MPN/100 mL、大肠埃希菌为10 MPN/100 mL、耐热大肠菌群为350 MPN/100 mL, 沙门菌未检出。测定9个加标水样, 加标后水样中的沙门菌浓度在4.2×103cfu/mL以上时, 样品检测结果为阳性, 表明环境水样中沙门菌浓度高于最低检出限时, 阳性率为100%。加标后水样中的沙门菌浓度在1.6~4.0×103cfu/mL时, 1份样品3次检验结果中有1~2次为阳性结果。实际环境水样中的微生物生态环境复杂, 存在多种非目标菌的干扰, 结果显示该方法在环境水样的快速检测中能够实现较高的灵敏度和特异度。
3 讨论沙门菌依据菌体表面O抗原与H抗原进行血清分型, 不同血清型的菌体表面抗原不完全相同, 与沙门菌多克隆抗体结合的能力也不完全相同, 本实验选用的多克隆抗体, 可以实现对多种沙门菌常见血清型的快速检测, 在实际应用中克服了单一血清型检测范围的问题。在环境水样加标检测中, 当样品中存在多种非目标菌的干扰时, 本方法可以检测出其中的沙门菌, 阴性对照采用未加标的环境水样, 有效避免了假阳性结果的出现。据美国环保局资料显示, 大多数致病菌感染剂量超过103cfu即可导致感染症状[15]。本研究的检出限为5.5×103cfu/mL, 检测结果阳性表明会存在致病菌感染的危险, 所以今后的研究重点是提高检测灵敏度。如采用浓缩富集装置、免疫磁珠富集的方法对水样进行预处理等来提高方法的检出限。
光纤倏逝波生物传感器在微生物检测领域的最大优点是其抗干扰能力强和快速的现场检测能力。倏逝波是激发光在光纤传播过程中发生全内反射时产生的一种场深在μm级的波, 基于倏逝波的这种特性, 用光纤倏逝波生物传感器检测致病菌时, 只有结合到光纤表面的目标物才能被检测到, 未结合到光纤表面的物质不会对检测产生干扰, 而且检测结果为阴性的光纤可以继续使用, 在实际应用过程中, 可以简化传统检测繁复的清洗步骤, 节约检测时间和检测费用。
上述实验结果显示, 本研究建立的光纤生物传感器检测沙门菌的方法显示出了较高的灵敏度和很好的特异性, 响应时间短, 完成一次完整的检测用时为40 min, 大大缩短了检测时间, 是一种监测A-E群致病性沙门菌污染的快速检测方法, 为以后进行沙门菌污染的检测提供技术方法支持, 同时为其他水源性和食源性致病菌提供一种快速检测技术平台。
| [1] | Valadez AM, Lana CA, Tu SI, et al. Evanescent wave fiber optic biosensor for salmonella detection in food[J]. Sensors, 2009, 9(7): 5810–5824. doi: 10.3390/s90705810 |
| [2] | 王章云. 肠炎沙门氏菌引起的食物中毒细菌学调查[J]. 中国人兽共患病杂志, 1999, 15(3): 151–153. |
| [3] | 张代涛, 阚飙. 沙门菌属分子分型技术研究进展[J]. 中国人兽共患病学报, 2009, 29(5): 465–468. |
| [4] | 孙长颢. 营养与食品卫生学[M]. .第6版.北京: 人民卫生出版社, 2008: 422-425. |
| [5] | DeMarco DR, Saaski EW, McCrae DA, et al. Rapid detection of Escherichia coli O157:H7 in ground beef using a fiber-optic biosensor[J]. Journal of Food Production, 1999, 62(7): 711–716. doi: 10.4315/0362-028X-62.7.711 |
| [6] | Miyajima K, Itabashi G, Koshida T, et al. Fluorescence immunoassay using an optical fiber for determination of Dermatophagoidesfarinae (Der f1)[J]. Environ Monit Assess, 2011, 182(1-4): 233–241. doi: 10.1007/s10661-011-1872-6 |
| [7] | Thévenot DR, Toth K, Durst RA, et al. Electrochemical biosensors:recommended definitions and classification (Technical Report)[J]. Pure Appl Chem, 1999, 71(12): 2333–2348. |
| [8] | Nayak M, Kotian A, Marathe S, et al. Detection of microorgams using biosensors-a smarter way towards detection techniques[J]. Biosens Bioelectron, 2009, 25(4): 661–667. doi: 10.1016/j.bios.2009.08.037 |
| [9] | Arora P, Sindhu A, Kaur H, et al. An overview of transducers as platform for the rapid detection of foodborne pathogens[J]. Appl Microbiol Biotechnol, 2013, 97(5): 1829–1840. doi: 10.1007/s00253-013-4692-5 |
| [10] | Lazcka O, Del Campo FJ, MuñozFX. Pathogen detection:a perspective of traditional methods and biosensors[J]. Biosens Bioelectron, 2007, 22(7): 1205–1217. doi: 10.1016/j.bios.2006.06.036 |
| [11] | Leonard P, Hearty S, Quinn J, et al. A generic approach for the detection of whole Listeria monocytogenes cells in contaminated sample using surface Plasmon resonance[J]. Biosens Bioelectron, 2004, 19(10): 1331–1335. doi: 10.1016/j.bios.2003.11.009 |
| [12] | Nanduri V, Kim G, Morgan MT, et al. Antibody immobilization on waveguides using a flow-through system shows improved Listeria monocytogenes detection in an automated fiber optic biosensor:RAPTOR[J]. Sensors, 2006, 6(8): 808–822. doi: 10.3390/s6080808 |
| [13] | Lu Q, Lin H, G eS, et al. Wireless, remote-query, and high sensitivity Escherichia coli O157:H7 biosensor based on the recognition action of concanavalinA[J]. Anal Chem, 2009, 81(14): 5846–5850. doi: 10.1021/ac9008572 |
| [14] | Simpson-Stroot JM, Kearns EA, Stroot PG, et al. Monitoring biosensor capture efficiencies:development of a model using GFP-expressing Escherichia coli O157:H7[J]. Microbiol Methods, 2008, 72(1): 29–37. doi: 10.1016/j.mimet.2007.11.004 |
| [15] | 中华人民共和国卫生部, 中国国家标准化管理委员会. GB/T 5750-2006生活饮用水标准检验方法[S]. 北京: 中国标准出版社, 2007. |
| [16] | 中华人民共和国卫生部. GB 4789-2010食品卫生微生物学检验[S]. 北京: 中国标准出版社, 2010. |
| [17] | Kong RYC, So CL, Law WF, et al. A sensitive and versatile multiplex PCR system for the rapid detection of Enterotoxigenic (ETEC), Enterohaemorrhagic (EHEC) and Enteropathogenic (EPEC) Strains of Escherichia coli[J]. Marine Pollution Bulletin, 1999, 38(12): 1207–1215. doi: 10.1016/S0025-326X(99)00164-2 |



