蚤状溞(daphnia pulex)属于节肢动物门,甲壳纲,枝角类,在水域生态系统中占有重要位置,他们不仅是许多经济鱼类的开口食物,而且可以调节控制轮虫、原生动物、藻类等水生浮游生物种群的发生、发展,并且能够通过孤雌生殖获得纯品系[1]。他们具有生命周期短、个体小、对污染物敏感等特点,是一种较理想的毒性实验的生物材料。在美国,水蚤已被美国国家卫生研究院(NIH)批准为用于环境科学和其他生物学领域研究的一种重要的模式生物[2]。目前,蚤状溞的全部基因组已经完成测序,为进一步研究这一模式物种的生长发育及毒理学机理提供了分子基础[3]。
抗氧化酶系统主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽硫转移酶(GST),他们广泛存在于生物体各种组织中。已有研究发现,当生物体受到重金属、农药及其他污染胁迫时,抗氧化酶系统在胁迫轻微时会被激活,以清除生物体产生的活性氧自由基,降低损伤;但是严重的环境胁迫会降低抗氧化酶活性,引起生物体的氧化应激和氧化损伤,进而对生物体造成伤害[4-6]。因此,抗氧化酶活性变化可反映生物体在亚致死情况下受到的环境影响,近年来在水生动物生态毒理学研究中受到重视。
本实验以蚤状溞为受试生物,研究镉胁迫对其抗氧化酶系统及其生长的影响,探讨以蚤状溞监测重金属污染的可行性,研究结果一方面可为蚤状溞的生态毒理学积累资料,以便于后续研究;另一方面对于修订相关的水质标准及保护水生态系统具有重要的科学意义。
1 材料与方法 1.1 实验材料蚤状溞采自韶关市大塘路池塘,实验室进行5代以上孤雌生殖获得纯品系,选用出生不超过24 h的幼溞进行实验。实验用CdCl2·2.5H2O为国产分析纯试剂。
1.2 实验方法 1.2.1 染毒根据预实验结果设置10个Cd2+浓度梯度(0.00、0.02、0.04、0.08、0.10、0.12、0.14、0.16、0.18 mg/L),每个浓度设置3个平行组。取不同浓度的Cd2+溶液100 mL,置于烧杯中,每杯中放入用双蒸水洗净的试验蚤状溞20只。试验期间不投饵,室内正常光照,室温25℃左右。于24 h和48 h分别记录每一烧杯蚤状溞的死亡数量,用一元线性回归方程法求得24 h和48 h的LC50值分别为0.1 mg/L和0.05 mg/L。
根据急性毒性试验结果,按照24 h LC50的0、1/8、1/4、1/2设置Cd2+染毒浓度,分别为0、0.0125、0.025、0.05 mg/L,每个浓度组投放出生不超过12 h的幼溞60只,每组设置3个平行。实验条件同急性毒性实验。
1.2.2 生长率测定在实验的第48 h、3、5和7 d随机取5只水蚤,在显微镜下测量体长。利用公式(1)[6]计算其生长率:
| $ {{\rm{L}}_{{\rm{Ri}}}} = \left( {{{\rm{L}}_{\rm{i}}} - {{\rm{L}}_0}} \right)/{{\rm{L}}_0} \times 100\% $ | (1) |
式中:LRi-相对生长率,%;
Li-实验期间每天的体长,μm;
L0-初始体长,μm;
1.2.3 安全浓度的测定根据经验公式(2) 计算安全浓度:
| $ 安全浓度\left( {{\rm{mg}}/{\rm{L}}} \right) = \frac{{{\rm{L}}{{\rm{C}}_{50 - 48}} \times 0.3}}{{{{\left( {{\rm{L}}{{\rm{C}}_{50 - 24}}/{\rm{L}}{{\rm{C}}_{50 - 48}}} \right)}^2}}} $ | (2) |
式中:LC50-24-24 h半致死浓度,mg/L;
LC50-24-48 h半致死浓度,mg/L;
LC50-致死中浓度/半致死浓度/半数致死浓度,mg/L。
1.2.4 抗氧化酶活性测定在实验的12、24、48和72 h每浓度组分别随机取10只蚤状溞,冰浴匀浆,4℃、6 000 r/min冷冻离心,取上清液测定其总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和谷胱甘肽硫转移酶(GST)活力,采用南京建成生物工程研究所生产的试剂盒测试,严格按照测试盒说明书操作。蛋白质含量采用考马斯亮兰方法测定。所有酶活力最终均以比活力,即活力单位/毫克蛋白质(U/mg protein)表示。
1.2.5 数据处理利用SPSS 17.0软件进行差异性和显著性检验,采用单因素方差分析(One-Way ANOVA),应用Dunnettn法将染毒组与相应对照组进行比较,显著性水平P < 0.05,数值以平均数±标准差表示。
2 结果 2.1 不同Cd2+浓度对蚤状溞生长率的影响Cd2+对蚤状溞生长率的影响如表 1所示,与对照组相比,低质量浓度(0.0125 mg/L)在短期内(24 h)对蚤状溞的生长有显著的促进作用(P < 0.05),到第3 d,二者达到持平;第5 d开始,低质量浓度组生长率开始低于对照组,但无显著差异(P > 0.05);中、高质量浓度(0.025 mg/L及以上浓度组)与对照组相比,对蚤状溞的生长有显著的抑制作用(P < 0.05),随染毒浓度增大和染毒时间的延长,抑制作用显著增强。
| 时间 | 对照组 | 0.0125(mg/L) | 0.025(mg/L) | 0.05(mg/L) |
| 48 h | 5.59±1.26 | 6.2±0.46* | 2.79±0.22* | 1.26±0.26* |
| 3 d | 8.3±0.70 | 8.68±2.02 | 6.31±0.90* | 1.98±0.30* |
| 5 d | 24.98±5.26 | 21.37±0.48 | 13.53±3.86* | 9.96±0.84* |
| 7 d | 48.65±11.65 | 43.92±7.69 | 37.72±3.52* | 23.96±0.31* |
| 注:表内数值为平均数±标准差,n=3,*表示和对照组相比,差异显著,P < 0.05 | ||||
2.2 不同浓度的Cd2+对蚤状溞抗氧化酶活性的影响
不同浓度的Cd2+对蚤状溞抗氧化酶活性的影响如图 1所示。染毒12 h后检测到各浓度组T-SOD酶活性下降,中、高质量浓度组和对照组相比差异显著(P < 0.05;图 1 a),说明Cd2+对蚤状溞的生理代谢产生影响。低、中质量浓度组24 h后T-SOD酶活性显著升高,72 h时恢复到对照水平(P > 0.05)。高质量浓度处理组T-SOD酶活性则一直低于对照组(P < 0.05)。CAT酶活性变化如图 1 b所示,各浓度组在短时间(12 h)内酶活性都比对照组显著降低(P < 0.05),低质量浓度组24 h时显著高于对照组(P < 0.05),48 h后和对照组差异不显著(P > 0.05)。中质量浓度组在24 h时,酶活力显著升高,随后降低,72 h时显著低于对照组(P < 0.05)。高质量浓度处理组则一直低于对照组(P < 0.05)。
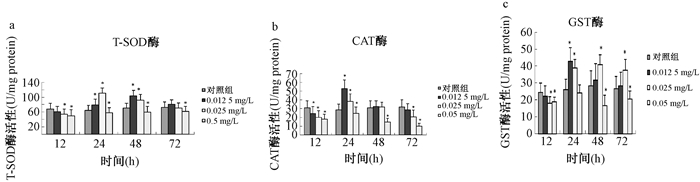
|
| 图 1 不同Cd2+浓度对蚤状溞抗氧化酶活性的影响,*表示和对照组相比,差异显著,P < 0.05 |
GST酶活性变化如图 1 c所示,各浓度组在短时间(12 h)内酶活性都比对照组显著降低(P < 0.05),低质量浓度组24 h时显著升高(P < 0.05),随后恢复到对照组水平(P > 0.05),中质量浓度组从24 h时开始升高,一直到72 h是都高于对照组(P < 0.05),高质量浓度组除24 h时和对照组差异不显著外(P > 0.05),其余时间一直低于对照组(P < 0.05)。
3 讨论随着电镀、电子、化工等工业的快速发展,镉污染日益严重,Cd2+对大多数敏感水生生物(如藻类、浮游动物、鱼类等)具有较强的毒性效应[8-10]。本研究中,Cd2+对蚤状溞24 h的半致死浓度为0.1 mg/L,48 h的半致死浓度为0.05 mg/L。根据安全浓度的经验公式(2) 可计算得出Cd2+对蚤状溞的安全浓度0.00375 mg/L,低于我国《渔业水质标准》(GB 11607-1989)[11]规定的养殖用水中Cd2+最低浓度0.005 mg/L,可见蚤状溞是对镉污染比较敏感的生物,可以选用作为检测环境或者水体镉污染的指示生物。
在亚致死浓度范围内,低浓度的Cd2+在短时间内对蚤状溞的生长有一定的促进作用,即所谓的“毒性兴奋效应”[12],这是蚤状溞在低毒刺激下, 提高自身的新陈代谢, 抵抗外界的毒害作用的表现。如低浓度重金属能够增强安氏伪镖水蚤的摄食活动[13],对中华哲水溞的摄食和排粪也具有积极的促进作用[14]。低浓度的Cu2+和Zn2+,对西藏拟溞存活、生长和生殖亦有一定的促进作用[15]。随着时间的延长,“毒性兴奋效应”减弱,促进作用消失。本实验中,低质量浓度(0.0125 mg/L)的Cd2+对蚤状溞生长的促进作用在实验48 h最为明显,随着时间的延长,促进作用减弱直至消失。在高质量浓度组,Cd2+对蚤状溞的生长表现出较强的抑制作用,随着染毒浓度的增大和染毒时间的延长,这种抑制显著增强。
在无脊椎动物中,抗氧化酶系统中SOD和CAT被认为是最重要的酶,GPX和GST次之[16]。SOD能催化生物体产生的O2-形成H2O2,H2O2再经CAT分解为H2O和CO2,两种酶协同作用,清除活性氧自由基,使机体免受氧化伤害[17]。当生物体受到轻微胁迫时,SOD和CAT酶活性被诱导,以清除机体产生的活性氧自由基;然而严重的胁迫往往超过了生物体自我修复的能力,SOD和CAT酶活性反而会降低。本实验中,低质量浓度的Cd2+诱导蚤状溞SOD和CAT酶活性升高,以保护机体免受氧化损伤;中、高质量浓度的Cd2+已超出了生物体清除活性氧自由基的能力,导致SOD和CAT酶活性降低。
GST酶是生物机体内重要的代谢酶系之一,可催化谷胱甘肽(GSH)与化学物质的亲电基团结合,最终形成硫醚氨酸排出体外,具有消除自由基和解毒的双重功能,其活力的大小可反映机体抗氧化能力的高低[5]。本实验中,低质量浓度组GST酶活性24 h时被诱导,以清除活性氧自由基,随后恢复到对照组水平;中质量浓度组GST酶活性则一直保持较高的水平,说明随染毒浓度增大,生物体需要较长的时间来自我修复;高质量浓度组GST酶活性则一直低于对照组,说明较高质量浓度的Cd2+已超出了生物体自我修复的能力,使其抗氧化能力下降。
4 结论Cd2+对蚤状溞的安全质量浓度为0.00375 mg/L,低于我国《渔业水质标准》(GB 11607-1989)[11]规定的养殖用水中Cd2+最低质量浓度0.005 mg/L,说明蚤状溞是对Cd2+比较敏感的水生生物,可被筛选为监测Cd2+污染的指示生物。
0.0125 mg/L及以下质量浓度的Cd2+所造成的胁迫能够被蚤状溞自身的抗氧化系统修复,不会对机体产生伤害,相反还能刺激机体的新陈代谢。
0.025 mg/L质量浓度的Cd2+使蚤状溞生长率降低,诱导蚤状溞SOD、GST酶活性升高,但CAT酶在72 h时活性显著低于对照组,说明较长时间此浓度的Cd2+胁迫已经抑制了部分抗氧化酶活性,会对生物体产生潜在的伤害。
0.05 mg/L质量浓度的Cd2+胁迫48h即会抑制SOD、CAT及GST的酶活性,对生物体造成潜在的伤害。
| [1] | 陆正和. 蚤状溞繁殖生物学研究[D]. 南京师范大学学位论文, 2012, 南京. http://cdmd.cnki.com.cn/Article/CDMD-10269-1014322141.htm |
| [2] | Francis SC.Model organisms for biomedical research:daphnia[EB/OL].(2011-4-30)[2014-4-25].http://www.nih.gov/science/models/dphnia/index.html. |
| [3] | Colbourne JK, Pfrender ME, Gilbert D, et al. The ecoresponsive genome of daphnia pulex[J]. Science, 2011, 331(6017): 555–561. doi: 10.1126/science.1197761 |
| [4] | 王茜, 张辰佳, 刘占峰, 等. 工业污水对多刺裸腹溞心率、体长和抗氧化酶系的影响[J]. 生态学杂志, 2009, 28(2): 300–303. |
| [5] | 张辰佳, 王兰, 王茜. 3种酚类化合物对多刺裸腹溞GST和AChE活力的影响[J]. 生态毒理学报, 2009, 4(2): 258–264. |
| [6] | 陈志鑫, 朱丽岩, 周浩, 等. Hg(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)对中华哲水蚤总超氧化物歧化酶活性的影响[J]. 渔业科学进展, 2011, 32(1): 99–103. |
| [7] | 路鸿燕, 何志辉. 大庆原油及成品油对蒙古裸腹溞的毒性[J]. 大连水产学院学报, 2000, 35(3): 169–174. |
| [8] | 田丹, 赵文, 王媛, 等. 镉胁迫对两种海洋微藻生长和抗氧化系统的影响[J]. 大连海洋大学学报, 2010, 25(5): 417–421. |
| [9] | 张婷, 张玉, 李德亮, 等. 鲢鱼对环境镉胁迫的生理响应及其对湘江鱼类增殖放流的启示[J]. 中国科学:生命科学, 2013, 43(5): 432–439. |
| [10] | 邵蕾, 黄建国, 袁玲. 重金属镉对三种水溞繁殖能力的影响[J]. 西南大学学报(自然科学版), 2010, 32(3): 102–106. |
| [11] | 国家环境保护局. GB 11607-1989国家渔业水质标准[s]. 北京: 环境保护杂志社, 1989. |
| [12] | Stebbing ADR. Hormes is the stimulation of growth by low levels of inhibitions[J]. Science of the Total Environment, 1982, 2: 213–234. |
| [13] | 石琛, 张君纲, 何学佳, 等. 重金属对安氏伪镖水蚤的急性毒性及摄食的影响[J]. 安徽农业科学, 2011, 39(12): 7265–7269. doi: 10.3969/j.issn.0517-6611.2011.12.127 |
| [14] | 林汝榕, 李少菁. 重金属对桡足类的急性毒性及其对排粪的生理效应[J]. 海洋环境科学, 1991, 7(3): 7–15. |
| [15] | 赵文, 霍元子, 贾旭. Cu2+和Zn2+对西藏拟溞存活、生长和生殖的影响[J]. 水生生物学报, 2010, 34(4): 694–699. |
| [16] | Barata C, Varo I, Navarro JC, et al. Antioxidant enzyme activities and lipid peroxidation in the freshwater cladoceran Daphnia magna exposed to redox cycling compounds[J]. Comparative Biochemistry and Physiology (C), 2005, 140(2): 175–186. |
| [17] | 鲁双庆, 刘少军, 刘红玉, 等. Cu2+对黄鳝肝脏保护酶SOD、CAT、GSH-PX活性的影响[J]. 中国水产科学, 2002, 9(2): 138–141. |



