2. 石家庄市疾病预防控制中心;
3. 河北省疾病预防控制中心
军团菌广泛存在于各种天然和人工水体中,其中嗜肺军团菌是引起人类非典型肺炎的重要病原菌[1-2],可经水源传播,引起爆发流行,在公共卫生上意义重大。但军团菌肺炎缺乏典型临床表现,诊断主要依靠实验室检查。传统的细菌培养,特异性好,但培养难度大、阳性率低,仅为50%~60%[3]。普通PCR、酶联免疫等检测技术,存在检测步骤复杂,耗时长、特异性差的不足,缺乏对环境监测和流行病学调查的必要的敏感性[4]。而尿抗原检测仅能检测LP1型抗原,且无法确定是新近感染还是既往感染[5]。
近年来,实时荧光PCR技术以其敏感性高、特异性强及耗时短等优点得到广泛应用。本研究将军团菌属23S rRNA基因[6]和嗜肺军团菌mip基因[7]特异性相结合,采用TaqMan探针PCR检测技术,建立一种能同时区分军团菌属及嗜肺军团菌种的快速、敏感、污染小的检测方法,可用于环境调查和各基层医院临床标本的检测。
1 材料与方法 1.1 材料 1.1.1 菌株嗜肺军团菌血清1型(legionella pneumophila serogroup 1,LP1,ATCC 33152)、嗜肺军团菌血清3型、5型、部分嗜肺军团菌地方株(未分型)、部分非嗜肺军团菌地方株(未分型);阴性对照肺炎克雷伯菌、产酸克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、大肠杆菌、阴沟肠杆菌、奇异变形杆菌、粪肠球菌、屎肠球菌、金黄色葡萄球菌、肺炎链球菌、弗氏柠檬酸杆菌、空肠弯曲杆菌、脑膜炎奈瑟菌、粘质沙雷菌、阿贡那沙门菌、肠炎沙门菌、副溶血性弧菌为本院实验室提供。
1.1.2 试剂和仪器军团菌培养基基础粉及BCYE生长添加剂(友康基业生物科技北京有限公司);细菌基因组DNA提取试剂盒、各种限制性内切酶、TaqDNA聚合酶和dNTPs(大连Takara公司);琼脂糖和pGEM®-T载体(美国Promega公司);荧光定量PCR仪(TL 988型,西安天隆科技有限公司)。
1.2 方法 1.2.1 菌株培养取ATCC 33152菌株划线接种于军团菌(BCYE)生长培养基上,放入恒温箱,CO2浓度5%,温度37℃,湿度80%,孵育3~5 d。取单个菌株传代培养,培养平皿菌液用于提取DNA。
1.2.2 引物与探针设计选定军团菌属23S rRNA基因,和嗜肺军团菌mip基因的保守序列设计引物和TaqMan探针(表 1)。送上海生工生物工程技术服务有限公司合成。
| 引物和探针名称 | 引物和探针序列 (5′-3′) | 目的片段大小 |
| Leg23SF forward | CCCATGAAGCCCGTTGAA | 92 bp |
| Leg23SR reverse | ACAATCAGCCAATTAGTACGAGTTAGC | |
| Lep23SP FAM-TAMRA | TCCACACCTTGCCTATCAACGTCGTAGT | |
| LmipF forward | AAAGGCATGCAAGACGCTATG | 78 bp |
| LmipR reverse | GAAACTTGTTAAGAACGTCTTTCATTTG | |
| LmipP FAM-TAMRA | TGGCGCTCAATTGGCTTTAACCGA |
1.2.3 DNA模板制备
取菌液1 mL,用细菌基因组DNA提取试剂盒提取DNA,作为模板。
1.2.4 嗜肺军团菌的稀释与计数取菌量为n×108 cfu/mL(用活菌计数办法估算)的LP1菌液,10倍系列稀释,用各浓度稀释液100 μL涂布培养基,每稀释度做3个平皿,培养5 d后计数。同时取不同稀释度的菌液各1 mL,提取DNA为模板,用做PCR敏感性试验。
1.2.5 标准质粒的构建以ATCC 33152菌株为模板,分别扩增23S rRNA、mip目的基因,PCR产物纯化回收,连接至pGEM®-T载体,挑取阳性克隆转化至DH5a大肠杆菌中,经蓝白筛选,选择合适菌落提取质粒DNA进行酶切及序列测定,鉴定插入序列,并测定质粒DNA浓度,进行拷贝数的换算。构建2个标准质粒:pUC-Lp-23S、pUC-Lp-mip。
1.2.6 TaqMan探针PCR实验条件的优化PCR反应时同一模板按2个引物各自反应体系分别配制,双管同时检测,反应条件相同。因TaKaRa公司的荧光定量PCR试剂反应预混液已为最优化,所以本研究对引物和探针用量、热循环参数进行优化,以达到最佳扩增效率。
1.2.7 荧光定量PCR方法验证 1.2.7.1 敏感性检验分别取梯度含量的质粒标准品进行方法敏感性检测,每个PCR反应中标准品质粒拷贝数依次为100~106个。同时,将1×106 cfu/mL的菌液提取DNA,对不同稀释度进行方法敏感性评价。
1.2.7.2 特异性检验对6株嗜肺军团菌、6株非嗜肺军团菌及18株其他菌株提取DNA,验证方法的特异性。
1.2.7.3 重复性检验取3个不同稀释度质粒标准品,对每个稀释度作3次重复检测,计算Ct值的变异系数(Cv)验证检测体系的稳定性。
1.2.8 PCR阳性结果判定 1.2.8.1 普通PCR电泳条带明显者为阳性,不明显者为阴性。
1.2.8.2 荧光定量PCRCt值小于35且扩增曲线良好可直接判定为阳性,Ct值35~37之间需要重复实验,2次实验均能得到良好S型扩增曲线方可判定为阳性。
1.2.9 环境水样及痰样的处理 1.2.9.1 环境水样的处理取环境水样500 mL,无菌滤纸过滤后,用装有0.3 μm孔径醋酸纤维滤膜的过滤器过滤,剪去滤膜的外围受压部分,将膜转移到灭菌塑料离心管内,加入2 mL灭菌蒸馏水,充分振荡,取1 mL,用试剂盒提取DNA,共35份水样。同时另取同样的水样500 mL送石家庄市疾病预防控制中心做军团菌的菌培养,共35份。
1.2.9.2 模拟痰样的处理刮取适量LP1菌落于1 mL无菌蒸馏水中,以10倍系列稀释法制成不同浓度的细菌悬液,做活菌计数。将不同浓度的LP1 细菌悬液加入到TaqMan探针PCR结果阴性的临床标本中制成模拟痰标本。Saccomanno液与DTT液等体积混合,1~2倍体积加入到模拟痰样中,震荡液化30 min。用试剂盒提取DNA。
1.2.9.3 临床痰样的处理Saccomanno液与DTT液等体积混合液按上述方法处理痰样及制备DNA。
2 结果 2.1 PCR最优反应体系和优化的反应条件最优反应体系见表 2,总反应体积为25 μL(冰上配置)。
| 试剂 | 23S rRNA基因检测 | mip基因检测 |
| 2×Premix Ex TaqTM | 12.5 μl | 12.5 μl |
| 上游引物 | 0.5 μl | 0.7 μl |
| 下游引物 | 0.5 μl | 0.7 μl |
| 探针 | 1.0 μl | 1.0 μl |
| 模板 | 2.0 μl | 2.0 μl |
| ddH2O | 8.5 μl | 8.1 μl |
| 注:优化的反应条件为:95℃ 2 min,1个循环;95℃ 5 s,60℃ 30 s,40个循环 | ||
2.2 灵敏度 2.2.1 标准质粒灵敏度
不同稀释度标准质粒做荧光PCR检测,生成扩增曲线(图 1),并绘制标准曲线(图 2),23S rRNA基因检测、mip基因检测标准曲线的相关系数R2分别为0.996、0.990,表明不同浓度质粒标准品在标准曲线上的数据点与曲线拟合良好,最低可检测到10拷贝数/反应载量的质粒标准品。
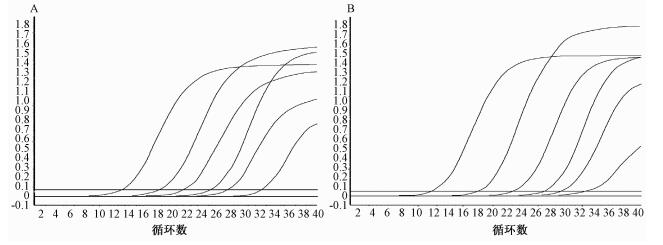
|
| 注:A,以pUC-LP-23S质粒为模板,荧光PCR扩增曲线;B,以pUC-LP-mip质粒为模板,荧光PCR扩增曲线;由左向右各条曲线对应的模板拷贝数分别为106~100 图 1 质粒扩增曲线 |
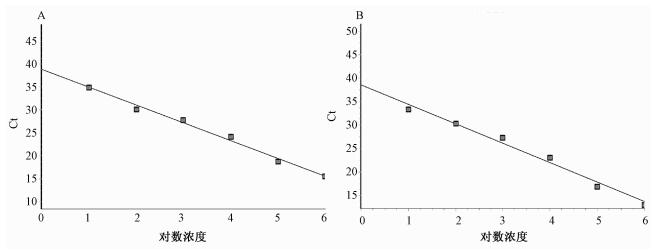
|
| 注:A,以pUC-LP-23S质粒为模板,根据荧光PCR获得的Ct值绘制标准曲线;B,以pUC-LP-mip质粒为模板,根据荧光PCR获得的Ct值绘制标准曲线;横坐标为质粒拷贝数的对数值,纵坐标为荧光PCR获得的Ct值 图 2 质粒标准曲线 |
2.2.2 利用活菌进行评价
分别取10-2~10-7稀释度的LP1菌液涂板,菌落计数相应为3 562、690、70、8 cfu/mL。不同稀释度菌液分别提取DNA,用普通PCR和荧光PCR进行检测,普通PCR灵敏度达690 cfu/mL(图 3)。而荧光PCR方法可检测到8 cfu/mL。可见,荧光PCR方法较普通PCR方法灵敏度高。
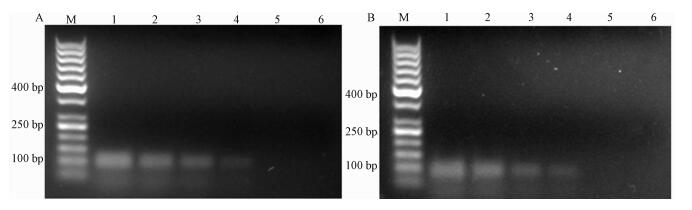
|
| 注:A,从不同稀释度的LP1菌液中提取DNA为模板,普通PCR法扩增23S rRNA基因片段后琼脂糖电泳图像;B,从不同稀释度的LP1菌液中提取DNA为模板,普通PCR法扩增mip基因片段后琼脂糖电泳图像;1—6号样品 菌液菌落计数依次为3.0×105,3×104,3.5×103,6.9×102,7.0×101,8.0×100cfu/mL;M,50 bp DNA marker 图 3 普通PCR检测质粒标准品结果 |
2.3 特异性
所有嗜肺军团菌23S rRNA基因检测及mip基因检测均为阳性,非嗜肺军团菌23S rRNA基因检测阳性而mip基因检测阴性,而其他非军团菌两种基因检测均呈阴性结果,可见本方法具有良好的特异性。
2.4 重复性3个稀释度质粒标准品配制反应体系(102拷贝数/反应、103拷贝数/反应、104拷贝数/反应),每个稀释度分别做3次重复检测,结果23S rRNA基 因检测Ct值的变异系数分别为1.235%、2.059%和2.136%;mip基因检测Ct值的变异系数分别为1.153%、1.871%和0.748%。
3 方法的应用 3.1 环境水样的检测用该方法对采集的35份环境水样进行检测(表 3),结果检出3株非嗜肺军团菌和3株嗜肺军团菌,经重复测定结果相同。而所有水样经传统分离培养法和普通PCR法检测均显示为阴性。
| 水样种类 | 采样数(份) | 阳性数 | |||
| 定量PCR | 分离培养 | 普通PCR | |||
| 23S rRNA基因检测 | mip基因检测 | ||||
| 民心河 | 5 | 4 | 2 | 0 | 0 |
| 自来水 | 10 | 0 | 0 | 0 | 0 |
| 分体空调 | 10 | 2 | 1 | 0 | 0 |
| 浴室喷头 | 10 | 0 | 0 | 0 | 0 |
3.2 痰样的检测
用该方法对不同稀释度菌液模拟痰样检测,菌量为102 cfu/mL及以上浓度的模拟痰样均可检出,再低浓度未见荧光。
对临床80份随机痰液标本进行检测,2份23S rRNA基因检测及mip基因检测均阳性,而其余标本均阴性。对此2例检测阳性患者随访:1例为住院患者,中年男性,诊断为“肺炎”,检测结果回报后即给予左氧氟沙星治疗,治疗半月症状消失,肺部病灶明显吸收,出院;1例为门诊患者,表现为干咳、肌肉酸痛、乏力,门诊给予服用阿奇霉素治疗,治疗7 d后症状消失。
4 讨论军团菌属数量庞大,致病菌90%以上为嗜肺军团菌[2]。因此,区分嗜肺军团菌与非嗜肺军团菌有非常重要的临床意义。本研究采用军团菌属23S rRNA基因和嗜肺军团菌种mip基因保守序列设计引物和探针,建立了一个具有高度特异性和敏感性、能同时区别军团菌属和嗜肺军团菌种的快速检测方法。该方法对PCR仪器要求不高,普通单通道PCR仪即可实现检测,使基层医院开展军团菌的定量检测成为可能。
本研究所建立的标准质粒,最低能检测到10拷贝数/反应体系;比普通PCR灵敏度高,与国外报道结果一致[8]。荧光定量PCR从根本上解决了普通PCR扩增产物污染和不能定量的问题。本方法具有引物和探针双重特异性,不与其他细菌发生交叉反应,稳定性好,检测快速,整个过程可在2 h内完成。
经验证,本研究建立的方法可用于临床标本检测和环境水源污染情况的调查,对军团菌病的早期诊断、疗效观察和环境监测提供了有效的手段。本次调查石家庄民心河军团菌检出率达80%、嗜肺军团菌检出率40%,分体空调军团菌检出率20%、嗜 肺军团菌检出率10%,自来水及浴室喷头未有军团菌检出。说明环境水源中军团菌普遍存在,而随着经济发展,空调、热水器等人工水环境越来越普及,军团菌污染对人群健康的潜在威胁将越来越重。本研究临床痰标本检出率为2.5%,考虑到痰液为随机抽取,未区分社区获得性与医院获得性,但也说明军团菌是本地区肺炎患者的病原体之一,应引起临床医生的警惕。
| [1] | Coscolla M, Gonzalez-Candelas F. Direct sequencing of legionella pneumophila from respiratory samples for sequence-based typing analysis[J]. J Clin Microbiol, 2009, 47(9): 2901–2905. doi: 10.1128/JCM.00268-09 |
| [2] | Zhan XY, Li LQ, Hu CH, et al. Two-step scheme for rapid identification and differentiation of legionella pneumophila and non-Legionella pneumophila species[J]. J Clin Microbiol, 2010, 48(2): 433–439. doi: 10.1128/JCM.01778-09 |
| [3] | Den Boer JW, Yzerman EP. Diagnosis of legionella infection in legionnaires' disease[J]. Eur J Clin Microbiol Infect Dis, 2004, 23(12): 871–878. |
| [4] | Waterer GW, Baselski VS, Wunderink RG. Legionella and community-acquired pneumonia:a review of current diagnostic tests from a clinician's viewpoint[J]. Am J Med, 2001, 110(1): 41–48. doi: 10.1016/S0002-9343(00)00624-0 |
| [5] | Diederen BM, Kluytmans JA, Vandenbroucke-Grauls CM, et al. Utility of real-time PCR for diagnosis of legionnaires' disease in routine clinical practice[J]. J Clin Microbiol, 2008, 46(2): 671–677. doi: 10.1128/JCM.01196-07 |
| [6] | Nazarian EJ, Bopp DJ, Saylors A, et al. Design and implementation of a protocol for the detection of legionella in clinical and environmental samples[J]. Diagn Microbiol Infect Dis, 2008, 62(2): 125–132. doi: 10.1016/j.diagmicrobio.2008.05.004 |
| [7] | Wilson DA, Yen-Lieberman B, Reischl U, et al. Detection of legionella pneumophila by real-time PCR for the mip gene[J]. J Clin Microbiol, 2003, 41(7): 3327–3330. doi: 10.1128/JCM.41.7.3327-3330.2003 |
| [8] | Templeton KE, Scheltinga SA, Sillekens P, et al. Development and clinical evaluation of an internally controlled, single-tube multiplex real-time PCR assay for detection of legionella pneumophila and other legionella species[J]. J Clin Microbiol, 2003, 41(9): 4016–4021. doi: 10.1128/JCM.41.9.4016-4021.2003 |



