叶绿素荧光技术是目前检测活体植物光合作用变化的常规方法[1-3]。叶绿素荧光、光合作用能量转换和非辐射能量耗散来源于同一激发态,三者之间具有互补的关系。叶绿素荧光产量的测定最常用的方法是脉冲振幅调制方法[1-4],脉冲振幅调制方法是应用短脉冲光测量叶绿素的荧光产量。通过叶绿素荧光技术来检测光合作用,可以在不破损活体样品的情况下了解其生理状态,判断其转化光能的效率,测量电子传递的速率,估计其受胁迫(如农药、干旱等)的状况等,操作简单,效果好[5]。藻类生长利用的是光合作用固定的能量,因此光合作用在藻类的细胞代谢中居于核心地位。光合作用不是孤立的过程,是与细胞内的其它代谢紧密联系在一起的,因此所有对单胞藻生长产生不良影响的因素均会引起光合作用活性的下降。藻类在受到极低浓度(10-10 mg/L)的某些环境污染物刺激时,其光合作用电子传递过程受到抑制,光合活性明显下降,藻液荧光产量增加。2002年Schreiber等[6]采用藻类作为指示生物,首次将叶绿素的荧光检测技术应用于水中毒物的检测,利用水中毒性物质影响藻类光合活性的特点,判断水体的综合毒性,获得了很高的灵敏度。与其他色谱技术比较,该技术最大的优势是所需仪器体积小,便于携带,指示藻易于培养,适合于野外现场监测。
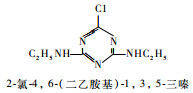
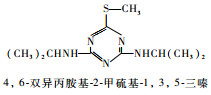
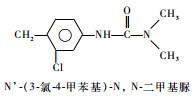
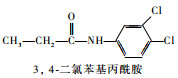
为研究叶绿素的荧光检测技术对水中毒物检测的效果,选择几种常用除草剂进行初步探索研究。西玛津(Simazine)、扑草净(Prometryn)、绿麦隆(Chlorotoluron)、敌稗(Propanil)是世界各地广泛应用的除草剂,常用于农业生产,易被雨水、灌溉水淋溶至较深层土,或是随地表径流进入河流、湖泊,对地下水和地表水造成污染。其化学结构式、除草剂类型见表 1。这4种除草剂的作用机理均是通过抑制光合作用中的电子传递过程来达到除草的目的[7]。本文利用叶绿素荧光检测技术,初步探索研究西玛津、扑草净、绿麦隆和敌稗对三角褐指藻光合信号的抑制效应。
1 材料与方法 1.1 仪器
ToxY-PAM双通道脉冲振幅调制叶绿素荧光仪(德);HGP-280H恒温光照培养箱(国产);显微镜OLYMPUS BHT312(日本)。
1.2 试剂和材料 1.2.1 试剂西玛津:100 μg/mL,编号GSBG 23077-94;扑草净:100 μg/mL,编号GSBG 23082-94;绿麦隆:100 μg/mL,编号GSBG 23079-94;敌稗:100 μg/mL,编号GSBG 23081-94。以上试剂由农业部环境保护科研监测所生产。
1.2.2 生物材料根据文献[6, 8],选择三角褐指藻作为指示生物。本实验所用三角褐指藻(Phaeodactylum tricornutum)购于青岛海洋研究所。使用F/2培养液[9-10],在恒温光照培养箱中培养。三角褐指藻的培养条件是[11]:2 000 Lux光照强度、温度20℃、培养液12 mg/L氮和1.3 mg/L磷。光暗周期为12 h/12 h,光照期间每日摇瓶2~3次。在试验前对藻液稀释,使之瞬间荧光值(F)在1 200~1 400之间。
1.3 混标溶液的配制将西玛津、扑草净、绿麦隆、敌稗的标准溶液按以下六种组合配制成除草剂的混合标准溶液,在每组组合中,每种除草剂的浓度均分别为10、1、0.1、0.05 mg/L。
1.3.1西玛津、扑草净、绿麦隆、敌稗的混合标准溶液(简称西扑绿敌混标);
1.3.2西玛津、扑草净的混合标准溶液(简称西扑混标);
1.3.3西玛津、绿麦隆的混合标准溶液(简称西绿混标);
1.3.4西玛津、敌稗的混合标准溶液(简称西敌混标);
1.3.5绿麦隆、敌稗的混合标准溶液(简称绿敌混标);
1.3.6西玛津、扑草净、绿麦隆的混合标准溶液(简称西扑绿混标)。
1.4 测定步骤在ToxY-PAM双通道脉冲振幅调制叶绿素荧光仪的2个检测室内分别放置2个检测皿,即参比检测皿和样品检测皿。测试时,各取1.0 mL三角褐指藻溶液于2个检测皿中,待基线平稳后,再分别加入10 μL纯水和相应的除草剂单标或混标溶液,用玻璃棒混匀。观察抑制百分比的变化情况。
1.5 标准曲线 1.5.1 标准储备液分别取西玛津、扑草净、绿麦隆、敌稗的标准储备液10 mL于4个100 mL容量瓶中, 加水定容至刻度。西玛津、扑草净、绿麦隆、敌稗的标准中间液浓度均为10 mg/L。
1.5.2 标准工作液用上述标准储备液逐级稀释,得到4种除草剂的标准系列工作液(表 2)。
| 名称 | 标准系列浓度(mg/L) |
| 西玛津 | 0.10、0.20、0.40、0.60、1.0 |
| 扑草净 | 0.01、0.05、0.10、0.15、0.20、0.30 |
| 绿麦隆 | 0.01、0.05、0.10、0.15、0.20 |
| 敌稗 | 0.05、0.10、0.30、0.50、0.80 |
1.5.3 标准曲线的绘制
各取1.0 mL三角褐指藻溶液于2个检测皿中,待基线平稳后,再分别加入10 μL纯水和上述除草剂的工作液,用玻璃棒混匀。观察藻液中抑制百分比的变化情况。以藻液中除草剂浓度为横坐标,藻液光合信号的抑制百分比为纵坐标,绘制标准曲线。藻液中除草剂浓度见表 3。
| 名称 | 除草剂浓度 |
| 西玛津 | 1.0、2.0、4.0、6.0、10 |
| 扑草净 | 0.1、0.5、1.0、1.5、2.0、3.0 |
| 绿麦隆 | 0.1、0.5、1.0、1.5、2.0 |
| 敌稗 | 0.5、1.0、3.0、5.0、8.0 |
1.6 剂量效应曲线绘制
根据不同浓度的除草剂溶液及其引起藻液光合信号抑制的百分比,绘制抑制百分比随除草剂浓度的变化趋势图,西玛津、扑草净、绿麦隆、敌稗的浓度范围分别为1~1 000、0.1~1 000、0.1~1 000、0.5~1 000 μg/L。
2 结果 2.1 叶绿素荧光仪参数的选择经查阅文献,测量光的强度影响检测结果的灵敏性。文献显示ToxY-PAM叶绿素荧光仪测量光频率(ML-F)设置在5时,检测效果最好[6]。另外,两个通道内藻液的前处理过程应相同,可以通过调节通道2设置(Ch2-A)实现[6]。经调试,Ch2-A设置在4时,检测效果最好。因此本次试验,叶绿素荧光仪参数选择为ML-F=5,Ch2-A=4。
2.2 单标抑制效应 2.2.1 4种除草剂的剂量效应曲线4种除草剂的剂量效应曲线如图 1所示,西玛津、扑草净、绿麦隆和敌稗的半数抑制浓度(IC50)分别为143、18、17.5和53 μg/L。
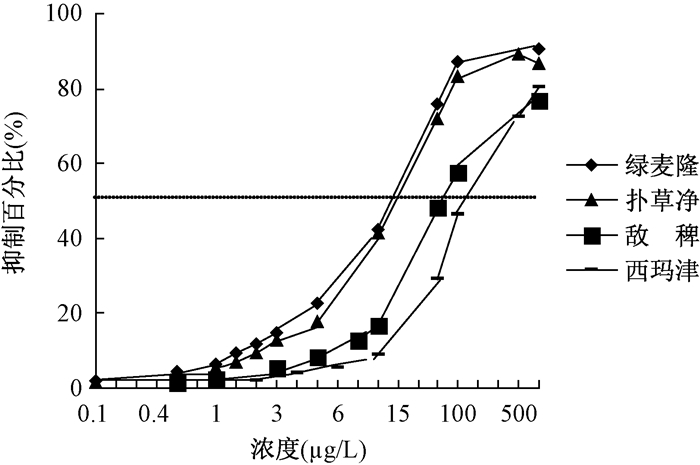
|
| 图 1 4种除草剂的剂量效应曲线 |
2.2.2 标准曲线
4种除草剂的标准曲线如图 2所示。低浓度下,西玛津、扑草净、绿麦隆和敌稗浓度与抑制百分比成线性关系。西玛津、扑草净、绿麦隆和敌稗的标准曲线线性范围分别是1~10、0.1~ 3、0.1~2和0.5~8 μg/L,相关系数分别为0.9992、0.9985、0.9990和0.9999。
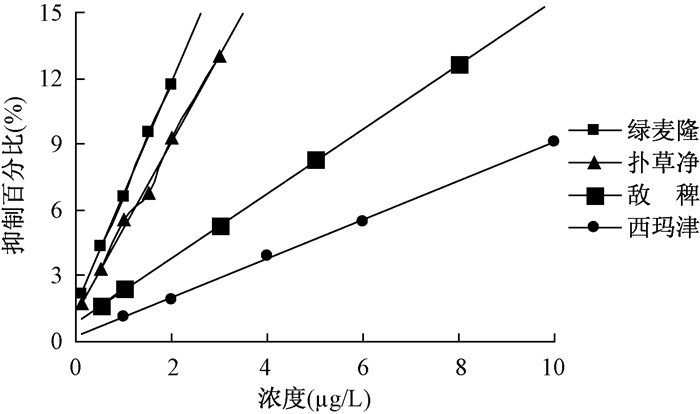
|
| 图 2 4种除草剂的标准曲线 |
2.2.3 精密度实验
各选取西玛津、扑草净、绿麦隆低、高两个浓度,分别在叶绿素荧光仪上重复测量6次,计算抑制百分比的平均值、SD、RSD见表 4。
| 除草剂 | 浓度 (μg/L) |
抑制百分比 (%) |
抑制百分 比均值(%) |
SD (%) |
RSD (%) |
||
| 西玛津 | 4 | 3.65 | 3.9 | 3.00 | 3.64 | 0.54 | 14.7 |
| 3.99 | 4.3 | 3.01 | |||||
| 10 | 7.66 | 7.73 | 7.9 | 7.79 | 0.22 | 2.88 | |
| 8.08 | 7.44 | 7.9 | |||||
| 扑草净 | 0.5 | 3.83 | 3.07 | 2.92 | 3.12 | 0.42 | 13.3 |
| 3.26 | 3.06 | 2.58 | |||||
| 2 | 9.49 | 10.0 | 9.26 | 9.53 | 0.27 | 2.82 | |
| 9.36 | 9.65 | 9.42 | |||||
| 绿麦隆 | 0.5 | 3.33 | 3.51 | 3.17 | 3.27 | 0.15 | 12.8 |
| 4.33 | 3.13 | 3.35 | |||||
| 1.5 | 9.52 | 7.85 | 7.79 | 8.08 | 0.73 | 9.02 | |
| 8.04 | 7.77 | 7.49 | |||||
2.2.4 回收率试验
以扑草净、绿麦隆为例,进行自来水样品加标回收率试验(表 5)。
2.3 混标抑制效应
4种除草剂的不同组合混标溶液经叶绿素荧光仪测试得到相应的抑制百分比,与单标除草剂溶液的叶绿素荧光仪测试结果相比较(表 6)。
| 单种除草剂浓度(μg/L) | 抑制百分比(%) | |||||||||
| 西玛津 | 扑草净 | 绿麦隆 | 敌稗 | 西扑绿敌 | 西扑混标 | 西绿混标 | 西敌混标 | 敌绿混标 | 西扑绿混标 | |
| 100 | 46.08 | 83.27 | 86.98 | 57.69 | 86.88 | 85.09 | 85.9 | 66.89 | 79.78 | 85.52 |
| 10 | 9.1 | 41.28 | 42.22 | 16.53 | 66.55 | 51.98 | 50.36 | 26.05 | 52.26 | 51.96 |
| 1 | 1.17 | 5.51 | 6.61 | 2.41 | 14.5 | 6.73 | 7.1 | 4.8 | 8.33 | 11.83 |
| 0.5 | 0 | 3.26 | 4.33 | 1.63 | 9.06 | 3.53 | 4.8 | 1.55 | 5.82 | 7.64 |
3 讨论
4种除草剂的单独效应结果显示,叶绿素荧光检测仪对西玛津、扑草净、绿麦隆和敌稗的藻类抑制作用均有很好的响应,IC50分别为143、18、17.5和53 μg/L,标准曲线的线性范围在0~10 μg/L之间。抑制作用由强到弱依次为绿麦隆>扑草净>敌稗>西玛津。扑草净和绿麦隆的作用强度比较接近,结果相差不大。
混合效应试验主要考虑4种除草剂标准曲线的线性范围,重点观察线性范围内、外的混合效应,选择了0.5、1.0、10、100 μg/L的浓度进行试验。0.5和1.0 μg/L是绿麦隆和扑草净线性范围的中低点,是敌稗和西玛津的低点。10 μg/L是西玛津的标准曲线上限,扑草净、绿麦隆、敌稗均超过了标准曲线的范围。100 μg/L时,绿麦隆和扑草净的抑制效应超过80%。
在1.0和0.5 μg/L的浓度下,各种除草剂的混合效应近似等于各个除草剂的单独效应之和。此时的浓度正好落在除草剂的标准曲线范围内,由此推测:在线性范围内西玛津、扑草净、绿麦隆、敌稗四种除草剂的混合效应是近似相加的。这种规律是否适用于其他物质,需要进一步筛选大量毒物进行测试和研究。
在10 μg/L浓度下,扑草净、绿麦隆和敌稗均超过了标准曲线的范围,而西玛津在标准曲线范围的上限。因此,西扑、西绿、西敌的混标组合作用应近似于单种除草剂的作用之和。这与表 6的结果是一致的。西扑绿混标近似等于西扑或西绿的混合作用,由于10 μg/L的绿麦隆的效果近似等于10 μg/L的扑草净的效果,推测二者混合时是否存在着拮抗作用。经查阅相关资料发现[12],除草剂和有机污染物的交互作用主要表现在对吸附位点的竞争上。环境中有机质的碳链结构构成的疏水微环境对除草剂和有机污染物的吸附起着非常重要的作用。除草剂与有机污染物在环境中的吸附系数存在差异,二者在环境中的同时出现势必导致其吸附过程的相互制约[13]。从而导致对植物的毒性也表现出差异。有研究显示除草剂敌草隆与灭菌丹的复合污染对浮萍生长的抑制和叶绿素含量的变化仅取决于敌草隆的浓度变化[14]。同理推测,由于绿麦隆和扑草净都是同一类电子传递抑制剂[7, 15],作用于同一个位点,因此二者混合作用时可能存在相互制约作用,需要进一步的实验研究验证。而西扑绿敌混标的效应大于每种除草剂的单独作用,大于其他组合的混标溶液效应,小于4种除草剂单独作用之和;而近似等于西玛津、扑草净、敌稗或西玛津、绿麦隆、敌稗3种单独作用之和。可能原因同上,要获得和探知绿麦隆和扑草净的交互作用,需要进一步测试西玛津、扑草净、敌稗各10 μg/L和西玛津、绿麦隆、敌稗各10 μg/L的混标溶液来验证上面的假设。
在100 μg/L浓度下,四种除草剂的各种组合(西敌混标除外)的结果均在79%~87%之间,尤其是绿麦隆、扑草净因其单独效应较强,因此,含二者的混合溶液抑制效应也较其他溶液要强,但总的来说抑制效应差异变化不大。
4 结论本文利用叶绿素荧光检测技术,研究了西玛津、扑草净、绿麦隆和敌稗4种除草剂对三角褐指藻光合信号单独效应和混合效应,试验表明叶绿素荧光检测仪对西玛津、扑草净、绿麦隆和敌稗的藻类抑制作用均有很好的响应,且具有突出优势:测试时间短,每次不超过10 min;测试需样量少,每次只需0.01~0.1 mL;以藻类光合作用抑制率为检测指标,在低浓度毒性物质存在时即有响应,获得生物毒性水平的信息,可直接评价水质的安全状况;所需仪器体积小,易于携带,指示藻易于培养。鉴于该技术检测灵敏度较高,在低浓度即有响应的突出优势,因此适用于水中农药的现场监测,尤其在水体农药突发事件应急检验、预测预报水体污染程度等方面,具有良好的应用前景。
| [1] | George C, Papageorgiou, Govindjee. Advances in Photosynthesis and Respiration, Volume 19:'Chlorophyll a Fluorescence:A Signature of Photosynthesis'[J]. Photosynthesis Research, 2005, 83(1): 101–105. doi: 10.1007/s11120-004-7360-x |
| [2] | Brack W, Frank H. Chlorophyll a fluorescence:a tool for the investigation of toxic effects in the photosynthetic apparatus[J]. Ecotoxicol Environ Saf, 1998, 40(1-2): 34–41. doi: 10.1006/eesa.1997.1639 |
| [3] | Popovic R, Dewez D, Juneau P. Applications of chlorophyll fluorescence in ecotoxicology:heavy metals, herbicides, and air pollutants. Practical Applications of Chlorophyll Fluorescence in Plant Biology[M]. 2003, 151-184. |
| [4] | Roháček K, Barták M. Techinque of the modulated chlorophyll fluorescence:basic concepts, useful parameters and some applications[J]. Photosynthetica, 1999, 37(3): 339–363. doi: 10.1023/A:1007172424619 |
| [5] | 韩志国. 叶绿素荧光与光合作用能量转换-叶绿素荧光基础实验指南[M]. 2004, 3-6. |
| [6] | Schreiber U, Müller JF, Haugg A, Gademann, R. New type of dual-channel PAM chlorophyll fluorometer for highly sensitive toxicity biotests[J]. Photoasynthesis Research, 2002, 74(3): 317–330. doi: 10.1023/A:1021276003145 |
| [7] | 朱良天. 农药[M]. 北京: 化学工业出版社, 2004. |
| [8] | Bengtson Nash SM, Schreiber U, Ralph PJ, Muller JF. The combined SPE:ToxY-PAM phytotoxicity assay; application and appraisal of a novel biomonitoring tool for the aquatic environment[J]. Biosens Bioelectron, 2005, 20(7): 1443–1451. doi: 10.1016/j.bios.2004.09.019 |
| [9] | Guillard RRL, Ryther JH. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt and Detonula confervacea Cleve[J]. Can. J. Microbiol, 1962, 8(2): 229–239. doi: 10.1139/m62-029 |
| [10] | Guillard RRL. Culture of phytoplankton for feeding marine invertebrates. In "Culture of Marine Invertebrate Animals." (eds:Smith W.L. and Chanley M.H.)[M]. New York USA: Plenum Press, 1975: 26-60. |
| [11] | 王丽, 应波, 鄂学礼. 三角褐指藻培养条件的选择[J]. 中国卫生检验杂志, 2006, 16(7): 777–779. |
| [12] | 黄河, 熊治廷, 刘杰, 等. 除草剂在土壤-植物系统中的环境行为与毒性效应[J]. 湖北农学院学报, 2002, 22(3): 282–284. |
| [13] | Xing BS, Pignatelle JJ, Gigllotti B. Competitive sorption between atrazine and other organic compounds in soils and model sorbents[J]. Environ Sci Technol, 1996, 30(08): 2432–2440. doi: 10.1021/es950350z |
| [14] | Teisseire H, Couderchet M, Vernet G. Phytotoxicity of diuron alone and in combination with copper or folpet on duckweed (Lemna minor)[J]. Environ Pollution, 1999, 106(1): 39–45. doi: 10.1016/S0269-7491(99)00066-4 |
| [15] | 韩博平, 韩志国, 付翔. 藻类光合作用机理与模型[M]. 2003, 121-149. |