2. 中国环境科学研究院
普通Fenton试剂是指Fe2+/H2O2体系,通过体系中的Fe2+催化分解H2O2产生的·OH氧化分解有机物,使废水的化学需氧量(COD)迅速且大幅度地降低。近几年,随着对Fenton试剂氧化机理和动力学的深入研究,出现了类Fenton试剂[1-3]和改性Fenton试剂[4-5],在一定程度上提高了普通Fenton试剂氧化有机污染物的速率和氧化能力。
磁性纳米粒子Fe3O4是近年来纳米材料研究中的热点物质,由于其具有许多特殊的理化性质,被作为功能材料在很多领域得到广泛应用[6-10],而在环保领域的应用却刚刚起步。本研究采用普通Fenton试剂和改性Fenton试剂(纳米Fe3O4/H2O2体系)处理模拟苯酚废水,研究其最佳反应条件,探讨改性Fenton试剂的反应机理,为含酚废水的处理提供了新途径,同时为改性Fenton试剂投入工程应用提供技术支持。
1 材料与方法 1.1 模拟苯酚废水水质取苯酚200 mg加入蒸馏水1 000 mL中,配制200 mg/L的模拟苯酚废水,测得pH为6,COD为596 mg/L。
由于模拟废水中COD完全由苯酚贡献,为了检测实验数据的准确性,消除纳米对各种波长光的吸收影响,本实验中的苯酚去除率用COD去除率表示。
1.2 仪器和试剂仪器:搅拌器、重铬酸钾法测定COD回流装置。
试剂:30%过氧化氢、硫酸亚铁、纳米四氧化三铁、重铬酸钾、硫酸亚铁铵、硫酸银、硫酸、氢氧化钠(均为分析纯)。
1.3 实验方法普通Fenton试验:取适量的模拟苯酚废水于烧杯中,调节pH值,投加FeSO4·7H2O和H2O2,将烧杯置于搅拌器上反应,反应结束后测定水样的COD。
改性Fenton试验:取适量的模拟苯酚废水于烧杯中,调节pH值,投加纳米Fe3O4,投加H2O2,将烧杯置于搅拌器上反应,反应结束后测定水样的COD,确定最佳反应条件。
1.4 分析方法水质测定方法参照国家环保总局编的《水和废水监测分析方法(第四版)》[11]。其中COD采用重铬酸钾法测定。
2 结果与讨论 2.1 COD与H2O2质量比为了解COD与H2O2的质量比对不同体系中处理含酚废水效果的影响,取模拟苯酚废水200 mL,当pH = 3、m(Fen+):m(H2O2)=1:5时,根据不同COD与H2O2的质量比投加还原剂和H2O2,搅拌反应60 min,测定反应结束后水样的COD(图 1)。
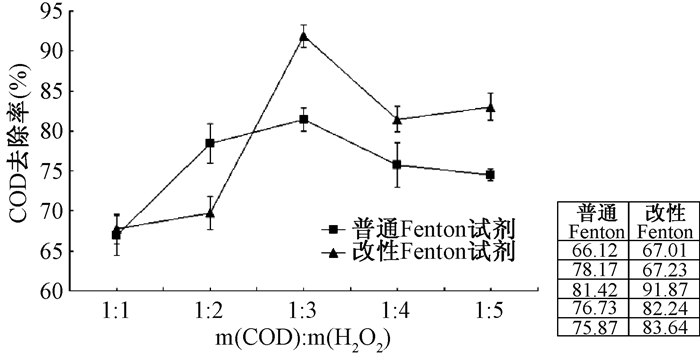
|
| 图 1 m(COD):m(H2O2)对处理效果的影响 |
由图 1可知,在改性Fenton体系中,当m(COD):m(H2O2) = 1:3时COD去除率达到(91.87±1.40)%;而相同条件下普通Fenton对废水的COD去除率为(81.42±1.42)%。随着H2O2量的不断增加,·OH量也随之增加,对废水中有机物的氧化速率不断增加,COD值呈降低趋势。当H2O2投加到一定量时处理效率反而下降,其原因是过量的·OH发生复合反应,生成H2O2,而使·OH的数量减少,致使氧化效率降低。
2.2 H2O2与还原剂摩尔比取模拟苯酚废水200 mL,pH = 3,n(COD):n(H2O2) = 1:3,根据还原剂与H2O2的不同摩尔比投加一定量的还原剂和H2O2,搅拌反应60 min,测定反应结束后水样的COD(图 2)。
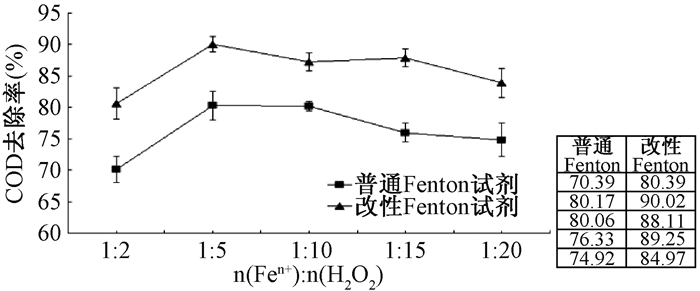
|
| 图 2 n(Fen+):n(H2O2)对处理效果的影响 |
由图 2看到,改性Fenton试剂处理的效果明显优于普通Fenton试剂处理的效果,当n(Fen+):n(H2O2)=1:5时,改性Fenton体系中COD去除率达到(90.02±1.28)%。当n(Fen+):n(H2O2)过高时,反应体系中Fen+浓度较高,过多的Fen+作为·OH的捕捉剂消耗了大量的·OH,氧化降解能力降低;且未被氧化的Fen+在测定COD时与重铬酸钾发生反应,致使COD值升高。而n(Fen+):n(H2O2)过低时,体系中H2O2过量,同样不利于对废水中有机物的氧化降解。
2.3 pH值取200 mL模拟苯酚废水,调节不同的pH值,根据m(COD):m(H2O2) = 1:3,n(Fen+):n(H2O2) = 1:5,投加一定量的还原剂和H2O2,搅拌反应60 min,测定反应结束后水样的COD。考察pH值对废水处理效果的影响(图 3)。
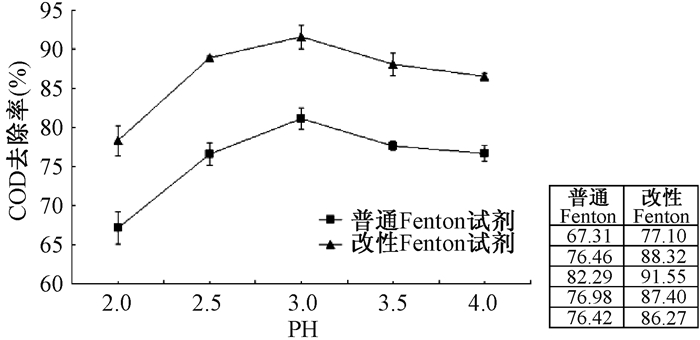
|
| 图 3 pH值对处理效果的影响 |
从反应机理来看,Fenton试剂在酸性条件下的氧化性最强,一般要求pH值在3~5之间,pH值过高或过低对去除COD都不利,pH值过高时,Fe2+易形成Fe(OH)+、胶体等无定形的沉淀[12],导致体系的催化活性下降。本实验考察了在pH2.0~4.0的范围内,研究了体系pH值变化对苯酚废水处理的影响,由图 3可知,改性Fenton试剂最佳pH范围与普通Fenton试剂相似,就本实验可得,当pH = 3时,改性Fenton体系的COD去除率为(91.55±1.48)%,是改性Fenton体系处理模拟苯酚废水的最佳pH值。根据Fenton试剂的反应机理,在酸性条件下容易反应,普通Fenton试剂中的Fe2+与H2O2反应产生OH-,不利于反应的顺利进行,需要加酸进行调整,而改性Fenton体系中的Fe2+/Fe3+能够在更宽的pH值范围内发生反应,可以节省大量调整pH值的成本,从工程的实际运用及成本考虑,改性Fenton体系更宽的pH值,将更加有利于不同工业废水的处理。
2.4 最佳反应时间取模拟苯酚废水200 mL,pH = 3,根据m(COD):m(H2O2) = 1:3,n(Fen+):n(H2O2) = 1:5投加一定量的还原剂和H2O2,搅拌,测定反应结束后水样的COD。考察不同的时间对废水处理效果的影响(图 4)。
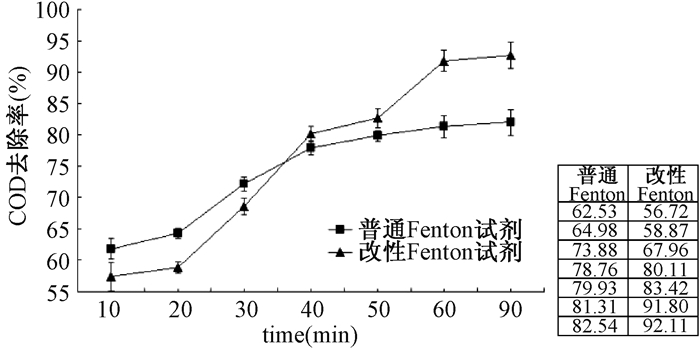
|
| 图 4 时间对处理效果的影响 |
当反应进行到40 min后,改性Fenton试剂的处理效果逐渐优于普通Fenton试剂的处理效果。当反应时间达到60 min时,改性Fenton体系中COD的去除率达到(91.80±1.64)%。
由图 4可知,前半段反应时间,普通Fenton降解COD效率高于纳米铁Fenton体系,因为降解效率主要由·OH的产生速率及其与废水中有机物的反应速率所决定,由于普通Fenton试剂中的还原剂为FeSO4 ·7H2O,Fe2+直接催化H2O2分解产生大量·OH,而纳米Fe3O4在偏酸性条件下,产生Fe2+和Fe3+,生成了Fe(Ⅱ)和Fe(Ⅲ)盐溶液[13],催化H2O2分解产生·OH,所以普通Fenton前半段的降解速率高于纳米铁Fenton体系。随着反应时间的增加,普通Fenton去除率降低并趋于平缓,而纳米铁Fenton仍保持较高的降解效率,因为在普通Fenton体系中,H2O2逐渐被消耗,浓度逐渐降低,从而降低了COD去除率,而在纳米铁Fenton体系中,Fe3+主要以[Fe(OH)]2+形式存在,其能够产生更多·OH,同时Fe3+会促进Fenton体系的氧化性能,使反应能够持续进行,可见Fe3+对Fenton试剂氧化性能的影响相当重要,因此纳米铁Fenton体系有效作用时间要高于普通Fenton体系。结合纳米材料的特性,纳米铁Fenton体系和普通Fenton试剂的强氧化作用,对于COD而言,采用纳米铁Fenton体系处理含酚废水,反应60 min时COD去除率比普通Fenton提高10.49%,比磁性Fenton提高5.5%[14]。由此可知,纳米铁Fenton体系能够提高对含酚废水的氧化能力。纳米铁Fenton体系对于含酚废水的处理效果优于普通Fenton法和磁性Fenton体系。
3 改性Fenton试剂处理含酚废水机理探讨 3.1 ·OH生成量的比较采用甲基紫光度法测定·OH,用ΔA间接表示·OH的生成量,ΔA越大,·OH的生成量越多。在相同的反应条件下,结果详见表 1。
| 吸光度值A | ΔA | ||
| 普通Fenton | 空白 | 0.042 | 0.463 |
| 水样 | 0.505 | ||
| 纳米铁Fenton体系 | 空白 | 0.048 | 0.814 |
| 水样 | 0.862 | ||
由表 1直观地看出,反应时间一定,纳米铁Fenton体系处理含酚废水的ΔA高于普通Fenton,间接可知纳米铁Fenton体系中生成的·OH量比普通Fenton体系中的多。因此,纳米铁Fenton体系处理含酚废水的效果应优越于普通Fenton法,这个结论在以上实验中得到了验证。
3.2 效应机理纳米Fe3O4作为Fenton试剂的催化剂替代单一的Fe2+完成对H2O2的催化分解,其反应机理比较复杂,既有纳米材料的特性,又有Fe2+/ Fe3+/H2O2体系的性质,而且两者之间的耦合作用是否存在还有待研究。目前国内外学者对纳米Fe3O4的制备及表征研究比较多,其在环保领域的应用也有报道[15-16],但对纳米Fe3O4/H2O2体系的探索比较少。通过实验研究分析,对改性Fenton试剂处理苯酚废水的作用机理有以下解释[17-18]:
(1) 纳米Fe3O4既具有纳米的量子尺寸效应,又具有超顺磁性。对于直径5 nm的特定球形颗粒集合体而言,每个颗粒可能包含了5 000个以上的原子,颗粒的总磁矩有可能大于10 000个玻尔磁子。也就形成了类似于磁场作用和洛仑兹力的作用,使水的微观结构发生了变化,也可能会出现微观电磁感应现象等。采用纳米Fe3O4处理苯酚废水,不需要外加磁场的条件下,借助于自身的超顺磁性,在一定程度上增强了·OH的活性,提高其氧化性能,从而达到优于普通Fenton试剂的处理效果。
(2) 纳米Fe3O4在偏酸性条件下,可产生大量的Fe2+和Fe3+,生成了Fe(Ⅲ)和Fe(Ⅱ)盐溶液,催化H2O2分解产生·OH,达到氧化苯酚的目的,处理效果还要优于单独的Fe(Ⅱ)盐溶液。其发生的反应可归纳为[19]:
| $ \begin{array}{l} {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to {{\rm{[Fe(H}}{{\rm{O}}_{\rm{2}}}{\rm{)]}}^{{\rm{2 + }}}}{\rm{ + }}{{\rm{H}}^{\rm{ + }}}\\ {{\rm{[Fe(H}}{{\rm{O}}_{\rm{2}}}{\rm{)]}}^{{\rm{2 + }}}} \to {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + H}}{{\rm{O}}_{\rm{2}}} \cdot \\ {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + }} \cdot {\rm{OH + O}}{{\rm{H}}^{\rm{ - }}} \end{array} $ |
本试验的最佳pH为3。当pH>2时,还可能存在如下反应:
| $ \begin{array}{l} {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}} \to {\left[{{\rm{Fe}}\left( {{\rm{HO}}} \right)} \right]^{{\rm{2 + }}}}\\ {\left[{{\rm{Fe}}\left( {{\rm{HO}}} \right)} \right]^{{\rm{2 + }}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to {{\rm{[Fe}}\left( {{\rm{HO}}} \right){\rm{(H}}{{\rm{O}}_{\rm{2}}}{\rm{)]}}^{{\rm{2 + }}}}{\rm{ + }}{{\rm{H}}^{\rm{ + }}}\\ {{\rm{[Fe}}\left( {{\rm{HO}}} \right){\rm{(H}}{{\rm{O}}_{\rm{2}}}{\rm{)]}}^{{\rm{2 + }}}} \to {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + H}}{{\rm{O}}_{\rm{2}}} \cdot {\rm{ + O}}{{\rm{H}}^{\rm{ - }}} \end{array} $ |
当pH值为3~5左右时,Fe3+主要以[Fe(OH)]2+形式存在,其能够产生更多·OH,同时能加强Fe3+的还原,提高Fe2+的浓度,有利于H2O2催化分解,从而提高对污染物的处理能力。
4 结论在pH=3,m(COD):m(H2O2)=1:3,n(Fen+):n(H2O2)=1:5,搅拌60 min的条件下,纳米Fe3O4/H2O2体系处理200 mL模拟苯酚废水COD的去除率高于普通Fenton试剂10.49%。在最佳COD去除率的条件下,纳米Fe3O4/H2O2体系具有更宽的pH值范围。当反应时间大于40 min,改性Fenton试剂的处理效果逐渐优于普通Fenton试剂的处理效果。
在改性Fenton体系中,纳米Fe3O4既有纳米的本质特性,又有普通Fenton试剂作用机理,在量子尺寸效应、超顺磁性的作用下,使水的微观结构发生了变化,出现了微观电磁感应现象。同时,Fe3+的不断被释放和转化,在一定程度上增强了·OH的活性,这些多层次的联合协同效应,使得纳米Fe3O4/H2O2体系的氧化能力进一步提高,从而对废水的处理效果优于普通Fenton体系。
| [1] | 封享华, 文良琴, 朱明雄, 等. 类Fenton氧化技术去除榨菜生产废水COD的研究[J]. 环境工程学报, 2008, 2(11): 1483–1486. |
| [2] | 何立平, 杨迎春, 徐成华, 等. Fe/活性炭多相类Fenton法湿式氧化罗丹明B废水的研究[J]. 环境工程学报, 2009, 3(8): 1433–1437. |
| [3] | 黄力群, 张杰, 田宁宁, 等. 用H2O2/Fe3+处理高浓度含甲醛废水的研究[J]. 环境工程学报, 2009, 3(7): 1274–1278. |
| [4] | Xie J, Xu C, Kohler N, et al. Controlled PEGylation of monodisperse Fe3O4 nanoparticles for reduced non-specific uptake by macrophage cells[J]. Adv Mater, 2007, 19(20): 3163–3166. doi: 10.1002/adma.200701975 |
| [5] | 郑洪贵. 改性菲顿试剂化学氧化修复石油污染土壤的实验研究[D]. 西安: 西安建筑科技大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10703-1011297507.htm |
| [6] | 陈芳艳, 肖洁, 唐玉斌. 微波-改性活性炭-Fenton试剂氧化法降解水中2, 4-二氯酚[J]. 化工环保, 2008, 28(2): 106–110. |
| [7] | Frankamp BL, Fischer NO, Hong R, et al. Surface modification using cubic silsesquioxane ligands facile synthesis of water-soluble metal oxide nanoparticles[J]. Chem Mater, 2006, 18(4): 956–959. doi: 10.1021/cm052205i |
| [8] | Lu A H, Salabas EL, Schuth F, et al. Magnetic nanoparticles:synthesis, protection, funcfionalization and application[J]. Angew Chem Int Ed, 2007, 46(8): 1222–1244. doi: 10.1002/(ISSN)1521-3773 |
| [9] | Zhang T, Ge J, Hu Y, et al. A general approach for transferring hydrophobic nanocrystals into water[J]. Nano Lett, 2007, 7(10): 3203–3207. doi: 10.1021/nl071928t |
| [10] | Demortière A, Panissod P, Pichon BP, et al. Size-dependent properties of magnetic iron oxide nanocrystals[J]. Nanoscale, 2011, 3(1): 225–232. doi: 10.1039/C0NR00521E |
| [11] | 国家环境保护总局水和废水监测分析方法编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 460. |
| [12] | 刘向东, 郭鹏, 褚衍洋. Fenton试剂氧化苯酚的影响因素与过程研究[J]. 污染防治技术, 2008, 21(1): 1–5. |
| [13] | 杨敏, 高迎新, 王东升, 等. Fe(Ⅲ, Ⅱ)/H2O2体系中Fe(Ⅲ)水解特征的对比[J]. 环境科学学报, 2003, 23(2): 174–177. |
| [14] | 冯俊生, 陶静, 付益伟. 磁强化Fenton处理苯酚废水的试验研究[J]. 环境科学与技术, 2011, 34(6): 177–180. |
| [15] | 佟瑞利, 赵娜娜, 王湘英, 等. Fe3O4纳米颗粒的制备及其净化含油污水的研究[J]. 化学工程, 2009, 37(7): 47–50. |
| [16] | 成翠兰, 毋伟, 沈淑玲, 等. 纳米四氧化三铁吸附水中汞离子的研究[J]. 北京化工大学学报, 2008, 35(3): 5–8. |
| [17] | 刘莹. 智能型聚合物包覆磁性纳米Fe3O4催化降解含酚废水研究[D]. 天津: 南开大学, 2011. http://d.wanfangdata.com.cn/Thesis/Y2003139 |
| [18] | 刘忠煌. 纳米四氧化三铁的制备及其对含酚废水的处理[D]. 合肥: 合肥工业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10359-2010246620.htm |
| [19] | Gallard H, Laat JD. Kinetic modelling of Fe(Ⅲ)/H2O2 oxidation reactions in dilute aqueous solution using atrazine as a model organic compound[J]. Water Res, 2000, 34(12): 3007–3016. |



