近年来,纳米材料被广泛应用于生产和生活的各个领域[1],尤其是在医学领域的应用备受关注。磁性纳米四氧化三铁颗粒性能稳定,硬度大,是一种磁性强、制备相对简单、而且生物相容性较好的磁性材料[2]。这些性能为其在医学上的广泛应用提供了可能,因此备受关注,但与此同时,其安全性也引起了人们的关注。有研究表明,一些人造纳米颗粒可引起靶器官炎症[3]、导致大脑损伤、使机体产生氧化应激[4]。无论是包覆或未包覆的纳米粒子经静脉注射后,主要分布于肝、脾、肺、骨髓等具有网状内皮细胞的组织中[5-7]。还有研究发现,纳米四氧化三铁可引起小鼠外周血象发生改变,使全血中白细胞和血小板计数下降,红细胞计数和血红蛋白含量上升[8],还可致小鼠肝、脾、肾等组织损伤[9],对雄性小鼠生殖细胞有致突变性[2]等。但对骨髓细胞的研究还比较少,本实验采用一次性尾静脉注射方式进行染毒,3 d后观察小鼠骨髓细胞DNA损伤作用,为其在临床上的进一步应用提供理论依据。
1 材料与方法 1.1 主要仪器与试剂SW-CJ-2F型无菌操作台(苏州净化设备厂),Rigaku D/max型X—射线衍射仪[日本Rigaku (理学)公司],Perkin Elmer Spectrum One型傅立叶变换红外光谱仪(美国Perkin Elmer公司),JEM-1230型透射电镜(日本JEOL公司),电泳仪(北京新康义达公司),水平式凝胶电泳槽(北京六一仪器厂),荧光倒置显微镜(Olympus日本),低熔点琼脂糖(sigma公司),正常熔点琼脂糖(sigma公司),EB(sigma公司)。
1.2 Nano-Fe3O4磁性粒子的制备Nano-Fe3O4磁性粒子(纯度>99.5%,平均粒径为9 nm),采用水相共沉淀法制备:将含有5.6 mmol/L FeCl2和11.2 mmol/L FeCl3的150 mL水通N2除氧,加热至50℃,在500 rpm搅拌、通氮气的条件下迅速加入12.5 mL NH3·H2O,50℃水浴反应30 min。反应完毕后,通过磁铁磁吸黑色的Fe3O4纳米粒子,倾去上清液,用除氧水洗涤3遍,备用。以X—射线衍射仪、傅立叶变换红外光谱仪及透射电镜对Nano-Fe3O4粒子进行表征测定,Zeta电位仪测定Nano-Fe3O4在高纯水中粒子的分布状态。
取适量Nano-Fe3O4磁性粒子,无菌条件下用高纯水进行稀释成混悬液,现用现配。
1.3 实验动物选择40只成年清洁级ICR小鼠,雌雄各半,体重为(20 ± 2) g,(由吉林大学基础医学院动物中心提供),动物合格证号为(SYXK(吉) 2007-0011),动物房合格证号为(SCXK(吉) 2007-0003)。饲养温度为18 ~ 24℃,相对湿度为50% ~ 70%,5只/笼。
根据预实验结果(水基Nano-Fe3O4悬液经尾静脉注射,小鼠的LD50约为160 mg/kg),将40只成年清洁级ICR小鼠,雌雄各随机分为4组,分别为溶剂对照(高纯水)组和低剂量(2.5 mg/kg,1/64 LD50)、中剂量(10 mg/kg,1/16 LD50)和高剂量(40 mg/kg,1/4 LD50) Nano-Fe3O4染毒组,每组5只。采用一次性尾静脉注射方式进行染毒,注射容积为10 mL/kg,注射速度约为0.02 mL/s。
1.4 骨髓细胞的分离与制备染毒3 d后,脱臼处死,取出股骨,用生理盐水冲洗骨髓腔,收集骨髓细胞,用PBS洗涤2次后,悬浮于PBS中,制成细胞悬液调整细胞密度为1 × 106个/mL。
1.5 单细胞凝胶电泳在磨砂载玻片上加0.5%正常融点的琼脂糖溶液100 μL,加盖玻片使琼脂糖均匀分开,4℃固化10 min,刮掉第1层胶,再铺含有细胞悬液的0.8%低熔点琼脂糖溶液100 μL,4℃固化10 min后,铺0.5%正常熔点琼脂糖溶液100 μL为第3层,4 ℃固化10 min。取下盖玻片,将载玻片浸没于新配制的裂解液中(4℃)避光保存1 h。从裂解液中取出载玻片,用蒸馏水冲洗3次,置于水平电泳槽中阳极端附近。倒入新配制的电泳缓冲液,使液面完全覆盖载玻片,避光静置40 min,使DAN解螺旋后,在电压为25 V,电流300 mA,室温下电泳20 min。取出载玻片,用pH7.5的Tris-HCl漂洗3次,溴化乙锭(EB)染色(以上步骤应在黄光或暗处进行。避免其他原因所指致的DAN损伤),在荧光显微镜下观察。
1.6 判定标准每张玻片计细胞数不少于50个,计算DAN损伤率。根据DNA损伤程度分为5级,0级:<5%,无损伤,细胞无拖尾,只有1个圆形细胞核形成的荧光头; Ⅰ级: 5% ~ 20%,低度损伤,有少量拖尾; Ⅱ级: 20% ~ 40%,中度损伤,出现明显拖尾; Ⅲ级: 40% ~ 95%,高度损伤,出现严重拖尾; Ⅳ级:>95%,重度损伤,成为片段。DAN损伤率(%) = (DNA损伤细胞数/观察细胞数) × 100%
1.7 统计学方法实验数据均以珚X±s进行表示。采用SPSS 13.0软件中的方差分析进行统计学处理。显著性检验水准α = 0.05。
2 结果 2.1 Nano-Fe3O4表征以X—射线衍射仪、傅立叶变换红外光谱仪及透射电镜对Nano-Fe3O4粒子进行表征,结果显示,Nano-Fe3O4粒子为球形结构,纯反尖晶石型。Zeta电位仪测定结果显示,Nano-Fe3O4在高纯水中粒子的分布较均匀,超声3 min后,在5 min内其水合粒径无明显改变,即未发生团聚。
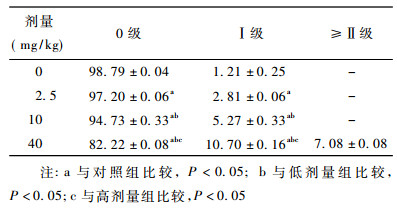
2.2 Nano-Fe3O4染毒对雌性小鼠骨髓细胞DNA损伤作用Nano-Fe3O4染毒对雌性小鼠骨髓细胞DNA损伤作用见表 1,雌性小鼠骨髓细胞DNA损伤0级各剂量组明显低于对照组(P<0.05),并且随着剂量的增加无损伤比例逐渐降低,如图 1中A所示; Ⅰ级损伤各剂量组明显高于对照组(P<0.05),且随着剂量升高损伤程度逐渐增强; ≥Ⅱ级损伤仅高剂量组出现,如图 1中B所示。
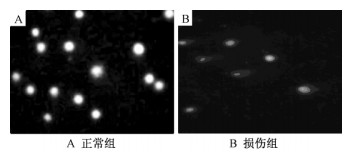
|
| 图 1 小鼠单细胞凝胶电泳图(EB × 200) |
2.3 Nano-Fe3O4染毒对雄性小鼠骨髓细胞DNA损伤作用
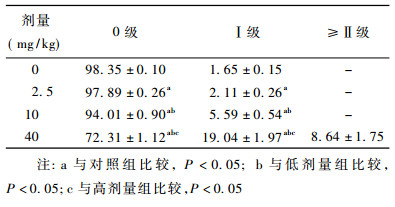
Nano-Fe3O4染毒对雄性小鼠骨髓细胞的DNA损伤作用见表 2,雄性小鼠骨髓细胞DNA损伤0级各剂量组明显低于对照组(P<0.05),并且随着剂量的升高无损伤比例逐渐降低,如图 1中A所示; Ⅰ级损伤中各剂量组明显高于对照组(P<0.05),且随着剂量的升高损伤程度逐渐增强; ≥Ⅱ级损伤仅高剂量组出现,如图 1中B所示。
3 讨论
纳米氧化铁具有良好的超顺磁性和靶向定位性,且制备工艺简单,在生物医学领域有着广泛的应用前景,包括作为磁共振诊断对比剂,恶性肿瘤磁靶向热疗、磁靶向给药和DNA基因载体等,成为目前医用生物材料研究的热点之一。临床上常见的铁氧化合物主要是三氧化二铁(Fe2O3)和四氧化三铁(Fe3O4)两种,氧化铁纳米颗粒在医学应用中进入人体的方式以静脉注射为主[10],与日益成熟的纳米生物研发技术相比,对这些材料的安全性评价尚处于起步阶段。刘鹏鹏等[11]研究发现纳米银可导致HL-7702肝细胞DNA损伤。此外,还有研究表明,纳米ZnO颗粒能够明显影响小鼠胚胎成纤维细胞(MEF)的生长形态,对细胞活性的抑制作用具有明显的时间—效应和剂量—效应关系,并且能诱导MEF细胞产生DNA损伤[12]。冯本秀等[13]研究发现腹腔注射到32 mg/kg纳米TiO2可导致大鼠淋巴细胞DNA的损伤。贾玉巧等[14]研究PM10、PM2.5染毒24 h后能诱导人肺成纤维细胞分泌炎性因子TNF-a、IL-6、IL-8。体内试验还发现颗粒物成分可导致血液成分改变,如纤维蛋白原增加[15-16],进而导致血液凝集、血液粘稠度增加等。然而对纳米氧化铁颗粒对于骨髓细胞DNA影响的研究还很少。
单细胞凝胶电泳试验(SCGE),又称彗星试验,是一种快速、简便、廉价和较敏感的、可以检测单个细胞DNA断裂损伤的技术,尤其在对DNA损伤的检测方面有很高的灵敏性。本实验中,雌雄小鼠骨髓细胞Ⅰ级损伤各剂量组明显高于对照组(P<0.05),且随着剂量升高损伤程度逐渐增强,≥Ⅱ级损伤仅高剂量组出现。可能是因为纳米粒子进入血液中后,其具有的颗粒性质可导致血管内皮细胞的炎性因子的释放,这些炎性因子可随血液循环到达骨髓,引起骨髓细胞的DNA损伤。也可能是Nano-Fe3O4在水溶液中会有少量的Fe离子析出,进入血液系统后,会使血液中的Fe离子增加,纳米Fe离子作为过渡金属离子可催化DNA的断链反应,也可与嘌呤的N7和嘧啶的N3直接键和,扰乱DNA的双链结构[17],从而引起骨髓细胞的DNA的损伤。
综上所述,一次性尾静脉注射Nano-Fe3O4颗粒3 d后,可引起小鼠骨髓细胞的DNA损伤,且与Nano-Fe3O4的剂量有关,剂量越大,损伤越严重。
| [1] | 肖延龄, 李伯. 载药纳米微粒的临床应用研究进展[J]. 国外医学生物医学工程分册, 2002, 25(4): 174–179. |
| [2] | 刘岚, 唐萌, 何整, 等. Fe3O4及Fe3O4-Glu纳米颗粒的毒性和致突变性研究[J]. 环境与职业医学, 2004, 21(1): 14–17. |
| [3] | Chiu WL, John TJ, Richard MC, et al. Pulmonary toxicity of singlewall carbon nanotubes in mice 7 and 90 days after intratracheal instillation[J]. Toxicol Sci, 2004, 7(7): 126–134. |
| [4] | Borm PJ. Particle toxicology: from coalmining to nanotechnology[J]. Inhal Toxicol, 2002, 14(3): 311–324. doi: 10.1080/08958370252809086 |
| [5] | 王国斌, 肖勇, 陶凯雄, 等. 纳米级四氧化三铁的药物动力学和组织分布研究[J]. 中南药学, 2005, 3(1): 5–7. |
| [6] | 范我, 杨凯, 钱建华, 等. 59Fe示踪法测定纳米级磁性氧化铁在小鼠体内的分布[J]. 同位素, 2001, 14(1): 31–35. |
| [7] | Tapan KJ, Maram KR, Marco AM, et al. Biodistribution, clearance, and biocompatibility of iron oxide magnetic nanoparticles in rats[J]. Molecular Pharmaceutics, 2007, 5(1): 316–327. |
| [8] | 李雪, 陶易, 李景舜, 等. 纳米四氧化三铁对小鼠外周血象的影响[J]. 环境与健康杂志, 2011, 28(1): 33–35. |
| [9] | 郝玉兰, 李清钊, 郑国颖, 等. 纳米四氧化三铁染毒小鼠肝、肾、脑组织的病理形态学观察[J]. 环境与健康杂志, 2011, 28(9): 773–774. |
| [10] | KANGJ O. Chronic iron overload and toxicity: clinical chemistry perspective[J]. Clin Lab Sci, 2001, 14(3): 208–219. |
| [11] | 刘鹏鹏, 关荣发, 伍义行, 等. 纳米银对HL-7702肝细胞DNA的损伤作用[J]. 中国药理学与毒理学, 2010, 24(6): 466–469. |
| [12] | 杨辉, 刘超, 杨丹凤, 等. 碳、氧化锌和碳载氧化锌复合纳米颗粒对小鼠胚胎成纤维细胞活性抑制及DNA损伤的研究[J]. 卫生研究, 2008, 37(1): 12–15. |
| [13] | 冯本秀, 徐海娟, 杨敏, 等. 纳米二氧化钛对大鼠淋巴细胞DNA损伤的影响[J]. 职业与健康, 2011, 27(13): 1489–1491. |
| [14] | 贾玉巧, 赵晓红, 郭新彪, 等. 大气颗粒物PM10和PM2.5对人肺成纤维细胞及其炎性因子分泌的影响[J]. 环境与健康, 2011, 28(3): 206–207. |
| [15] | Gardner SY, Lehmann JR, Costa DL. Oil fly ash-induced elevation of plasma fibrinogen levels in rats[J]. Toxicol Sci, 2000, 56(1): 175–180. doi: 10.1093/toxsci/56.1.175 |
| [16] | Ghio AJ, Hall A, Bassett MA, et al. Exposure to concentrated ambient particles alters hematologic indices in humans[J]. Inhal Toxicol, 2003, 15(14): 1465–1478. doi: 10.1080/08958370390249111 |
| [17] | 王新莹, 纪鸣, 李志果, 等. 金属离子与DNA相互作用的研究进展[J]. 分析科学报, 2005, 21(5): 557–562. |