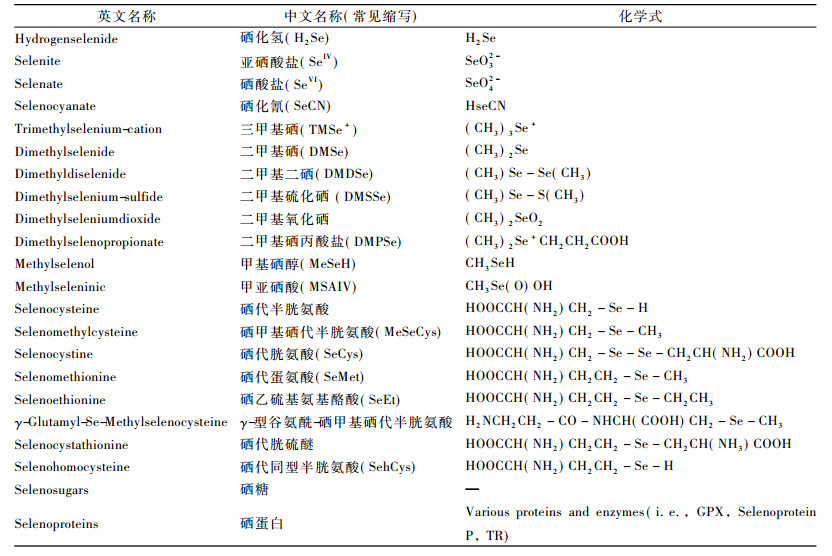
硒被世界卫生组织列为人和动物所必需的14种微量元素之一, 缺硒会导致人体心、肝、肾、肌肉等多种组织产生病变, 诱发心脑血管疾病(如克山病)、肝病、糖尿病、哮喘、癌症等多种疾病; 当人体中的硒含量高出正常含量的3 ~ 5倍时, 又会引发硒中毒, 可出现毛发脱落、肝功能异常、自主神经功能紊乱等临床表现。硒的有益剂量和毒性剂量范围很窄, 在实际生物体内, 仅在一个有限的浓度范围内发挥作用。仅从调查统计得到硒与某种疾病的发病率有相关性, 并不足以说明它的缺少或过多就是产生这种疾病(或毒性)的原因。体内各种硒化物不同的生理、生物活性及其迁移转化规律, 不仅取决于硒的总浓度水平, 而且与硒的不同生物化学形态以及不同生物化学形态下硒化物的浓度水平直接相关。BERNHARD等[1]研究发现肺纤维化病人血清总硒、硒代半胱氨酸和中性/阳离子含硒化合物水平远远低于正常人含量; ALAEJOS等[2]研究显示当人体摄入过量含硒化合物后, 在人尿液中可发现三甲基硒化合物, 它是人体摄入硒的代谢产物, 这一物质的存在可以作为评价人体硒值的一个“指示物”。大量研究表明, 不同形态的含硒化合物对于了解人体的健康状况具有重要的指示作用[3]。表 1列出了目前文献报道的人体中常见的硒形态。本文针对近年来发表的人血液和尿液中的硒形态, 从样品的前处理方法和最常用的分离检测技术高效液相-电感耦合等离子质谱(HPLC-ICP-MS)进行分析, 做一个较系统、全面的概述。
1 人体的血液和尿液样品前处理技术
样品前处理是硒形态分析全过程的第一个环节, 对分析结果有着重要的影响。如果前处理方法不正确, 不仅影响到分析结果的准确性, 还可能导致错误的结论。应当指出, 元素的总量分析和形态分析之间的最重要的差别是在样品采集、储存和制备的过程中都应保持其原有的化学形态的完整性, 避免硒原有化学形态的改变。由此可见, 人血液和尿液中的硒形态分析对样品的前处理有着严格的要求, 而且这一要求也贯穿在后续的分离检测过程中。
1.1 血液的前处理新鲜的血浆和血清样品在室温下只能存放6 h, 在4℃下可存放1 ~ 2 d, 如果需要更长时间的存贮, 应放置在-20℃或-80℃, 存贮过程中的样品腐败会导致形态的分解及错误的形态信息。研究发现人血清中的谷胱甘肽过氧化物酶四聚物极易受影响, 当储存时间增长至30 d, 它降解转化为谷胱甘肽过氧化物酶单体和亚硒酸盐, 而在新鲜样品中并未检测出转化产物亚硒酸盐[5]。
为了避免色谱柱的堵塞, 血样在分析前, 通常先离心去除杂质。PALACIOS等[5]研究血清样品, 先将-20℃储存的样品转移至4℃冰箱, 然后用50 mmol /L醋酸铵缓冲溶液稀释2倍后, 通过0.22 μm滤膜过滤后上柱。这种方法有效避免色谱柱的堵塞, 在实验中获得了广泛的使用。目前人体中的硒形态研究多集中在血液和尿液中的较简单的、低分子量含硒化合物[4], 分离时通常采用截取滤膜超滤装置离心过滤。YU等[6]分析血清中含硒化合物, 采用截留分子量3 KDa的离心浓缩装置离心过滤去除高分子量物质后, 滤液直接上机测定。这种方法操作简便, 重现性好, 适合于各种生物样品中含硒小分子的形态分析, 但实际生物样品测定时需加标后才有检出; 蛋白质沉淀法也可用来定量检测人体血清中的非蛋白含硒化合物, 该方法前处理起到预浓缩的作用, 可定量检出实际样品中的小分子含硒化合物, 但个别含硒化合物回收率不理想。KOKARNIG等[7]分析血清中的硒形态时, 加入乙腈沉淀蛋白, 然后取上清液离心冷冻浓缩至干后, 用流动相稀释上机测定, Selenosugar 1、TMSe+、SeMet、SeⅥ、MeSeCys的加标回收率为73% ~ 103%, 而SeⅣ回收率只有44%, 推测原因是SeⅣ部分与蛋白质结合沉淀造成。
1.2 尿液待测总硒的尿样, 在室温下存放时, 细菌的作用会使其发生变化, 因此通常情况下, 采样时需加入盐酸、硝酸等防腐剂, 而这些可能导致硒形态发生降解或改变。KUEHNELT等[8]在研究中将新鲜尿液收集于冷冻管中, 用-80℃的干冰转移至实验室, 最终保存在-80℃冰箱中, 可以确保尿液中的硒糖不发生降解。
尿液样品基体较“脏”, 其含有的蛋白质和脂类溶液极易堵塞色谱柱, 因此目前多数文献报道在测定尿液形态时, 通常直接采用去离子水进行稀释或滤膜过滤, 并未进行去蛋白处理。YANG等[9]将尿液用去离子水稀释5倍后上柱测定, 很好地分离了SeⅣ、SeⅥ、TMSe+, 并将该方法应用于冻干的尿粉标准物质(NIST SRM 2670) 进行验证, 检测限为22 ~ 74 pg。YU等[6]采用0.22 μm滤膜过滤后直接上机测定。固相萃取技术也常用来作为生物样本的前处理方法以提高硒的检出限和克服基质的干扰, 但由于操作过程中易引入污染, 部分含硒化合物形态发生变化, 目前文献报道较少。WROBEL等[10]曾使用固相萃取技术来富集尿中的硒形态浓度同时减少基质干扰。
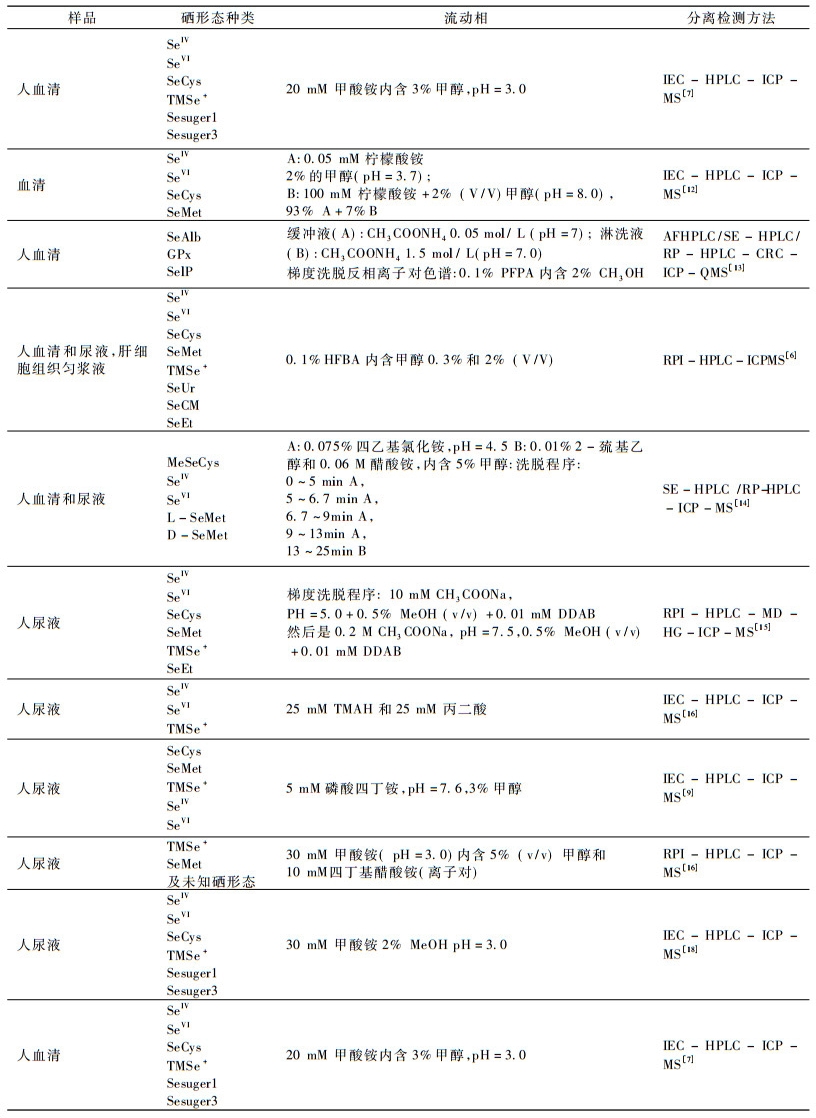
2 人体的血液和尿液硒形态分离检测技术 2.1 硒形态色谱分离技术人体的硒化合物含量极低, 所以对硒的形态分析, 需要高灵敏度和高分辨率相结合的分离检测技术手段。气相色谱(GC)、毛细管电泳(CE)和高效液相色谱(HPLC)是硒形态分析中较常用的分离技术。GC一般适用于测定易挥发的含硒化合物(如DMDSe, DMSe), 而无机的硒酸盐、亚硒酸盐以及有机的硒代氨基酸等难挥发的含硒化合物则需衍生化后才能分析, 且柱前衍生步骤繁琐, 很大程度上限制了其应用; CE是近十几年发展起来的分离技术, 以分析时间短、样品量少、分辨率高等优点而应用于生物样品的硒形态分离, 但重现性差和缓冲溶液对硒形态的影响不容忽视, 并且CE与ICP-MS的接口问题远没有HPLC成熟。HPLC适用于热稳定性差、分子量大、极性较强的含硒化合物的分离, 不需要衍生化分析物, 避免了衍生化过程发生的热分解, 与CE相比, 有较好的重现性, 根据分离机理的不同, HPLC可分为离子交换色谱(IEC-HPLC)、反相色谱(RP-HPLC)、反相离子对色谱(RPI-HPLC)和体积排阻色谱(SE-HPLC)等四种常见的分离模式。到目前为止, 人尿液中的硒形态分离大都直接采用离子交换色谱和反向离子对色谱技术, 而血清硒形态分离常采用二维色谱分离技术, 先使用体积排阻色谱(SE-HPLC)对血清中的形态进行初分, 然后采用其他色谱技术进行进一步的分离。表 2总结近年HPLC-ICP-MS联用技术用于人血清和尿液硒形态分析的研究。
2.2 硒形态检测技术———电感耦合等离子体-质谱(ICP-MS)
众所周知, ICP-MS具有诸多的优点, 如高灵敏度、高选择性、线性范围宽以及可测定试样中元素的同位素比等, 其中最为突出的是具有极为出色的检测能力, 与ICP-AES相比, 它对许多元素的检出限降低了2 ~ 3个数量级。正是由于这一点, ICP-MS在形态分析中占有特殊的地位, 成为诸多联用技术中最有发展前景的高灵敏检测手段。目前, ICP -MS的概念不仅是指低分辨率的四级杆质谱仪, 还包括相继推出的高分辨率的多接收器的磁扇形等离子体质谱、等离子体飞行时间质谱仪以及等离子体离子阱质谱仪等。硒的第一电离能较高, 而且存在着多原子离子和同量异序元素的干扰问题, 虽然高分辨ICP-MS可以解决, 但由于仪器成本高, 目前实验室普及率远不如四极杆ICP-MS。近年来有关硒形态分析的四极杆ICP-MS检测方法的最大研究进展是动态碰撞/反应池技术使用和同位素稀释法应用[3]。
2.2.1 碰撞/动态反应池技术(CRC)有关碰撞池技术的原理在一些文献中已有提及[16-17], 它是在截取锥和质谱仪之间放置一个六极杆或八极杆, 其中填充适当的气体, 比如氦气以及氙气, 通过气体与多原子离子进行碰撞或反应以消除多原子离子的干扰。对于反应池技术(四极杆), 填充的是氢气、氧气、氮气、氨气等。商品化的CRC有3种类型:四极杆型(以DRC技术为代表)、六极杆型(以CCT技术为代表)和八极杆型(以ORS技术为代表), 不同的技术具有各自的特点。其中六极杆和八极杆碰撞/反应池不可以动态扫描, 仅仅作为离子的通道, 不同质荷比的离子不加选择地通过, 具有很好的离子聚焦功能, 待测离子损失较少, 干扰离子则通过碰撞/反应气体消除; 而四极杆型碰撞/反应池具备选择特定质荷比范围的离子通过功能, 即选择性“离子带通”(Bandpass)功能, 可以选择进入反应池的离子范围, 且可对反应池产生的副产物进行选择性消除, 具有更好的灵活性。硒形态分析研究中常见的动态反应气体主要有甲烷以及甲烷和氨气的混合气体、氢气、氦气、氧气等[20]。SLOTH和LARSEN[21]报道使用装有DRC的ICP-MS测定Se形态时, 加入甲烷为反应气体, 可使氩的聚合物对Se的干扰强度降低5个数量级。KUO等[22]采用离子色谱和动态反应池ICP-MS检测生物样本中硒和碲形态, 以甲烷为反应气体, 动态反应池模式经优化后可以有效去除38Ar 40Ar +和40 Ar 40 Ar +对78 Se +与80 Se +的干扰, 硒形态(SeⅣ, SeⅥ, MeSeCys, SeMet)检测限范围可达0.01 ~ 0.03 ng·mL-1, 碲形态(TeⅣ, TeⅥ)为0.01 ~ 0.08 ng·mL-1。
碰撞/动态反应池不能解决形态分析中所有干扰问题。人的尿液和血清中含有较高浓度的溴, 当采用CRC技术, 反而会增强80 Se和82 Se的检测信号, 另外若选用的反应气体不合适, 将无法获得满意的去除效果。KITAGUCHI等[24]发现使用氢气为反应气体, 血样的基体会带来79 Br1H +和81 Br1H +的多原子离子干扰。CHEN等[23]采用氢气和氦气为反应气体的碰撞池技术来去除40 Ar 40 Ar +多原子离子对80 Se干扰, 发现单独使用氦气效果不好, 背景值的减少是以牺牲灵敏度为代价, 而氢气效果显著, SeⅣ与SeⅥ检测限分别为0.4 μg·L-1和0.2 μg·L-1。
2.2.2 同位素稀释分析法(IDA)硒含有多个同位素, 采用IDA可以校正同质异位素的干扰, 同时可以提高生物组织中含硒化合物定量分析的精密度和准确度, 所以近年来对IDA研究呈增长趋势。IDA主要有两种方式:确定形态的IDA(加入的同位素有确定的形态)和无确定形态的IDA(不考虑待测物的形态)。在确定形态的IDA中, 用同位素标记的含硒形态被加入到样品中, 经过一个完整的分析流程后, 它会与分析物一起从色谱柱上洗脱下来。由于定量分析来源于色谱峰的混合物中某特定元素的同位素比, 因此回收不完全和基体效应等情况可以得到校正。但对于多数生物分子而言, 由于无法得到相应的同位素标记的校正标准物质, 因此通常会选用无确定形态的IDA, 又称柱后同位素稀释法, 即在分离之后引入浓缩的非确定形态的同位素标志物。ENCINAR等[11]运用同位素稀释法定量研究人血清中的硒蛋氨酸, 采用特定同位素的77 Se /78 Se和77 Se /80 Se比值测定, 从而达到去除血清中79 BrH +对77 Se /80 Se的干扰, 降低检出限的效果。REYES等[25]曾使用亲和色谱和体积排阻色谱相结合的分离方法, 采用柱后同位素稀释ICP-MS检测出人血浆中的三种含硒蛋白(硒白蛋白、谷胱甘肽过氧化物酶、硒蛋白P), 较准确的定量测定硒蛋白P占总硒的55%, 硒白蛋白和谷胱甘肽过氧化物酶各占20%, 改善了分析测定的精密度和准确性。目前同位素稀释法最大的问题在于同位素标志物的缺乏[23]。
3 展望人血液和尿液中的硒元素形态分析与人体健康密切相关, 目前人体中的硒元素形态分析研究正逐步从低分子质量的含硒化合物向大分子量的硒蛋白过渡。HPLC-ICP-MS是目前硒形态分析联用技术中发展较为完善的分离检测技术, 但其自身仍存在着不足[3]。HPLC-ICP-MS进行硒形态分析常需与标准物质对照完成, 但目前只有少数的硒化合物有标准物质, 这为实际样品的硒形态测定带来一定困难。另外HPLC-ICP-MS虽然可以提供样品分离后相应元素测量信息, 但并不能给出对应的结构组成。分子质谱(ESI-MS, ESI-MS-MS)与ICP-MS技术相结合可以很好地解决上述问题。对于基体复杂的人体液样品, 可通过HPLC或CE分离后, 用ESI-MS测定相对分子质量。由于人体中的硒元素形态多样性和复杂性, 各种色谱分离技术(HPLC, CE, LC /MS)与原子光谱/质谱和分子质谱(ESI-MS、MALDI-TOF-MS)等平行检测技术的联合应用相信在未来的工作中会得到更长足的发展。另外, 预计今后在目标化合物的提取、提纯、分离、检测以及鉴定方法将会有更多研究工作开展, 同时, 随着分离和鉴定工作的不断改进, 有望在血清和尿液中制备出新的标准参考物质。
| [1] | Bernhard M. Selenium speciation in human serum of cystic fibrosis patients compared to serum from healthy persons[J]. Journal of Chromatography A, 2004, 1058(12): 203–208. |
| [2] | Alaejos MS, Romero CD. Selenium concentration in milks[J]. Food Chemistry, 1995, 52(1): 1–18. doi: 10.1016/0308-8146(94)P4174-E |
| [3] | Pedrero Z, Madrid Y. Novel approaches for selenium speciation in foodstuffs and biological specimens: A review[J]. Analytica Chimica Acta, 2009, 634(2): 135–152. doi: 10.1016/j.aca.2008.12.026 |
| [4] | Hymer CB, Caruso JA. Selenium speciation analysis using inductively coupled plasma-mass spectrometry[J]. Journal of Chromatography A, 2006, 1114(1): 1–20. doi: 10.1016/j.chroma.2006.02.063 |
| [5] | Palacios ò, Lobinski R. Investigation of the stability of selenoproteins during storage of human serum by size-exclusion LC-ICP-MS[J]. Talanta, 2007, 71(4): 1813–1816. doi: 10.1016/j.talanta.2006.08.018 |
| [6] | Yu H, Chen C, Gao Y, et al. Selenium speciation in biological samples using a hyphenated technique of high-performance liquid chromatography and inductively coupled plasma mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2006, 34(6): 749–753. doi: 10.1016/S1872-2040(06)60036-4 |
| [7] | Kokarnig S, Kuehnelt D, Stiboller M, et al. Quantitative determination of small selenium species in human serum by HPLC / ICP-MS following a protein-removal, pre-concentration procedure[J]. Analytical and Bioanalytical Chemistry, 2011, 400(8): 2323–2327. doi: 10.1007/s00216-011-4992-5 |
| [8] | Kuehnelt D, Juresa D, Francesconi K A, e t al. Selenium metabolites in urine of cancer patients receiving l-selenomethionine at high doses[J]. Toxicology and Applied Pharmacology, 2007, 220(2): 211–215. doi: 10.1016/j.taap.2007.01.005 |
| [9] | Yang KL, Jiang S J. Determination of selenium compounds in urine samples by liquid chromatography-inductively coupled plasma mass spectrometry with an ultrasonic nebulizer[J]. Analytica Chimica Acta, 1995, 307(1): 109–115. doi: 10.1016/0003-2670(95)00010-W |
| [10] | Wrobel K, Kannamkumarath S, et al. Hydrolysis of proteins with methanesulfonic acid for improved HPLC-ICP-MS determination of seleno-methionine in yeast and nuts[J]. Analytical and Bioanalytical Chemistry, 2003, 375(1): 133–138. doi: 10.1007/s00216-002-1648-5 |
| [11] | Encinar JR, Schaumloffel D, Ogra Y, et al. Determination of selenomethionine and selenocysteine in human serum using speciated isotope dilution-capillary HPLC-inductively coupled plasma collision cell mass spectrometry[J]. Analytical Chemistry, 2004, 76(22): 6635–6642. doi: 10.1021/ac049280h |
| [12] | Hu L, Dong ZQ, Huang XH, et al. Analysis of small molecular selenium species in serum samples from mercury-exposed people supplemented with selenium-enriched yeast by anion exchangeinductively coupled plasma mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2011, 39(4): 466–470. doi: 10.1016/S1872-2040(10)60432-X |
| [13] | Jitaru P, Goenaga-Infante H, Vaslin-Reimann S, et al. A systematic approach to the accurate quantification of selenium in serum selenoalbumin by HPLC-ICP-MS[J]. Analytica Chimica Acta, 2010, 657(2): 100–107. doi: 10.1016/j.aca.2009.10.037 |
| [14] | Moreno F, Garcia-Barrera T, Gomez-Ariza J L. Simultaneous analysis of mercury and selenium species including chiral forms of selenomethionine in human urine and serum by HPLC columnswitching coupled to ICP-MS[J]. Analyst, 2010, 135(10): 2700–2705. doi: 10.1039/c0an00090f |
| [15] | González Lafuente JM, Marchante-Gayón JM, Fernández Sánchez ML, et al. Urinary selenium speciation by high-performance liquid chromatograpHy-inductively coupled plasma mass spectrometry: advantages of detection with a double-focusing mass analyser with a hydride generation interface[J]. Talanta, 1999, 50(1): 207–217. doi: 10.1016/S0039-9140(99)00121-6 |
| [16] | Chatterjee A, Tao H, Shibata Y, et al. Determination of selenium compounds in urine by high-performance liquid chromatography-inductively coupled plasma mass spectrometry[J]. Journal of Chromatography A, 2003, 997(1-2): 249–257. doi: 10.1016/S0021-9673(03)00434-5 |
| [17] | Gomez MM, Gasparic T, Palacios MA, et al. Determination of five selenium compounds in urine by liquid chromatograpHy with focused microwave assisted digestion and hydride generation-atomic absorption spectrometric detection[J]. Analytica Chimica Acta, 1998, 374(2-3): 241–251. doi: 10.1016/S0003-2670(98)00417-6 |
| [18] | Gammelgaard B, Jessen KD, Kristensen FH, et al. Determination of trimethylselenonium ion in urine by ion chromatograpHy and inductively coupled plasma mass spectrometry detection[J]. Analytica Chimica Acta, 2000, 404(1): 47–54. doi: 10.1016/S0003-2670(99)00692-3 |
| [19] | 邱建华, 王秋泉, 黄本立. 硒形态分析研究进展[J]. 光谱学与光谱分析, 2006, 26(9): 1692–1701. |
| [20] | Darrouzes J, Bueno M, Lespes G, et al. Optimisation of ICPMS collision / reaction cell conditions for the simultaneous removal of argon based interferences of arsenic and selenium in water samples[J]. Talanta, 2007, 71(5): 2080–2084. doi: 10.1016/j.talanta.2006.09.019 |
| [21] | Sloth JJ, Larsen EH. The application of inductively coupled plasma dynamic reaction cell mass spectrometry for measurement of selenium isotopes, isotope ratios and chromatographic detection of selenoamino acids[J]. Journal of Analytical Atomic Spectrometry, 2000, 15(6): 669–672. doi: 10.1039/b001798l |
| [22] | Kuo CY, Jiang SJ. Determination of selenium and tellurium compounds in biological samples by ion chromatography dynamic reaction cell inductively coupled plasma mass spectrometry[J]. Journal of Chromatography A, 2008, 1181(1-2): 60–66. doi: 10.1016/j.chroma.2007.12.065 |
| [23] | Chen Z, Wang W, Mallavarapu M, et al. Comparison of no gas and He /H2 cell modes used for reduction of isobaric interferences in selenium speciation by ion chromatograpHy with inductively coupled plasma mass spectrometry[J]. Spectrochimica Acta Part B: Atomic Spectroscopy, 2008, 63(1): 69–75. doi: 10.1016/j.sab.2007.11.019 |
| [24] | Kitaguchi T, Ogra Y, Iwashita Y, et al. Speciation of selenium in selenium-enriched seeds, buckwheat (Fagopyrum esculentum Moench) and quinoa (Chenopodium quinoa Willdenow)[J]. European Food Research and Technology, 2008, 227(5): 1455–1460. doi: 10.1007/s00217-008-0866-2 |
| [25] | Hinojosa Reyes L, Marchante-Gayon JM, Garcia Alonso JI, et al. Quantitative speciation of selenium in human serum by affinity chromatograpHy coupled to post-column isotope dilution analysis ICP-MS[J]. Journal of Analytical Atomic Spectrometry, 2003, 18(10): 1210–1216. doi: 10.1039/B305455A |