2. 贵州省生物研究所, 贵阳 550000;
3. 河北工程大学能源与环境工程学院, 邯郸 056038
2. Guizhou Institute of Biology, Guiyang 550000;
3. College of Energy and Environmental Engineering, Hebei University of Engineering, Handan 056038
水体富营养化被认为是湖泊生态系统从清水态快速转变为浊水态的主要原因(Scheffer et al., 1993).过度的营养盐会引起水体中藻类的大量生长, 形成水华(Carpenter et al., 2008), 使水体生态系统多样性降低(Palmer et al., 2009; Dudgeon, 2010; Taylor et al., 2014), 其中, 有害藻类水华严重威胁到人类的健康.为了解决水体富营养化的问题, 针对如何降低营养盐的输入, 相关研究人员采取了很多措施, 比如:针对点源污染实施城市截污和集中式污水处理工程(张德浩等, 2005); 针对面源污染实施防护林带建设与农业面源控制工程(薛建辉等, 2008); 针对内源污染实施底泥疏浚工程(金相灿等, 1999).这些方法虽然能在一定程度上缓解湖泊的富营养化现状, 降低水体的污染程度, 但这些措施在经济上耗费巨大, 而且很多富营养化湖泊的蓝藻水华问题并没有得到有效解决, 蓝藻水华仍在大量暴发(郭怀成等, 2002).
国内外利用沉水植物抑制藻类生长的报道较多(章宗涉, 1998; Hilt et al., 2008; Mjelde et al., 2010).在“草型-清水态”的生态系统中, 沉水植物的旺盛生长能对底泥起到固定作用, 减缓底泥-水界面的营养盐循环, 起到抑制浮游植物生长的作用(Folke et al., 2004).相反, 沉水植物衰退时期常伴随较高的水体叶绿素a浓度(Short et al., 1995; Moore et al., 2000).Dong等(2014)的研究指出, 沉水植被的消失是引起藻类功能群改变的主要原因, 促使滇池的优势藻类由栅藻、盘星藻向微囊藻转变.另外, 沉水植物对水体营养盐升高的敏感性比藻类要低(Correll et al., 1998).沉水植被在抑制藻类生长, 调整藻类群落结构上具有积极的作用.当然, 在具有高浓度营养盐和高密度藻类的水体中, 沉水植物对藻类的抑制作用也会减弱(代亮亮等, 2016).
那么, 利用沉水植物对营养盐变化不敏感, 且能抑制藻类生长的特性, 可否不需要将水体营养盐控制到极低水平, 利用沉水植物就能达到控制藻类水华发生的目的?为探讨沉水植物在不同营养盐浓度下对蓝藻水华的控制作用, 作者在有无沉水植物以及不同营养盐水平的处理中, 研究了蓝藻水华暴发的频率、强度和持续时间, 以期探究不同营养水平下沉水植物的抑藻效应.
2 材料与方法(Materials and methods) 2.1 材料实验用铜绿微囊藻(Microcystis aeruginosa)FACHB-469来自中国科学院水生生物研究所淡水藻种库.藻种用BG-11培养基进行保种, 置于光照培养箱中保存, 定期进行接种, 以保证实验使用.实验用金鱼藻采集自云南滇池, 用蒸馏水将金鱼藻表面的杂质和附着物清洗干净, 然后挑选生长状况良好且一致的植株用于实验.
水体中的磷浓度通过奥绿肥来控制, 由美国Osmocote公司生产, 缓释期为400 d, 配比如表 1所示.称取相应质量的奥绿肥于培养装置中, 控制P元素的释放率分别为0.025、0.05、0.1 mg·d-1.
| 表 1 奥绿肥中各元素质量占比 Table 1 The element content in Osmocote |
将从滇池草海采集的原位湖水用GF/C膜过滤, 进行高温灭菌, 测定其总磷(TP)、总氮(TN)含量, 然后将原位湖水的TP含量分别稀释到0.025、0.05和0.1 mg·L-1(设计为对应地表水Ⅲ~Ⅴ类), 而此时对应的TN含量分别为0.25、0.5和1.0 mg·L-1.
将上述灭菌稀释过的湖水分别加入到1 L的锥形瓶中, 向其中加入铜绿微囊藻, 控制藻类的叶绿素a浓度分别为5.0 μg·L-1和10 μg·L-1(分别表征尚未发生水华和发生水华两种状态).将奥绿肥放入小玻璃瓶中, 用细绳将小玻璃瓶悬挂于1 L锥形瓶中, 瓶身完全浸入水面以下, 小玻璃瓶和锥形瓶之间用纱布隔开, 以防止藻类在奥绿肥表面生长, 影响营养盐的释放.每天测定培养装置中的磷含量, 通过细绳来调控奥绿肥的浸没时间, 以此来维持磷浓度分别为0.025、0.05、0.1 mg·L-1.在相同的实验条件下, 另一组实验中, 向每个培养装置加入5株金鱼藻, 金鱼藻的总重量约为2.50 g.实验培养条件为温度25 ℃, 光暗周期为12 h/12 h, 光照强度为25 μmol·m-2·s-1, 每天早中晚各摇瓶1次.上述实验均设置3组平行对照, 每天记录水华发生的情况.在形成水华时, 水体中叶绿素a的浓度一般在10 μg·L-1以上(孔繁翔等, 2005), 因此, 本研究在叶绿素a浓度大于10 μg·L-1时, 则视作发生蓝藻水华.
2.3 相关参数的测定每天取适量培养液测定藻类的叶绿素a浓度, 实验结束时, 对金鱼藻的鲜重进行测定.叶绿素a的值通过Phyto-pam(WALZ, 德国)测定(陈元等, 2009).水质理化指标中总氮的测定参照碱性过硫酸钾消解紫外分光光度法, 总磷的测定参照钼酸铵分光光度法(魏复盛, 2002).
2.4 数据处理数据、图形处理分别利用SPSS 20(IBM, USA)和Origin 9(OriginLab, USA)完成, 利用Change-Point Analyzer对数据进行分析.
3 结果(Results) 3.1 无沉水植物下, 营养盐浓度对蓝藻生长的影响单因素方差分析的结果表明, 初始藻浓度为5 μg·L-1情况下, 不同营养盐浓度对藻类水华发生的影响存在显著性差异(p<0.05)(图 1).磷浓度为0.025 mg·L-1时, 大于10 μg·L-1的藻类水华发生了4次, 最长持续时间为2 d, 出现在第17~18 d.磷浓度为0.05 mg·L-1时, 大于10 μg·L-1的藻类水华发生了1次, 持续时间18 d, 为第9~26 d.当磷浓度0.1 mg·L-1时, 从第5 d开始持续发生蓝藻水华, 第22 d左右到达稳定生长期, 第31 d时蓝藻水华的叶绿素a浓度最高为(1175.4±138.7) μg·L-1.
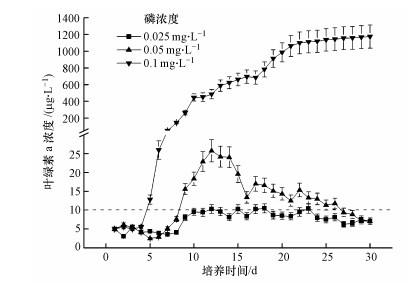 |
| 图 1 初始叶绿素a浓度5 μg·L-1情况下, 营养盐浓度对蓝藻水华发生的影响 Fig. 1 Effects of nutrient concentration on cyanobacteria blooms at the condition of 5 μg·L-1 initial chlorophyll-a concentration |
Change-Point Analyzer的分析结果显示, 当磷浓度分别为0.025、0.05、0.1 mg·L-1情况下, 在30 d的监测周期内, 分别出现了2个、3个、5个拐点(图 2).当磷浓度为0.025 mg·L-1时, 叶绿素a浓度由第8 d的4.2 μg·L-1变迁到第9 d的9.3 μg·L-1, 再从第24 d的9.3 μg·L-1到25 d的7.3 μg·L-1(图 2a).当磷浓度为0.05 mg·L-1时, 叶绿素a浓度由第8 d的4.9 μg·L-1变迁到第10 d的22.5 μg·L-1, 从第15 d的22.5 μg·L-1变迁到第16 d的14.0 μg·L-1, 再从第26 d的14.0 μg·L-1到16 d的8.1 μg·L-1(图 2b).当磷浓度为0.1 mg·L-1时, 叶绿素a浓度呈现出一次又一次跃迁的趋势, 第25 d时跃迁至1156.9 μg·L-1(图 2c).
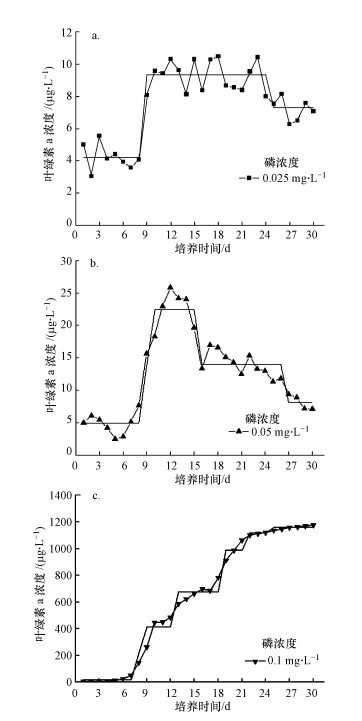 |
| 图 2 初始叶绿素a浓度5 μg·L-1情况下, 营养盐浓度对藻类水华发生影响的拐点分析 Fig. 2 Turning-Point analysis of the effects of nutrient concentration on cyanobacteria blooms at the condition of 5 μg·L-1 initial chlorophyll-a concentration |
单因素方差分析的结果表明, 初始藻浓度为10 μg·L-1情况下, 不同营养盐浓度对藻类水华发生的影响存在显著性差异(p<0.05)(图 3).磷浓度为0.025 mg·L-1时, 发生水华的最高强度为(31.0±3.7) μg·L-1.磷浓度0.05 mg·L-1时, 发生水华的最高强度为(187.0±22.1) μg·L-1.当磷浓度为0.1 mg·L-1时, 藻类快速生长, 第27 d左右到达稳定生长期, 此时发生蓝藻水华的叶绿素a浓度为(1748.6±206.3) μg·L-1.
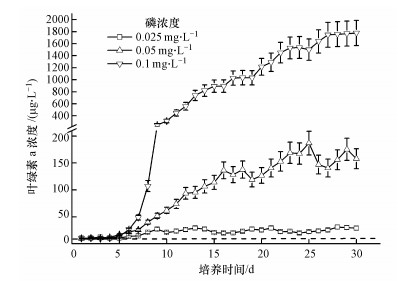 |
| 图 3 初始叶绿素a浓度10 μg·L-1情况下, 营养盐浓度对藻类水华发生的影响 Fig. 3 Effects of nutrient concentration on cyanobacteria blooms at the condition of 10 μg·L-1 initial chlorophyll-a concentration |
Change-Point Analyzer的分析结果显示, 当磷浓度分别为0.025、0.05、0.1 mg·L-1情况下, 在30 d的监测期间内, 分别出现了1个、3个、3个拐点(图 4).当磷浓度为0.025 mg·L-1时, 叶绿素a浓度由第7 d的11.6 μg·L-1变迁到第8 d的24.7 μg·L-1(图 4a).当磷浓度为0.05 mg·L-1时, 叶绿素a浓度由第8 d的18.3 μg·L-1变迁到第11 d的87.7 μg·L-1, 从第13 d的87.7 μg·L-1变迁到第16 d的129.7 μg·L-1, 再从第20 d的129.7 μg·L-1变迁到23 d的162.6 μg·L-1(图 4b).当磷浓度为0.1 mg·L-1时, 叶绿素a浓度由第7 d的18.1 μg·L-1变迁到第15 d的977.4 μg·L-1, 从第19 d的977.4 μg·L-1变迁到第22 d的1504.9 μg·L-1, 再从第25 d的1504.9 μg·L-1变迁到27 d的1763.8 μg·L-1(图 4c).
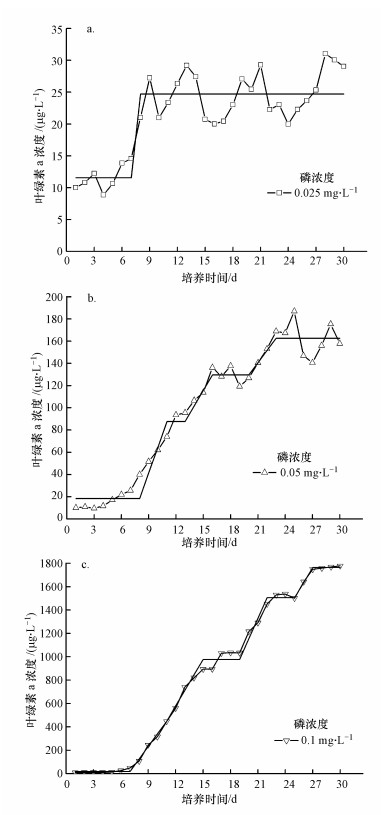 |
| 图 4 初始叶绿素a浓度10 μg·L-1情况下, 营养盐浓度对藻类水华发生影响的拐点分析 Fig. 4 Turning-Point analysis of the effects of nutrient concentration on cyanobacteria blooms at the condition of 10 μg·L-1 initial chlorophyll-a concentration |
图 5为加入金鱼藻的条件下, 不同营养盐水平和初始藻浓度下藻类水华的发生情况, 图中叶绿素a浓度为平均值.铜绿微囊藻的初始叶绿素a浓度为5 μg·L-1时, 不同磷浓度下, 各处理组叶绿素a浓度表现出一定的差异性.0.1 mg·L-1处理组, 实验初期的叶绿素a浓度高于其它两个处理组, 第3 d的叶绿素a浓度最高为8.8 μg·L-1.整个实验周期内, 各处理组的叶绿素a浓度均未超过10 μg·L-1 (图 5a).
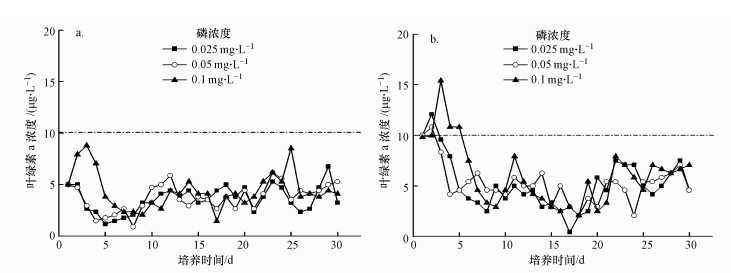 |
| 图 5 种植金鱼藻条件下, 营养盐浓度对蓝藻水华发生的影响 (a. chlorophyll-a 5 μg·L-1; b. chlorophyll-a 10 μg·L-1) Fig. 5 Effects of nutrient concentration on cyanobacteria blooms at the condition of planting C. demersum (a. chlorophyll-a 5 μg·L-1; b. chlorophyll-a 10 μg·L-1) |
当铜绿微囊藻初始的叶绿素a为10 μg·L-1时, 不同磷浓度下, 各处理组叶绿素a浓度也表现出一定的差异性.实验初期, 0.025~0.1 mg·L-1处理组均发生了短期水华, 0.1 mg·L-1处理组暴发的水华最强, 其水华持续时间为5 d, 第3 d时叶绿素a浓度最高为15.4 μg·L-1.实验中后期, 各处理组的叶绿素a浓度均低于10 μg·L-1 (图 5b).
3.3 实验结束时金鱼藻的生物量图 6为实验结束时不同磷浓度下金鱼藻的生物量.Control处理组为实验初始时金鱼藻的生物量, 约为2.50 g.初始叶绿素a为5 μg·L-1时, 不同磷浓度下, 各处理组金鱼藻的生物量表现出一定的差异性.随着营养盐浓度的上升, 各处理组金鱼藻生物量逐渐升高, 0.1 mg·L-1处理组在实验结束时的生物量最大为(4.79±0.53) g(图 6a).
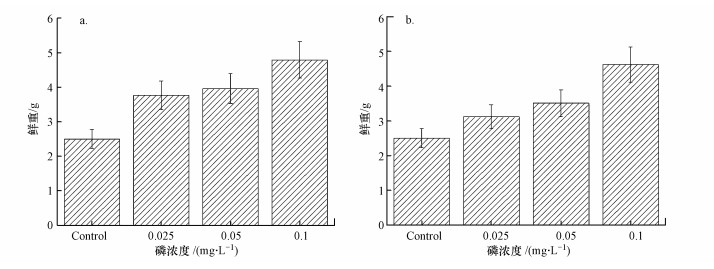 |
| 图 6 不同营养盐浓度下金鱼藻的生物量 (a. chlorophyll-a 5 μg·L-1; b. chlorophyll-a 10 μg·L-1) Fig. 6 The biomass of C. demersum at different nutrient concentration (a. chlorophyll-a 5 μg·L-1; b. chlorophyll-a 10 μg·L-1) |
初始叶绿素a为10 μg·L-1时, 不同磷浓度下, 各处理组金鱼藻的生物量也表现出一定的差异性.随着营养盐浓度的上升, 各处理组金鱼藻生物量逐渐升高, 0.1 mg·L-1处理组在实验结束时的生物量最大为(4.62±0.51) g(图 6b).
4 讨论(Discussion) 4.1 水体营养盐浓度对蓝藻水华发生的影响蓝藻是地球上最古老的生物, 能够在湖泊、水库、河流和海洋生态系统中形成有害藻类水华(Anderson et al., 2002).最近的研究表明, 富营养化和气候变暖是推动蓝藻大量增殖和水华暴发的两个重要因素(O′neil et al., 2012).所有导致藻类水华发生的因子中, 营养盐是全球关注得最多的影响因子.水体中营养盐含量的升高, 尤其磷浓度的升高, 会使浮游植物群落快速转变为以蓝藻占优势的群落结构(Correll et al., 1998; Paerl et al., 2009).本研究在不同初始叶绿素a浓度下, 探讨了不同营养盐水平对铜绿微囊藻生长的影响.实验设定的初始叶绿素a浓度为5 μg·L-1和10 μg·L-1, 分别表征尚未发生水华和发生水华两种状态.结果表明在不同营养盐水平下, 各处理组均发生了藻类水华, 且藻类水华的强度随营养盐水平的升高而增加; 同等营养盐浓度下, 已发生水华的水体(初始chlorophyll-a浓度10 μg·L-1), 其后期形成的水华强度更大, 持续时间更长(图 1~图 4).这表明在较低的营养盐水平(磷浓度对应Ⅲ~Ⅳ类水)下, 蓝藻水华仍有可能发生, 那么在已有蓝藻水华发生的湖泊(磷浓度对应Ⅴ类水)中, 若通过控制营养盐浓度到较低水平(对应Ⅲ~Ⅳ类水)来控制藻类水华的发生, 一是成本高, 二是水华很有可能得不到有效的控制.
4.2 沉水植物恢复对蓝藻水华的抑制作用水体富营养化是世界范围内普遍存在的环境问题(Anderson et al., 2002), 有效控制富营养化水体中藻类的生长, 是迫切需要解决的问题.研究发现, 在一定范围的营养盐浓度下, 高等水生植物的旺盛生长可以抑制藻类水华的发生(朱伟等, 2006), 其主要机制是高等水生植物与藻类之间存在资源利用性竞争(光照、营养盐等)和相互干扰性竞争(释放化感物质).Lombardo等(2003)的研究认为金鱼藻能有效地利用水体中的营养盐, 从而影响浮游藻类的生长.此外, 金鱼藻分泌的N-苯基-2-萘胺、脱氢枞酸甲酯和脱氢枞酸乙酯对铜绿微囊藻具有明显的抑制作用(Pelechata et al., 2010).在本实验中, 磷浓度为0.1 mg·L-1且无金鱼藻的处理中, 铜绿微囊藻的叶绿素a浓度超过了1000 μg·L-1, 说明暴发了藻类水华; 而金鱼藻的种植, 可以控制藻类的叶绿素a浓度低于10 μg·L-1(图 5).说明沉水植被的存在或许可以抑制营养盐升高对藻类的促进作用.相反地, 沉水植被的消亡促进了滇池藻类水华的发生(Dong et al., 2014).十一五期间, 本课题组通过生态修复条件创建、水生植被构建和水生植物维护技术的优化与集成, 在较高营养盐水平(TP:0.60~0.92 mg·L-1, TN:5.0~11.4 mg·L-1)的滇池外草海中, 建成了以轮叶黑藻(Hydrilla varticillata)为优势种群的水生植被恢复区, 进而促进了藻型浊水态向草型清水态的转变(李根保等, 2014).上述结果证实, 较高的营养浓度下, 沉水植物的存在能够抑制藻类水华的发生.
5 结论(Conclusions)1) 初始藻浓度为5 μg·L-1和10 μg·L-1情况下, 3种营养盐水平下都会发生水华, 营养盐水平的升高会导致蓝藻水华暴发的强度和持续时间增加.初始藻浓度为10 μg·L-1条件下, 其后期形成的水华强度更大, 持续时间更长.
2) 金鱼藻和藻类共培养条件下, 初始藻浓度为5 μg·L-1的实验体系中, 没有形成水华.初始藻浓度为10 μg·L-1的实验体系中, 不同营养盐浓度下, 实验初始时均会形成短暂水华, 之后, 各处理组的叶绿素a浓度均低于10 μg·L-1, 表明蓝藻的生长受到抑制.
3) 沉水植物的存在抑制营养盐对水华蓝藻生长的促进作用.
Anderson D M, Glibert P M, Burkholder J M. 2002. Harmful algal blooms and eutrophication: Nutrient sources, composition, and consequences[J]. Estuaries, 25(4): 704–726.
DOI:10.1007/BF02804901
|
Carpenter S R, Lathrop R C. 2008. Probabilistic estimate of a threshold for eutrophication[J]. Ecosystems, 11(4): 601–613.
DOI:10.1007/s10021-008-9145-0
|
陈元, 赵洋甬, 潘双叶, 等. 2009. PHYTO-PAM对浮游植物中叶绿素的分类测定[J]. 现代科学仪器, 2009, 19(4): 100–103.
|
Correll D L. 1998. Role of phosphorus in the eutrophication of receiving waters: A review[J]. Journal of Environmental Quality, 27(2): 261–266.
|
代亮亮, 郭亮亮, 吴中奎, 等. 2016. 不同浓度藻类水华对两种沉水植物的影响[J]. 中国环境科学, 2016, 36(9): 2765–2773.
DOI:10.3969/j.issn.1000-6923.2016.09.035 |
Dong J, Yang K, Li S S, et al. 2014. Submerged vegetation removal promotes shift of dominant phytoplankton functional groups in a eutrophic lake[J]. Journal of Environmental Sciences, 26: 1699–1707.
DOI:10.1016/j.jes.2014.06.010
|
Dudgeon D. 2010. Prospects for sustaining freshwater biodiversity in the 21st century: linking ecosystem structure and function[J]. Current Opinion in Environmental Sustainability, 2(5): 422–430.
|
Folke C, Carpenter S, Walker B, et al. 2004. Regime shifts, resilience, and biodiversity in ecosystem management[J]. Annu Rev Ecol Evol Syst, 35(1): 557–581.
DOI:10.1146/annurev.ecolsys.35.021103.105711
|
郭怀成, 孙延枫. 2002. 滇池水体富营养化特征分析及控制对策探讨[J]. 地理科学进展, 2002, 21(5): 500–506.
DOI:10.3969/j.issn.1007-6301.2002.05.012 |
Hilt S, Gross E M. 2008. Can allelopathically active submerged macrophytes stabilise clear-water states in shallow lakes?[J]. Basic & Applied Ecology, 9(4): 422–432.
|
金相灿, 刘文生. 1999. 湖泊污染底泥疏浚工程技术:滇池草海底泥疏挖及处置[J]. 环境科学研究, 1999, 12(5): 9–12.
DOI:10.3321/j.issn:1001-6929.1999.05.003 |
孔繁翔, 高光. 2005. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J]. 生态学报, 2005, 25(3): 589–595.
DOI:10.3321/j.issn:1000-0933.2005.03.028 |
李根保, 李林, 潘珉, 等. 2014. 滇池生态系统退化成因、格局特征与分区分步恢复策略[J]. 湖泊科学, 2014, 26(4): 485–496.
|
Lombardo P, Cooke G D. 2003. Ceratophyllum demersum-phosphorus interactions in nutrient enriched aquaria[J]. Hydrobiologia, 497(1): 79–90.
|
Mjelde M, Faafeng B. 2010. Ceratophyllum demersum hampers phytoplankton development in some small Norwegian lakes over a wide range of phosphorus concentrations and geographical latitude[J]. Freshwater Biology, 37(2): 355–365.
|
Moore K A, Wetzel R L. 2000. Seasonal variations in eelgrass (Zostera marina L.) responses to nutrient enrichment and reduced light availability in experimental ecosystems[J]. Journal of Experimental Marine Biology & Ecology, 244(1): 1–28.
|
O′neil J, Davis T W, Burford M A, et al. 2012. The rise of harmful cyanobacteria blooms: the potential roles of eutrophication and climate change[J]. Harmful Algae, 14: 313–334.
DOI:10.1016/j.hal.2011.10.027
|
Paerl H W, Huisman J. 2009. Climate change: a catalyst for global expansion of harmful cyanobacterial blooms[J]. Environmental Microbiology Reports, 1(1): 27–37.
DOI:10.1111/emi4.2009.1.issue-1
|
Palmer M A, Lettenmaier D P, Poff N L, et al. 2009. Climate change and river ecosystems: Protection and adaptation options[J]. Environmental Management, 44(6): 1053–1068.
DOI:10.1007/s00267-009-9329-1
|
Pelechata A, Pelechaty M. 2010. The in situ influence of Ceratophyllum demersum on a phytoplankton assemblage[J]. Oceanological & Hydrobiological Studies, 39(1): 95–101.
|
Scheffer M, Hosper S, Meijer M, et al. 1993. Alternative equilibria in shallow lakes[J]. Trends in Ecology & Evolution, 8(8): 275–279.
|
Short F T, Burdick D M, III J E K. 1995. Mesocosm experiments quantify the effects of eutrophication on eelgrass, Zostera marina[J]. Limnology & Oceanography, 40(4): 740–749.
|
Taylor J M, King R S, Pease A A, et al. 2014. Nonlinear response of stream ecosystem structure to low-level phosphorus enrichment[J]. Freshwater Biology, 59(5): 969–984.
DOI:10.1111/fwb.12320
|
魏复盛. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社: 243–257.
|
薛建辉, 阮宏华, 刘金根, 等. 2008. 太湖流域水岸生态防护林体系建设技术与对策[J]. 南京林业大学学报(自然科学版), 2008, 32(5): 13–18.
DOI:10.3969/j.issn.1000-2006.2008.05.004 |
张德浩, 蒋岭. 2005. 深圳特区城市水环境污染原因与对策[J]. 西南给排水, 2005, 27(2): 25–27.
|
章宗涉. 1998. 水生高等植物-浮游植物关系和湖泊营养状态[J]. 湖泊科学, 1998, 10(4): 83–86.
|
朱伟, 张俊, 赵联芳. 2006. 底质中氨氮对沉水植物生长的影响[J]. 生态环境学报, 2006, 15(5): 24–30.
|
 2019, Vol. 39
2019, Vol. 39


