底泥沉积物是河流生态系统中重要的部分, 河道底泥中污染物长期累积, 对上覆水水质的影响持久(钟萍等, 2007), 即使在外源污染得到有效控制后, 底泥中的这些污染物仍可能对水体产生“二次污染”(贺宝根等, 1999; Eggleton et al., 2004; 余光伟等, 2007).因此, 底泥内源污染的控制和修复技术成为解决河道水体水质的一个关键因素.
底泥成分复杂、污染物种类繁多, 单一的修复技术均存在缺陷(彭祺等, 2007).协同修复技术一般包括化学-生物协同修复和微生物-植物协同修复, 有利于综合不同修复手段的优点, 发挥更有效的修复效果, 降低修复成本. Xiong等(2016)将乳酸钠、丙酸钠分别与菌剂Bacillus sp. GZT联合投加, 用于修复受2, 4, 6-三溴苯酚(TBP)污染的底泥, 7周后TBP的去除率分别为44.3%和47.0%, 表明乳酸钠、丙酸钠能作为电子供体提高生物强化过程对TBP的降解率. Vezzulli等(2004)发现投加生物强化剂和生物激活剂, 可有效提高底泥微生物总活性, 底泥微生物产酶量及胞外酶活性被显著提高, 底泥污染物降解速率加快.刘成(2012)利用生物促生剂和微生物菌剂联合修复, 发现有机质降解率达18.98%, 底泥生物降解能力增长率达336.00%.上覆水体中COD、TN、NH3-N和TP的去除率分别达62.86%、74.25%、99.42%和63.64%, 基本消除了上覆水体黑臭现象.本实验在投加异养硝化-好氧反硝化菌的基础上, 促生剂的投量分别设计为0、0.08、0.09、0.10和0.11 g·L-1(促生剂的质量/底泥体积), 以探明促生剂投量对底泥中微生物群落结构的影响及其与底泥修复效果之间的关系.
虽然研究表明联合投加微生物菌剂和生物促生剂可有效地降低水体氮磷元素含量, 对河道污染修复效果较为彻底, 但其对底泥微生物群落结构的影响鲜见报道.本文采用实验室模拟河道装置, 研究在微生物-生物促生剂协同修复情况下, 底泥中酶活性及微生物群落特征的变化, 结合底泥与上覆水体中碳氮元素变化规律, 进而分析微生物群落特征改变对底泥污染物质变化的影响, 讨论底泥微生物群落与河道底泥污染修复的关系, 以期为河道底泥生态修复提供理论依据和支持.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 样品采集与处理实验原泥样品为海河故道清淤底泥, 取搅拌均匀后的底泥铺入反应器中, 厚度为13 cm.底泥中TOC含量为0.8%~1.2%, 全氮含量为1.2~1.6 mg·g-1, 总磷含量为0.8~1.0 mg·g-1.为了排除外源污染对系统运行的干扰, 反应器中原水为自来水, 水深为57 cm.
2.1.2 异养硝化-好氧反硝化菌所选用的异养硝化-好氧反硝化菌由本课题组筛选驯化而来, 经过长期验证, 具有较好的硝化和反硝化性能(杨晓杰, 2016).对保存的菌液进行稀释涂布, 分离出单个菌落, 送往北京奥维森基因科技有限公司进行菌种鉴定.从1个菌体样中提取基因组DNA, 用引物27F、1492R进行PCR扩增细菌16S rRNA基因片段, 通过测序, 将测序结果序列在美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)上进行Blast比对, 菌种鉴定的结果显示为Citrobacter sp.(KP068655.1), 属于变形菌门(Proteobacteria).
2.1.3 生物促生剂经课题组前期调研和实验筛选(吕梦怡, 2016), 从市售的生物制剂中选择碧沃丰生物科技股份有限公司的反硝化制剂作为本实验的生物促生剂, 该生物促生剂为粉状制剂, 含有促进微生物生长和代谢的酶类和营养物质.
2.2 实验方法 2.2.1 实验装置模拟河道实验装置主要组成包括反应器、高位储水箱和集水箱, 均为矩形玻璃容器.实验装置示意如图 1所示.
 |
| 图 1 模拟河道试验装置图 Fig. 1 Schematic of the experiment apparatus |
实验开始前以虹吸的方式向反应器中注入自来水, 加水过程要避免对底泥产生扰动.静置两周, 用于反应器中底泥的稳定, 待底泥稳定后即认为反应器启动.为模拟实际缓流河道水, 通过蠕动泵将水打入高位水箱中, 高位水箱底部安装有1个出水口, 通过重力流向反应器进水.各个反应器出水通过出水管流到相应集水箱, 再通过蠕动泵将集水箱中收集的出水打入高位水箱, 如此循环.通过输液器调节进水流量, 使进水流量控制在与实际河道水流速相近的(9.96±0.1) L·h-1.
2.2.2 实验方案为探究促生剂投量对底泥微生物群落组成及修复效果的影响, 根据课题组前期实验结果, 反应器启动时向各反应器底泥和水中分别注射体积比例为0.09%和0.03%, 浓度为108 cfu·mL-1的菌剂(杨晓杰, 2016), 菌剂成分详见2.1.2节所述.并根据促生剂使用说明书, 综合预实验与课题组前期研究结果, 在反应器启动时向各反应器的上覆水中分别均匀注入促生剂质量与底泥体积比为0(空白对照实验)、0.08、0.09、0.10和0.11 g·L-1的生物促生剂(吕梦怡, 2016).
为估计测量的随机误差, 所有样品均设置3组平行实验进行分析.使用SPSS 21.0和Excel 2013软件确定实验数据平均值, 标准偏差和方差分析(ANOVA).使用单因素方差分析比较平均值, 显著性水平p < 0.05.使用多因素置换方差分析比较组间差异性, 显著性水平p < 0.05.
2.2.3 水样及泥样采集方法使用注射器采集水下5 cm处水样20 mL装入离心管中, 立即对水样各项指标进行测定.用自制底泥采样器采集表层底泥样品, 将泥样在室内自然风干后剔除粗杂质, 之后用玻璃研钵将其研碎, 过100目筛, 备用.
2.2.4 水体及底泥指标测定常规指标主要包括水样的氨氮、硝酸盐氮、COD和底泥的TN、TOC等, 水样的分析方法参照《水和废水监测分析方法》(第四版)执行, 相应指标的具体分析方法如表 1所示.
| 表 1 水质及底泥指标分析方法 Table 1 Water quality and sediment index analysis method |
脲酶活性测定采用靛酚蓝比色法(关松荫, 1986; 中华人民共和国国家质量监督检验检疫总局, 2002; 2003), 在578 nm波长处分光比色, 酶活性以每小时每克土壤中NH3-N的毫克数表示, 单位为mg·g-1·h-1.
蛋白酶的测定以精制酪素为基质, 比色测定酪氨酸的量, 用分光光度计在波长680 nm下测定光密度, 可作为土壤蛋白酶的活性指标(关松荫, 1986; 林先贵, 2010).蛋白酶活性以每小时每克土壤中酪氨酸的毫克数表示, 单位为mg·g-1·h-1.
多酚氧化酶的测定以左旋多巴(L-DOPA)为基质, 在460 nm处分光, 酶活性以每克土样每分钟生成的反应生成物diqc的量来表示(Toberman et al., 2008; 高璟赟, 2010).
2.2.6 微生物群落结构分析① DNA提取 利用Fast DNA® SPIN Kit for Soil土壤DNA快速提取试剂盒进行DNA提取, 将提取好的DNA存于-20 ℃冰箱长期保存或4 ℃暂时保存.
② DNA样品的品质检验 利用凝胶成像仪对电泳后的条带进行观察, 使用超微量紫外分光光度计测DNA总量和浓度.若电泳条带清晰, DNA无降解、无或轻微粘稠、颜色异常、杂质污染, 无杂带, DNA总量≥150 ng, DNA浓度≥5 ng·μL-1, 样品体积范围15~100 μL, 则认为DNA品质检验合格.
③ 高通量测序 完成基因组DNA抽提及品质检验后, 对环境样本16S rRNA V3~V4区进行PCR扩增, 引物序列为ACTCCTACGGGAGGCAGCAG、GGACTACHVGGGTWTCTAAT, PCR采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase.全部样本按照正式实验条件进行, 每个样本3个重复, 将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测, 使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物, Tris_HCl洗脱; 2%琼脂糖电泳检测.参照电泳初步定量结果, 将PCR产物用QuantiFluorTM -ST蓝色荧光定量系统(Promega公司)进行检测定量, 之后按照每个样本的测序量要求, 进行相应比例的混合.在构建好Miseq文库的基础上上机测序, 获到高通量测序数据.采用RDP Classifier算法对97%的相似水平下的OUT代表序列进行生物信息统计分析, 并在各个水平(界、门、纲、目、科、属、种)注释其群落的物种信息.根据分类学分析结果, 用Excel 2013和R语言等软件, 对物种及其丰度分析以及主成分分析进行处理.其中物种及其丰度分析通过与数据库进行对比, 对物种进行门、纲、目、科、属、种的等级分类, 可以观察出不同物种在每个样品所占的比例以及组间差异.主成分分析是一种展示样品间多样性差异大小的方法, 两样品距离越远, 则表示两样品的物种组成差异越大.
3 结果与讨论(Results and discussion) 3.1 促生剂不同投量条件下微生物群落组成变化由高通量测序结果发现, 115 d时属与种水平上微生物群落组成中有多于70%为未识别出的菌种, 且门水平微生物群落组成中, 识别出的主要菌种已体现出较大的差异性, 故此处采用门水平下菌群结构组成进行微生物群落分析.底泥修复115 d时门水平上的微生物群落组成如图 2a所示, 反映出促生剂不同投量条件下底泥中微生物结构的差异性.结果显示, 底泥样品中相对丰度大于1%的8个主要细菌门类分别是Proteobacteria(45.72%~56.40%)、Chloroflexi(13.92%~19.24%)、Bacteroidetes(6.81%~11.45%)、Nitrospirae(3.61%~7.72%)、Acidobacteria(3.12%~4.36%)、Aminicenantes(1.42%~3.76%)、Firmicutes(1.18%~3.43%)、Actinobacteria(0.76%~1.62%), 其中, 各样本的优势菌门均为Proteobacteria.研究发现, Proteobacteria(变形菌门)在硝酸盐降解、硫氧化以及有机物降解去除等方面具有重要作用(Chen et al., 2017). Chloroflexi(绿弯菌门)可利用葡萄糖和N-乙酰氨基葡糖进行代谢, 能降解污水中的溶解性微生物产物(SMP), 还能诱导厌氧条件下的氮去除(Miura et al., 2007). Nitrospirae(硝化螺旋菌门)与亚硝酸盐氧化、硫氧化、硫酸盐还原等有关(Huang et al., 2016).菌剂与促生剂协同修复组中的主要优势菌群(门)均与氮素、有机质的循环有关.协同修复组中Firmicutes的相对丰度分别为2.37%、2.71%、1.91%、3.43%, 均高于对照组中其相对丰度值1.18%, 且促生剂投量为0.11 g·L-1时Firmicutes的相对丰度显著高于其他投量条件下的相对丰度值(p < 0.05).许多研究表明, Firmicutes具有异养硝化功能, 且对某些有机污染物具有一定去除能力(He et al., 2016).说明投加促生剂可增强底泥中的硝化作用, 提升微生物对有机物的转化利用作用, 且促生剂投量为0.11 g·L-1时该促进效果可能更显著.
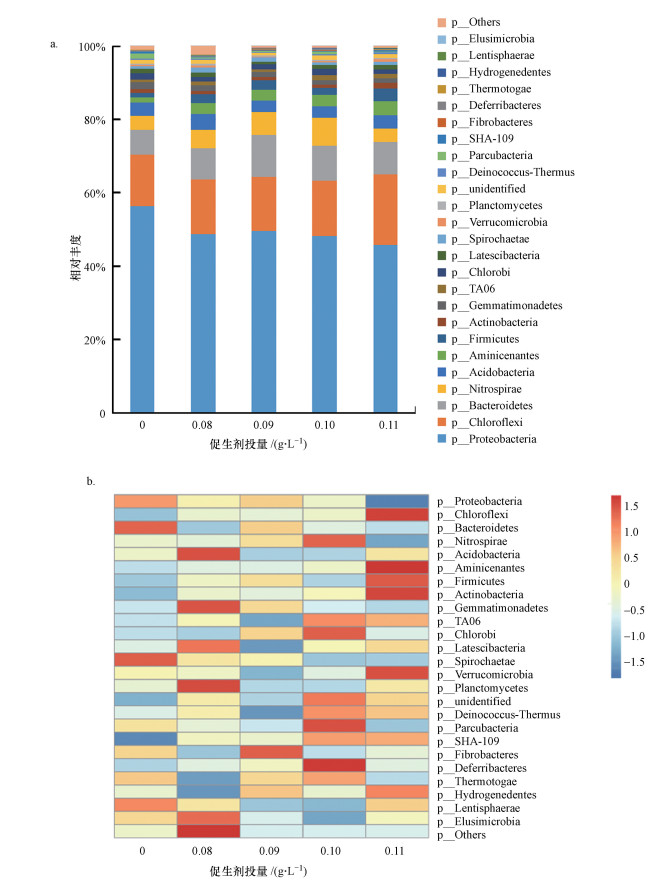 |
| 图 2 促生剂不同投量下底泥中底泥细菌(门)群落结构组成图(a)和主要细菌门类热图(b) Fig. 2 Structure composition of bacterial community(phylum) (a) and heat map(b) in sediment under different dosages of biostimulant |
由热图分析也可以得到类似的结果.如图 2b所示, 投加促生剂后底泥中的微生物群落结构会发生演替.与对照组相比, 协同修复组的优势菌(门)主要为Aminicenantes、Firmicutes、Actinobacteria.其中, Aminicenantes与苯酚降解有关, 且对碳水化合物有较高的代谢能力(Huang et al., 2016). Actinobacteria(放线菌门)可以多种复杂有机化合物为营养物质生长, 产生降解纤维素和木质素的酶(Getha et al., 2005). Morgante等(2010)的研究表明生物修复措施能引起底泥原有微生物群落演替.这说明投加促生剂可刺激底泥土著微生物群落向更适宜去除氮、磷及有机质的方向演替, 从而增强对底泥中氮、磷及有机质等污染物质的去除效果(刘晓伟等, 2013).同时可以发现, 促生剂不同投量条件下底泥中微生物群落组成差异较为明显, 说明促生剂投量对细菌(门)群落构成具有一定影响.
通过PERMANOVA分析得R2=0.80433, p < 0.05, 说明投加促生剂会对底泥微生物群落造成较大的差异.通过115 d时细菌门类水平上的群落结构主成分分析(图 3)可以看出, 两个轴贡献了70.9%的信息量.各协同修复组距离对照组均较远, 且随促生剂投量的增加, 距离总体上呈递增趋势, 说明菌群差异性随促生剂投量的增加而升高.
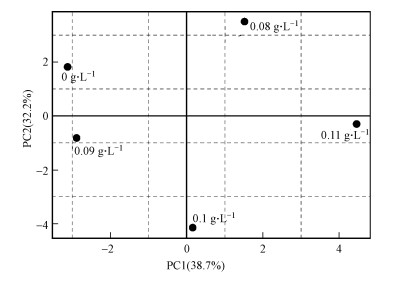 |
| 图 3 促生剂不同投量下底泥中细菌门类PCA图 Fig. 3 PCA map of bacterial phyla species in sediment under different dosages of biostimulant |
促生剂不同投量条件下反应器底泥中脲酶活性的变化如图 4a所示.各反应器中底泥脲酶活性在前期均波动下降, 50 d后保持相对稳定, 研究发现, 脲酶活性与底泥中总可利用氮呈正相关(Reynolds et al., 1985), 说明各促生剂投量条件下底泥中可利用氮含量均下降.其中, 在促生剂投量为0.10 g·L-1的菌剂与促生剂协同修复组中, 脲酶活性在第50 d左右时就达到较低水平并在后期保持相对稳定, 此投量条件下脲酶活性比其余各组更快稳定在较低水平, 说明促生剂投量为0.10 g·L-1的协同修复组可加快底泥对可利用氮的降解, 且降解效果良好.
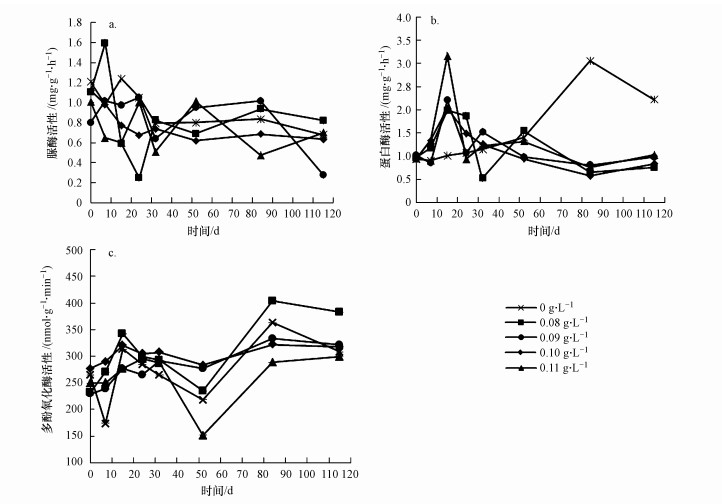 |
| 图 4 不同促生剂投量下底泥酶活性的变化 (a.脲酶, b.蛋白酶, c.多酚氧化酶) Fig. 4 Effect of different dosages of biostimulant on enzyme activity of sediment (a. urease, b. protease, c. polyphenol oxidase) |
图 4b反映的是促生剂不同投量条件下底泥蛋白酶的活性, 除对照组外, 各协同修复组中底泥蛋白酶活性均在第10 d时升高, 在第20 d时达到峰值, 后期波动下降; 单独投加菌剂组蛋白酶活性从第50 d开始升高, 在第84 d时达到峰值3.06 mg·g-1·h-1, 后期逐渐下降.据Wilczek等(2005)的报道, 底泥中蛋白酶的活性与蛋白质含量呈正相关, 且与氮循环相关.在单独投加菌剂组中, 实验后期蛋白酶活性较高, 说明底泥中剩余较多的蛋白质, 充足的蛋白质能满足微生物的代谢和繁殖, 没有成为蛋白酶合成和分泌的限制因子.在协同修复组中, 由于投加的促生剂能刺激底泥微生物的代谢和繁殖, 以及增加底泥中TTN的含量, 因此投加促生剂在前期提高了蛋白酶活性, 刺激蛋白酶的合成与分泌, 加快对蛋白质类物质的分解去除; 后期经过菌剂和促生剂协同修复后底泥中大量蛋白质类物质被降解, 蛋白酶活性明显下降.同时, 由图 2a可以看出, 协同修复组中Bacteroidetes(拟杆菌门)相对丰度明显高于对照组, 根据Kampmann等(2012)的研究, Bacteroidetes在蛋白质降解过程中起到重要作用, 说明投加促生剂能有效促进底泥微生物活性, 进而加快蛋白酶的合成与分泌, 提高对蛋白质类物质的降解效果.促生剂投量为0.10 g·L-1时, 蛋白酶活性更早维持在较低水平, 但到后期, 协同修复组中不同投量的促生剂对底泥蛋白酶活性的影响无明显差异.
通过图 4c可以看出, 各反应器中底泥多酚氧化酶活性均呈现波动升高的趋势, 说明底泥中含有较多难降解芳香族化合物.在菌剂与促生剂协同修复组中, 多酚氧化酶在后期的活性随促生剂投量的增大而降低, 这可能是由于促生剂投量的增加在一定程度上会增强降解难降解有机物的微生物的活性, 促进对酚类等难降解物质的分解去除.后期底泥中多酚氧化酶活性较弱可能是由于难降解有机质得到去除或转化, 剩余酚类物质含量降低, 底泥有机质的可生化性提高, 这与Tang等(2017)的研究结果类似.但总体上与单独投加菌剂组相比, 协同修复组多酚氧化酶的活性没有明显差异, 说明促生剂对多酚氧化酶的刺激效果并不十分理想.
3.3 促生剂投量对上覆水体相关指标影响图 5a反映的是各反应器上覆水的CODCr变化, 各反应器中上覆水CODCr均在前期急剧升高后波动下降.前期对照组上覆水CODCr的增幅低于菌剂与促生剂协同修复组, 这说明投加促生剂可提升底泥微生物活性, 使得底泥中有机质被大量分解并释放至上覆水中, 与孙远军(2009)研究结果类似.后期对照组的上覆水CODCr为30.00 mg·L-1, 各协同修复组中上覆水CODCr分别为22.30、28.46、16.82、19.20 mg·L-1, 单独投加菌剂组上覆水CODCr高于菌剂与促生剂协同修复组, 表明菌剂与促生剂协同修复在后期可通过提高对于微生物营养物质的供给来促进上覆水中的微生物代谢活动(郗文君等, 2015), 进而提高对有机污染物的利用(Milestone et al., 2007; Mounteer, 2009), 促进有机物的降解速率, 有利于上覆水中有机物的去除.其中, 协同修复组中当促生剂投量为0.10 g·L-1时, 上覆水CODCr稳定浓度低于其余各组, 说明在协同修复组中投量为0.10 g·L-1的促生剂对微生物的促进效果较优.
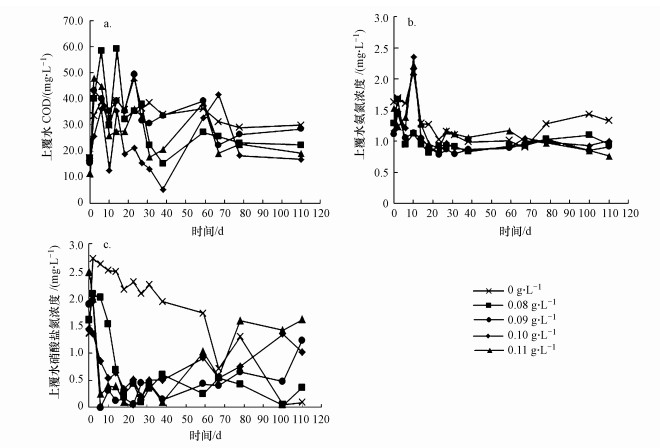 |
| 图 5 不同投量的促生剂对上覆水体的影响 (a.COD, b.氨氮, c.硝酸盐氮) Fig. 5 Effect of different dosages of biostimulant on overlying water quality (a.COD, b.NH4+-N, c.NO3--N) |
如图 5b所示, 所有反应器中上覆水NH4+-N浓度在前期明显升高, 之后随时间逐渐降低, 最后维持在稳定状态.上覆水中NH4+-N浓度在前期升高, 可能是由于营养盐从底泥释放至上覆水中.后期协同修复组中上覆水NH4+-N稳定浓度均低于对照组稳定浓度1.33 mg·L-1, 说明投加促生剂可提高上覆水中微生物硝化作用的效果.各反应器上覆水NO3--N浓度如图 5c所示, 前期60 d内, 菌剂与促生剂协同修复组上覆水NO3--N浓度降低86.6%~96.8%, 下降幅度较大, 与对照组NO3--N浓度变化趋势有明显差异, 这说明投加促生剂在前期可有效提高上覆水中微生物的反硝化作用, 提高上覆水中NO3--N的去除率.后期协同修复组中NO3--N浓度呈现上升趋势, 结合图 5b可知, 上覆水中NH4+-N与NO3--N发生了相互转化, 促生剂的作用使得硝化反应占主导地位.
3.4 促生剂投量对底泥修复效果影响底泥中有机物随时间变化的情况如图 6a所示.根据t分布检验结果, 第30 d促生剂投量为0.10 g·L-1时的底泥TOC数据认为是异常值不予考虑.从图中可以看出, 底泥TOC含量在前60 d处于波动稳定, 60 d后逐渐下降, 说明促生剂对于有机质的去除主要在后期起效.在菌剂与促生剂协同修复组中, 促生剂投量为0.10 g·L-1时底泥TOC含量在60 d后下降幅度较大且下降速率最快, 总体上比其余各组的TOC含量低, 底泥TOC含量由初始值0.808%下降至第115 d时的0.687%, 去除率为14.9%.这可能是由于促生剂投量为0.10 g·L-1的协同修复组在第115 d时优势菌群(纲)Betaproteobacteria的含量(16.1%)远高于其余各组, 相关研究表明, Betaproteobacteria可降解芳香烃类化合物及多环有机化合物(Martin et al., 2012), 有效降解去除底泥中有机质, 因此该投量下的底泥TOC去除效果更好.
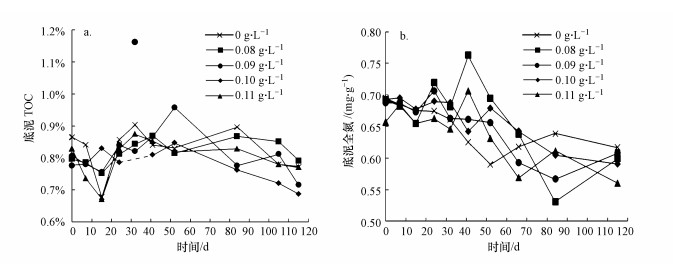 |
| 图 6 不同投量的促生剂对底泥的修复效果 (a.TOC, b.全氮) Fig. 6 Effect of different dosages of biostimulant on the remediation of sediment (a. TOC, b.TN) |
图 6b反映了各反应器中底泥的全氮的变化, 从图中可以看出, 底泥全氮整体上均呈波动下降的趋势, 80 d后, 菌剂和促生剂协同修复组的底泥全氮均比对照组低, 说明投加的促生剂提高了底泥全氮的去除率. 115 d时单独投加菌剂组与协同修复组的底泥全氮分别为0.616、0.599、0.608、0.591、0.560 mg·g-1, 促生剂投量为0.11 g·L-1时的底泥全氮含量最低, 去除率为14.8%高于其余各组, 这可能与115 d时该组中Chloroflexi的相对丰度明显高于其余各组有关(图 2a).促生剂可为底泥中的反硝化菌提供必需的营养物质和酶, 有利于促进反硝化过程, 当促生剂与菌剂协同修复时, 促生剂不仅能促进底泥土著微生物生长, 还能为投加的异养硝化-好氧反硝化菌提供营养物质(Tang et al., 2017).
4 结论(Conclusions)1) 底泥的生态环境修复有助于从根源消除污染问题.高通量测序结果表明, 与单独投加菌剂组相比, 菌剂与促生剂协同修复组中促生剂对底泥微生态环境改善效果良好.在本实验设计的0~0.11 g·L-1促生剂投量条件下, 促生剂投量为0.10 g·L-1的协同修复组中主要功能菌群相对丰度较其他组有明显提升.
2) 酶活性常用于指示环境中的微生物活性及相关营养物质的含量变化.菌剂与促生剂协同修复组中, 脲酶活性与蛋白酶活性总体上低于对照组, 投加生物促生剂可加快底泥对可利用氮及蛋白质类物质的降解, 且降解效果良好.菌剂与促生剂协同修复对底泥中酚类等难降解有机物的降解无明显作用, 但能提高上覆水中CODCr的去除效果.
3) 微生物群落结构对底泥中氮素及有机质的转化降解有重要影响. Chloroflexi、Proteobacteria及Firmicutes等主要功能菌在氮循环中起到重要作用, 菌剂与促生剂协同修复可为微生物提供必要的营养物质并加强微生物活性, 使底泥硝化作用与反硝化作用均得到提升, 在菌剂与促生剂协同修复组中, 促生剂投量为0.11 g·L-1时的底泥全氮含量最低, 去除率14.8%高于其余各组, 系统中氮的降解效果明显提高, 这可能与115 d时该组中Chloroflexi的相对丰度明显高于其余各组有关.促生剂投量为0.10 g·L-1的协同修复组中底泥TOC去除率为14.9%, 高于其余各组底泥TOC去除率, 这与Betaproteobacteria、Chloroflexi、Bacteroidetes等功能细菌群落的变化规律类似.投加生物促生剂, 促使微生物群落向更适宜降解去除氮素及有机质的方向演替.
Chen C, Xu X, Xie P, et al. 2017. Pyrosequencing reveals microbial community dynamics in integrated simultaneous desulfurization and denitrification process at different influent nitrate concentrations[J]. Chemosphere, 171: 294–301.
DOI:10.1016/j.chemosphere.2016.11.159
|
Eggleton J, Thomas K V. 2004. A review of factors affecting the release and bioavailability of contaminants during sediment disturbance events[J]. Environment International, 30(7): 973–980.
DOI:10.1016/j.envint.2004.03.001
|
Getha K, Vikineswary S, Wong W H, et al. 2005. Evaluation of Streptomyces sp. strain g10 for suppression of Fusarium wilt and rhizosphere colonization in pot-grown banana plantlets[J]. Journal of Industrial Microbiology & Biotechnology, 32(1): 24–32.
|
高璟赟. 2010.稻田土壤氧化酶活性与有机碳转化关系研究[D].武汉: 华中农业大学
http://cdmd.cnki.com.cn/Article/CDMD-10504-1010010379.htm |
关松荫. 1986. 土壤酶及其研究法[M]. 北京: 农业出版社: 294–306.
|
贺宝根, 周乃晟, 袁宣民. 1999. 底泥对河流的二次污染浅析[J]. 环境污染与防治, 1999, 21(3): 41–43.
|
He T, Guan W, Luan Z, et al. 2016. Spatiotemporal variation of bacterial and archaeal communities in a pilot-scale constructed wetland for surface water treatment[J]. Applied Microbiology & Biotechnology, 100(3): 1479–1488.
|
Huang C, Shi Y, Gamal El-Din M, et al. 2016. Optimization of ozonation combined with integrated fixed-film activated sludge (IFAS) in the treatment of oil sands process-affected water (OSPW)[J]. International Biodeterioration & Biodegradation, 112: 31–41.
|
Kampmann K, Ratering S, Kramer I, et al. 2012. Unexpected stability of bacteroidetes and firmicutes communities in laboratory biogas reactors fed with different defined substrates[J]. Applied and Environmental Microbiology, 78(7): 2106–2119.
DOI:10.1128/AEM.06394-11
|
林先贵. 2010. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社: 254–255.
|
刘成. 2012.生物促生剂联合微生物菌剂修复城市黑臭河道底泥实验研究[D].南宁: 广西大学
http://cdmd.cnki.com.cn/Article/CDMD-10593-1012495539.htm |
刘晓伟, 谢丹平, 李开明, 等. 2013. 投加生物促生剂对底泥微生物群落及氮磷的影响[J]. 中国环境科学, 2013, 33(S1): 87–92.
|
吕梦怡. 2016.河道底泥的化学-生物协同修复效果及作用机制[D].天津: 天津大学
http://cdmd.cnki.com.cn/Article/CDMD-10056-1018069788.htm |
Martin F, Torelli S, Paslier D L, et al. 2012. Betaproteobacteria dominance and diversity shifts in the bacterial community of a PAH-contaminated soil exposed to phenanthrene[J]. Environmental Pollution, 162(162): 345–353.
|
Milestone C B, Stuthridge T R, Fulthorpe R R. 2007. Role of high molecular mass organics in colour formation during biological treatment of pulp and paper wastewater[J]. Water Science & Technology A Journal of the International, 55(6): 191.
|
Miura Y, Watanabe Y, Okabe S. 2007. Significance of chloroflexi in performance of submerged Membrane Bioreactors (MBR) treating municipal wastewater[J]. Environmental Science & Technology, 41(22): 7787–7794.
|
Morgante V, Lópezlópez A, Flores C, et al. 2010. Bioaugmentation with Pseudomonas sp. strain MHP41 promotes simazine attenuation and bacterial community changes in agricultural soils[J]. Fems Microbiology Ecology, 71(1): 114–126.
DOI:10.1111/fem.2010.71.issue-1
|
Mounteer A. 2009. Improvement of eucalyptus bleached kraft pulp effluent treatment through combined ozone-biological treatment[J]. World Pulp & Paper, 7(7): 26.
|
彭祺, 郑金秀, 涂依, 等. 2007. 污染底泥修复研究探讨[J]. 环境科学与技术, 2007(2): 103–106.
DOI:10.3969/j.issn.1003-6504.2007.02.038 |
Reynolds C M, Wolf D C, Armbruster J A. 1985. Factors related to urea hydrolysis in soils[J]. Soil Science Society of America Journal, 49(1): 104–108.
DOI:10.2136/sssaj1985.03615995004900010021x
|
孙远军. 2009.城市河流底泥污染与原位稳定化研究[D].西安: 西安建筑科技大学
http://cdmd.cnki.com.cn/Article/CDMD-10703-2009136332.htm |
Tang Y, Li M, Xu D, et al. 2017. Application potential of aerobic denitrifiers coupled with a biostimulant for nitrogen removal from urban river sediment[J]. Environmental Science & Pollution Research, 25(6): 5980–5993.
|
Toberman H, Evans C D, Freeman C, et al. 2008. Summer drought effects upon soil and litter extracellular phenol oxidase activity and soluble carbon release in an upland Calluna heathland[J]. Soil Biology and Biochemistry, 40(6): 1519–1532.
DOI:10.1016/j.soilbio.2008.01.004
|
Wilczek S, Fischer H, Pusch M T. 2005. Regulation and seasonal dynamics of extracellular enzyme activities in the sediments of a large Lowland River[J]. Microbial Ecology, 50(2): 253–267.
DOI:10.1007/s00248-004-0119-2
|
Xiong J, Li G, An T. 2016. The microbial degradation of 2, 4, 6-tribromophenol (TBP) in water/sediments interface: Investigating bioaugmentation using Bacillus sp. GZT[J]. Science of the Total Environment, 575: 573–580.
|
郗文君, 张安龙, 杜飞, 等. 2015. 生物促生剂处理造纸废水的最佳工艺条件[J]. 纸和造纸, 2015, 34(11): 61–65.
|
杨晓杰. 2016.化学-生物生态协同修复受污染底泥的效果及评价[D].天津: 天津大学
http://cdmd.cnki.com.cn/Article/CDMD-10056-1017131597.htm |
余光伟, 雷恒毅, 刘广立, 等. 2007. 重污染感潮河道底泥释放特征及其控制技术研究[J]. 环境科学学报, 2007, 27(9): 1476–1484.
DOI:10.3321/j.issn:0253-2468.2007.09.011 |
中华人民共和国国家质量监督检验检疫总局. 2003. GB 19106-2003次氯酸钠溶液[S].北京: 中国标准出版社
|
中华人民共和国国家质量监督检验检疫总局. 2002. GB/T 601-2002化学试剂: 标准滴定溶液的制备[S].北京: 中国标准出版社
|
中华人民共和国环境保护部. 2015a. HJ 501-2009水质总有机碳的测定: 燃烧氧化-非分散红外吸收法[S].北京: 中国环境科学出版社
|
中华人民共和国环境保护部. 2015b. HJ 717-2014土壤质量全氮的测定: 凯氏法[S].北京: 中国环境科学出版社
|
钟萍, 李丽, 李静媚, 等. 2007. 河流污染底泥的生态修复[J]. 生态科学, 2007, 26(2): 181–185.
DOI:10.3969/j.issn.1008-8873.2007.02.019 |
 2019, Vol. 39
2019, Vol. 39


