2. 四会市环境科学研究所, 肇庆 526200;
3. 广州市环境监测中心站, 广州 510030
2. Sihui Institute of Environmental Sciences, Zhaoqing 526200;
3. Guangzhou Environmental Monitoring Center, Guangzhou 510030
三氯生作为抗菌素和抗菌剂被认为对人体无急性毒性而被广泛使用.过去人们一度认为三氯生是安全低毒的, 因此尚未得到足够重视.但随着三氯生被广泛使用, 环境中检测到三氯生的含量越来越高(Singer et al., 2002; Wu et al., 2007; Chau et al., 2008; Ramaswamy et al., 2011; Zhao et al., 2013).在植物、动物甚至人体体内均能检测到三氯生(Adolfsson-Erici et al., 2002; Allmyra et al., 2006; Kookana et al., 2013).虽然环境中的大部分三氯生最终会随污水进入污水处理厂, 但目前的污水处理系统并未能让三氯生得到有效处理, 由于三氯生的疏水性, 大部分被污泥吸附, 少部分随污水出水进入自然水体中(Bester et al., 2003; Heidler et al., 2007), 即便如此, 由于污水处理厂出水频繁, 也使得这成为三氯生进入环境水体的重要方式.污水厂出水受纳河流的水生生物直接暴露于较高浓度的三氯生下, 使水生动物活性降低(Nassef et al., 2010), 严重影响河流的生物膜功能, 使其大幅降低光合效率、细菌和硅藻的生存发育能力以及磷酸盐的吸收等(Ricart et al., 2010; Proia et al., 2013).
尽管三氯生的半衰期较短, 但由于长期大量输入环境中使得三氯生呈现出一种“持续性存在的状态”.其生物毒性、类似于内分泌干扰物的特征(Crawford et al., 2012)、降解过程的中间和最终产物的高毒性(Lindström et al., 2002; Butler et al., 2012; Lozano et al., 2013)等引起了研究者们的极大重视.目前, 已有不少针对三氯生去除技术的研究, 本试验针对生物炭吸附去除三氯生过程中的吸附特征进行研究, 以期能为三氯生的去除方法提供思路.
2 材料与方法(Materials and methods) 2.1 生物炭制备将玉米秸秆(Corn stalks)、皇竹草(Napier)和花生壳(Peanut shells)洗净, 55 ℃下烘至恒重, 粉碎机粉碎, 密封, 待用.
取上述生物质置于管式炉碳化, 碳化过程采用程序控温法, 碳化最高温度为700 ℃, 碳化和冷却过程均通氮气以隔绝空气.
制得的玉米秸秆生物炭(BCcs)、皇竹草生物炭(BCn)、花生壳生物炭(BCps)用1 mol·L-1的盐酸浸泡12 h, 去除灰分, 用去离子水洗至洗出液呈中性, 65 ℃烘至恒重, 研磨过60目筛, 储于棕色瓶备用.
2.2 实验试剂实验用三氯生为分析纯(东京化成工业株式会社), 三氯生标准品为色谱纯(美国Sigma).NaOH、HCl、氯化钠均为分析纯, KBr为光谱纯.
2.3 实验仪器Agilent 6420三重串联四极杆质谱, Agilent 1290超高效液相色谱仪, Spark Holland全自动在线固相萃取仪; 元素分析仪(德国Elemenetar公司的Vario EL cube), 回旋式振荡器(HY-5), WP-UP-Ⅱ-10型分析型超纯水机, 电子天平(JA1103N), pH计(PHS-3C), 电导率仪(DDS-307), 植物粉碎机, 恒温鼓风干燥箱.
2.4 实验方法 2.4.1 三氯生的测定方法① 测定参数 采用On-line SPE LC-MS/MS测定三氯生的浓度, 条件:在线固相萃取柱采用C18柱, 分析柱采用:poroshell 120 EC-C18, 3.0 mm×100 mm×2.7 μm (美国Agilent公司).在线固相萃取活化步骤为2 mL甲醇、2 mL水, 流速1.0 mL·min-1, 分析柱所用流动相为甲醇-水, 流速0.4 mL·min-1, 进样体积为4000 μL, 流动相程序见表 1.
| 表 1 流动相梯度条件 Table 1 Mobile phase condition |
质谱检测器采用电喷雾离子化源(ESI), 负离子方式检测; 毛细管电压2000 V; 温度:320 ℃; 干燥气10 L·min-1, 雾化器40 psi; 扫描方式为多重反应监测(MRM), 具体参数见表 2.
| 表 2 目标化合物MS/MS参数 Table 2 MS/MS parameters for triclosan detection |
经On-line SPE LC-MS/MS测定.以化合物与内标的质量浓度比为横坐标, 峰面积比(y)为纵坐标作图, 过原点绘制标准曲线.标准曲线(过原点)为y=1.500x, R2=0.9997.该实验方法测定三氯生的检出限(LOD)为10 ng·L-1, 以检出限(LOD)的4倍计算的定量限(LOQ)为40 ng·L-1.
② 加标回收率 取10 mL样品加入一定量的三氯生标准溶液, 使加标浓度为50 ng·L-1和500 ng·L-1, 与样品同分析, 计算回收率.
| 表 3 加标回收率 Table 3 Spike recovery of samples |
生物炭CEC的测定采用乙酸铵交换法(GB7863-87)(鲍士旦, 2010); 生物炭表面官能团的定量测试采用Boehm滴定法(Boehm et al., 1964; 1966);采用德国BRUKER公司VERTEX 70型傅里叶变换红外光谱仪(KBr压片法, 波数范围4000~650 cm-1)进行傅里叶红外光谱分析.本试验样品采用pH值漂移法测定等电点(Faria et al., 2004).生物炭经研磨、过筛后, 置于元素分析仪(德国Elemenetar公司的Vario EL cube型元素分析仪)中测定生物炭的C、H、N、S元素的百分含量, O元素由差减法得出, 样品平行测定3次.
2.4.3 实验方法称取一定量的生物炭于100 mL具塞离心管中, 加入50 mL三氯生溶液, 于150 r·min-1恒温摇床中振荡, 做两组空白, 每个处理3个平行, 用过滤装置使其固液分离(过滤对三氯生测定值无影响), 测定三氯生浓度.空白实验结果表明, 吸附过程中三氯生的光解、挥发以及离心管对其的吸附可以忽略不计.
2.4 数据处理三氯生吸附量和去除率用以下公式计算.
吸附量计算式:

|
(1) |
去除率计算式:
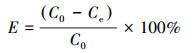
|
(2) |
式中, qe为吸附剂的吸附量(mg·g-1); V为三氯生溶液的体积(L); C0为三氯生的初始浓度(mg·L-1); Ce为吸附达到平衡时溶液中三氯生的浓度(mg·L-1); m为生物炭用量(g); E为三氯生的去除率.
3 结果与讨论(Results and discussion) 3.1 生物炭表征 3.1.1 生物炭CEC乙酸铵交换法测得的BCcs、BCn、BCps阳离子交换容量分别为2622、4181、910 mmol·kg-1.
3.1.2 生物炭表面官能团从表 4可以看出3种生物炭表面酸性官能团数量与碱性官能团数量相当, BCn和BCps中两种官能团数量约各占50%, BCcs的碱性官能团为52%, 略大于酸性官能团.3种生物炭的酸性官能团均是羧基数量>内酯基>酚羟基, 且3种生物炭表面官能团的数量均是BCcs>BCn>BCps, 生物炭表面含更多的官能团可能会提高对三氯生的吸附量, 从而增大吸附容量.
| 表 4 生物炭的Boehm滴定结果 Table 4 Boehm titration results of biochar |
3种生物炭的FT-IR红外光谱图如图 1所示.BCcs在785.36 cm-1的峰、BCn在794.14 cm-1的峰、BCps在795 cm-1的峰可能是吡啶β位上的—CH2—的振动(安增莉, 2011); BCcs在1087.36 cm-1处的峰, BCn在1099.36 cm-1、1151 cm-1处的峰和BCps在1093.29 cm-1、1161 cm-1处的峰则可能是羟基或羧基的C—O伸缩振动(石夏颖, 2014); BCcs在1560 cm-1处的峰、BCn在1573.36 cm-1处的峰、BCps在1570 cm-1处的峰可能来自羧基中的—COO-的反对称伸缩振动和内酯基中C=O的伸缩振动; BCcs在3425.14 cm-1处的吸收峰、BCn在3429 cm-1处的吸收峰、BCps在3614 cm-1处的宽峰可能为—OH伸缩振动产生, 可能的表面基团是羟基和羧基(石夏颖, 2014; 赵娟, 2016).
 |
| 图 1 3种生物炭的红外光谱图 Fig. 1 FT-IR spectra of the three biochars |
可见, 3种生物炭表面均存在羟基、羧基和内酯基.对比3种生物炭的红外谱图可以看出3种生物炭的特征吸收峰的波数范围大致相同, 表明这3种生物炭含的表面官能团也相同, 但3种生物炭的特征峰值和峰宽不同, 说明所含的官能团的数量可能不同(Singh et al., 2012; 杨颖等, 2012; 石夏颖, 2014).这与Boehm定量滴定结果相符.
3.1.4 生物炭等电点分析由图 2可知BCps的等电点为6.80, BCn的等电点为6.95, BCcs的等电点为8.90.随着pH值的增大BCps首先带负电荷, 然后是BCn和BCcs, 而当溶液pH>pKa(8.14)时三氯生开始去质子化成为阴离子(Lindström et al., 2002), 若在该pH下, 生物炭也带负电荷, 会与三氯生离子产生静电排斥, 不利于吸附进行.可见3种生物炭对三氯生的吸附适宜的pH范围大小为BCcs>BCn>BCps.
 |
| 图 2 生物炭等电点分析 Fig. 2 Isoelectric point analysis of the Corn stalks Biochars |
采用元素分析仪测定生物炭的元素组成, 结果见表 5.可见, 不同生物炭元素组成, 灰分含量不同, 对比3种生物炭的元素含量, 均是C含量最高, 两种秸秆生物炭(BCcs、BCn)的灰分要高于花生壳生物炭的灰分, 这可能是因为秸秆中富含氮、磷、钾、钙、镁等元素.
| 表 5 生物炭元素质量组成及原子比 Table 5 Mass composition and atomic ratio of the corn stalks biochar′ elements |
H/C、(O+N)/C、O/C可以反映出生物炭的芳香性, 极性以及亲水性特征, H/C越小芳香性越高、(O+N)/C越大极性越大、O/C越大亲水性越大(Chen et al., 2011; Jia et al., 2013).可以看出芳香性BCn>BCcs>BCps, 表面极性和亲水性大小均是BCcs>BCn>BCps, 因此更容易吸附极性分子, 而BCcs和BCn的H和O含量较高, 说明这两种生物炭可能含有更多的表面含氧官能团, 这与前面3种生物炭的红外光谱图以及Boehm滴定结果相符.
3.1.6 扫描电镜分析图 3为BCcs、BCn放大1000、2000和10000倍, BCps放大1000、2000和5000倍的电镜照片.可以看出BCcs呈块状、疏松多孔结构, 散落着长短不一、内含狭长孔道结构的树枝状物质.随着放大倍数的增大, 可以清晰的看到生物炭表面大小不一的多孔结构, 内部空心状, 表面比较粗糙; BCn呈层片状结构, 在孔隙中分布着小颗粒, 层状分布的坑洼结构上布满了排布规律的孔隙, 孔隙大小不一.BCps的表面则较为粗糙, 散落着颗粒, 与前两种生物炭相比所含孔隙极少, 并且随着放大倍数的增大也不能清晰的看到孔隙度, 甚至无法看清放大10000倍的扫描电镜图.
 |
| 图 3 生物炭扫描电镜图 Fig. 3 Scanning electron micrographs of biochar |
三氯生初始浓度为10 mg·L-1, 生物炭添加量为0.2、0.6、1、1.6、2、3、0.2、6、10、12、16、20 g·L-1.25 ℃下恒温振荡24 h, 3种生物炭添加量对三氯生去除率的影响见图 4a, 可知:①3种生物炭对三氯生的吸附能力为BCcs>BCn>BCps.三氯生的去除率与生物炭的种类有关, 不同生物炭官能团种类、数量、比表面积差异较大, 导致对三氯生的吸附能力不同, BCcs的表面官能团的数量最多, 表面孔隙丰富, 比表面积大, 吸附能力最好, 其次是BCn, BCps的吸附能力最差; ②一定范围内, 三氯生的去除率随着生物炭添加量的增加而增加, 25 ℃下, BCcs在3 g·L-1的添加量时, 对三氯生的吸附去除率就能达到98%, BCn在添加量为6 g·L-1时, 去除率能达到90%, 而BCps在添加量为10 g·L-1时, 去除率才达到85%.随着生物炭添加量的增加, 可提供的吸附位点就越多, 三氯生就越容易被吸附, 因而去除率增大, 但去除率不会随着生物炭添加量增加而无限增大, 因此, 从去除率和经济性考虑, 在处理含三氯生的污水时, 生物炭的添加量不宜过多.
 |
| 图 4 生物炭添加量(a)、振荡时间(b)、初始浓度(c)、振荡温度(d)、pH(e)和离子强度(f)对去除率的影响 Fig. 4 The efficiency of removal rate over biochar dosage(a), oscillation time(b), initial concentration(c), temperature oscillation(d), pH(e) and ionic strength(f) |
如图 4b所示, 25 ℃下, 三氯生初始浓度为10 mg·L-1, 生物炭添加量为4 g·L-1, 三氯生去除率随时间的变化.可知同样条件下, 3种生物炭对三氯生的去除率大小为BCcs>BCn>BCps, 达到吸附平衡的时间刚好相反.3种生物炭对三氯生的吸附可以分为两个阶段, 第一阶段为快速吸附阶段.BCcs、BCn和BCps分别是0~90、0~120以及0~200 min左右.第二阶段吸附速率逐渐趋于平缓, 直至达到吸附平衡.快速吸附阶段可能是由于反应刚开始时生物炭可以提供较多的吸附点位, 随着反应的进行, 生物炭表面的吸附结合位点逐渐减少, 从而导致吸附速率下降.
3.2.3 初始浓度25 ℃下, 在初始浓度(C0)为2、4、6、8、10 mg·L-1的三氯生溶液中加入10 g·L-1的生物炭, 24 h后取样, 从图 4c可以看出:三氯生的初始浓度对BCps去除率影响最小, 在三氯生初始浓度为2 mg·L-1与10 mg·L-1时去除率仅相差2%, 同样条件下BCn相差了20%, BCcs甚至相差了39%.3种生物炭对三氯生的吸附去除率均随着浓度的升高而升高, 可能随着初始三氯生质量浓度的增加能提高三氯生由液相向生物炭表面迁移的推动力, 导致吸附量增加.3种生物炭在三氯生的5种初始浓度下吸附去除率的差别可能是由于生物炭结构的差异性, BCcs表面官能团数量最多, 孔隙度丰富, 比表面积大, 更容易吸附三氯生.
3.2.4 振荡温度不同温度下, 在浓度为10 mg·L-1的三氯生溶液中加入6 g·L-1的生物炭, 三氯生去除率随时间的变化趋势见图 4d.可以看出3种生物炭对三氯生的去除率均随着温度的升高而降低, 低温有利于3种生物炭对三氯生的吸附, 3种生物炭对三氯生的吸附反应均为放热反应.
3.2.5 pH25 ℃下, 三氯生初始浓度为10 mg·L-1, BCcs、BCn和BCps添加量分别为6、10和10 g·L-1, 用1 mol·L-1的HCl或NaOH调节初始浓度为10 mg·L-1的三氯生溶液的pH值分别为3、5、7、9、10, 振荡120 min.生物炭对三氯生吸附去除率随着pH的变化见图 4e.
从图 4e可以看出, 酸性pH更有利于吸附反应的进行.这是因为当溶液的pH < 三氯生的pKa(8.14)时, 三氯生更多的以分子态存在, 当溶液pH>pKa时, 会有超过50%的三氯生去质子化, 当pH为9时, pH>pKa, 溶液中的三氯生主要以阴离子形态存在(Lindström et al., 2002), 由生物炭的等电点测定可知, BCps的等电点为6.80, BCn的等电点为6.95, BCcs的等电点为8.90.当溶液pH值超过等电点时, 生物炭开始带负电荷, 与三氯生阴离子之间存在静电斥力, 不利于吸附的进行, 因而随着pH值升高, 生物炭对三氯生的吸附能力减小.
3.2.6 离子强度25 ℃下, 三氯生初始浓度为10 mg·L-1, BCcs、BCn和BCps添加量分别为6、10和10 g·L-1, 用2 mol·L-1的NaCl调节离子强度至200、700、1000、2000、3000、6000 μS·cm-1, 振荡120 min.离子强度对三氯生去除率的影响见图 4f.可以看出, BCps对三氯生的吸附能力随着离子强度的增加而略有增大, 而BCn和BCcs则是随着离子强度的增大而减少.一般认为, 电解质的加入会削弱吸附剂与吸附质的相互作用(Filius et al., 2000), 在高离子强度下, 电解质占据了带相反电荷的点位, 削弱了吸附点位与吸附质之间的静电作用, 所以, 当吸附剂以静电吸附吸附吸附质时, 增加离子强度会削弱吸附剂对吸附质的吸附, 当吸附剂和吸附质之间存在静电排斥作用时, 增加离子强度可以增加吸附剂对吸附质的吸附.BCcs与BCn对三氯生的吸附可能属于静电吸附, 而BCps与三氯生之间可能存在静电排斥.
3.3 吸附热动力学 3.3.1 吸附动力学在10、25、40 ℃下, 生物炭添加量为2 g·L-1, 三氯生溶液初始浓度为10 mg·L-1, 在一定时间取样测定三氯生浓度.
① 吸附动力学曲线 3种生物炭在3种不同温度下的吸附动力学曲线见图 5.可知, 3种生物炭的吸附过程均分为两个阶段, 快速吸附和吸附速率变缓阶段.达到吸附平衡时饱和吸附量大小为BCcs>BCn>BCps.可见3种生物炭对三氯生的吸附量随温度的升高而降低, 吸附过程为放热反应.
 |
| 图 5 3种生物炭的吸附动力学曲线 Fig. 5 Adsorption kinetics of the three biochars |
② 吸附动力学模拟 采用准一级动力学模型、准二级动力学模型和颗粒内扩散模型(徐春梅, 2012)对实验结果进行分析模拟, 相关参数见表 6、表 7.可知, 实验条件下, 3种生物炭对三氯生的吸附均更符合准二级反应动力学, 且从该模型中计算的饱和吸附量(qe)与实际吸附量比较接近.平衡吸附量BCcs>BCn>BCps, 这与生物炭表征结果相符, 3种生物炭中BCcs的表面孔隙度和官能团最多, 极性最大, 能提供的吸附位点也更多, 对极性分子三氯生的吸附能力更强.其次是BCn, BCps对三氯生的吸附能力最弱.3种生物炭对三氯生的平衡吸附量随温度的升高缓慢减小, 进一步表明吸附过程为放热反应, 升高温度不利于吸附的进行, 与吸附能力实验结果一致.
| 表 6 不同温度下的准一级与准二级动力学模型相关参数 Table 6 Model parameters of quasi-one and quasi-second-order kinetic at different temperatures |
| 表 7 不同温度下的颗粒内扩散模型相关参数 Table 7 Intraparticle diffusion model parameters at different temperatures |
根据颗粒内扩散模型将3种生物炭的吸附过程分为两个阶段, 从表 7可知, 第一阶段(0~120 min)吸附速率较快, 比较符合颗粒内扩散动力学模型(R12>0.9);第二阶段(120 min~吸附平衡)吸附速率变慢, 吸附基本达到平衡, R22较小, 相关系数差, 不符合颗粒内扩散方程, 可能当接近平衡时间时, 由于吸附剂和吸附质的减少, 颗粒内扩散速率也变慢.整个吸附过程是多种动力学机理共同作用的结果(Özcan et al., 2006).
③ 吸附动力学参数 采用3种生物炭的准二级动力学方程的吸附速率常数k2进行拟合, 得到3种生物炭吸附三氯生的吸附活化能相关参数(表 8).BCcs的活化能(8.38)<BCn活化能(14.84)<BCps活化能(15.90), 这与3种生物炭吸附三氯生的吸附速率和吸附能力相符.
| 表 8 吸附活化能拟合图相关参数 Table 8 Fitting parameters of activation energy diagram |
在不同温度下, 三氯生溶液分别为1、2、4、6、8、10、12 mg·L-1, 生物炭含量为2 g·L-1.恒温振荡24 h, 取样测定.
① 吸附等温线和吸附等温方程拟合 用式(1)计算3种生物炭对不同浓度的三氯生溶液吸附达到平衡后的qe和Ce作图, 得到不同温度下吸附等温线如图 6所示.
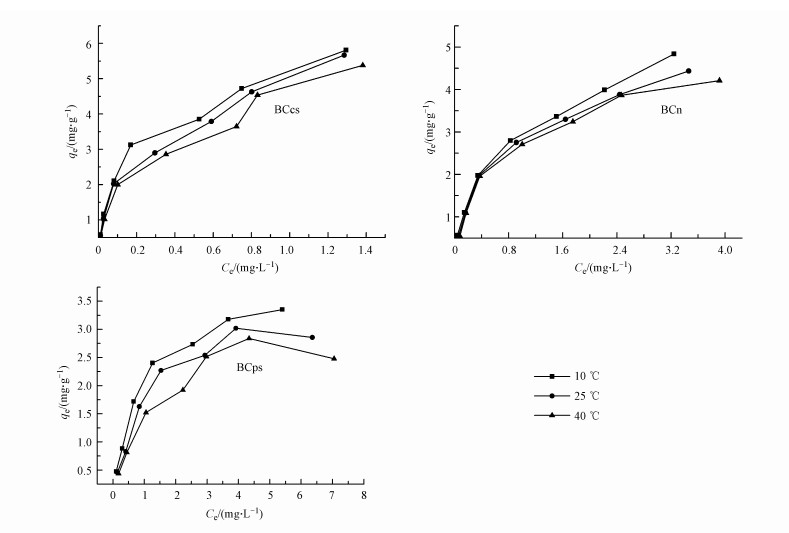 |
| 图 6 生物炭的吸附等温线 Fig. 6 Sorption isotherms of the three biochars |
描述等温吸附线的数学表达方程称为吸附等温方程, 采用Langmuir(Liu, 2006)吸附等温方程和Freundlich(Mesquita et al., 2002)吸附等温方程对图 6的3种生物炭的吸附等温线分别进行拟合, 得到相关参数, 见表 9.可知两个等温方程都能描述3种生物炭对三氯生的吸附行为, 可决系数R2均在0.93以上.BCcs和BCn的Freundilich拟合方程算出的n>2, 说明这两种生物炭容易吸附三氯生, BCps的Freundilich拟合方程算出的1<n<2, 说明BCps较难吸附三氯生(Chen et al., 2011).3种生物炭的饱和吸附量qmax和平衡常数KL随温度升高而减小, 进一步证实了该吸附过程为放热反应.
| 表 9 3种生物炭吸附三氯生的Langmuir和Freundlich拟合参数 Table 9 Fitting parameters of the Langmuir and Freundlich of biochar′s adsorption on triclosan |
② 吸附热力学参数 吸附热力学参数主要用来描述吸附反应的可能性大小.根据Langmuir平衡常数进行数据拟合, 得到吸附热力学参数(表 10).吸附自由能(△G)反映吸附过程推动力大小, 绝对值越大, 吸附推动力越大, 吸附剂与吸附质之间的作用力分为范德华力、氢键力、配位基交换、疏水键力、偶极间作用力和化学吸附力等.在吸附过程中放出热量用来补偿反应中熵的损失.各种作用力越强, 放热越多.因此, 通过测定三氯生在3种生物炭上的吸附热(即吸附焓变△H), 可以推断吸附的主要作用力, 有利于判断吸附机理(何敏祯, 2012).3种生物炭吸附三氯生的焓变值(△H)小于0说明3种生物炭对三氯生吸附无化学键和配位基交换等强的作用力(VonOepen et al., 1991), 自由能(△G)小于0, 说明该吸附反应是自发进行的, △G在-20~0 kJ·mol-1属于物理吸附, 在-80~-400 kJ·mol-1时, 属于化学吸附(Vimonses et al., 2009), 可见3种生物炭对三氯生的吸附为物理吸附.每种生物炭的△G随温度的升高而增大, 表明吸附过程中升高温度对3种生物炭的吸附均不利, 进一步证明3种生物炭对三氯生的吸附反应为放热反应.3种生物炭△G绝对值BCcs>BCn>BCps, 说明吸附过程推动力大小为BCcs>BCn>BCps(何敏祯等, 2013), 这与吸附能力研究实验结果相符, 熵值(△S)均为负值, 表明这3种生物炭在吸附过程中吸附体系的混乱度减小(吴鸿伟等, 2018).
| 表 10 不同温度下吸附热力学参数 Table 10 Parameters of absorption thermodynamics at different temperatures |
1) 生物炭表征结果表明:乙酸铵交换法测得的BCcs、BCn、BCps阳离子交换容量分别为2622、4181、910 mmol·kg-1; Boehm滴定结果表明3种生物炭表面均含羟基、羧基和内酯基等官能团, 且表面官能团数量均是BCcs>BCn>BCps; 3种生物炭的等电点分析结果表明3种生物炭对三氯生的吸附适宜的溶液pH范围大小为BCcs>BCn>BCps; 根据3种生物炭的FT-IR红外光谱图可知:3种生物炭表面均存在羟基、羧基和内酯基, 所含官能团种类相同但数量可能不同; 不同的生物炭表面结构有很大差异, BCps的表面光滑, 没有明显的孔隙结构, 而BCcs和BCn表面则含有较多大小不一的孔隙.从表征结果来看3种生物炭对三氯生的吸附能力大小可能为BCcs>BCn>BCps.
2) 吸附能力实验研究表明:3种生物炭对三氯生的吸附能力为BCcs>BCn>BCps.低温和酸性条件均有利于这3种生物炭对三氯生的吸附.低离子强度有利于BCcs和BCn对三氯生的吸附, 而BCps则相反.综合考虑三氯生去除效果, 经济性等方面因素, 去除三氯生的最佳条件是在25 ℃, 中性, 以BCcs为吸附剂, 吸附剂量为3 g·L-1, 反应90 min, 在三氯生初始浓度为10 mg·L-1时, 去除率就能达到98.28%.
3) 吸附机理研究表明:在10、25、40 ℃ 3种温度下, 3种生物炭对三氯生的吸附均更符合准二级反应动力学.吸附动力学参数分析表明3种生物炭对三氯生的吸附容易程度为BCcs>BCn>BCps.吸附热力学研究表明, 在10、25、40 ℃ 3种温度下, Freundilich等温方程和Langmuir等温方程均能描述3种生物炭对三氯生的吸附行为.3种生物炭吸附三氯生的反应均为自发放热反应, 吸附机制主要为物理吸附, 生物炭与三氯生之间无化学键、配位基交换等强作用力.这3种生物炭在吸附三氯生的过程中吸附体系的混乱度减小.
5 建议(Suggestion)本研究采用静态摇瓶试验方法, 用去离子水配置三氯生溶液, 模拟地表水中三氯生的污染情况, 对生物炭吸附三氯生的热力学和动力学机理进行了室内模拟研究, 鉴于模拟的三氯生溶液浓度与实际污水存在一定差异, 建议后续研究采用动态吸附柱试验并以含三氯生的环境废水为对象, 进一步考察上述3种生物炭的吸附性能.
Allmyr M, Adolfsson-Erici M, McLachlan M S, et al. 2006. Triclosan in plasma and milk from Swedish nursing mothers and their exposure via personal care products[J]. Science of the Total Environment, 372(1): 87–93.
DOI:10.1016/j.scitotenv.2006.08.007
|
安增莉. 2011.生物炭的制备及其对Pb(Ⅱ)的吸附特性研究[D].泉州: 华侨大学
http://cdmd.cnki.com.cn/Article/CDMD-10385-1011303787.htm |
鲍士旦. 2010. 土壤农化分析(第三版)[M]. 北京: 中国农业出版社: 156–159.
|
Bester K. 2003. Triclosan in a sewage treatment process-balances and monitoring data[J]. Water Research, 37(16): 3891–3896.
DOI:10.1016/S0043-1354(03)00335-X
|
Boehm H P, Diehl E, Heck W, et al. 1964. Surface oxides of carbon[J]. Angewandte Chemie International Edition in English, 3(10): 669–677.
DOI:10.1002/(ISSN)1521-3773
|
Boehm H P. 1966. Chemical Identification of Surface Groups[M]//Advances in catalysis. Academic Press, 16: 179-274
|
Crawford B R. 2012. Disruption of blastocyst implantation by triclosan in mice:impacts of repeated and acute doses and combination with bisphenol-A[J]. Reproductive toxicology, 34(4): 607–613.
DOI:10.1016/j.reprotox.2012.09.008
|
Butler E, Whelan M J, Sakrabani R, et al. 2012. Fate of triclosan in field soils receiving sewage sludge[J]. Environmental Pollution, 167: 101–109.
DOI:10.1016/j.envpol.2012.03.036
|
Chau W C, Wu J, Cai Z. 2008. Investigation of levels and fate of triclosan in environmental waters from the analysis of gas chromatography coupled with ion trap mass spectrometry[J]. Chemosphere, 73(1): S13–S17.
DOI:10.1016/j.chemosphere.2007.01.087
|
Chen H, Zhao J, Wu J, et al. 2011. Isotherm, thermodynamic, kinetics and adsorption mechanism studies of methyl orange by surfactant modified silkworm exuviae[J]. Journal of hazardous materials, 192(1): 246–254.
|
Chen X C, Chen G C, Chen L G, et al. 2011. Adsorption of copper and zinc by biochars produced from pyrolysis of hardwood and corn straw in aqueous solution[J]. Bioresource Technology, 102(19): 8877–8884.
DOI:10.1016/j.biortech.2011.06.078
|
Faria P C C, Orfao J J M, Pereira M F R. 2004. Adsorption of anionic and cationic dyes on activated carbons with different surface chemistries[J]. Water Research, 38(8): 2043–2052.
DOI:10.1016/j.watres.2004.01.034
|
Filius J D, Lumsdon D G, Meeussen J C L, et al. 2000. Adsorption of fulvic acid on goethite[J]. Geochimica et Cosmochimica Acta, 64(1): 51–60.
DOI:10.1016/S0016-7037(99)00176-3
|
何敏祯, 胡勇有, 雷超, 等. 2013. HDTMA改性沸石对三氯生的吸附特性研究[J]. 环境科学学报, 2013, 33(1): 20–29.
|
何敏祯. 2012. HDTMA改性沸石对三氯生的吸附行为与机理研究[D].广州: 华南理工大学
http://cdmd.cnki.com.cn/Article/CDMD-10561-1012452928.htm |
Heidler J, Halden R U. 2007. Mass balance assessment of triclosan removal during conventional sewage treatment[J]. Chemosphere, 66(2): 362–369.
DOI:10.1016/j.chemosphere.2006.04.066
|
Jia M Y, Wang F, Bian Y R, et al. 2013. Effects of pH and metal ions on oxytetracycline sorption to maize-straw-derived biochar[J]. Bioresource Technology, 136: 87–93.
DOI:10.1016/j.biortech.2013.02.098
|
Kookana R S, Shareef A, Fernandes M B, et al. 2013. Bioconcentration of triclosan and methyl-triclosan in marine mussels (Mytilus galloprovincialis) under laboratory conditions and in metropolitan waters of Gulf St Vincent, South Australia[J]. Marine pollution bulletin, 74(1): 66–72.
DOI:10.1016/j.marpolbul.2013.07.030
|
Lindström A, Buerge I J, Poiger T, et al. 2002. Occurrence and environmental behavior of the bactericide triclosan and its methyl derivative in surface waters and in wastewater[J]. Environmental Science & Technology, 36(11): 2322–2329.
|
Liu Y. 2006. Some consideration on the Langmuir isotherm equation[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 274(1/3): 34–36.
|
Lozano N, Rice C P, Ramirez M, et al. 2013. Fate of triclocarban, triclosan and methyltriclosan during wastewater and biosolids treatment processes[J]. Water research, 47(13): 4519–4527.
DOI:10.1016/j.watres.2013.05.015
|
Mesquita M E, e Silva J M V. 2002. Preliminary study of pH effect in the application of Langmuir and Freundlich isotherms to Cu-Zn competitive adsorption[J]. Geoderma, 106(3/4): 219–234.
|
Nassef M, Matsumoto S, Seki M, et al. 2010. Acute effects of triclosan, diclofenac and carbamazepine on feeding performance of Japanese medaka fish (Oryzias latipes)[J]. Chemosphere, 80(9): 1095–1100.
DOI:10.1016/j.chemosphere.2010.04.073
|
Özcan A, Öncü E M, Özcan A S. 2006. Adsorption of Acid Blue 193 from aqueous solutions onto DEDMA-sepiolite[J]. Journal of Hazardous materials, 129(1/3): 244–252.
|
Adolfsson-Erici M, Pettersson M, Parkkonen J, et al. 2002. Triclosan, a commonly used bactericide found in human milk and in the aquatic environment in Sweden[J]. Chemosphere, 46(9/10): 1485–1489.
|
Proia L, Vilches C, Boninneau C, et al. 2013. Drought episode modulates the response of river biofilms to triclosan[J]. Aquatic toxicology, 127: 36–45.
DOI:10.1016/j.aquatox.2012.01.006
|
Ramaswamy B R, Shanmugam G, Velu G, et al. 2011. GC-MS analysis and ecotoxicological risk assessment of triclosan, carbamazepine and parabens in Indian rivers[J]. Journal of hazardous materials, 186(2-3): 1586–1593.
DOI:10.1016/j.jhazmat.2010.12.037
|
Ricart M, Guasch H, Alberch M, et al. 2010. Triclosan persistence through wastewater treatment plants and its potential toxic effects on river biofilms[J]. Aquatic Toxicology, 100(4): 346–353.
DOI:10.1016/j.aquatox.2010.08.010
|
石夏颖. 2014.油料作物生物炭的制备、表征及其对Cr(Ⅵ)和Cu(Ⅱ)的吸附性能研究[D].兰州: 兰州交通大学
http://cdmd.cnki.com.cn/article/cdmd-10732-1014421774.htm |
Singer H, Müller S, Tixier C, et al. 2002. Triclosan:occurrence and fate of a widely used biocide in the aquatic environment:field measurements in wastewater treatment plants, surface waters, and lake sediments[J]. Environmental Science & Technology, 36(23): 4998–5004.
|
Singh S R, Singh A P. 2012. Treatment of water containg chromium (Ⅵ) using rice husk carbon as a newlow cost adsorbent[J]. International Journal of Environmental Research, 6(4): 917–924.
|
Vimonses V, Lei S M, Jin B, et al. 2009. Kinetic study and equilibrium isotherm analysis of Congo Red adsorption by clay materials[J]. Chemical Engineering Journal, 148(2/3): 354–364.
|
Von Oepen B, Kördel W, Klein W. 1991. Sorption of nonpolar and polar compounds to soils:processes, measurements and experience with the applicability of the modified OECD-Guideline 106[J]. Chemosphere, 22(3/4): 285–304.
|
吴鸿伟, 陈萌, 黄贤金, 等. 2018. 改性生物炭对水体中头孢噻肟的吸附机制[J]. 中国环境科学, 2018, 38(7): 2527–2534.
DOI:10.3969/j.issn.1000-6923.2018.07.018 |
Wu J L, Lam N P, Martens D, et al. 2007. Triclosan determination in water related to wastewater treatment[J]. Talanta, 72(5): 1650–1654.
DOI:10.1016/j.talanta.2007.03.024
|
徐春梅. 2012.小麦秸秆吸附剂的制备及其对溶液中磷酸根的吸附性能研究[D].兰州: 兰州理工大学
http://cdmd.cnki.com.cn/Article/CDMD-10731-1012411469.htm |
杨颖, 李磊, 孙振亚, 等. 2012. 活性炭表面官能团的氧化改性及其吸附机理的研究[J]. 科学技术与工程, 2012, 12(24): 6132–6137.
DOI:10.3969/j.issn.1671-1815.2012.24.033 |
赵娟. 2016.双酚A环氧树脂体系主要性能表征技术研究[D].青岛: 青岛科技大学
http://cdmd.cnki.com.cn/Article/CDMD-10426-1016720024.htm |
Zhao J L, Zhang Q Q, Chen F, et al. 2013. Evaluation of triclosan and triclocarban at river basin scale using monitoring and modeling tools:Implications for controlling of urban domestic sewage discharge[J]. Water Research, 47(1): 395–405.
DOI:10.1016/j.watres.2012.10.022
|
 2019, Vol. 39
2019, Vol. 39


