2. 四川大学 建筑与环境学院, 成都 610065
2. College of Architecture & Environment, Sichuan University, Chengdu 610065
三氯生(2, 4, 4-三氯-2-羟基二苯醚,triclosan, TCS)作为一种广谱杀菌消毒剂被广泛添加于日常生活用品和个人护理品(如牙膏、肥皂、洗手液、洗涤剂、护肤品等)(Gao et al., 2014).当前,TCS在不同环境介质(包括生活污水、地表水、地下水和底泥)中频繁被检出,美国30个洲139条河流中有80条检测到TCS;我国在珠江流域水体中检出TCS浓度高达478 ng·L-1(Kliegman et al., 2013; Kolpin et al., 2002; Zhao et al., 2010).有研究表明,TCS对某些水生生物(如藻类、鱼类等)有急性或慢性毒性作用.例如,TCS对淡水藻(S. subspicatus)的最大无影响浓度(NOEC)、最低有影响浓度(LOEC)和半抑制浓度(EC50)分别为0.5、1.2和2.8 μg·L-1;对青鳉(O. latipes)的半致死浓度(LC50)为600 μg·L-1(Kim et al., 2009; Orvos et al., 2002).此外,TCS能够干扰人体雌雄激素的分泌、诱发抗药性细菌的出现,其对人体健康和生态系统的影响不容忽视(Aranami and Readman, 2007; Gao et al., 2014).因此,TCS被认定为一种新兴的环境污染物,有必要对其在水中的消除进行研究.目前,国内外对水中TCS的去除已有诸多研究报道,多种处理技术(如臭氧氧化(Suarez et al., 2007)、高铁酸盐氧化(Yang et al., 2011)、高锰酸盐氧化(Zhang and Huang, 2003)、紫外/过氧化氢(罗从伟等,2017)、紫外/过硫酸盐(李青松等,2017)、光催化氧化(Yu et al., 2006)等)被证明能够有效降解水中的TCS.
TCS对光较为敏感,在太阳光照下,水中的TCS可直接发生降解.Aranami和Readman(2007)发现:TCS在淡水和海水中可被直接光解,其在这两种水体中的半衰期分别为8 d和4 d.虽然已有文献报道了TCS在水中的光解,但是研究重点集中在TCS的降解动力学和反应产物,对水中常见成分(如天然有机物(NOM)、无机阴离子等)对TCS光解的影响却少见报道.NOM和硝酸盐(NO3-)是水体中比较常见的两种光敏物质,其在太阳光照下可以产生羟基自由基(HO·),从而可以导致水中污染物的间接降解(Chen et al., 2009; Keen et al., 2012).传统的混凝沉淀和活性污泥处理工艺不能完全去除TCS,而UV-254 nm在饮用水和污水的消毒中正逐渐被使用,因此有必要研究UV-254 nm对TCS的光解.本研究拟在254 nm波长紫外光照下,考察pH、NOM、NO3-和HCO3-对水中TCS降解的影响;并利用液相色谱——质谱联用仪对TCS的降解产物进行检测分析;最后,根据鉴定的反应产物推测TCS的光解机理.
2 材料与方法(Materials and methods) 2.1 试剂三氯生(HPLC级,纯度≥97%)购自Sigma-Aldrich公司;硝酸钠(NaNO3)、碳酸氢钠(NaHCO3)、磷酸氢二钾(K2HPO4)、磷酸二氢钾(KH2PO4)均为分析纯级,购自Fisher Scientific公司;Suwannee河腐殖酸(Humic acid, HA)和富里酸(Fulvic acid, FA)购自国际腐殖质学会(International Humic Substances Society, IHSS);甲醇和乙腈为色谱纯;去离子水(Milli-pore, 18 MΩ·cm)用于试剂和反应液的配置.
2.2 光照实验光照实验在自制的平行光发射装置中进行,如图 1所示.所用光源为两根15 W的低压汞灯(Cole-Parmer公司),主要发射波长254 nm的紫外光.紫外光光强通过校准的光辐射计进行测定,平均光强为0.1 mW·cm-2.一个典型的试验过程如下:在反应器(Pyrex玻璃培养皿)中加入总体积为10 mL的反应液,盖上石英盖,将反应器放置到磁力搅拌器上,打开遮光板,平行光即会照射到反应器中,反应即开始并开始计时,在指定的取样时间点,取出0.15 mL的反应液加入到液相小瓶中,避光待测.整个试验都是在恒温和恒定搅拌速度下进行的.反应溶液的pH利用10 mmol·L-1的磷酸盐缓冲液进行调节.在TCS光解影响因素实验中,使用初始浓度为1 μmol·L-1的TCS;在TCS光解产物研究中,TCS初始浓度为10 μmol·L-1.除了产物分析,其他所有实验都至少重复3次.
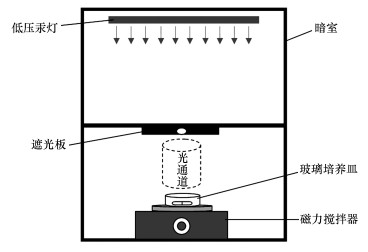 |
| 图 1 实验反应装置 Fig. 1 Experimental setup |
TCS利用高效液相色谱仪(HPLC, Agilent 1100)进行定量检测.Discovery HS C18色谱柱(2.1mm×150 mm, 5 μm, Supelco公司)用作固定相;流动相由25%纯水和75%乙腈组成;流速为0.2 mL·min-1;检测波长为221 nm;进样体积为50 μL;柱温为25 ℃.溶液pH采用pH计(pH meter 245, Corning公司)进行检测.TCS紫外可见吸收光谱利用紫外可见分光光度计(8452A, Hewlett Packard公司)进行扫描.TCS降解产物利用液相色谱——超高解析度四级杆飞行时间串联质谱仪(LC-QTOF/MS, Agilent公司)进行检测和鉴定.具体方法如下:色谱柱为Agilent ZORBAX Eclipse XDB-C18 Narrow Bore Rapid Resolution(2.1 mm×50 mm, 3.5 μm);流动相由纯水和乙腈组成,采用梯度洗脱的方式:0~8 min,乙腈由20%匀速增加到85%;然后保持1 min;9~10 min,乙腈由85%降回到20%.流速为0.4 mL·min-1;进样体积为20 μL;柱温为30 ℃.采用电喷雾电离(ESI),在负离子模式下进行扫描,扫描范围在50~500 u.所有质谱数据利用MassHunter B.04.00工作站软件(Agilent公司)进行分析.
3 结果与讨论(Results and discussion) 3.1 pH的影响如图 2所示,TCS在紫外辐射下可以发生降解,且降解效率随着pH的升高而逐渐增大.TCS的光解符合准一级反应动力学,其降解速率可以表示如下:
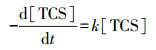
|
(1) |
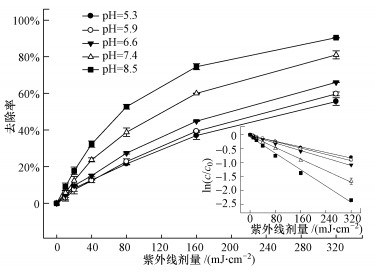 |
| 图 2 pH对TCS降解的影响 (实验条件:[TCS]0 = 1 μmol·L-1, 10 mmol·L-1磷酸盐缓冲液) Fig. 2 Effect of pH on the degradation of TCS by UV irradiation |
将式(1)修改为基于紫外线剂量的准一级反应动力学形式(Khan et al., 2014),得:
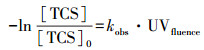
|
(2) |
式中,[TCS]0和[TCS]为反应前和指定的紫外线剂量下TCS的摩尔浓度(μmol·L-1);kobs为基于紫外线剂量的表观准一级反应速率常数(cm2·mJ-1);UVfluence为紫外线剂量(mJ·cm-2).
根据式(2),我们可以求得不同pH条件下TCS直接光解的表观速率常数,见表 1.在紫外光照下,TCS降解的表观速率随着pH的升高而逐渐增大,从pH 5.3时的(2.51 ± 0.19) × 10-3 cm2·mJ-1增大到pH 8.5时的(7.36 ± 0.04) × 10-3 cm2·mJ-1.该结果可能与TCS的摩尔吸光系数(εTCS)和量子产率(ΦTCS)有关,因为一种有机物发生光解需要满足两个必要条件:①有机物吸收一定波长的光子后可以发生激发,即摩尔吸光系数的情况;②激发态的有机物发生化学分解过程要明显优于物理失活过程,即量子产率的大小(Liu et al., 2015).图 3为不同pH值下TCS的摩尔吸光系数.在254 nm波长下,TCS的摩尔吸光系数从pH 5.9时的2118.1 L·mol-1·cm -1逐渐升高到pH 8.5时5065.1 L·mol-1·cm -1,如表 1所示.因此,在pH 5.9~8.5范围内,TCS降解速率的提高可能归因于逐渐升高的εTCS.除了摩尔吸光系数,量子产率也是影响化合物光解效率的一个重要因素.TCS在254 nm波长下的量子产率可以根据式(3)计算(Bolton and Stefan, 2002):
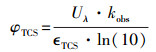
|
(3) |
| 表 1 不同pH值下TCS光解的表观速率常数及在254 nm波长下的摩尔吸光系数和量子产率 Table 1 The observed degradation rate constant, molar absorption coefficient and quantum yield at 254 nm of TCS at different pH values |
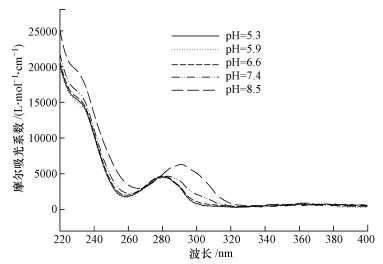 |
| 图 3 不同pH下TCS的摩尔吸光系数 (实验条件:[TCS]0 = 30 μmol·L-1, 10 mmol·L-1磷酸盐缓冲液) Fig. 3 The molar absorption coefficient of TCS at different pH values |
式中:Uλ为254 nm波长下的摩尔光子能量,其值为471528 J·Einstein-1(Bolton and Stefan, 2002).
求出的ΦTCS见表 1.虽然TCS在pH 5.3时的摩尔吸光系数高于pH 5.9时的值,但是pH 5.3时的ΦTCS最小,因此,这两种因素可能综合影响了TCS在该pH值下的光解,使其在研究的pH值中降解速率最慢.TCS的pKa为8.1(Kliegman et al., 2013),随着pH的升高,TCS主要以去质子化的形态存在,由上述结果可知:去质子化的TCS吸光能力强于质子化的TCS.
3.2 NOM的影响NOM在自然水体中是普遍存在的,在太阳光照下,其对水中污染物降解影响的研究已经被大量报道(Canonica, 2007; Carlos et al., 2012; Yu et al., 2010).通常,NOM对水中污染物的去除具有双重效应:①由NOM的遮光作用和自由基淬灭引起的抑制效应;②由激发态的NOM或光激发生成的活性氧物质(Reactive Oxygen Species, ROS,如HO·、1O2和O2·-等)引起的促进作用(Carlos et al., 2012; Xu et al., 2011).当前研究中,我们分别采用腐殖酸(HA)和富里酸(FA)代表NOM,研究NOM对254 nm波长紫外辐射下TCS降解的影响.如图 4所示,当存在不同浓度的HA或者FA时(通过溶解性有机碳来定量),TCS降解的表观速率与纯水中的相比会有一定程度的减小,且NOM浓度越高,TCS光解被抑制的越多.与FA相比,HA对TCS降解的抑制作用更大,这可能与它们的分子量及分子结构不同有关,需要对此进一步研究.该结果表明:在直接紫外光解TCS时,NOM的效应①强于效应②.
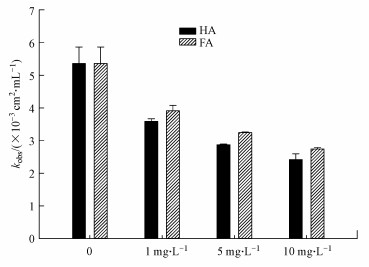 |
| 图 4 NOM对TCS去除的影响 (实验条件:[TCS]0 = 1 μmol·L-1, 10 mmol·L-1磷酸盐缓冲液(pH = 7.4)) Fig. 4 Effect of NOM on TCS removal under UV irradiation |
由图 5可以看出,NO3-的存在可以促进TCS的光解,且降解速率随着NO3-浓度的升高而增快.这可能归因于光激发NO3-产生的HO·的作用.NO3-作为水中比较常见的一种光敏物质,其在太阳光照下可以产生HO·,如式(4)~(7)所示(Mack and Bolton, 1999).为了证明上述的解释,我们向反应溶液中加入了HO·淬灭剂,即50 mmol·L-1甲醇(MeOH, kHO·/MeOH = 9.7 × 108 L·mol-1·s-1(Buxton et al., 1988)),结果如图 6所示.相比于UV/NO3-体系,TCS在UV/NO3-/MeOH体系中的降解受到了一定的抑制,与其直接紫外光解类似.这一结果有力地证明了我们的推测.
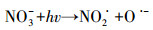
|
(4) |
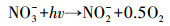
|
(5) |
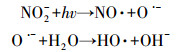
|
(6) |
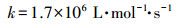
|
(7) |
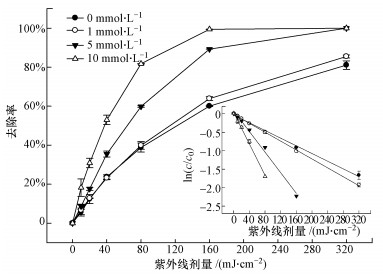 |
| 图 5 NO3-对TCS降解的影响 (实验条件:[TCS]0 = 1 μmol·L-1, 10 mmol·L-1磷酸盐缓冲液(pH = 7.4)) Fig. 5 Influence of NO3- on TCS degradation under UV irradiation |
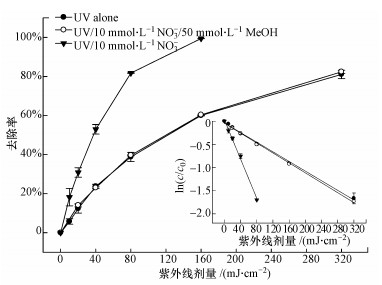 |
| 图 6 UV/NO3-体系中HO·的证明 (实验条件:[TCS]0 = 1 μmol·L-1, [NO3-]0 = 10 mmol·L-1, [MeOH]0 = 50 mmol·L-1, 10 mmol·L-1磷酸盐缓冲液(pH = 7.4)) Fig. 6 Confirmation of HO· in UV/NO3- system |
HCO3-是水体中普遍存在的一种阴离子,也是一种重要的HO·淬灭剂,两者的反应如式(8)所示(Buxton et al., 1988).自然水体中存在着多种光敏物质(如NOM、NO3-),在太阳光照下,这些光敏物质受激发可以生成一定浓度的HO·.因此,HCO3-可能会对水中有机污染物的光降解有一定的影响.为了弄清HCO3-对实际水体中TCS光解的影响,本研究利用UV/NO3-体系来探讨HCO3-对TCS光解的影响,结果如图 7所示.为了避免pH对TCS降解的影响,我们同时进行了3组控制实验,即TCS在UV/pH 8.5 buffer、UV/HCO3-和UV/NO3-/pH 8.5 buffer体系(4个反应体系pH相同,均为8.5)中的光解.从图 7可以看出,TCS在UV/pH 8.5 buffer和UV/HCO3-这两个体系中的降解基本类似;相比于UV/pH 8.5 buffer体系,TCS在UV/NO3-/pH 8.5 buffer体系中的降解效率明显提高,该发现与3.3节得到的结果相同,主要是由于光活化NO3-生成的HO·的作用.与UV/NO3-/pH 8.5 buffer体系相比,TCS在UV/NO3-/HCO3-中的降解速率进一步提高,这可能与HCO3-和HO·反应生成的碳酸根自由基(CO3·-)有关.CO3·-是一种选择性的单电子氧化剂,其主要通过电子转移或者抽氢作用与富含电子的有机物进行反应.虽然目前无文献资料报道CO3·-和TCS的二级反应速率常数,但是CO3·-与酚类化合物较易发生反应(Canonica et al., 2005),如苯酚(kCO3·-/phenol=2.4×108~4.7×108 L·mol-1·s-1)(Neta et al., 1988)、对氯苯酚(kCO3·-/4-chlorophenol=1.9×108 L·mol-1·s-1)(Neta et al., 1988).TCS分子结构中有酚结构,因此我们预测TCS与CO3·-的二级反应速率常数可能在106~108 L·mol-1·s-1范围内,两者可以发生较快的反应.
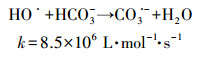
|
(8) |
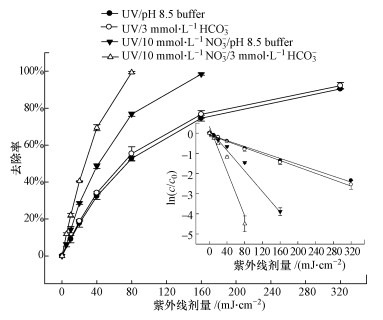 |
| 图 7 UV/NO3-体系中HCO3-的影响 (实验条件:[TCS]0 = 1 μmol·L-1, [NO3-]0 = 10 mmol·L-1, [HCO3-]0 = 3 mmol·L-1, 10 mmol·L-1磷酸盐缓冲液(pH = 8.5)) Fig. 7 Effect of HCO3- on TCS removal in UV/NO3- system |
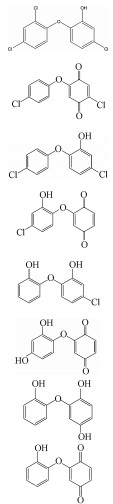
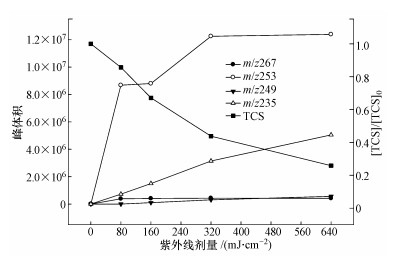
液相色谱——超高解析度四级杆飞行时间串联质谱仪(LC-QTOF/MS)用于TCS光解产物的检测和分析.为了提高产物丰度以便于检测,该部分研究使用初始浓度为10 μmol·L-1的TCS.为了避免磷酸盐对仪器测定的干扰,实验在超纯水中进行.在紫外光解TCS反应中,共检出7种降解产物,其分子质量(Mw)、质荷比(m/z)、分子式和可能的结构见表 2.图 8为TCS和主要反应产物(包括m/z 267、253、249和235)浓度随时间的变化.由于缺乏反应产物的标准物质,故不能对其浓度进行定量,因此本研究直接采用各个产物的峰体积数值(从质谱分析软件MassHunter B.04.00直接获得)来反映每种产物在反应体系中浓度的变化.从图 8可以看出,TCS持续被降解,在紫外线剂量为640 mJ·cm-2时,大约75%的TCS被消除;四种主要产物的浓度不断上升,其中m/z 253为最重要的产物.另外3种产物(m/z 231、217和215)在初始样品中未被检出,在光照后的水样中至少被检出2次,且浓度呈上升趋势,因此,也被认为是TCS的光解产物.
| 表 2 TCS光解产物 Table 2 Degradation products of TCS by UV irradiation |
 |
| 图 8 TCS及其主要降解产物随时间的变化 (实验条件:[TCS]0 = 10 μmol·L-1,去离子水) Fig. 8 Evolution of TCS and its major degradation products by UV irradiation |
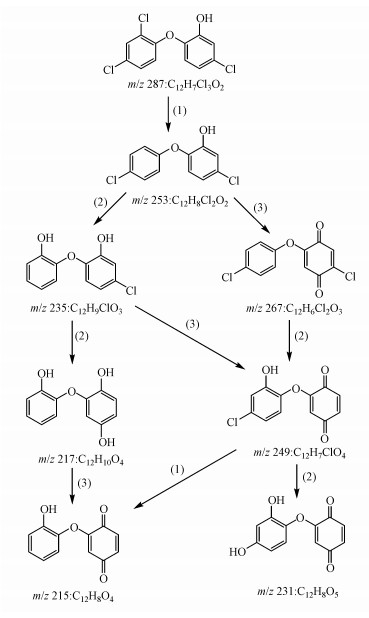
基于检出的降解产物,我们推测紫外光解TCS的反应机理主要包括3种不同的转化路径,分别为:(1)脱氯氢化、(2)脱氯羟基化、(3)醌化反应,如图 9所示.TCS在吸收紫外光子后可以转变为激发态的TCS,激发态的TCS可能会发生3种反应:①通过能量释放(如发射荧光)转变回基态的TCS;②直接分解;③通过能量转移(Ⅰ类反应)或电子转移(Ⅱ类反应)产生活性氧物质,如1O2、O2·-和HO·等,这些ROS可能与TCS发生反应.因此,TCS的紫外光降解可能包括直接光解和间接降解(自敏化降解)两种反应途径.其中,脱氯氢化可能是由直接紫外光解引起;脱氯羟基化和醌化反应可能是由自敏化降解引起.TCS通过脱氯氢化反应生成脱氯产物m/z 253,该产物通过脱氯羟基化反应和醌化反应分别生成产物m/z 235和m/z 267.生成的m/z 235通过路径(2)和(3)分别产生产物m/z 217和m/z 249,氢醌产物m/z 217通过抽氢作用生成产物m/z 215.产物m/z 249除了由m/z 235通过醌化反应生成,还可以由m/z 267通过路径(2)得到,该产物可进一步发生脱氯氢化和脱氯羟基化反应生成产物m/z 215和m/z 231.
 |
| 图 9 TCS可能的光解路径 Fig. 9 Possible transformation pathways of TCS by UV irradiation |
有研究表明,TCS在光照下可以转化为毒性更强的2, 8-二氯二苯并-对-二英(2, 8-dichlorodibenzo-p-dioxin, 2, 8-DCDD)(Latch et al., 2003; Wong-Wah-Chung et al., 2007).本研究只在紫外线剂量为80 mJ cm-2时检测到2, 8-DCDD,而在其他样品中未检出该化合物,因此我们不能确定该物质是否为TCS的光解产物,但是不能排除这种可能.由反应产物可以看出,TCS在紫外辐射下产生了多种醌类化合物,其毒性可能会有所增强,下一步我们将对反应液的毒性进行研究.
4 结论(Conclusions)1) TCS在紫外光照下可以发生降解,其光解遵循准一级反应动力学.TCS的降解效率随着pH的升高逐渐增大,去质子化的TCS摩尔吸光系数强于质子化的TCS.
2) 由于NOM的光掩蔽作用,NOM会抑制水中TCS的光解,且NOM浓度越高,抑制作用越明显.
3) NO3-的存在可以促进TCS的降解,这是由于光激发NO3-产生的HO·的作用.与单独存在NO3-相比,NO3-和HCO3-的同时存在进一步加快了TCS的光解,这可能归因于HCO3-和HO·反应生成的CO3·-.
4) TCS在紫外辐射下共生成7种降解产物,根据这些反应产物推测TCS的光解机理主要包括3种不同的转化路径,分别为脱氯氢化、脱氯羟基化和醌化反应.
Aranami K, Readman J W. 2007. Photolytic degradation of triclosan in freshwater and seawater[J]. Chemosphere, 66(6): 1052–1056.
DOI:10.1016/j.chemosphere.2006.07.010
|
Bolton J R, Stefan M I. 2002. Fundamental photochemical approach to the concepts of fluence (UV dose) and electrical energy efficiency in photochemical degradation reactions[J]. Research on Chemical Intermediates, 28(7): 857–870.
|
Buxton G V, Greenstock C L, Helman W P. 1988. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O-) in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 17(2): 513–886.
DOI:10.1063/1.555805
|
Canonica S. 2007. Oxidation of aquatic organic contaminants induced by excited triplet states[J]. Chimia, 61(10): 641–644.
DOI:10.2533/chimia.2007.641
|
Canonica S, Kohn T, Mac M, et al. 2005. Photosensitizer method to determine rate constants for the reaction of carbonate radical with organic compounds[J]. Environmental Science & Technology, 39(23): 9182–9188.
|
Carlos L, Martire D O, Gonzalez M C, et al. 2012. Photochemical fate of a mixture of emerging pollutants in the presence of humic substances[J]. Water Research, 46(15): 4732–4740.
DOI:10.1016/j.watres.2012.06.022
|
Chen Y, Hu C, Hu X, et al. 2009. Indirect photodegradation of amine drugs in aqueous solution under simulated sunlight[J]. Environmental Science & Technology, 43(8): 2760–2765.
|
Gao Y, Ji Y, Li G, et al. 2014. Mechanism, kinetics and toxicity assessment of OH-initiated transformation of triclosan in aquatic environments[J]. Water Research, 49(2): 360–370.
|
Keen O S, Love N G, Linden K G. 2012. The role of effluent nitrate in trace organic chemical oxidation during UV disinfection[J]. Water Research, 46(16): 5224–5234.
DOI:10.1016/j.watres.2012.06.052
|
Khan J A, He X, Shah N S, et al. 2014. Kinetic and mechanism investigation on the photochemical degradation of atrazine with activated H2O2, S2O82- and HSO5-[J]. Chemical Engineering Journal, 252: 393–403.
DOI:10.1016/j.cej.2014.04.104
|
Kim J W, Ishibashi H, Yamauchi R, et al. 2009. Acute toxicity of pharmaceutical and personal care products on freshwater crustacean (Thamnocephalus platyurus) and fish (Oryzias latipes)[J]. The Journal of Toxicological Sciences, 34(2): 227–232.
DOI:10.2131/jts.34.227
|
Kliegman S, Eustis S N, Arnold W A, et al. 2013. Experimental and theoretical insights into the involvement of radicals in triclosan phototransformation[J]. Environmental Science & Technology, 47(13): 6756–6763.
|
Kolpin D W, Furlong E T, Meyer M T, et al. 2002. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000:a national reconnaissance[J]. Environmental Science & Technology, 36(6): 1202–1211.
|
Latch D E, Packer J L, Arnold W A, et al. 2003. Photochemical conversion of triclosan to 2, 8-dichlorodibenzo-p-dioxin in aqueous solution[J]. Journal of Photochemistry and Photobiology A:Chemistry, 158(1): 63–66.
DOI:10.1016/S1010-6030(03)00103-5
|
李青松, 李学艳, 姚宁波, 等. 2017. UV/SPS降解水中三氯生的效能及动力学[J]. 环境科学, 2017, 38(4): 1467–1476.
|
Liu Y, He X, Duan X, et al. 2015. Photochemical degradation of oxytetracycline:Influence of pH and role of carbonate radical[J]. Chemical Engineering Journal, 276: 113–121.
DOI:10.1016/j.cej.2015.04.048
|
罗从伟, 马军, 江进, 等. 2017. UV/H2O2降解三氯生动力学及反应机理[J]. 哈尔滨工业大学学报, 2017, 49(2): 26–31.
DOI:10.11918/j.issn.0367-6234.2017.02.005 |
Mack J, Bolton J R. 1999. Photochemistry of nitrite and nitrate in aqueous solution:a review[J]. Journal of Photochemistry and Photobiology A:Chemistry, 128(1/3): 1–13.
|
Neta P, Huie R E, Ross A B. 1988. Rate constants for reactions of inorganic radicals in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 17(3): 1027–1284.
DOI:10.1063/1.555808
|
Orvos D R, Versteeg D J, Inauen J, et al. 2002. Aquatic toxicity of triclosan[J]. Environmental Toxicology and Chemistry, 21(7): 1338–1349.
DOI:10.1002/etc.v21:7
|
Suarez S, Dodd M C, Omil F, et al. 2007. Kinetics of triclosan oxidation by aqueous ozone and consequent loss of antibacterial activity:Relevance to municipal wastewater ozonation[J]. Water Research, 41(12): 2481–2490.
DOI:10.1016/j.watres.2007.02.049
|
Wong-Wah-Chung P, Rafqah S, Voyard G, et al. 2007. Photochemical behaviour of triclosan in aqueous solutions:Kinetic and analytical studies[J]. Journal of Photochemistry and Photobiology A:Chemistry, 191(2/3): 201–208.
|
Xu H, Cooper W J, Jung J, et al. 2011. Photosensitized degradation of amoxicillin in natural organic matter isolate solutions[J]. Water Research, 45(2): 632–638.
DOI:10.1016/j.watres.2010.08.024
|
Yang B, Ying G, Zhao J, et al. 2011. Oxidation of triclosan by ferrate:Reaction kinetics, products identification and toxicity evaluation[J]. Journal of Hazardous Materials, 186(1): 227–235.
DOI:10.1016/j.jhazmat.2010.10.106
|
Yu C, Zhang Y, Quan X, et al. 2010. Photochemical effect of humic acid components separated using molecular imprinting method applying porphyrin-like substances as templates in aqueous solution[J]. Environmental Science & Technology, 44(15): 5812–5817.
|
Yu J C, Kwong T Y, Luo Q, et al. 2006. Photocatalytic oxidation of triclosan[J]. Chemosphere, 65(3): 390–399.
DOI:10.1016/j.chemosphere.2006.02.011
|
Zhang H, Huang C. 2003. Oxidative transformation of triclosan and chlorophene by manganese oxides[J]. Environmental Science & Technology, 37(11): 2421–2430.
|
Zhao J, Ying G, Liu Y, et al. 2010. Occurrence and risks of triclosan and triclocarban in the Pearl River system, South China:from source to the receiving environment[J]. Journal of Hazardous Materials, 179(1/3): 215–222.
|
 2018, Vol. 38
2018, Vol. 38