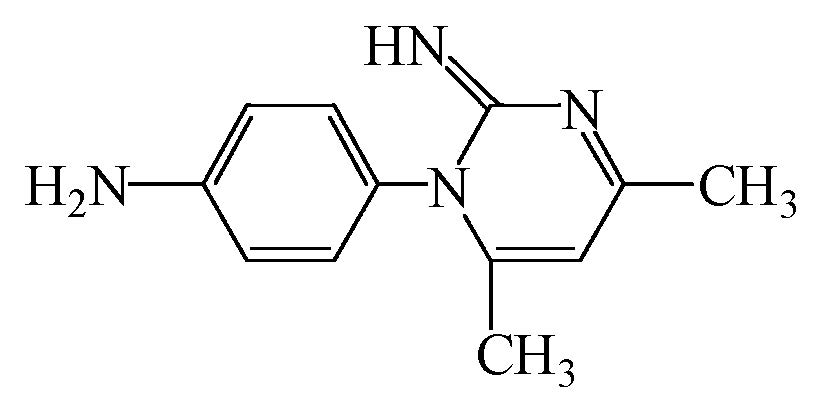
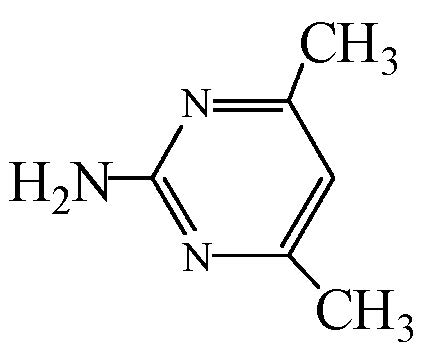
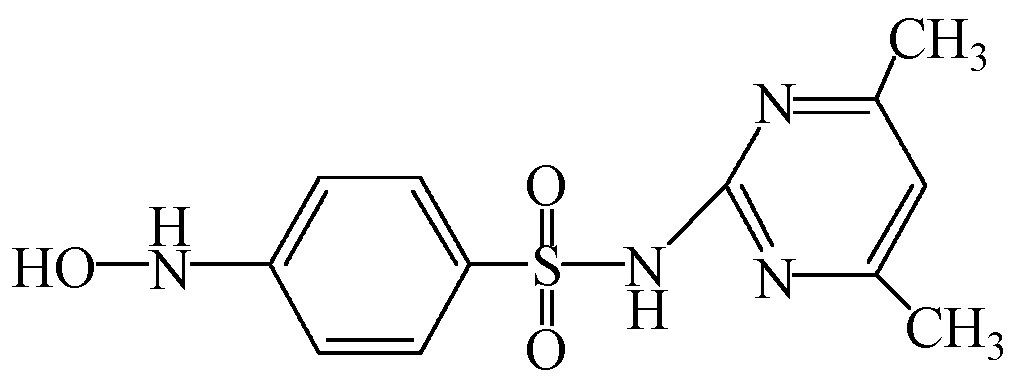
磺胺类药物(SAs)是具有对氨基苯磺酰胺结构的一类药物总称,因抗菌谱广、性质稳定、抗菌作用较强且价格低廉而广泛应用于人类医疗、食品加工、畜牧和水产动物养殖的疾病防治中,是成功应用于人类传染性疾病治疗的第一类抗菌剂(García Galán et al., 2008).据国内外的相关报道(郭欣妍等,2013;Baran et al., 2011;叶计朋等,2007),SAs虽然在环境水体中的检出浓度较低,但仍具有一定的生态毒性,因此,其环境残留问题也越来越受到国内外学者的重视.目前,国内外用于磺胺类药物降解的技术主要有O3氧化(Garoma et al., 2010)、UV/H2O2氧化(Guo et al., 2012)、Fenton氧化(符荷花等,2014)和UV-A/TiO2光催化降解(Baran et al., 2009)等.其中,Fenton技术是运用最多的高级氧化技术,可以降解大部分复杂的有机污染物,在废水处理中具有较高的优越性.然而Fenton技术的应用还存在着一些问题,例如,Watts等(1996)发现,H2O2不易运输与保存,并且在投加时稳定性差,容易分解,导致H2O2利用效率不高,从而使处理成本提高.Fenton反应的适宜pH范围为3~4,不利于污水的前处理,且随着pH的提高,Fe3+会产生大量Fe(OH)3沉淀影响后续处理(李宏,2007).因此,需要对传统的Fenton技术进行改良.
过碳酸钠(Sodium Percarbonate,SPC),化学式为2Na2CO3·3H2O2或Na2CO3·1.5H2O2,又称过氧碳酸钠,俗称固体双氧水.SPC与液态H2O2相比,性质更稳定,更容易保存与运输,分解产物为H2O2和Na2CO3,具有无毒、无臭、无污染等优点(赵启红,2007;Hong,2000).SPC的化学性质不仅与液态H2O2相似,而且使用的pH条件宽泛,即使在中性条件下仍然具有较强的氧化性(Fu et al., 2015; Miao et al., 2014).因此,可以使用SPC作为新型氧化剂,替代Fenton反应中的H2O2,改良成新的氧化体系——Fe2+/SPC.因此,本文以典型的磺胺类抗生素——磺胺二甲嘧啶(Sulfamethazine,SMT)作为目标污染物(其物化性质如表 1所示),以Fe2+/SPC为氧化体系,研究磺胺二甲嘧啶的降解情况,着重考察Fe2+和SPC初始浓度及溶液初始pH对其降解的影响.同时,通过猝灭实验探究体系中的主要活性物种,通过HPLC-MS/MS技术鉴定主要的产物并提出可能的降解途径,以期为工程实际中抗生素类新兴污染物的处理提供理论参考.
| 表 1 SMT理化性质 Table 1 Physical and chemical of properties Sulfamethazine |
磺胺二甲嘧啶,纯度>99%,购自阿拉丁试剂公司;过碳酸钠(Na2CO3·1.5H2O2),纯度>98%,购自Sigma试剂公司;甲醇、乙腈均为色谱纯,购自美国ACS恩科化学;硫酸亚铁、氢氧化钠、浓硫酸、异丙醇均为市售AR试剂;实验过程用水均为超纯水.
2.2 实验方法 2.2.1 SMT降解实验SMT在不同体系下的降解:反应溶液体积为500 mL,SMT浓度为0.02 mmol·L-1,4种反应体系中SPC初始浓度为0.2 mol·L-1,Fe2+初始浓度为0.3 mmol·L-1,Na2CO3初始浓度为0.2 mmol·L-1,H2O2初始浓度为0.3 mmol·L-1,pH为5.6,反应温度为(20±1)℃,每组实验做3次平行,分别在0、1、3、5、10 min取样3 mL,用等体积的0.1 mol·L-1硫代硫酸钠溶液终止反应,采用HPLC测定溶液中SMT的残留浓度.
Fe2+与SPC初始浓度的影响:SMT浓度为0.02 mmol·L-1,分别改变Fe2+与SPC的初始浓度(0.1~1.2 mmol·L-1),其余同上.
初始pH的影响:将0.02 mmol·L-1 SMT反应液分别用1%的NaOH或H2SO4调节溶液pH为4.0、6.0、8.0,并做1组空白对照试验(pH不调,为5.6),Fe2+/SPC/SMT物质的量比为15∶10∶1,其余同上.
自由基猝灭实验:在0.02 mmol·L-1 SMT反应液中添加0.5~6.0 mmol·L-1异丙醇猝灭HO·,Fe2+/SPC/SMT物质的量比为15∶10∶1,其余同上.
SMT降解产物分析:SMT浓度为0.02 mmol·L-1,Fe2+/SPC/SMT物质的量比为15∶10∶1,pH为5.6,反应温度为(20±1)℃,反应10 min后,取150 mL反应液于旋转蒸发仪,浓缩150倍后用于液质检测.
2.2.2 SMT降解率及降解变化率的计算SMT的降解率η用公式(1)计算,SMT降解率的变化率υk用公式(2)计算.

|
(1) |

|
(2) |
式中,C0和C分别为初始和t时刻的SMT的浓度(mmol·L-1),mSPCk为在k点时SPC的物质的量(mol),其中,k≥2.
2.3 分析方法SMT浓度采用高效液相色谱仪(岛津LC-20AT)分析,色谱柱:VP-ODS,SHIMADZU(150 mm×4.6 mm,5 μm);检测器为光电二极管阵列检测器SPD-M20A;检测波长为266 nm,流动相为乙腈-水(20∶80,体积比),流速1 mL·min-1,进样量10 μL,柱温35 ℃.
SMT的降解产物采用HPLC-MS/MS鉴定分析.测定仪器:高效液相色谱-离子肼质谱仪(Agilent 1100-MSD-Trap-XTD);色谱柱:ODS色谱柱(250 mm×4.6 mm,5 μm);进样量 10 μL;流动相组成:水(含0.2%冰醋酸)、甲醇.采用梯度洗脱:10%的甲醇在15 min内上升到90%,90%的甲醇维持5 min;洗脱液流速1.0 mL·min-1.MS部分采用电喷雾电离源(ESI),检测模式为负离子检测;干燥气(N2)流速10.0 L·min-1,温度350 ℃,碰撞气为氩气,离子源喷射电压 3500 V,雾化气(N2)压强为275.8 kPa,扫描范围为50~500(m/z).
3 结果与讨论(Results and discussion) 3.1 不同反应体系中SMT的降解情况实验研究了初始浓度为0.02 mmol·L-1的SMT溶液分别在单独使用SPC、Fe2+/Na2CO3、Fe2+/H2O2、Fe2+/SPC 4种反应体系下的降解效果(Fe2+初始浓度为0.3 mmol·L-1,Na2CO3初始浓度为0.2 mmol·L-1,H2O2初始浓度为0.3 mmol·L-1),结果如图 1所示.
 |
| 图 1 不同反应体系中SMT的降解情况 Fig. 1 The degradation of SMT under different systems |
从图 1可知,单独使用SPC与Fe2+/Na2CO3对SMT的降解效果不明显,只有不到2%的降解率.这是因为单独使用SPC时,溶液中SPC产生的H2O2很难分解生成活性物质,H2O2在短时间内对SMT几乎没有降解作用,而Fe2+/Na2CO3体系并不能产生可以降解SMT的物质,对SMT的降解能力几乎可以忽略.Fe2+/H2O2体系的使用在一定程度上提高了SMT的降解率,反应10 min后可以达到56%,主要是因为H2O2在Fe2+催化作用下分解产生强氧化性的HO·,HO·可以分解SMT,类似的结果多有报道(符荷花等,2014;冯精兰等,2012),但降解效果都不明显.而在Fe2+/SPC体系中,SMT的降解率提高迅速,在反应1 min时其降解率就高达84%,效果显著,这可能与体系中HO2-的生成有关,因为SPC水溶液呈较强的碱性,存在反应式(3),而HO2-比H2O2更容易分解产生活性氧,因此,相对于Fe2+/H2O2体系,Fe2+/SPC体系对SMT的降解能力更强.

|
(3) |
SMT在Fe2+/SPC氧化体系中的降解分为两个阶段:在第1阶段(1 min内)其反应基本完成,主要原因是SPC分解得到的H2O2浓度高,Fe2+与H2O2迅速反应,产生大量HO·,SMT与HO·快速反应而被去除;而在第2阶段(1 min以后),SMT的降解率几乎没有再上升,呈平缓状态,这是因为HO·的浓度较低.造成HO·浓度较低的原因有两点:一是在第1阶段时绝大部分的Fe2+被氧化成Fe3+,Fe3+与Fe2+相比,和H2O2的反应速率慢得多;二是在第2阶段中间产物浓度较高,HO·可能会被某些中间产物消耗掉.以上两点都会导致第2阶段的反应大大降低甚至使反应停止,因此,第2阶段降解率呈平缓的状态.
3.2 Fe2+初始浓度的影响由于Fe2+的初始浓度可以直接影响HO·的产量,因此,本文拟探究Fe2+的初始浓度对SMT降解的影响.保持反应溶液内SPC/SMT的物质的量比为10∶1(SPC初始浓度为0.2 mmol·L-1,SMT初始浓度为0.02 mmol·L-1),只改变Fe2+的初始浓度,SMT的降解情况如图 2所示.
 |
| 图 2 SMT降解率随Fe2+初始浓度的变化情况(插图为不同Fe2+/SPC/SMT比例下SMT的降解情况) Fig. 2 Changes in the degradation rate of SMT with Fe2+ concentration(Insert:Performance of SMT degradation under different molar ratio of Fe2+/SPC/SMT) |
从图 2可知,Fe2+初始浓度对Fe2+/SPC体系降解SMT具有显著影响.Fe2+初始浓度由0.1 mmol·L-1增加到0.3 mmol·L-1的过程中,SMT的降解率由3%迅速提高到84%.这是因为Fe2+的加入可以催化分解SPC溶于水产生的H2O2生成HO·(式(4)、(5)),这种促进作用随着Fe2+初始浓度的提高而加大.当Fe2+的初始浓度分别为0.3、0.4和0.6 mmol·L-1时,SMT的降解率分别为84%、86%、87%,其降解率提高不明显.这是因为体系中SPC在水中生成的H2O2量是一定的,过量的Fe2+并不能与H2O2发生Fenton反应产生更多的HO·.当Fe2+初始浓度提高到0.8 mmol·L-1后,其降解率为81%,开始出现下降的趋势,当把Fe2+初始浓度继续提高到1.2 mmol·L-1后,其降解率甚至下降到了76%.这是由于当Fe2+初始浓度很高时,过量的Fe2+会与HO·发生反应,反而抑制了SMT的降解(式(6)),类似的结果也有报道(Pignatello et al., 2006).

|
(4) |

|
(5) |

|
(6) |
在Fe2+/SMT的物质的量比为15∶1(Fe2+初始浓度为0.3 mmol·L-1,SMT初始浓度为0.02 mmol·L-1)的情况下,只改变SPC的初始浓度,实验考察了SPC初始浓度对SMT降解的影响,结果如图 3所示.
 |
| 图 3 SMT降解率随SPC初始浓度的变化情况(插图为不同Fe2+/SPC/SMT比例下SMT的降解情况) Fig. 3 Changes in the degradation rate of SMT with SPC concentration(Insert:Performance of SMT degradation under different molar ratio of Fe2+/SPC/SMT) |
由图 3可知,作为体系中H2O2的直接来源,SPC初始浓度对Fe2+/SPC体系降解SMT同样具有明显影响.当SPC初始浓度由0.1 mmol·L-1提高到0.2 mmol·L-1后,SMT的降解率由68%提高到84%,提升效果显著.因为在较低浓度时,增加SPC的初始浓度可以增加H2O2的量,在Fe2+的催化作用下,H2O2生成更多的HO·促进了SMT的降解.但当SPC初始浓度提高到0.6 mmol·L-1后,SMT的降解率却由84%下降到了11%,抑制效果十分显著.导致这种现象的主要原因是此时体系中HO·浓度较大,一方面HO·被HO·自身猝灭(式(7)),另一方面,HO·会与过量的H2O2发生反应(式(8)),结果导致HO·有效利用率大大下降,影响SMT的去除(Monteagudo et al., 2012).当继续提高SPC的初始浓度,SMT的降解率不再下降,在0.9 mmol·L-1和1.2 mmol·L-1时SMT的降解率分别为11%和10%.这是因为此时溶液中的Na2CO3浓度较高(式(4)),溶液的pH值升高,Fe2+迅速转化为Fe3+,并生成Fe(OH)3沉淀,从而降低了Fe2+的浓度,最终抑制了SMT的降解(Sik et al., 2009).

|
(7) |

|
(8) |
由上述两组实验结果可知,对于0.02 mmol·L-1的SMT溶液,Fe2+与SPC的最佳初始浓度分别为0.3 mmol·L-1和0.2 mmol·L-1,即Fe2+/SPC的最佳物质的量比为15∶10,按此比例增大氧化剂SPC的用量,考察SMT的降解情况,结果如图 4所示.
 |
| 图 4 SMT在不同氧化剂SPC用量下的降解情况及降解率的变化率 Fig. 4 Performance of SMT degradation and the change of the degradation rate under different SPC concentration |
从图 4可以看出,在Fe2+/SPC物质的量比为15∶10的情况下,增大氧化剂SPC的量可以有效提高SMT的降解效果.当SPC的浓度分别为0.1、0.2和0.4 mmol·L-1,SMT的降解率分别为52%、84%和95%,当浓度达到0.6 mmol·L-1以后,降解甚至率可达100%,效果显著.从SMT降解率变化情况可以看出,当SPC的浓度为0.1 mmol·L-1时,SMT降解对氧化剂的利用率是最高的,随着氧化剂使用量增大,其对氧化剂的利用率不断降低,但在浓度为0.2 mmol·L-1时仍有较高的氧化剂利用率.综合考虑处理效果及成本,本实验拟用Fe2+/SPC=15∶10作为降解SMT的最佳比例.该实验结果可以作为实际工程应用的指导,在保证处理效果的情况下最大化提高氧化剂的利用率,提高经济效益.
3.4 溶液初始pH的影响pH值会影响Fe2+的浓度及SMT在水溶液的解离形态,故在SMT初始浓度为0.02 mmol·L-1,Fe2+/SPC/SMT物质的量比保持在15∶10∶1,体系初始pH分别为4.0、6.0、8.0及初始pH未调节时考察SMT的降解情况,结果如图 5所示.
 |
| 图 5 溶液初始pH对SMT降解率的影响 Fig. 5 Effect of initial solution pH on SMT degradation performance |
由图 5可以看出,溶液初始pH对SMT的降解效果有一定影响.当溶液初始pH分别为4.0、5.6(pH不调)、6.0和8.0时,反应10 min后SMT的降解率依次为88%、84%、83%及75%,SMT的降解随溶液pH升高而逐渐降低.这主要与溶液中铁的存在形式有关,随着pH的升高,Fe2+容易形成水合络合物Fe(OH)+和Fe(OH)2,然后进一步转化为Fe(OH)3沉淀(杨春维,2012),导致Fe2+的浓度下降,从而大大降低了HO·的产生,SMT的降解受到抑制.
然而SMT在pH为8.0时的降解率仍达到了75%,有较高的去除效果.原因有两方面:一方面是SMT分子结构中含有2个解离位点,在水溶液中的存在形态与pH有关,其主要有3种解离形态,分别为SMT的阳离子态(H2SMT+)、中性离子态(HSMT0)和阴离子态(SMT-).如图 6所示(Boreen et al., 2004;Boreen et al., 2005),当pH值由4.0升高到8.0的过程中,中性离子态(HSMT0)的比例由100%下降到20%,去质子化的阴离子态(SMT-)的比例由0提高到80%.Chen等(2012)在研究光降解胺类化合物时,认为随着pH的升高,去质子化氨基上未配对N电子的可利用性提高,这个N电子可快速转移至激发态等具有高活性的物质上,失去电子的胺类化合物从而可以快速降解.因此,可以认为去质子化的阴离子态(SMT-)更容易将N电子转移给HO·,从而使化合物快速降解,提高降解率.另一方面是Fe2+与H2O2反应的过程中有H+产生,最终导致反应体系呈现较强的酸性.表 2列出了不同反应初始pH条件下体系反应前后溶液pH的变化,可见在反应10 min后,体系pH都下降到3.0左右.因此,虽然体系pH的升高会抑制SMT的降解,但由于上述两方面的原因会减轻这种不利作用,导致SMT的降解率下降幅度不大.
 |
| 图 6 水溶液中SMT在不同pH下的解离形态分布 Fig. 6 Distribution of dissociation species of SMT under different pH |
| 表 2 Fe2+/SPC体系反应前后溶液pH的变化 Table 2 pH changes in the Fe2+/SPC system |
可见,Fe2+/SPC体系可以在比较宽泛的pH条件下降解SMT,即使在偏碱性条件下也可以达到较好的处理效果,与传统的Fenton技术反应需要比较低的pH条件相比有着巨大的应用前景.
3.5 Fe2+/SPC体系中自由基的确定为确定Fe2+/SPC体系降解SMT的活性物种,实验通过添加异丙醇(Isopropanol,IPA,HO·猝灭剂)(Latch et al., 2003;Alexandra et al., 2006)来考察SMT的降解情况.SMT溶液初始浓度为0.02 mmol·L-1,Fe2+/SPC/SMT物质的量比为15∶10∶1,结果如图 7所示.
 |
| 图 7 IPA对Fe2+/SPC降解SMT的抑制情况 Fig. 7 Inhibition effect of IPA on SMT degradation in Fe2+/SPC system |
由图 7可知,在添加了IPA的样品中表现出对SMT降解明显的抑制作用,说明Fe2+/SPC体系中有HO·的产生.当IPA的添加浓度分别为0.5、1.0、2.0、4.0和6.0 mmol·L-1时,反应10 min,对SMT降解的抑制率分别为57%、72%、82%、94%和96%,可见随着IPA浓度的增加,HO·的浓度不断降低,在IPA的添加浓度为6.0 mmol·L-1时,可以认为反应体系中的HO·已经被完全清除.实验结果表明,SMT在Fe2+/SPC体系中的降解主要是由HO·引起的,同样的结论在Miao等(2015)的研究中也有报道.
3.6 SMT的降解产物及途径本实验利用HPLC-MS/MS分析SMT在Fe2+/SPC体系中的降解产物,其总离子流色谱图(TIC)如图 8所示.从图 8可知,共有7种中间产物被检测到,分别用P1~P7表示.根据总离子流色谱图(TIC)和产物的二级质谱图信息推测其主要降解产物的结构并提出可能的降解途径,以进一步了解SMT的降解机理,SMT降解产物的质谱碎片信息及推测的可能结构列于表 3.从表 3可知,P6是与苯环相连的氨基发生羟基取代反应生成的羟胺产物;P4、P7是羟胺产物上的N原子进一步被氧化发生亚硝基化反应的产物;P2、P5是磺酰胺键[S—N]断裂生成的产物;P3的生成途径有2种:一是P2上与苯环相连的氨基发生羟基取代生成的,二是P6上磺酰胺键[S—N]断裂生成的产物;P1是母体脱SO2后发生分子间重排的产物.
 |
| 图 8 SMT降解产物的总离子流图 Fig. 8 Total ion chromatogram(TIC)of SMT degradation products |
| 表 3 SMT降解产物的质谱碎片信息和推测结构 Table 3 Mass spectrometry information and proposed structure of the degradation products of SMT |
由此推测其可能的降解途径有3种,具体如图 9所示.途径Ⅰ是HO·攻击SMT上与苯环相连接的N原子上的H原子.由于苯环的大π电子体系使N原子的电负性更强,N原子上的H原子容易与HO·发生取代反应,生成羟胺产物P6,然后P6的羟胺基上的N原子通过电子转移形成氮中心自由基,进一步被HO·进攻形成亚硝基产物P7,Ahmed等(2012)在利用SO4·-降解磺胺甲恶唑的研究中也有相同的报道.研究发现,磺胺类抗生素在氧化过程中其分子结构上的磺酰胺键[S—N]容易受到氧化剂或者活性自由基的攻击而发生断裂(Gao et al., 2012;García Galán et al., 2008),SMT的降解也有相似的过程,具体如途径Ⅱ所示,SMT分子中的磺酰胺键[S—N]在HO·攻击下断裂,生成两种分子量较小化合物P2和P5.P2会逐步被氧化,先是与苯环相连的氨基发生羟基取代反应生成羟胺产物P3,然后是P3羟胺基上的N原子发生亚硝基化反应生成P4,该过程与途径Ⅰ类似.途径Ⅲ是参考Gao等(2012)的研究而作出的推测,他们发现SMT在UV/PS体系氧化作用下会发生分子间重排生成一种脱SO2的化合物.由于正电子的离域作用,与N原子相连的芳香苯环的对位有很强的缺电性,因而变得容易受到分子间的亲核攻击.因此,他们认为SMT分子中的苯胺部分在SO4·-或HO·作用下会产生苯胺自由基,而SMT分子中嘧啶环上的N原子恰恰可以作为亲核试剂进攻该位置,最终导致分子结构重排,SO2部分被脱除.因此,可以推断SMT在本实验中的降解也发生了类似的过程,生成P1.
 |
| 图 9 SMT在Fe2+/SPC体系中降解的可能途径 Fig. 9 Possible degradation pathways of SMT in Fe2+/SPC system |
El Ghenymy等(2013)在研究SMT在电-Fenton法中的降解时,同样认为SMT的降解主要是通过羟基取代反应及磺酰胺键[S—N]的断裂进行的;Tentscher等(2013)研究发现,SMT在光降解的过程中会有一种分子间重排的化合物生成;Gao等(2012)利用氧化锰降解SMT,通过量子化学计算建模和瞬态吸收光谱发现了苯胺自由基的存在,证明SMT在降解过程中确实是通过苯胺自由基发生分子间重排而脱SO2的.本文的研究结果与其结论相一致.
4 结论(Conclusions)1)SMT在Fe2+/SPC体系中可以被有效降解,Fe2+与SPC的初始浓度对SMT的降解率影响显著,适当增大初始浓度可以有效提高SMT的降解率,但当浓度达到一定值后,反而会抑制SMT的降解,体系中Fe2+与SPC存在最佳物质的量比.
2)溶液初始pH对SMT在Fe2+/SPC体系的降解抑制作用较小,在偏碱性条件下SMT仍能有较高的降解率.
3)Fe2+/SPC体系中对SMT降解的主要活性物种是HO·. 4 )HPLC-MS/MS分析结果表明,Fe2+/SPC体系降解SMT可能的途径有3种,主要涉及苯环相连的氨基发生羟基取代反应、磺酰胺键[S—N]断裂及分子间结构重排脱SO2.
| [${referVo.labelOrder}] | Ahmed M M, Barbati S, Doumenq P, et al. 2012. Sulfate radical anion oxidation of diclofenac and sulfamethoxazole for water decontamination[J]. Chemical Engineering Journal, 197(14) : 440–447. |
| [${referVo.labelOrder}] | Alexandra T H, Claire R. 2006. Simulated solar light irradiation of mesotrione in natural waters[J]. Environmental Science&Technology, 40(12) : 3842–3847. |
| [${referVo.labelOrder}] | Baran W, Adamek E, Sobczak A, et al. 2009. Photocatalytic degradation of sulfa drugs with TiO2, Fe salts and TiO2/FeCl3 in aquatic environment-Kinetics and degradation pathway[J]. Applied Catalysis B Environmental, 90(3/4) : 516–525. |
| [${referVo.labelOrder}] | Baran W, Adamek E, Ziemiańska J, et al. 2011. Effects of the presence of sulfonamides in the environment and their influence on human health[J]. Journal of Hazardous Materials, 196(1) : 1–15. |
| [${referVo.labelOrder}] | Boreen A L, Arnold W A, Kristopher M N. 2004. Photochemical fate of sulfa drugs in the aquatic environment:sulfa drugs containing five-membered heterocyclic groups[J]. Environmental Science Technology, 38(14) : 3933–3940. DOI:10.1021/es0353053 |
| [${referVo.labelOrder}] | Boreen A L, Arnold W A, Kristopher M N. 2005. Triplet-sensitized photodegradation of sulfa drugs containing six-membered heterocyclic groups:identification of an SO2 extrusion photoproduct[J]. Environmental Science Technology, 39(10) : 3630–3638. DOI:10.1021/es048331p |
| [${referVo.labelOrder}] | Chen Y, Li H, Wang Z, et al. 2012. Photodegradation of selectedβ-blockers in aqueous fulvic acid solutions:Kinetics, mechanism, and product analysis[J]. Water Research, 46(9) : 2965–2972. DOI:10.1016/j.watres.2012.03.025 |
| [${referVo.labelOrder}] | El Ghenymy A, Rodríguez R M, Arias C, et al. 2013. Electro-Fenton and photoelectro-Fenton degradation of the antimicrobial sulfamethazine using a boron-doped diamond anode and an air-diffusion cathode[J]. Journal of Electroanalytical Chemistry, 701 : 7–13. DOI:10.1016/j.jelechem.2013.04.027 |
| [${referVo.labelOrder}] | Fu X, Gu X, Lu S, et al. 2015. Benzene depletion by Fe2+-catalyzed sodium percarbonate in aqueous solution[J]. Chemical Engineering Journal, 267 : 25–33. DOI:10.1016/j.cej.2014.12.104 |
| [${referVo.labelOrder}] | 符荷花, 陈猛, 熊小京. 2014. Fenton氧化法对磺胺类抗生素的降解动力学[J]. 环境工程学报, 2014, 8(3) : 972–976. |
| [${referVo.labelOrder}] | 冯精兰, 师少辉, 孙剑辉. 2012. Fenton法降解抗生素磺胺间甲氧嘧啶钠[J]. 环境工程学报, 2012, 6(9) : 3125–3130. |
| [${referVo.labelOrder}] | Gao J, Hedman C, Liu C, et al. 2012. Transformation of sulfamethazine by manganese oxide in aqueous solution[J]. Environmental Science&Technology, 46(5) : 2642–2651. |
| [${referVo.labelOrder}] | Gao Y, Gao N, Deng Y, et al. 2012. Ultraviolet (UV) light-activated persulfate oxidation of sulfamethazine in water[J]. Chemical Engineering Journal, 195 : 248–253. |
| [${referVo.labelOrder}] | Garoma T, Umamaheshwar S K, Mumper A. 2010. Removal of sulfadiazine, sulfamethizole, sulfamethoxazole, and sulfathiazole from aqueous solution by ozonation[J]. Chemosphere, 79(8) : 814–820. DOI:10.1016/j.chemosphere.2010.02.060 |
| [${referVo.labelOrder}] | Garcíav Galán M J, Díaz-Cruz M S, BarcelóD. 2008. Identification and determination of metabolites and degradation products of sulfonamide antibiotics[J]. International Journal of Cancer, 27(11) : 1008–1022. |
| [${referVo.labelOrder}] | 郭欣妍, 王娜, 许静, 等. 2013. 5种磺胺类抗生素在土壤中的吸附和淋溶特性[J]. 环境科学学报, 2013, 33(11) : 3083–3091. |
| [${referVo.labelOrder}] | Guo Z, Fei Z, Zhao Y, et al. 2012. Gamma irradiation-induced sulfadiazine degradation and its removal mechanisms[J]. Chemical Engineering Journal, 191(19) : 256–262. |
| [${referVo.labelOrder}] | Hong X. 2000. Use of sodium percarbonate in the oxidation of functional groups[J]. Chemical Reagents, 22(2) : 93–97. |
| [${referVo.labelOrder}] | Latch D E, Stender B L, Packer J L, et al. 2003. Photochemical Fate of Pharmaceuticals in the Environment:Cimetidine and Ranitidine[J]. Environ Sci Technol, 37(15) : 3342–3350. DOI:10.1021/es0340782 |
| [${referVo.labelOrder}] | 李宏.2007.Fenton高级氧化技术氧化降解多环芳烃类染料废水的研究[D].重庆:重庆大学 |
| [${referVo.labelOrder}] | Miao Z, Gu X, Lu S, et al. 2014. Perchloroethylene (PCE) oxidation by percarbonate in Fe2+-catalyzed aqueous solution:PCE performance and its removal mechanism[J]. Chemosphere, 119C : 1120–1125. |
| [${referVo.labelOrder}] | Miao Z, Gu X, Lu S, et al. 2015. Enhancement effects of reducing agents on the degradation of tetrachloroethene in the Fe (II)/Fe (III) catalyzed percarbonate system[J]. Journal of Hazardous Materials, 300 : 530–537. DOI:10.1016/j.jhazmat.2015.07.047 |
| [${referVo.labelOrder}] | Monteagudo J M, Durán A, Corral J M, et al. 2012. Ferrioxalate-induced solar photo-Fenton system for the treatment of winery wastewaters[J]. Chemical Engineering Journal, 181(2) : 281–288. |
| [${referVo.labelOrder}] | Pignatello J J, Oliveros E, Mackay A. 2006. Advanced oxidation processes for organic contaminant destruction based on the Fenton reaction and related chemistry[J]. Critical Reviews in Environmental Science&Technology, 36(1) : 1–84. |
| [${referVo.labelOrder}] | Sik J Y, Woo Taik L, Joo-Yang P, et al. 2009. Effect of pH on Fenton and Fenton-like oxidation[J]. Environmental Technology, 30(2) : 183–190. DOI:10.1080/09593330802468848 |
| [${referVo.labelOrder}] | Tentscher P R,Eustis S,Mcneill K,et al.2013.Oxidation of sulfonamide antibiotics:Aromatic nucleophilic substitution of an aniline radical cation[Z].Amer Chemical Soc |
| [${referVo.labelOrder}] | Watts R J, Dilly S E. 1996. Evaluation of iron catalysts for the Fenton-like remediation of diesel-contaminated soils[J]. Journal of Hazardous Materials, 51(1/3) : 209–224. |
| [${referVo.labelOrder}] | 杨春维.2012.Fenton与电Fenton技术处理有机废水的应用研究[D].大连:大连理工大学 |
| [${referVo.labelOrder}] | 叶计朋, 邹世春, 张干, 等. 2007. 典型抗生素类药物在珠江三角洲水体中的污染特征[J]. 生态环境, 2007, 16(2) : 384–388. |
| [${referVo.labelOrder}] | 赵启红.2007.过碳酸钠对有机磷农药的降解研究[D].南京:南京师范大学 |
 2017, Vol. 37
2017, Vol. 37