传统生物脱氮工艺采用好氧硝化-厌氧反硝化的两步脱氮法,其中,第一步需要大量曝气,而第二步则需要为异养反硝化菌提供外加碳源(如甲醇)(Zhu et al.,2011).2006年,荷兰Nijmegen大学研究人员经过16个月的培养,在实验室中成功获得了DAMO的富集培养物,首次证实了DAMO过程的存在(Raghoebarsing et al.,2006),为生物脱氮工艺的改进提供了一种新思路.目前所发现的参与DAMO反应的微生物分属于NC10门细菌和ANME 古菌,它们以CH4为电子供体,以NO3-或NO2-作为电子受体(式(1)、(2)).相比于传统生物脱氮工艺,基于DAMO微生物的脱氮工艺以温室气体CH4为碳源,既节省了外加碳源,也可为减排温室气体、缓解温室效应做出贡献,同时具有剩余污泥少、占地面积小等优点(Lettinga,1995; Lema et al.,2001).目前,在污水处理厂(Luesken et al.,2011a;2011b)、淡水湿地(Hu et al.,2014)、淡水湖泊(朱群等,2013)、农田水稻土壤(Hu et al.,2014)、淡水河道(Shen et al.,2014)中均已检测到 DAMO 微生物的存在,因此,DAMO过程是地球生物碳、氮循环的重要组成部分,为生物地球化学循环做出了重要的贡献(Strous et al.,2004).

|
(1) |

|
(2) |
010年,Ettwig等在DAMO代谢途径的研究方面取得了重大突破,发现了一种全新的“胞内产氧”的途径,即:NC10细菌将NO2-还原为NO,随后该细菌内一种未知的NO歧化酶将NO分解为N2和O2,产生的O2一部分用于CH4的氧化(Ettwig et al.,2010; Wu et al.,2011).
同样作为电子受体,NO3-对DAMO微生物的影响是否与NO2-相同尚未可知,废水处理过程中NH4+的存在也是一个不可忽视的问题.另外,由于DAMO微生物倍增时间较长,许多相关研究关注于其富集培养条件的优化(He et al.,2015a;2015b),但目前尚未有研究表明不同接种物的影响.基于此,本文通过添加不同的电子受体和接种污泥(部分反应器中添加NH4+)以期获得不同的DAMO富集培养物,同时,利用分子生物学方法和化学分析方法,从微生物群落结构、代谢活性及富集驯化时间3个方面研究不同电子受体和接种污泥对DAMO微生物的影响.
2 材料与方法(Materials and methods) 2.1 试验装置试验装置如图 1所示,该反应器由有机玻璃制成,反应器直径16 cm,高30 cm,有效容积3.5 L.反应器所有阀门均关闭时处于全封闭状态,其内部环境保持厌氧状态.由磁力搅拌器使反应器内泥水均匀混合.
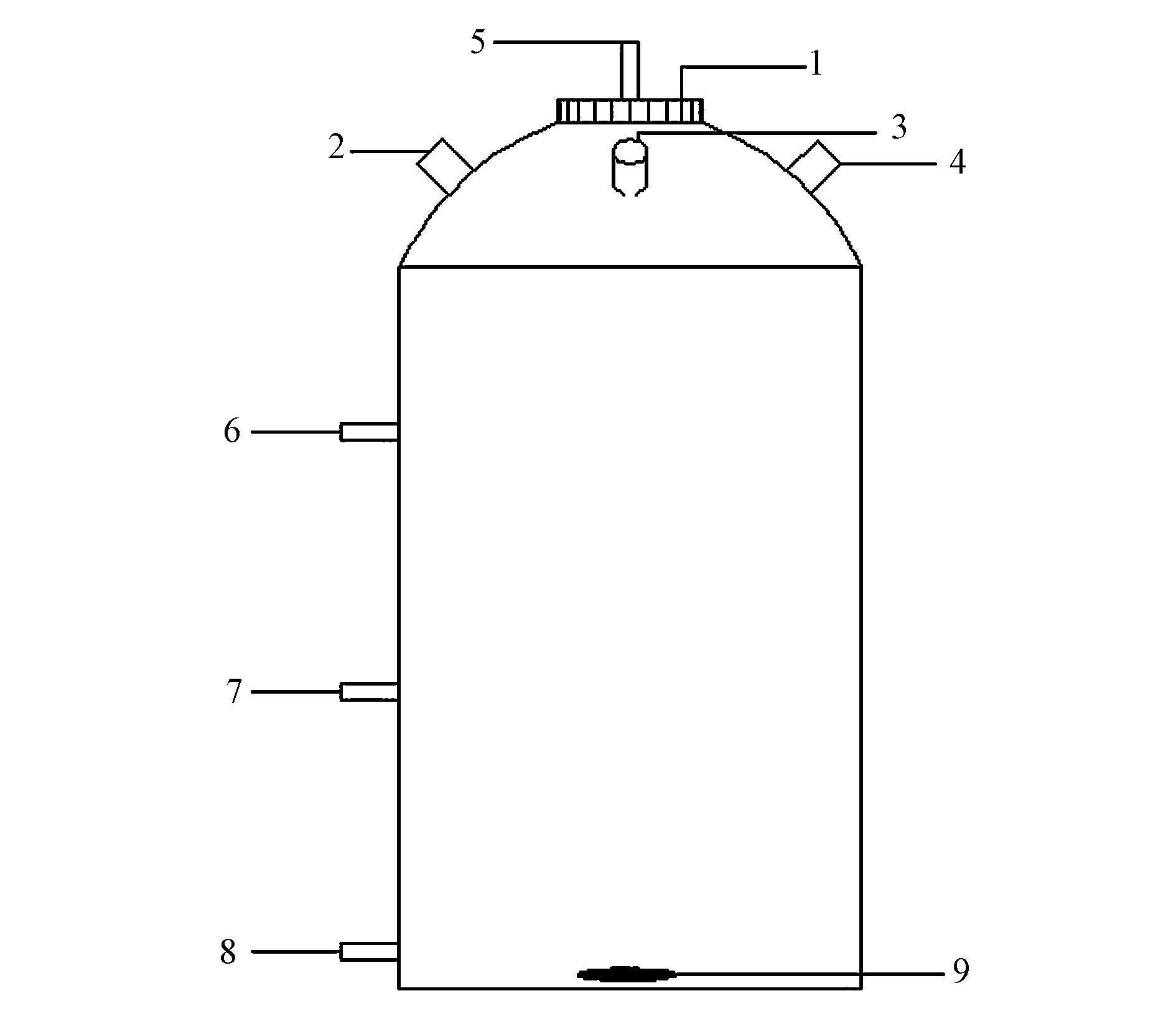 |
| 图 1 试验装置设计图(1.顶盖,2.加料口,3.第一传感器放置口,4.第二传感器放置口,5.排气口,6.第一取样口,7.第二取样口,8.第三取样口,9.搅拌子) Fig. 1 Schematic diagram of the experimental system |
为了探索不同培养条件对该试验的影响,设置了4套规格相同的反应器用于富集DAMO培养物.4套反应器均供给CH4作为电子供体,具体接种污泥及氮素见表 1.按表 1在各反应器中添加不同的混合污泥作为接种污泥,并分别添加不同质量或浓度的NaNO3、NaNO2、NH4Cl来提供氮素,营养液及微量元素组分参考文献(Raghoebarsing et al.,2006).运行时定期向反应器内充入CH4并使反应器内保持一定的压力,以提供微生物生长所需电子供体.反应器放置在转速为150 r·min-1的磁力搅拌器上,保证反应器内泥水均匀混合.各反应器均在20~22 ℃的室温下运行.用0.1 mol·L-1 HCl或 0.1 mol·L-1 NaOH来调节pH,使反应器内泥水混合液的pH维持在7.0 ± 0.2.
| 表 1 接种污泥及氮素设计 Table 1 Design of inocula and N feeding |
反应器运行过程中主要测定硝酸盐氮(NO3--N)、亚硝酸盐氮(NO2--N)、氨氮(NH4+-N)等,具体分析测定方法参考《水和废水监测分析方法(第4版)》(魏复盛,2002).pH用梅特勒FG2号便携式pH计进行测定,溶解氧(DO)监测用梅特勒FG4号便携式溶解氧测定仪.
2.3.2 荧光原位杂交(FISH)检测本试验所用16S rRNA探针及相应的探针序列、目标菌、标记物见表 2,样品预处理过程及FISH检测的操作步骤参考文献(徐少娟,2012).杂交完成后的样品玻片在激光共聚焦显微镜(ZEISS LSM780)下观察,并用其配套软件拍照,对DAMO古菌、DAMO细菌及厌氧氨氧化菌Anammox所占全菌比例进行分析.
| 表 2 探针序列 Table 2 Probes used for FISH detection |
反应器R1以西溪河底泥、西湖底泥与水稻田土壤的混合污泥为接种物,供给CH4、NO3-与NH4+作为营养物质,反应器启动初期,由于接种污泥中原本含有反硝化菌和厌氧氨氧化菌(蔡琛等,2013),系统内的NO3-和NH4+都有一定程度的降解,其碳源主要来自于接种污泥中本身所含有机物及在微生物死亡时释放出的细胞物质.富集过程中只向反应器提供CH4作为碳源,随着原有碳源的消耗,系统内的微生物逐渐以CH4作为唯一电子供体.经过1000多天的培养,其部分NO3-和NH4+消耗曲线如图 2所示.
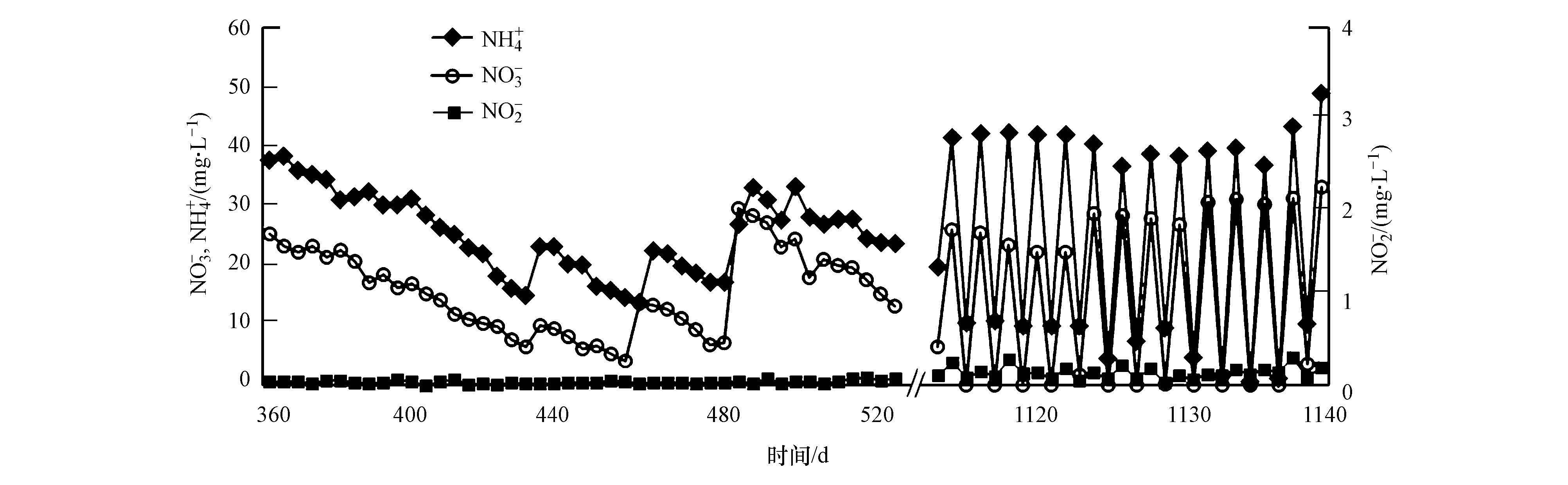 |
| 图 2 R1反应器中NO3-和NH4+的消耗曲线 Fig. 2 NO3- and NH4+ consumption in R1 |
从图 2可知,360 d后,NO3-与NH4+出现了较为规律稳定的降解曲线.稳定的NH4+消耗表明系统内部厌氧氨氧化反应(Anammox)的稳定进行,稳定的NO3-消耗说明系统内部的微生物已适应并成功利用CH4作为电子供体进行反硝化反应,即DAMO反应.已有研究表明(Zhu et al.,2010; Haroon et al.,2013),DAMO微生物可以与Anammox细菌形成协同关系,而R1反应器内部很可能已形成了这种协同作用,因而可初步认为在该反应器内已获得了以DAMO微生物为优势菌种的培养物A.1115 d后,NO3-与 NH4+的消耗速率明显提升,并分别稳定在21.3 mg·L-1·d-1(以N计)和24.3 mg·L-1·d-1(以N计),反应器中NO2-的浓度一直维持在0.3 mg·L-1·d-1(以N计)以下.
为了进一步确认系统中的微生物,取系统运行第846 d时R1反应器中的泥样进行荧光原位杂交,所得FISH图片见图 3.图 3a中绿色为FITC染料标记的EUBmix探针,目标菌为细菌全菌,红色为Cy-3染料标记的DARCH-0872探针,目标菌为ANME 古菌;图 3b中绿色为是FITC染料标记的Amx-820探针,目标菌为Anammox 细菌,显示为红色的是Cy-3标记的DARCH-0872探针,目标菌为ANME古菌.
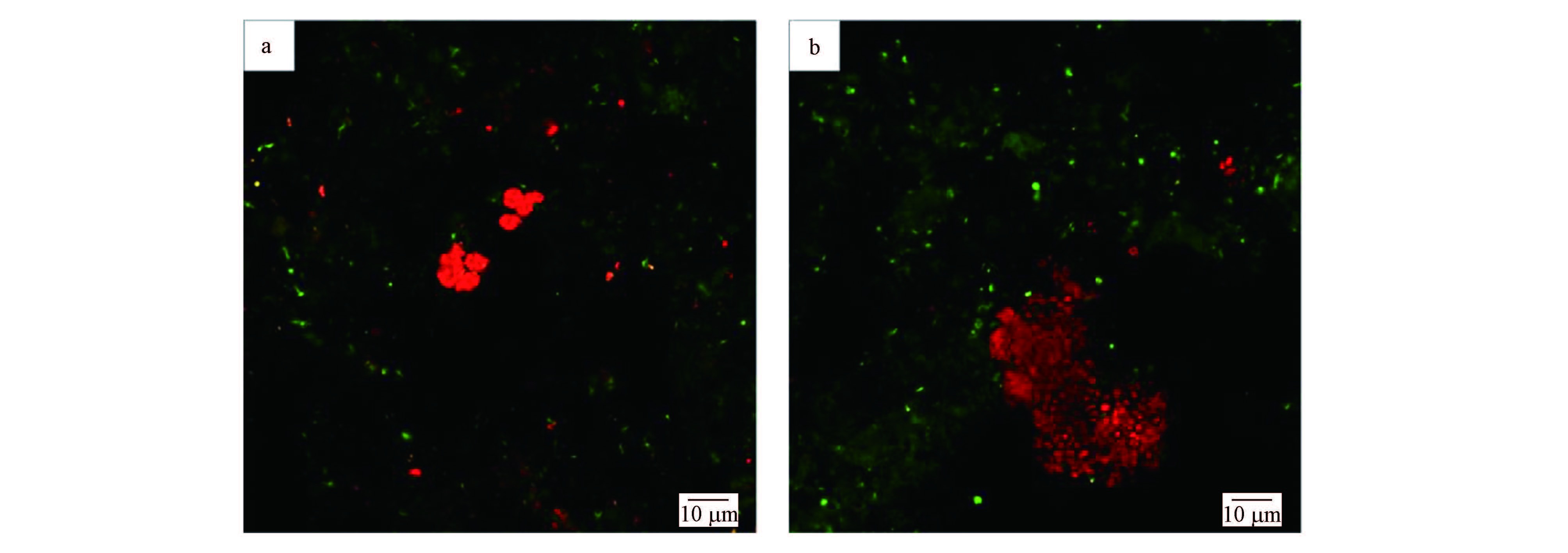 |
| 图 3 培养物A FISH检测结果(a.DAMO古菌(红色)与细菌全菌(绿色),b.DAMO古菌(红色)与Anammox细菌(绿色)) Fig. 3 FISH results of culture A(a.DAMO archaea(red)and general bacteria(green),b.DAMO archaea(red)and Anammox(green)) |
在杂交过程中,由红色Cy-3染料标记的DBACT-0193探针与其他探针混合也参与了杂交过程,所得目标菌NC10细菌杂交图片与细菌全菌杂交图片叠加后,应显示为黄色,但图 3a中并未出现黄色,表明培养物A中未检测到NC10细菌.图 3b则说明培养物A中可同时检测到ANME 古菌和Anammox 细菌,应用FISH技术的量化功能,经过统计学计算分析后,培养物A中ANME古菌占全菌比例约为39.4%,Anammox细菌占全菌比例约为45.8%,ANME古菌与Anammox细菌的比值约为0.86,无NC10细菌.进一步从分子生物学定量的角度上证明了DAMO微生物富集成功.
3.2 DAMO培养物B反应器R2的接种污泥与R1相同,但以NO2-为唯一的电子受体.经过949 d的培养,由于接种污泥中已含有一定浓度的NO2-,因而在培养过程的初期均并未向反应器内提供电子受体,只充入甲烷作为电子供体,使接种混合污泥中原有的微生物将系统内初始的NO2-消耗殆尽,待反应器内的NO2-下降至较低浓度时,向反应器内添加小剂量的NaNO2,并逐步加大剂量.富集前期,因为接种污泥中含有普通反硝化微生物,故其对NO2- 已有一定的降解能力,但其消耗速率很低,随着驯化培养的推移,由于系统只添CH4作为碳源,慢慢形成以CH4作为电子供体的厌氧反硝化微生物为优势菌群,NO2-的降解速率有了明显的提高,并逐步趋向稳定,自202 d开始,NO2-的降解速率稳定在约0.44 mg·L-1·d-1(以N计),可认为DAMO培养物B富集成功.图 4为150 d后NO2- 的消耗曲线.虽然系统内部微生物可将NO2-作为电子受体进行反硝化,但过高的NO2-浓度仍会对微生物代谢活性产生一定的抑制作用.因此,在培养物B的富集过程中,添加NaNO2所达到的NO2-最高浓度均控制在3.5 mg·L-1以下,以保证系统内部微生物的良好生长.
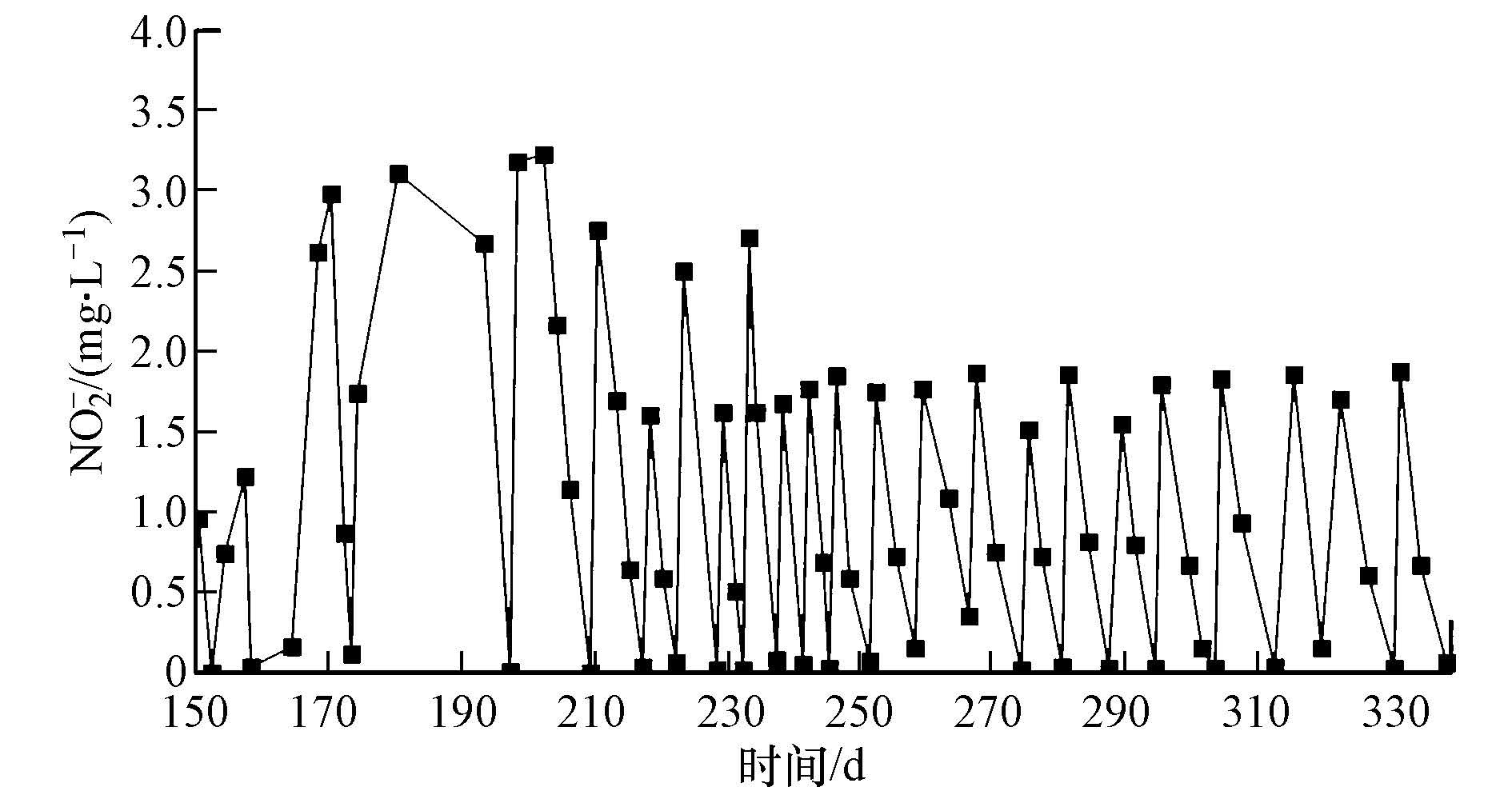 |
| 图 4 R2反应器中NO2-的消耗曲线 Fig. 4 NO2- consumption in R2 |
为确认系统中的微生物,取反应器运行第779 d时R2反应器中的泥样进行荧光原位杂交,所得 FISH图片见图 5.图 5a中绿色为FITC染料标记的Arch-0915探针,目标菌为古菌全菌,红色为Cy-3染料标记的DARCH-0193探针,目标菌为NC10细菌;图 5b为图 5a的局部放大图.
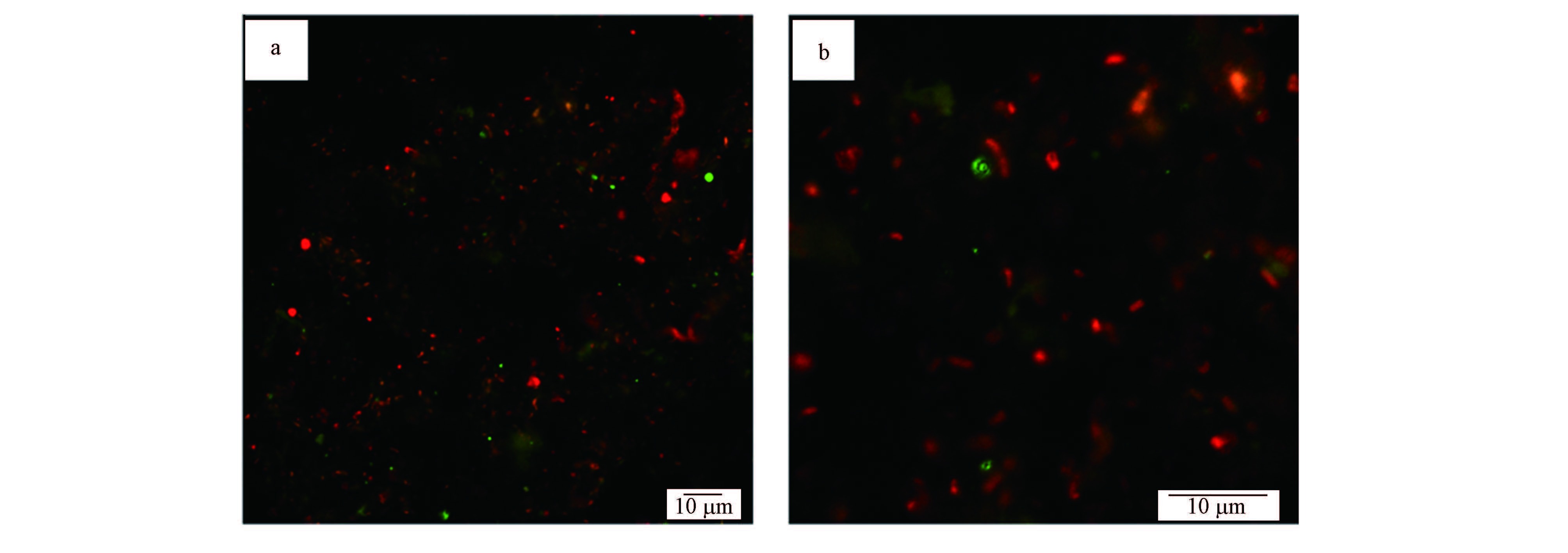 |
| 图 5 培养物B FISH检测结果(a. NC10细菌(红色)与古菌全菌(绿色),b.图a局部放大图) Fig. 5 FISH results of culture B(a.NC10(red)and general archaea(green),b.a local amplification figure of figure a) |
在杂交过程中,由红色Cy-3染料标记的DARCH-0872探针与其他探针混合也参与了杂交过程,所得目标菌ANME古菌杂交图片与古菌全菌杂交图片叠加后,应显示为黄色,但图 5中并未出现黄色,表明培养物B中未检测到ANME古菌.而经统计分析,培养物B中NC10细菌占了总菌的88.2%,为优势菌种.由图 5b可知,NC10细菌为杆状菌.该实验结果从定量角度证明了反应器 R2中以NC10细菌为优势菌种的培养物 B已成功富集.
3.3 DAMO培养物C获得反应器R3以西溪河底泥、杭州七格污水处理厂二沉池中的活性污泥及储泥池中的厌氧消化污泥的混合污泥为接种污泥.与R1相同,CH4为唯一碳源,同时供给NO3-与NH4+.反应器启动初期,系统内的NO3-和NH4+都具有一定被降解的情况.经过1000多天的培养,营养物质的消耗曲线见图 6.
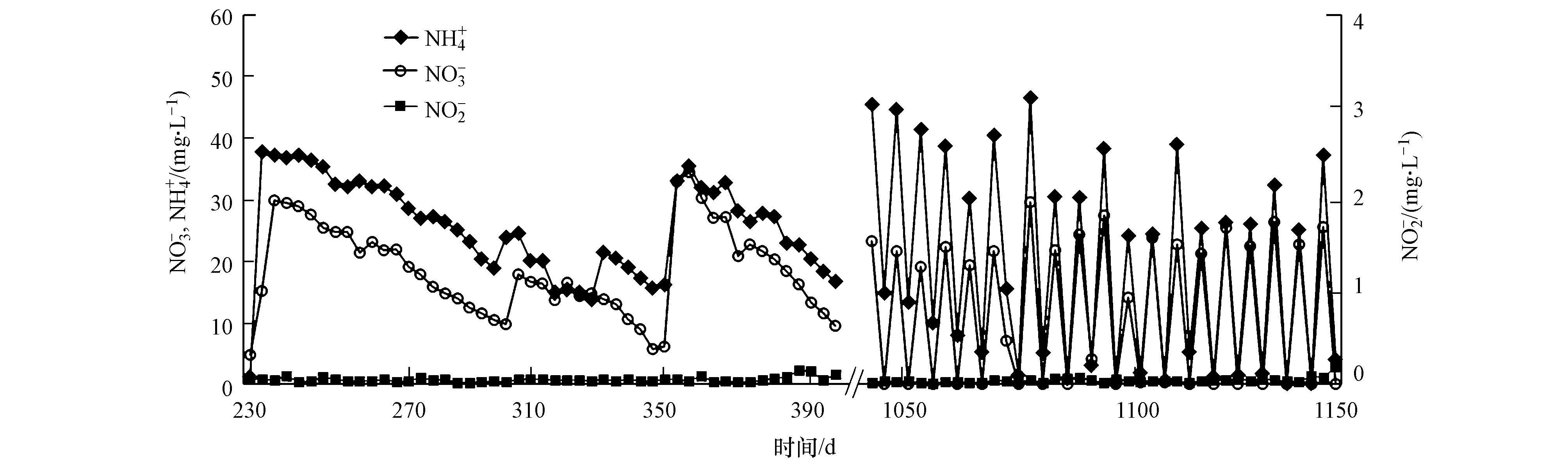 |
| 图 6 R3反应器 NO3-和NH4+消耗曲线 Fig. 6 NO3-,NH4+ consumption in R3 |
由图 6可知,230 d后,NO3-与NH4+的消耗均出现了较为规律稳定的降解曲线.因系统提供CH4为唯一碳源,稳定的NO3-消耗速率说明反应器内进行着DAMO反应,而稳定的NH4+消耗速率则说明系统内部Anammox反应的进行.如3.1节所述,根据以往的研究报道推测,反应器R3内部所富集的DAMO微生物与Anammox微生物已达成一种协同作用,初步认为R3反应器中培养物C富集成功.1040 d后,NO3-与 NH4+的消耗速率有了明显的提升,并分别稳定在4.4 mg·L-1·d-1(以N计)和6.1 mg·L-1·d-1(以N计),反应器中NO2-的浓度一直维持在0.1 mg·L-1·d-1(以N计)以下.
为了进一步确认系统中的微生物,取系统运行第714 d时R3反应器中的泥样进行荧光原位杂交,所得FISH图片见图 7.图 7a中绿色为FITC染料标记的EUBmix探针,目标菌为细菌全菌,红色为Cy-3染料标记的DARCH-0872探针,目标菌为ANME 古菌;图 7b中绿色为是FITC染料标记的Amx-820探针,目标菌为Anammox 细菌,红色的为Cy-3标记的DARCH-0872探针,目标菌为ANME古菌.
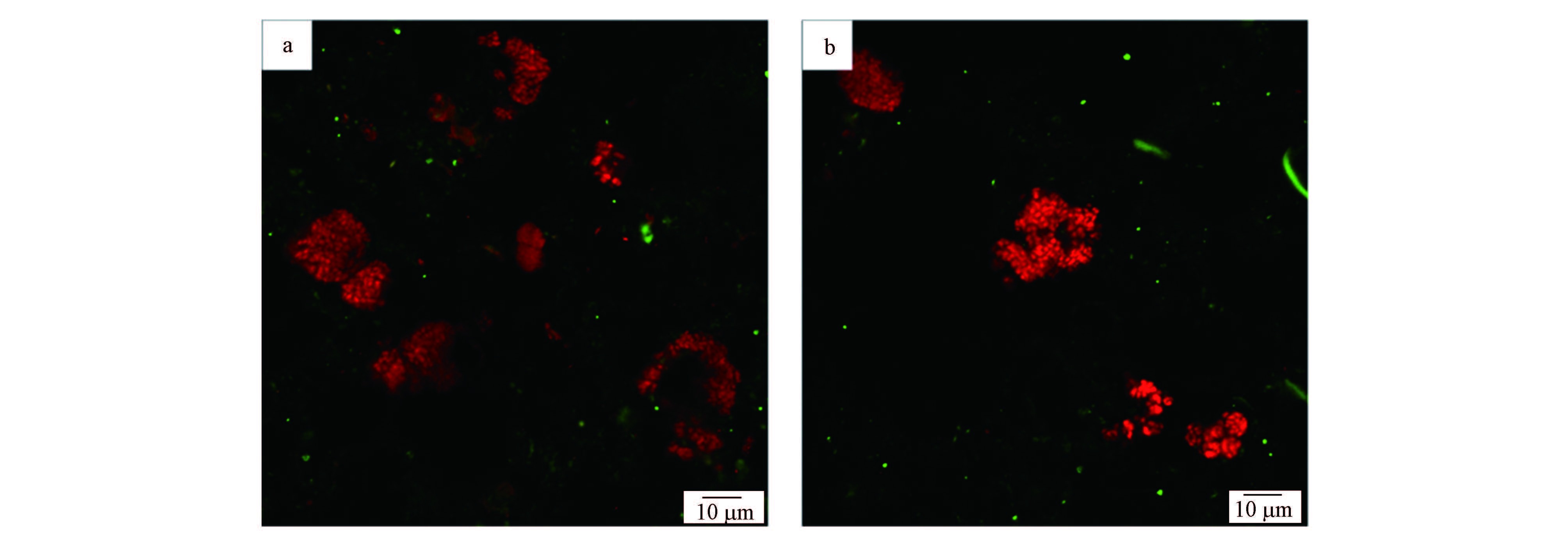 |
| 图 7 培养物C FISH检测结果(a.ANME古菌(红色)与细菌全菌(绿色),b.ANME古菌(红色)与Anammox细菌(绿色)) Fig. 7 FISH results of culture C(a.ANME archaea(red)and general bacteria(green),b.ANME archaea(red)and Anammox(green)) |
在杂交过程中,由红色Cy-3染料标记的DBACT-0193探针与其他探针混合也参与了杂交过程,所得目标菌NC10细菌杂交图片与细菌全菌杂交图片叠加后,应显示为黄色,但图 7a中并未出现黄色,表明培养物C中未检测到NC10细菌.图 7b则说明培养物C中可同时检测到ANME 古菌和Anammox 细菌,经统计学计算分析后,培养物C中ANME古菌占全菌比例约为77.7%,Anammox细菌占全菌比例约为17.7%,ANME古菌与Anammox细菌的比值约为4.39,无NC10细菌.该结果进一步从分子生物学定量的角度上证明了以ANME古菌为优势菌种的DAMO培养物C富集成功.
3.4 DAMO培养物DR4反应器以R3反应器内已富集驯化227 d后所得的培养物C为接种物,反应器在运行过程中,同样以CH4作为电子供体,只供给NO3-作为唯一氮源,其消耗曲线见图 8a.由于反应器R3的运行过程同时添加了NO3-与NH4+,因此,在反应器R4启动时系统内接种污泥中带有较低浓度的NO3-与NH4+,但NH4+很快就被接种物中已富集的Anammox细菌消耗完毕,此后再未投加NH4+也未检测到NH4+的存在.由图 8a可知,在220 d后,系统内NO3-出现了较为规律的降解,而NO2-一直处于较低浓度(0.1 mg·L-1以下),说明驯化系统达到了一个新的稳定状态,可初步认为反应器R4中培养物D富集成功.326 d后,反应器内NO3-的消耗速率有了较大程度的提高,稳定在3.9 mg·L-1·d-1(以N计).
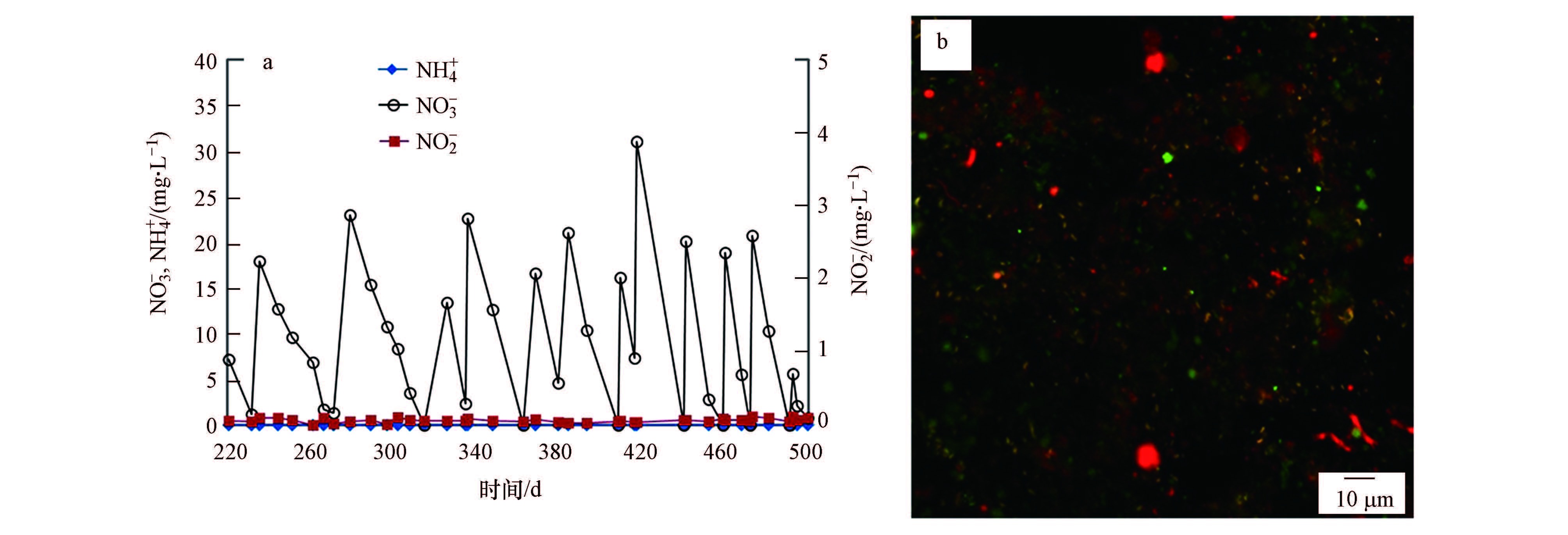 |
| 图 8 R4反应器NO3-、NH4+消耗曲线(a)和培养物D FISH检测结果(b) Fig. 8 NO3-,NH4+ consumption in R4(a)and FISH results of culture D(b) |
图 8b为R4反应器运行第 492 d时R4反应器内所取泥样进行杂交后的FISH图片.图中绿色为 FITC 染料标记的EUBmix探针,目标菌为细菌全菌,红色为 Cy-3 染料标记的 DARCH-0872探针,目标菌为ANME古菌,黄色为用红色Cy-3染料标记的DBACT-0193与细菌总菌杂交图片叠加而成,目标菌NC10细菌.应用 FISH 技术的量化功能,经过统计学计算分析后,培养物D中 ANME 古菌占全菌比例约为 26.5%,NC10细菌占全菌比例约为62.2%,ANME 古菌与NC10细菌的比值约为0.43.该结果进一步从分子生物学定量的角度上证明了以 DAMO 微生物为优势菌种的培养物 D 富集成功.
4 讨论(Discussion) 4.1 电子受体对DAMO富集培养物的影响在本研究中,培养物A和B均以淡水河道底泥、淡水湖泊底泥及水稻田土壤的混合物为接种污泥,且均以CH4为电子供体,区别在于前者以NO3-与NH4+为氮源,后者以NO2-为唯一电子受体.根据FISH检测结果,培养物B仅以NC10细菌为优势菌种,这说明NO2-作为电子受体对DAMO微生物培养过程中NC10细菌的富集具有重要意义.类似研究也表明,NC10细菌在NO2- 还原为N2的过程中发挥重要作用(Hu et al.,2009).
在培养物A中同时检测到ANME古菌和Anammox细菌,但并未检测到NC10细菌,与培养物B的检测结果差异较大.ANME 古菌的出现可说明NO3-作为电子受体对富集ANME古菌有重要意义.此前也有研究认为ANME古菌在NO3-还原为NO2-的过程中发挥重要作用(Hu et al.,2011).Anammox细菌的出现及NC10细菌的消失可能与NH4+的存在有关,有研究表明,Anammox细菌可以与DAMO微生物形成协同作用(Haroon et al.,2013).本试验中培养物A在富集过程中加入了NO3-与NH4+,NO3-为ANME古菌所利用,其还原产物NO2-可同时为Anammox细菌和NC10细菌利用,还原为N2,但由于Anammox细菌对NO2-的争夺力强于NC10细菌,NC10细菌在富集培养的过程中被逐渐淘汰,最终未被检出.ANME古菌与Anammox细菌形成协同关系.
就脱氮能力而言,培养物A的脱氮效率是培养物B的100倍之多,但R2反应器在经过202 d的富集培养后成功得到了培养物B,相比于培养物A,污泥驯化时间缩短了44%,但其中原因仍需要进一步深入研究.
培养物C以淡水河道底泥、活性污泥及厌氧消化污泥的混合物为接种污泥,且与反应器R1相同,加入NO3-与NH4+.FISH结果显示,培养物C中同样以ANME古菌和Anammox细菌为优势菌种,故可初步推断在培养物C中也存在与培养物A中相同的协同作用,即ANME古菌与Anammox细菌的协同关系.
培养物D以反应器R3内已富集驯化227 d后的培养物C为接种污泥,因而培养物D中最初含有已富集的Anammox细菌和ANME古菌,但由于在接下来的富集驯化过程中未加入NH4+,经过一段时间后FISH结果显示,培养物D以NC10细菌和ANME古菌为优势菌种,并未检测到Anammox细菌.可见,由于Anammox细菌缺少电子供体,在系统中逐渐消失,取代它的是NC10细菌,进一步证实NO2-对富集培养过程中NC10细菌的选择具有重要意义.同时,ANME古菌在新的富集培养过程中被保留下来,也说明NO3-对富集培养过程中ANME古菌的选择十分重要.在培养物D中,两种DAMO微生物形成了一种新的协同关系.
对比ANME古菌与Anammmox细菌之间的协同关系与ANME古菌和NC10细菌之间的协同关系可知,前者的脱氮速率是后者的2.7倍.有研究指出,Anammox细菌的亚硝酸盐半饱和常数低于NC10细菌(Winkler et al.,2015).因而相比于NC10细菌,Anammox细菌对NO2-具有更大的亲和力与竞争力,因此,仅从脱氮能力一方面考虑,DAMO 古菌与Anammmox细菌之间的协同作用确实优于与DAMO细菌之间的协同作用,但后者在减排温室气体甲烷及节约污水处理厂投资运营成本方面具有更大的意义.
4.2 接种污泥对DAMO富集培养物的影响培养物 A 与培养物 C在富集培养过程中均加入NH4+和NO3-作为氮源,但两者的接种污泥不同,前者以淡水河道底泥、淡水湖泊底泥与水稻田土壤的混合物为接种污泥,后者则以淡水河道底泥、活性污泥及厌氧消化污泥的混合物为接种污泥.FISH 试验结果表明,两种培养物均以ANME古菌与Anammox细菌为优势菌种,这两种微生物之间形成协同作用.但在不同的培养物中,两种微生物所占的比例并不相同,在培养物A中,两者比例相近(ANME古菌 39.4%,Anammox细菌 45.8%),而在培养物C中,ANME 古菌更占优势(77.7%).
就脱氮速率而言,培养物A的总脱氮速率可达45.6 mg·L-1·d-1(包括NH4+、NO3-),是培养物C的4.3倍.但培养物C的富集驯化时间较A缩短了36%.综上可知,不同接种污泥对DAMO微生物的群落结构、代谢活性及驯化时间有较大影响.
5 结论(Conclusions)本文利用两种电子受体和不同接种污泥,经过1000多天的富集驯化,获得了4种DAMO培养物,并通过分子生物学分析方法和化学分析方法,探究不同接种物对富集DAMO微生物的影响,结论如下:
1) 电子受体会影响DAMO微生物的选择,NO3-对选择ANME古菌有重要意义,而NO2-则影响NC10细菌的选择.当以NO3-作为唯一电子受体时,ANME古菌会与NC10细菌形成协同关系.
2) NH4+的加入会引起Anammox细菌与NC10细菌竞争NO2-,从而改变微生物群落结构.ANME古菌也可与Anammox细菌形成协同关系,且相比于与NC10细菌之间的协同关系,其脱氮速率提高了1.7倍.
3) 接种污泥会影响DAMO微生物的群落结构、代谢活性及驯化时间.以淡水河道底泥、淡水湖泊底泥及水稻田土壤的混合物为接种污泥所得到的富集培养物在脱氮速率方面优于以淡水河道底泥、活性污泥及厌氧消化污泥的混合物作为接种污泥所得到的培养物,但后者的富集驯化时间可缩短36%,且两者微生物群落结构存在明显差异.
| [1] | APHA.1998.Standard Methods for Examination of Water and Wastewater(20th ed)[S].Washington, DC: American Public HealthAssociation, American Water Works Association, Water Pollution Control Federation |
| [2] | 蔡琛. 2013.反硝化型甲烷厌氧氧化微生物的富集培养研究[D].杭州:浙江大学 http://cdmd.cnki.com.cn/article/cdmd-10335-1013153450.htm |
| [3] | Daims H, Bruhl A, Amann R, et al. 1999. The domain-specific probe EUB338 is insufficient for the detection of all bacteria: development and evaluation of a more comprehensive probe set[J]. Syst Appl Microbiol , 22 (3) : 434–444. DOI:10.1016/S0723-2020(99)80053-8 |
| [4] | Ettwig K F, Butler M K, Le Paslier D, et al. 2010. Nitrite-driven anaerobic methane oxidation by oxygenic bacteria[J]. Nature , 464 (7288) : 543–548. DOI:10.1038/nature08883 |
| [5] | Haroon M F, Hu S H, Shi Y, et al. 2013. Anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage[J]. Nature , 500 (7464) : 567–570. DOI:10.1038/nature12375 |
| [6] | He Z F, GengS, Shen L D, et al. 2015a. The short-and long-term effects of environmentalconditions on anaerobic methane oxidationcoupled to nitrite reduction[J]. Water Research , 68 : 554–562. DOI:10.1016/j.watres.2014.09.055 |
| [7] | He Z F, Geng S, Pan Y W, et al. 2015b. Improvement of the trace metal composition of medium fornitrite-dependent anaerobic methane oxidation bacteria: Iron (Ⅱ) and copper (Ⅱ) make a difference[J]. Water Research , 85 : 235–243. DOI:10.1016/j.watres.2015.08.040 |
| [8] | Hu B L, Shen L D, Lian X, et al. 2014. Evidence for nitrite-dependent anaerobic methane oxidation as a previously over looked microbial methane sink in wetlands[J]. Proc Natl Acad Sci USA , 111 (12) : 4495–500. DOI:10.1073/pnas.1318393111 |
| [9] | Hu S H, Zeng R J, Burow L C, et al. 2009. Enrichment of denitrifying anaerobic methane oxidizing microorgansims[J]. Env Microbiol Rep , 1 (5) : 377–384. DOI:10.1111/j.1758-2229.2009.00083.x |
| [10] | Hu S H, Zeng R J, Keller J, et al. 2011. Effect of nitrate and nitrite on the selection of microorganisms in the denitrifying anaerobic methane oxidation process[J]. Env Microbiol Rep , 3 (3) : 315–319. DOI:10.1111/j.1758-2229.2010.00227.x |
| [11] | Lema J M, Omil F. 2001. Anaerobic treatment:a key technology for a sustainablemanagement of wastes in Europe[J]. Water Sci Technol , 44 : 133–140. |
| [12] | Lettinga G. 1995. Anaerobic-digestion and waste-water treatment systems[J]. Antonie Van Leeuwenhoek , 67 : 3–28. DOI:10.1007/BF00872193 |
| [13] | Luesken F A, van Alen T A, van der Biezen E, et al. 2011a. Diversity and enrichment of nitrite-dependent anaerobic methane oxidizing bacteria from wastewater sludge[J]. Appl Microbiol Biotechnol , 92 (4) : 845–854. DOI:10.1007/s00253-011-3361-9 |
| [14] | Luesken F A, Sanchez J, van Alen T A, et al. 2011b. Simultaneous nitrite-dependent anaerobic methane and ammonium oxidation processes[J]. Appl Environ Microbiol , 77 (19) : 6802–6807. DOI:10.1128/AEM.05539-11 |
| [15] | Raghoebarsing A A, Pol A, van de Pas-Schoonen, et al. 2006. A microbial consortium couples anaerobic methane oxidation to denitrification[J]. Nature , 440 (7086) : 918–921. DOI:10.1038/nature04617 |
| [16] | Schmid M C, Maas B, Dapena A, et al. 2005. Biomarkers for in situ detection of anaerobic ammonium-oxidizing (Anammox) bacteria[J]. Appl Environ Microbiol , 71 (4) : 1677–1684. DOI:10.1128/AEM.71.4.1677-1684.2005 |
| [17] | Shen L D, Liu S, Zhu Q, et al. 2014. Distribution and diversity of nitrite-dependent anaerobic methane-oxidising bacteria in the sediments of the Qiantang River[J]. Microb Ecol , 67 : 341–349. DOI:10.1007/s00248-013-0330-0 |
| [18] | Strous M, Jetten M S M, et al. 2004. Anaerobic oxidation of methane and ammonium[J]. Annual Review of Microbiology , 58 : 99–117. DOI:10.1146/annurev.micro.58.030603.123605 |
| [19] | 魏复盛. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社 . |
| [20] | Winkler M K H, EttwigK F, VanneckeT P W, et al. 2015. Modelling simultaneous anaerobic methane and ammonium removal in a granular sludge reactor[J]. Water Research , 73 : 323–331. DOI:10.1016/j.watres.2015.01.039 |
| [21] | Wu M L, Ettwig K F, Jetten M S M, et al. 2011. A new intra-aerobic metabolism in the nitrite-dependent anaerobic methane-oxidizing bacterium Candidatus‘Methylomirabilisoxyfera’[J]. Biochem Soc Trans , 39 (1) : 243–248. DOI:10.1042/BST0390243 |
| [22] | 徐少娟. 2012.复合底物对颗粒化 EBPR 系统稳定过程影响机制研究[D].杭州:浙江工商大学 http://cdmd.cnki.com.cn/article/cdmd-10353-1012336357.htm |
| [23] | 朱群, 沈李东, 胡宝兰, 等.2013. 西湖底泥中的反硝化型甲烷厌氧氧化菌的分子生物学检测[J]. 环境科学学报 , 2013, 33 (5) : 1321–1325. |
| [24] | Zhu G, Jetten M S M, Kuschk P, et al. 2010. Potenial roles of anaerobic ammonium and methane oxidation in the nitrogen cycle of wetland ecosystems Interactions between denitrifying anaerobic methane oxidizing bacteria and anammox bacteria[J]. Applied Microbiology and Biotechnology , 86 (4) : 1043–1055. DOI:10.1007/s00253-010-2451-4 |
| [25] | Zhu B, Sanchez J, van Alen T A, et al. 2011. Combined anaerobic ammonium and methane oxidation for nitrogen and methane removal[J]. Biochem Soc Trans , 39 (6) : 1822–1825. DOI:10.1042/BST20110704 |
 2016, Vol. 36
2016, Vol. 36


