随着工业化的发展,重金属(如铅、铜、镉)以各种形式存在于水体、大气及土壤中而不被降解,且通过食物链最终在人体中富集(Liu et al., 2008;Jang et al., 2008;杨金艳等, 2016;Zhuang et al., 2009;张帆等,2013;艾翠玲等,2015;王学川等,2014;Boto et al., 1987).其中,水体中的重金属污染物可更直接对人体产生危害,因此,对水体中重金属污染的治理已经到了迫在眉睫的地步.目前,许多方法都被用于处理水体中的重金属污染,如反向渗透、化学沉淀、电解、超滤、絮凝及离子交换(Eilbeck et al., 1996;Wang et al., 1993).水凝胶是一种具有三维网络结构的聚合物材料,已作为节水材料(Wang et al., 2011;Nakason et al., 2010;Chen et al., 2009)、智能药物释放载体(Silan et al., 2012)、纳米反应器(Saeidian et al., 2009)和清除水体中的重金属离子(Kavianinia et al., 2012;Guilherme et al., 2010)、有机污染物(Rao et al., 2011)、燃料(Özkahraman et al., 2011)的高效吸附剂而广泛使用.水凝胶骨架上的亲水性基团(-COOH、-COO、-NH2和-OH)对污染物具有很高的亲和力,使水凝胶吸附剂具有吸附速率快和吸附容量高的优点(Yi et al., 2010;Yetimo ğlu et al., 2007).此外,水凝胶可通过骨架上基团的修饰制备成复合物来提高金属离子的吸附容量及拓展用途(Ozgur et al., 2009;Pekel et al., 2001).在众多水凝胶类吸附剂中,多糖基水凝胶因具有可再生性、可生物降解性、无毒等特性而引起人们的广泛关注(Ngah et al., 2011).
黄原胶作为多糖生物大分子,具有吸附重金属离子的结构优势,能通过许多吸附机理清除水体中的重金属离子,且黄原胶具有可生物降解性,是环境友好型吸附材料(李一鸣等,2011).羟基磷灰石(HPA)由羟基和磷灰石两部分组成,具有硬度高、优良的生物相容性和生物活性,对各种二价金属阳离子有着广泛的容纳性(彭继荣等,2005).在黄原胶基水凝胶的骨架上引入羟基磷灰石,不仅可提高水凝胶的强度,且通过Ca2+的离子交换作用可增加吸附剂对重金属阳离子的吸附性能.
因此,本研究以黄原胶为天然高分子骨架,丙烯酸为接枝单体,羟基磷灰石为无机组分,N, N-亚甲基双丙烯酰胺为交联剂,过硫酸钾为引发剂,通过一步法制备高分子改性黄原胶/羟基磷灰石复合水凝胶吸附剂.同时,利用红外光谱、扫描电镜对其聚合结构和形貌进行表征,并将该种有机/无机复合水凝胶吸附剂用于水体中重金属Cu2+和Pb2+的吸附,系统考察吸附浓度、吸附时间、pH范围对吸附性能的影响,并对吸附剂的重复使用性能进行测试,以期为水体重金属离子的吸附提供依据.
2 实验部分(Experimental) 2.1 试剂及仪器试剂:黄原胶(XG),MW=300000,脱乙酰度80%;丙烯酸(AA)、Pb (NO3)2、Cu (NO3)2、N, N-亚甲基双丙烯酰胺(MBA)、N, N, N, N-四甲基乙二胺(TEMED)、无水乙醇、无水甲醇、过硫酸铵(APS,使用前进行重结晶精制)、氢氧化钠(NaOH)均为AR级;羟基磷灰石(HAP)为CP级.
仪器:紫外-可见光谱仪(Agilent 8453,Agilent Technologies);冷冻干燥机(FD-1D-50,北京博医康实验仪器有限公司);红外光谱仪(Spectrum One Perkinelmer);热重分析仪(Pyris Diamond Perkinelmer);JSM6701扫描电子显微镜(SEM,JSMS-6701F,日本电子光学公司);Alpha-Centauri FT-IR型红外光谱仪(日本岛津),分辨率0.008 cm-1,KBr压片,4000~400 cm-1范围摄谱;pHS-3C型酸度计(上海雷磁仪器厂).
2.2 高分子改性黄原胶/羟基磷灰石复合水凝胶的制备准确称取0.3 g XG溶于40 mL去离子水中,充分溶解后加入到50 mL三颈瓶中;随后加入AA 2 g,MBA 0.2 g,充分搅拌并加入引发剂APS 0.15 g;然后加入计算量的HAP,在400 r·min-1条件下搅拌反应4 h;最后,加入TEMED 0.2 mL,100 r·min-1搅拌2 min,将混合液倒入试管中,置于50 ℃烘箱进行聚合反应6 h.聚合反应完成后,将得到的水凝胶从试管中取出,在温度80 ℃条件下烘干,即得高分子改性黄原胶/羟基磷灰石复合水凝胶(XG-g-PAA/HAP).按同样条件制备未加入HAP的黄原胶基水凝胶(XG-g-PAA).所制备的高分子改性黄原胶/羟基磷灰石复合水凝胶和黄原胶基水凝胶在吸附实验前,将吸附剂研磨过筛,收集40~80目样品进行吸附试验.
2.3 吸附剂的结构表征 2.3.1 红外光谱采用KBr压片法,将复合凝胶研成粉末并与KBr粉末充分研磨混合后压片,在红外光谱仪上测定黄原胶基水凝胶(XG-g-PAA)和高分子改性黄原胶/羟基磷灰石复合水凝胶(XG-g-PAA/HAP)在400~4000 cm-1下的透射率.
2.3.2 扫描电镜h将干燥后的黄原胶基复合水凝胶和黄原胶基水凝胶切成薄片,采用导电胶带粘贴于铜柱上,喷金后采用扫描电镜观察其表面结构.
2.3.3 表面电荷采用动态光散射(Dynamic Light Scattering,DLS)测试吸附剂的Zeta电位,微小粒子悬浮在液体中会无规则地运动,当光通过时,粒子会将光散射,在一定角度下可以检测到光信号,所检测到的信号是多个散射光子叠加后的结果,具有统计意义.大多数粒子在水溶液中被离子化或由于电荷的吸附作用都会使其带有表面电荷.使用Malvern DTS1060粒径仪测定XG-g-PAA和XG-g-PAA/HAP吸附剂在水溶液中的Zeta电位.XG-g-PAA和XG-g-PAA/HAP测定使用DTS1060型样品池,散射角度90°,测试温度25 ℃.
2.4 高分子改性黄原胶/羟基磷灰石复合水凝胶的重金属离子吸附性能准确称取25.0 mg黄原胶基复合水凝胶和黄原胶基水凝胶(误差范围±0.5 mg)加入到50 mL锥形瓶中,分别加入25 mL不同浓度的Cu2+或Pb2+溶液.将锥形瓶密封后放入振荡箱中,转速120 r·min-1,振荡6 h.吸附完成后,将上清液移入试管中,取一定体积的上清液利用紫外-可见分光光度计测其吸光度.
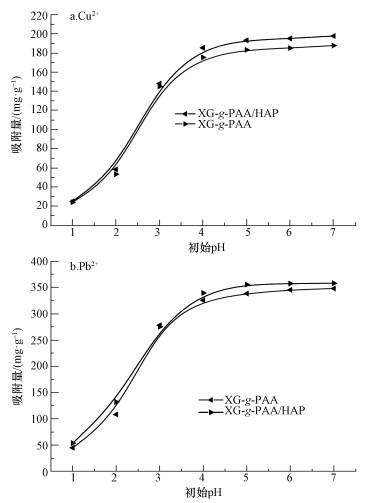
黄原胶基复合水凝胶和黄原胶基水凝胶对Cu2+和Pb2+的吸附效果可用溶液中金属离子的吸附量表示,其计算公式为:
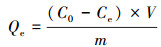
|
(1) |
式中,Qe为平衡吸附量(mg·g-1),C0和Ce分别为初始和吸附平衡时的金属离子浓度(mg·L-1);V为溶液体积(L);m为吸附剂质量(g).
用0.1 mol·L-1 NaOH或者HCl溶液调节Cu2+和Pb2+溶液的pH值,吸附液均振摇2 h,在pH=3~7下研究其对吸附剂吸附性能的影响.吸附剂的吸附动力学研究用200 mg·L-1的Cu2+或者400 mg·L-1的Pb2+溶液进行,吸附时间为5~120 min,依据准一级动力学方程和准二级动力学方程对吸附过程的主要影响因素进行评价.在溶液浓度为100~800 mg·L-1范围内测试Cu2+和Pb2+的等温吸附线.吸附剂对Cu2+和Pb2+吸附的最优pH为5.吸附过程中主要影响因素采用Langmuir和Freundlich等温吸附模型评价(吴敏等,2003).
脱附和再生性能采用如下过程进行研究:当吸附过程结束后,分离出吸附剂并将其置于25 mL的盐酸溶液中(0.5 mol·L-1)脱附4 h,用双蒸水洗涤数次后将吸附剂放置于氢氧化钠溶液(0.5 mol·L-1)中再生一定时间;最后,吸附剂用双蒸水再次洗涤数次后用于再一次的吸附过程.测试吸附-脱附过程的溶液浓度,计算吸附和脱吸附的百分比.
3 结果(Results) 3.1 高分子改性黄原胶/羟基磷灰石复合水凝胶的制备及表征本实验中,高分子改性黄原胶/羟基磷灰石复合水凝胶通过热引发聚合得到.首先,引发剂APS分解生成小分子自由基,随后,XG由于分子链上的羟基被小分子自由基活化转变为大分子自由基,含双键的AA和MBA就可以进行接枝反应,最终形成三维网状结构.为了验证整个聚合过程,分别对XG、HAP、XG-g-PAA和XG-g-PAA/HAP做红外谱图分析,结果如图 1所示.其中,曲线a为羟基磷灰石的红外谱图,630 cm-1处为-OH的伸缩振动,1626 cm-1和1381 cm-1处为-OH的弯曲振动,1052、621.3和583.1 cm-1处为磷酸基的弯曲和伸缩振动峰;曲线b为XG的红外谱图,3400 cm-1附近的峰为-OH的伸缩振动,2950 cm-1处为烷基中羟基的伸缩振动,1629 cm-1处为羧基的特征峰,1420、1062和790 cm-1处的特征峰分别为甲基中-CH的弯曲振动、环醚中-C-O-C-的伸缩振动及环状-CH的弯曲振动.这些特征峰在XG-g-PAA和XG-g-PAA/HAP的谱图中都出现.而XG-g-PAA (曲线c)和XG-g-PAA/HAP (曲线d)的谱图中1726和1453 cm-1处羧基的特征吸收峰明显增强,说明丙烯酸已经接枝到黄原胶上.以上结果表明,XG-g-PAA和XG-g-PAA/HAP成功制备.
 |
| 图 1 HAP (a)、XG (b)、XG-g-PAA (c)和XG-g-PAA/HAP (d)的红外谱图分析 Fig. 1 FT-IR spectra of HAP (a), XG (b), XG-g-PAA (c) and XG-g-PAA/HAP (d) |
从羟基磷灰石(HAP)、黄原胶基水凝胶(XG-g-PAA)、黄原胶基复合水凝胶(XG-g-PAA/HAP)的扫描电镜图可以看出,因为范德华力和氢键的存在,较易形成聚集体,造成羟基磷灰石结构较为致密;XG-g-PAA表面结构致密,没有孔道存在(图 2a).填入一定量的HAP后,XG-g-PAA/HAP吸附剂的结构发生了改变,结构变得较为疏松(图 2b).
 |
| 图 2 XG-g-PAA (a)、XG-g-PAA/HAP (b)和HAP (C)的扫描电镜 Fig. 2 The SEM images of XG-g-PAA (a), XG-g-PAA/HAP (b) and HAP (C) |
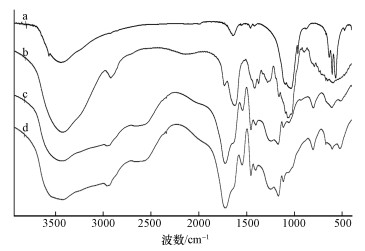
图 3为XG-g-PAA/HAP和XG-g-PAA在不同pH下的Zeta电位.由图 3可以看出,在相同pH条件下,XG-g-PAA/HAP比XG-g-PAA的Zeta电位变得更负,说明加入羟基磷灰石后表面负电荷增多,且在pH=4~6范围内负值较大,即在该pH范围内带负电荷较多.表面负电荷越多,越有利于与带正电荷的金属离子相互吸引,发生吸附.
 |
| 图 3 XG-g-PAA/HAP和XG-g-PAA在不同pH值下的Zeta电位 Fig. 3 Zeta Potentials of XG-g-PAA/HAP and XG-g-PAA as a function of pH |
吸附剂对金属离子的吸附性能受到多种因素的影响,如pH值、温度、金属离子浓度、吸附时间等.在不同条件下,黄原胶基复合水凝胶和黄原胶基水凝胶具有不同的吸附容量,分别如下所述.
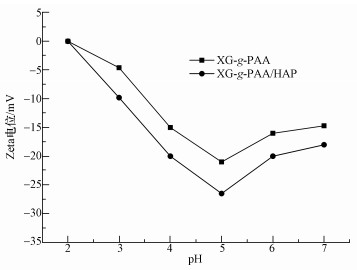
3.2.1 pH值对吸附效果的影响重金属离子溶液的pH值可影响金属形态和吸附剂表面电荷的分配,因此,吸附剂对重金属离子的吸附容量在一定程度上依赖于溶液的pH值.XG-g-PAA和XG-g-PAA/HAP对不同pH下的Cu2+和Pb2+吸附效果如图 4所示.
 |
| 图 4 高分子改性黄原胶/羟基磷灰石复合水凝胶在不同pH值下的吸附性能(25 ℃) Fig. 4 The absorption capacity of xanthan gum based organic/inorganic complexes in different pH (25 ℃) |
从图 4可以看出,室温下随着pH值的增大,XG-g-PAA和XG-g-PAA/HAP水凝胶的吸附能力逐渐增大,在pH为1~2之间时,吸附剂的吸附容量较小;在pH为2~3时,吸附剂的吸附容量快速增大.这主要是因为在pH < 2时,水凝胶中的COO-与溶液中的H+结合造成与金属离子结合的COO-离子数量减少,导致凝胶吸附容量降低.随着pH值增大,H+数量减少,COO-离子可与金属离子充分结合,吸附容量增大,pH>4后,吸附剂的吸附容量达到平衡.当pH高于最佳范围时,重金属离子水解生成相应的氢氧化物,产生聚合物沉积在吸附剂表面,从而使两种金属离子的吸附量都随着pH值升高而减少(陈刚,2009).另外,从图 3也可以看出,当pH从2升高至6时,吸附剂Zeta电位值变得越来越负,pH为4时负值最大,这说明吸附剂表面在溶液pH为4时带负电荷最多,最有利于与带正电荷的金属离子相互吸引发生吸附.
3.2.2 吸附时间对吸附效果的影响室温下, 吸附剂的吸附动力学结果如图 5所示.从图中可以看出,XG-g-PAA和XG-g-PAA/HAP水凝胶对Cu2+和Pb2+的吸附速度较快,90%以上的金属离子在30 min内被吸附完.XG-g-PAA和XG-g-PAA/HAP水凝胶对金属离子的吸附过程可分为两个阶段:第1阶段为前20 min,是快速吸附期;第2阶段为20~40 min,为慢速吸附期,直至吸附剂达到吸附平衡.在40 min后,吸附剂对Cu2+和Pb2+仍具有一定的吸附作用,但吸附速率较慢.重金属离子的清除作用主要在第1阶段进行,当吸附位点被金属离子结合完全后,金属离子可能在活性位点附近聚集,即吸附剂的吸附饱和状态(Abdel-Halim et al., 2013).XG-g-PAA/HAP的吸附容量大于XG-g-PAA,而且XG-g-PAA/HAP的吸附速度快于XG-g-PAA,这主要是因为在黄原胶基水凝胶的基础上加入羟基磷灰石,XG-g-PAA/HAP吸附剂的结构变得较XG-g-PAA疏松;而且,羟基磷灰石还具有容纳二价金属离子的效果,从而使XG-g-PAA/HAP的吸附速率和吸附容量较XG-g-PAA有所改善和提高,有利于清除水体中的重金属离子.
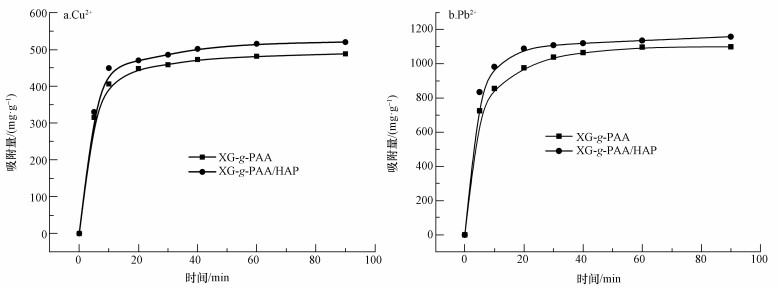 |
| 图 5 吸附时间对XG-g-PAA和XG-g-PAA/HAP吸附性能的影响(25 ℃) Fig. 5 The effect of absorption time for absorption capacity of xanthan gum based organic/inorganic complexes (25 ℃) |
为了更好地理解吸附机制和评价吸附重金属离子的吸附性能.吸附动力学过程采用准一级动力学模型(式(2))和准二级动力学模型(式(3))进行评价.

|
(2) |

|
(3) |
式中,qt和qe是吸附剂对Cu2+和Pb2+在t时刻和吸附平衡时的吸附量(mg·g-1),k1(min-1)和k2 (g·mg-1·min-1)分别为准一级和准二级动力学模型的速率常数,数据拟合结果如表 1所示.
| 表 1 准一级和准二级动力学方程参数对比 Table 1 Pseudo-first-order and pseudo-second-order parameters |
由表 1可知,准一级动力学方程拟合得到的R2均较低,说明该反应不符合准一级反应的相关特征.对反应进行准二级动力学拟合,得到的R2均大于0.99,拟合度高,说明准二级动力学模型可以很好地描述吸附数据,也说明Cu2+和Pb2+在吸附剂上的吸附过程属于化学吸附过程.
3.2.3 溶液中金属离子初始浓度对吸附效果的影响金属离子初始浓度对XG-g-PAA和XG-g-PAA/HAP的吸附性能具有非常大的影响.从图 6a可以看出,室温下,当Cu2+浓度在300 mg·L-1以下时,随着溶液中Cu2+初始浓度的增加,Cu2+吸附容量逐渐增加;当Cu2+浓度达到300 mg·L-1以上后,Cu2+的吸附量变化不大,这时吸附剂的结合位点大部分被金属离子占据,吸附容量达到饱和状态.从图 6b可以看出,当Pb2+浓度在600 mg·L-1以下时,随着溶液中Pb2+初始浓度的增加,Pb2+吸附量逐渐增加,这主要是因为高浓度的金属离子溶液可以为吸附剂的吸附提供驱动力,消除金属离子在吸附剂和溶液之间的频繁交换(Yi et al., 2010).当Pb2+浓度达到600 mg·L-1以上后,Pb2+的吸附量变化不大,说明吸附剂的吸附位点大部分已达到饱和状态.XG-g-PAA/HAP的吸附容量大于XG-g-PAA,而且XG-g-PAA/HAP的吸附速度快于XG-g-PAA,这主要与其各自的结构有关.
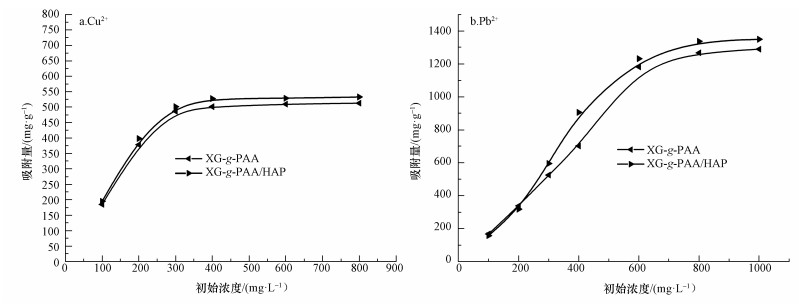 |
| 图 6 溶液中金属离子初始浓度对XG-g-PAA/HAP和XG-g-PAA吸附效果的影响(25 ℃) Fig. 6 The effect of initial concentration of metal ion for absorption capacity of XG-g-PAA/HAP and XG-g-PAA (25 ℃) |
为了分析吸附机理,使用Langmuir (式(4))和Freundlich (式(5))等温吸附模型用于分析实验数据,结果见表 2.
| 表 2 Langmuir及Freundlich等温方程吸附参数 Table 2 Parameters for Langmuir and Freundlich isotherm models |

|
(4) |

|
(5) |
式中,Ce和qe分别为吸附平衡浓度(mg·L-1)和平衡吸附量(mg·g-1);Qm为最大吸附容量(mg·g-1);KL(L·mg-1)和KF(mg1-1/n·L1/n·g-1)分别为Langmuir和Freundlich等温方程的等温常数,而n(无量纲)是描述吸附强度的常数.
从表 2可以看出,用Langmuir等温模型对数据与其他吸附剂相比,本研究制备的高分子改性黄原胶/羟基磷灰石复合水凝胶对Cu2+和Pb2+具有较好的吸附性能(表 3).进行拟合后,所得R2均高于0.99,而且计算值和实验值很接近.但用Freundlich等温模型拟合后,所得R2均低于0.99.从拟合结果分析可以得出,Langmuir等温模型可以更好地描述吸附数据.这就说明重金属离子在吸附剂上的吸附是单层吸附,而且这种吸附过程是一个化学吸附过程.
| 表 3 不同吸附剂吸附容量对比 Table 3 Comparison of Cu2+ and Pb2+ adsorption among different adsorbents |
采用5次连续的吸附-脱吸附循环法评价XG-g-PAA/HAP吸附剂对Cu2+和Pb2+的循环使用性能,结果如图 7所示.从图中可以看出,XG-g-PAA/HAP对Cu2+和Pb2+具有较好的重复使用性,在5次连续的吸附-脱吸附循环后,吸附剂的吸附性能可保持在80%以上,提示XG-g-PAA/HAP可作为一种清除水中重金属离子Cu2+和Pb2+的具有一定应用前景的吸附剂.
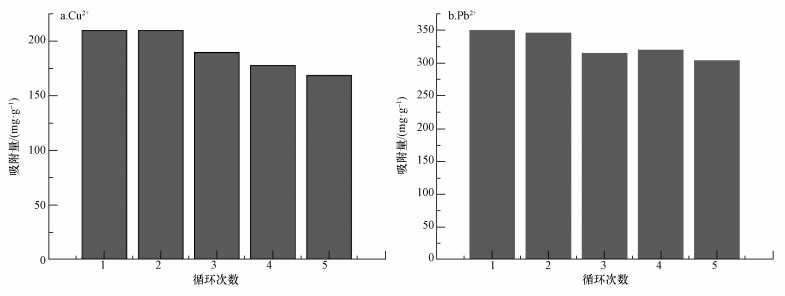 |
| 图 7 XG-g-PAA/HAP的重复使用性能 Fig. 7 The adsorption amount for Cu2+ and Pb2+ in different adsorption-desorption cycles of XG-g-PAA/HAP |
以天然高分子黄原胶为原料,采用有机/无机复合的方法通过接枝共聚, 成功制备了对金属离子具有高吸附性能的两种吸附剂:黄原胶接枝聚丙烯酸凝胶(XG-g-PAA)和黄原胶接枝聚丙烯酸复合羟基磷灰石凝胶(XG-g-PAA/HAP).经过吸附性能的测试,发现XG-g-PAA和XG-g-PAA/HAP对Cu2+和Pb2+具有良好的吸附性能.在pH < 2时,XG-g-PAA和XG-g-PAA/HAP的吸附容量均较小,当pH>2后,两者的吸附容量大幅增加.XG-g-PAA和XG-g-PAA/HAP吸附剂在30 min内可吸附溶液中90%以上的金属离子,其中,XG-g-PAA/HAP的吸附速度快于XG-g-PAA,吸附容量前者大于后者.
总体而言,采用天然高分子制备水吸附剂,通过加入廉价的羟基磷灰石不仅使吸附剂吸附性能得以保持,而且提高了其机械性能,降低了制备成本,使XG-g-PAA/HAP有望成为一种可重复使用且效率高的吸附剂.
致谢: 感谢参与本次实验的3位本科生(刘贝琴、郭佳娣、李永庭).| [${referVo.labelOrder}] | Abdel-Halim E S, Al-Deyab S S. 2013. Preparation of poly (acrylic acid)/starch hydrogel and its application for cadmium ion removal from aqueous solutions[J]. Reactive & Functional Polymers, 75(1) : 1–8. |
| [${referVo.labelOrder}] | Azzam A M, El-Wakeel S T, Mostafa B B, et al. 2016. Removal of Pb, Cd, Cu and Ni from aqueous solution using nanoscale zero valent iron particles[J]. Journal of Environmental Chemical Engineering, 4(2) : 2196–2206. DOI:10.1016/j.jece.2016.03.048 |
| [${referVo.labelOrder}] | 艾翠玲, 雷英杰, 张国春, 等. 2015. 纳米铁氧化物吸附处理重金属废水的研究进展[J]. 化工环保, 2015, 35(6) : 593–598. |
| [${referVo.labelOrder}] | Boto B, Pawlowski L. 1987. Wastewater Treatment by Ion Exchange[M]. New York: Chapmanand Hall. |
| [${referVo.labelOrder}] | Chen Y, Liu Y F, Tan H M, et al. 2009. Synthesis and characterization of a novel superabsorbent polymer of N, O-carboxymethyl chitosan graft copolymerized with vinyl monomers[J]. Carbohydrate Polymers, 75(2) : 287–292. DOI:10.1016/j.carbpol.2008.07.022 |
| [${referVo.labelOrder}] | 陈刚.2009.吸附法处理废水中重金属离子的研究[D].湘潭:湘潭大学.18 |
| [${referVo.labelOrder}] | Cui L, Wang Y, Gao L, et al. 2015. EDTA functionalized magnetic graphene oxide for removal of Pb (Ⅱ), Hg (Ⅱ) and Cu (Ⅱ) in water treatment:Adsorption mechanism and separation property[J]. Chemical Engineering Journal, 281 : 1–10. DOI:10.1016/j.cej.2015.06.043 |
| [${referVo.labelOrder}] | Eilbeck W, Mattock G. 1996. Chemical Processin Water Treatment[M]. New York: John Wiley and Sons. |
| [${referVo.labelOrder}] | Guilherme M R, Reis A V, Paulino A T, et al. 2010. Pectin-based polymer hydrogel as a carrier for release of agricultural nutrients and removal of heavy metals from wastewater[J]. Journal of Applied Polymer Science, 117(6) : 3146–3154. |
| [${referVo.labelOrder}] | Jang S H, Joung Y G, Min B G, et al. 2008. Preparation and lead ion removal property of hydroxyapatite/polyacrylamide composite hydrogels[J]. Journal of Hazardous Materials, 159(2/3) : 294–299. |
| [${referVo.labelOrder}] | Kavianinia I, Plieger P G, Kandile N G, et al. 2012. New hydrogels based on symmetrical aromatic anhydrides:Synthesis, characterization and metal ion adsorption evaluation[J]. Carbohydrate Polymers, 87(1) : 881–893. DOI:10.1016/j.carbpol.2011.08.076 |
| [${referVo.labelOrder}] | Liu C, Bai R, Quan S L. 2008. Selective removal of copper and lead ions by diethylenetriamine-functionalized adsorbent:Behaviors and mechanisms[J]. Water Research, 42(6/7) : 1511–22. |
| [${referVo.labelOrder}] | Liu Y, Fu R, Sun Y, et al. 2016. Multifunctional nanocomposites Fe3O4@SiO2-EDTA for Pb (Ⅱ) and Cu (Ⅱ) removal from aqueous solutions[J]. Applied Surface Science, 369 : 267–276. DOI:10.1016/j.apsusc.2016.02.043 |
| [${referVo.labelOrder}] | Liu D, Li Z, Zhu Y, et al. 2014. Recycled chitosan nanofibril as an effective Cu (Ⅱ), Pb (Ⅱ) and Cd (Ⅱ) ionic chelating agent:Adsorption and desorption performance[J]. Carbohydrate Polymers, 111 : 469–476. DOI:10.1016/j.carbpol.2014.04.018 |
| [${referVo.labelOrder}] | 李一鸣, 宋营营, 潘永萍, 等. 2011. 黄原胶对水中铅离子吸附性能研究[J]. 环境科学与技术, 2011(S1) : 1–4. |
| [${referVo.labelOrder}] | Nakason C, Wohmang T, Kaesaman A, et al. 2010. Preparation of cassava starch-graft-polyacrylamide superabsorbents and associated composites by reactive blending[J]. Carbohydrate Polymers, 81(2) : 348–357. DOI:10.1016/j.carbpol.2010.02.030 |
| [${referVo.labelOrder}] | Ngah W S W, Teong L C, Hanafiah M A K M. 2011. Adsorption of dyes and heavy metal ions by chitosan composites:A review[J]. Carbohydrate Polymers, 83(4) : 1446–1456. DOI:10.1016/j.carbpol.2010.11.004 |
| [${referVo.labelOrder}] | Ozgur O, Sema E, Yakup B, et al. 2009. Removal of toxic metal ions with magnetic hydrogels[J]. Water Research, 43(17) : 4403–4411. DOI:10.1016/j.watres.2009.06.058 |
| [${referVo.labelOrder}] | Özkahraman B, Acar I, Emik S. 2011. Removal of cationic dyes from aqueous solutions with poly (N-isopropylacrylamide-co-itaconic acid) hydrogels[J]. Polymer Bulletin, 66(4) : 551–570. DOI:10.1007/s00289-010-0371-1 |
| [${referVo.labelOrder}] | Pekel N, Şahiner N; ahiner, Güven O. 2001. Use of amidoximated acrylonitrile/N-vinyl 2-pyrrolidone interpenetrating polymer networks for uranyl ion adsorption from aqueous systems[J]. Journal of Applied Polymer Science, 81(10) : 2324–2329. DOI:10.1002/app.v81:10 |
| [${referVo.labelOrder}] | 彭继荣, 李珍. 2005. 羟基磷灰石的应用研究进展[J]. 中国非金属矿工业导刊, 2005(2) : 12–14. |
| [${referVo.labelOrder}] | Rao P, Lo I M C, Yin K, et al. 2011. Removal of natural organic matter by cationic hydrogel with magnetic properties[J]. Journal of Environmental Management, 92(7) : 1690–1695. DOI:10.1016/j.jenvman.2011.01.028 |
| [${referVo.labelOrder}] | Ren Y, Li N, Feng J, et al. 2012. Adsorption of Pb (Ⅱ) and Cu (Ⅱ) from aqueous solution on magnetic porous ferrospinel MnFe2O4[J]. Journal of Colloid and Interface Science, 367(1) : 415–421. DOI:10.1016/j.jcis.2011.10.022 |
| [${referVo.labelOrder}] | Saeidian H, Moghaddam F M, Pourjavadi A, et al. 2009. Superabsorbent polymer as nanoreactors for preparation of hematite nanoparticles and application of the prepared nanocatalyst for the Friedel-Crafts acylation[J]. Journal of the Brazilian Chemical Society, 20(3) : 466–471. DOI:10.1590/S0103-50532009000300009 |
| [${referVo.labelOrder}] | Silan C, Akcali A, Otkun M T, et al. 2012. Novel hydrogel particles and their IPN films as drug delivery systems with antibacterial properties[J]. Colloids & Surfaces B Biointerfaces, 89(1) : 248–53. |
| [${referVo.labelOrder}] | Wang S, Jang J. 1993. Heavy Metal Wastewater Treatment Technique[M]. Beijing: Metallurgy Technology Press. |
| [${referVo.labelOrder}] | Wang Y F, Liu M Z, Ni B L, et al. 2011. Preparation and properties of novel slow-release PK agrochemical formulations based on carboxymethylcellulose-graft-poly (acrylic acid-co-itaconic acid) superabsorbents[J]. Journal of Macromolecular Science, Part A, 48(10) : 806–815. DOI:10.1080/10601325.2011.603629 |
| [${referVo.labelOrder}] | 王学川, 张斐斐, 强涛涛. 2014. 重金属吸附材料研究现状[J]. 功能材料, 2014, 45(11) : 11001–11006. |
| [${referVo.labelOrder}] | 吴敏, 杨健. 2003. 蚯蚓生态床处理剩余污泥[J]. 中国给水排水, 2003, 19(5) : 57–61. |
| [${referVo.labelOrder}] | 杨金艳, 蒲生彦, 周艳, 等. 2016. 壳聚糖水凝胶制备及其对Pb2+吸附性能研究[J]. 环境工程, 2016(1) : 16–20. |
| [${referVo.labelOrder}] | Yari S, Abbasizadeh S, Mousavi S E, et al. 2015. Adsorption of Pb (Ⅱ) and Cu (Ⅱ) ions from aqueous solution by an electrospun CeO2 nanofiber adsorbent functionalized with mercapto groups[J]. Process Safety and Environmental Protection, 94 : 159–171. DOI:10.1016/j.psep.2015.01.011 |
| [${referVo.labelOrder}] | Yetimo ğlu E K, Kahraman M V, Ercan Ö, et al. 2007. N-vinylpyrrolidone/acrylic acid/2-acrylamido-2-methylpropane sulfonic acid based hydrogels:Synthesis, characterization and their application in the removal of heavy metals[J]. Reactive & Functional Polymers, 67(5) : 451–460. |
| [${referVo.labelOrder}] | Yi L, Wang W, Wang A. 2010. Adsorption of lead ions from aqueous solution by using carboxymethyl cellulose-g-poly (acrylic acid)/attapulgite hydrogel composites[J]. Desalination, 259(1) : 258–264. |
| [${referVo.labelOrder}] | 张帆, 李菁, 谭建华, 等. 2013. 吸附法处理重金属废水的研究进展[J]. 化工进展, 2013, 32(11) : 2749–2756. |
| [${referVo.labelOrder}] | Zhuang Y, Yang Y, Xiang G, et al. 2009. Magnesium silicate hollow nanostructures as highly efficient absorbents for toxic metal lons[J]. Journal of Physical Chemistry C, 113(24) : 10441–10445. DOI:10.1021/jp9014756 |
| [${referVo.labelOrder}] | Zare-Dorabei R, Ferdowsi S M, Barzin A, et al. 2016. Highly efficient simultaneous ultrasonic-assisted adsorption of Pb (Ⅱ), Cd (Ⅱ), Ni (Ⅱ) and Cu (Ⅱ) ions from aqueous solutions by graphene oxide modified with 2, 2'-dipyridylamine:Central composite design optimization[J]. Ultrasonics Sonochemistry, 32 : 265–276. DOI:10.1016/j.ultsonch.2016.03.020 |
| [${referVo.labelOrder}] | Zhao X, Hu B, Ye J, et al. 2013. Preparation, characterization, and application of graphene-zinc oxide composites (G-ZnO) for the adsorption of Cu (Ⅱ), Pb (Ⅱ), and Cr (Ⅲ)[J]. Journal of Chemical & Engineering Data, 58(9) : 2395–2401. |
 2017, Vol. 37
2017, Vol. 37


