2. 中国海洋大学海洋环境与生态教育部重点实验室, 青岛 266100
2. Key Laboratory of Marine Environmental Science and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100
湿地地处水陆交错地带,由于对污染物质具有去除作用而被称为地球之肾,同时具有维持全球碳平衡、调节气候、水文条件等重要的生态作用(田学智等,2011).由于湿地常含有较高的有机质特别是腐殖酸,因此,通过径流、大气沉降等进入湿地中的汞能够被有机质结合而固定下来,从而成为汞的汇(Galloway et al., 2004; Selvendiran et al., 2008),例如在佛罗里达大沼泽(Rood et al., 1995)、三江平原湿地(刘汝海等,2002)、红树林(丁振华等,2010)等湿地土壤中汞的含量均较高.同时湿地淹水环境也为汞的甲基化创造了条件,导致湿地中甲基汞的浓度较高,对湿地生态系统产生影响,如导致佛罗里达湿地野生动物体内较高的甲基汞、偏远地区湖泊鱼体较高的甲基汞浓度. 微生物可以促进汞的甲基化,在汞的生物地球化学循环中具有重要作用,硫酸盐还原菌是主要的汞甲基化细菌(Compeau et al., 1985),在滨海红树林湿地中发现硫酸盐还原菌对汞的甲基化过程产生重要作用(丁振华等,2010). 湿地环境变化也会导致微生物和甲基汞含量的变化.对湿地汞的生物地球化学循环产生重要的影响.三江平原湿地的开垦(刘汝海等,2003; 张仲胜等,2011)、热带雨林湿地的垦伐(Veiga et al., 1994)导致湿地固定的汞的流失,成为汞的源;在一些大型水库的水陆交错带,周期性的淹水和退水也对汞的行为产生影响(Zhu et al., 2011; Liang et al., 2014).黄河三角洲湿地是一个年轻的湿地,土壤中汞的含量、有机质含量以及氮磷等元素较低(凌敏等,2010;刘志杰等,2012),这与国内外湿地具有较高汞含量的特点明显不同,原因尚未清楚.黄河三角洲湿地被油田开发及道路建设分割成大小不等的湿地,除了河道两侧能够受到黄河水或海水的补给外,其它湿地水源主要来自自然降水,因地势低洼、地下水位浅从而发育成湿地.由于所在区域降水季节差异明显,七月下旬到八月降水集中,湿地积水植物生长茂盛,积水持续到秋季,而冬春季节降水稀少,湿地水位下降.因此分别采集秋季(淹水)和夏季(干旱无积水)湿地样品,以认识季节性的干湿变化对黄河三角洲湿地汞的地球化学行为的影响.
2 样品的采集与测定(Sampling and analytical methods)于2011年10月、2012年7月在黄河三角洲湿地进行了样品采集,采样点位图见图 1(共8个点位).秋季样品采集时,主要选取典型的芦苇洼地湿地进行采样,湿地有积水或土壤含水率高的点位的样品利用海洋沉积物常用的插管法采集湿地柱状样品,两端密封冷藏,可以较好保持样品层次,带回实验室按照3 cm切割分层取样,采样深度受含水率和插管难易影响略有差异,在夏季的采样点深度较浅.干旱土壤样品现场分层取样(2 cm),考虑到光照、有机物、水分、微生物等因素的影响,夏季统一采集0~10 cm深土壤比较.秋季采样时对采样点位标记,夏季采样点位距离秋季采样点位1.5 m,便于不同季节的对比减少人为干扰. 土壤样品测定了土壤中微生物(总菌、硫酸盐还原菌)、有机质、总汞、甲基汞等参数,同时记录环境参数(表 1).
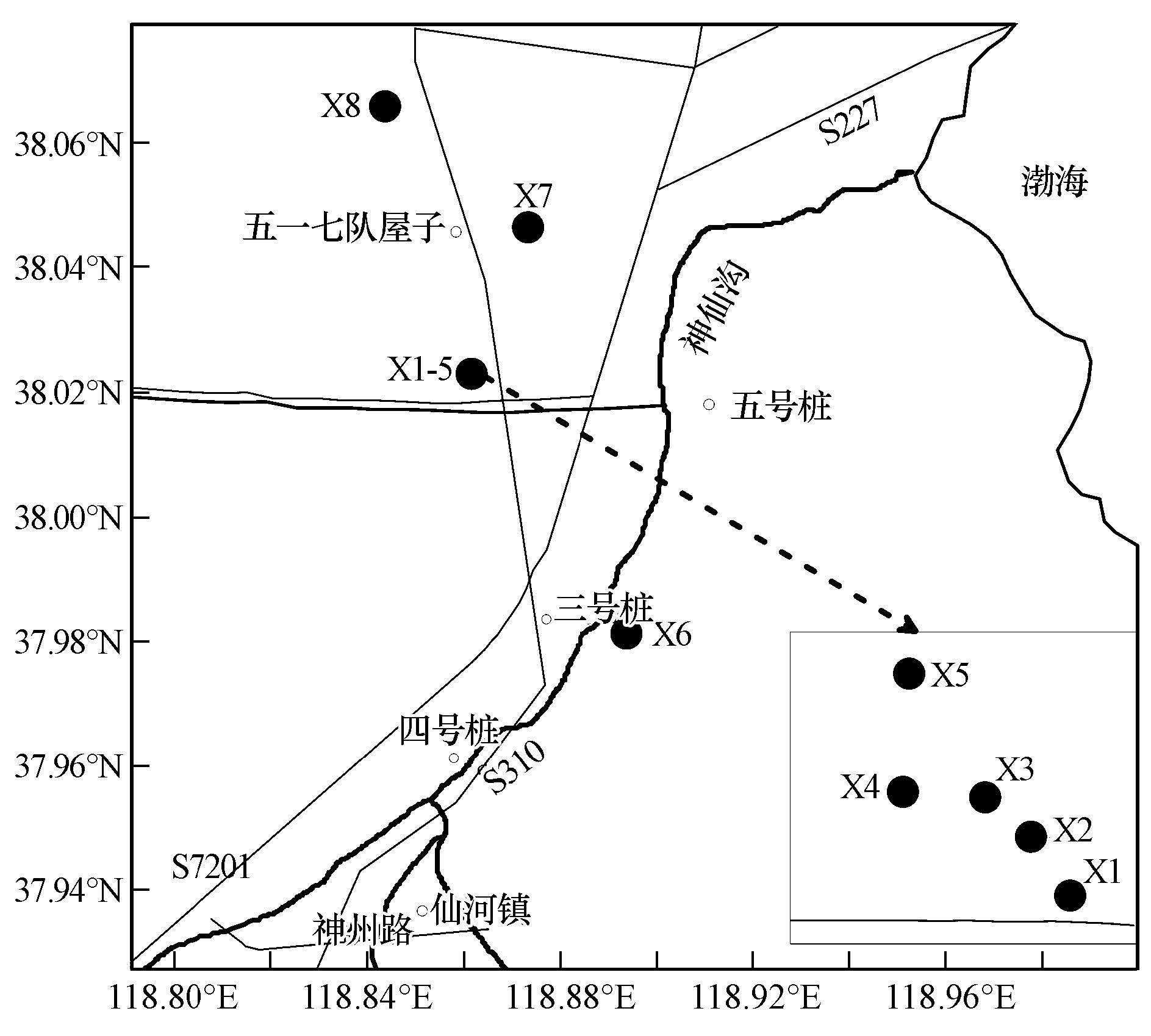 |
| 图 1 采样点位图示意图 Fig. 1 Sampling point in the wetlands |
| 表 1 秋季采样点环境参数 Table 1 Environment parameters in sampling site in autumn |
土壤中总汞的测定详细方法见GB17378—2007沉积物中总汞的测定,称取0.20 g土样于刻度试管中,加入王水8 mL,100 ℃下水浴加热45 min,冷却后,加1 mL KMnO4,反应15 min,加入盐酸羟胺使紫色褪去定容,用AFS-920双道原子荧光(北京吉天)测定.同时测定黄海沉积物标准物质进行质量控制(GBW07333),回收率平均为95%.
土壤中甲基汞的测定采用蒸馏乙基化气相色谱分离原子荧光测定(Horvat et al., 1993),称取0.5 g湿样于蒸馏瓶中,加入5 mL水0.2 mL20%氯化钾和0.5 mL 8 mol·L-1硫酸,稀释到10 mL,氮气吹气下蒸馏8 mL,20 mL冰水吸收蒸馏液,蒸馏液定容到50 mL暗处放置2 d,乙酸调节pH为4.5~4.9,然后加入四乙基硼化钠乙基化,氮气吹出Tenax管吸附,加热解析Tenax,GC分离、CVAFS(Brooks Rand Lab Model III)测定,根据含水率换算成干重.实验中同时采用甲基汞标准物质加标和沉积物标准样品进行质控,回收率为85%~110%,符合要求.
土壤中有机质的测定:参照海洋监测规范(GB17378.5—2007)进行土壤中有机质的测定.利用荧光显微镜采用计数法记录土壤中总菌(TB)的数量(Fuhrman et al., 1980);通过3管MPN法测定土壤中硫酸盐还原菌(SRB)的数量(Sy-T0531-93).
3 结果与讨论(Results and discussion) 3.1 夏秋季土壤总汞与甲基汞的含量差异黄河三角洲湿地降水主要集中在7月、8月.从2011年10月开始降水逐渐减少,特别是2012年春季和夏初降水稀少(图 2),蒸发量大,湿地水分逐渐减少;降水的季节变化导致湿地积水的变化,在2011年10月湿地有不同程度的积水,到2012年7月采样时各采样点无积水,湿地干旱已影响到湿地植被生长.
对比土壤中总汞的含量(0~10 cm)可以发现(图 3),在秋季各点位由于相对地势及积水深度的不同,总汞的含量也有显著差别,光板地X7显著低于低洼地点X1~X5(p<0.05),X1、X2显著高于X3、X4点位(p<0.05),X1、X2点位受道路影响较大,含量较高,从标准差来看X6点位标准差较大,其它点位较小,反映了1~10 cm沉积物汞含量的垂直差异.
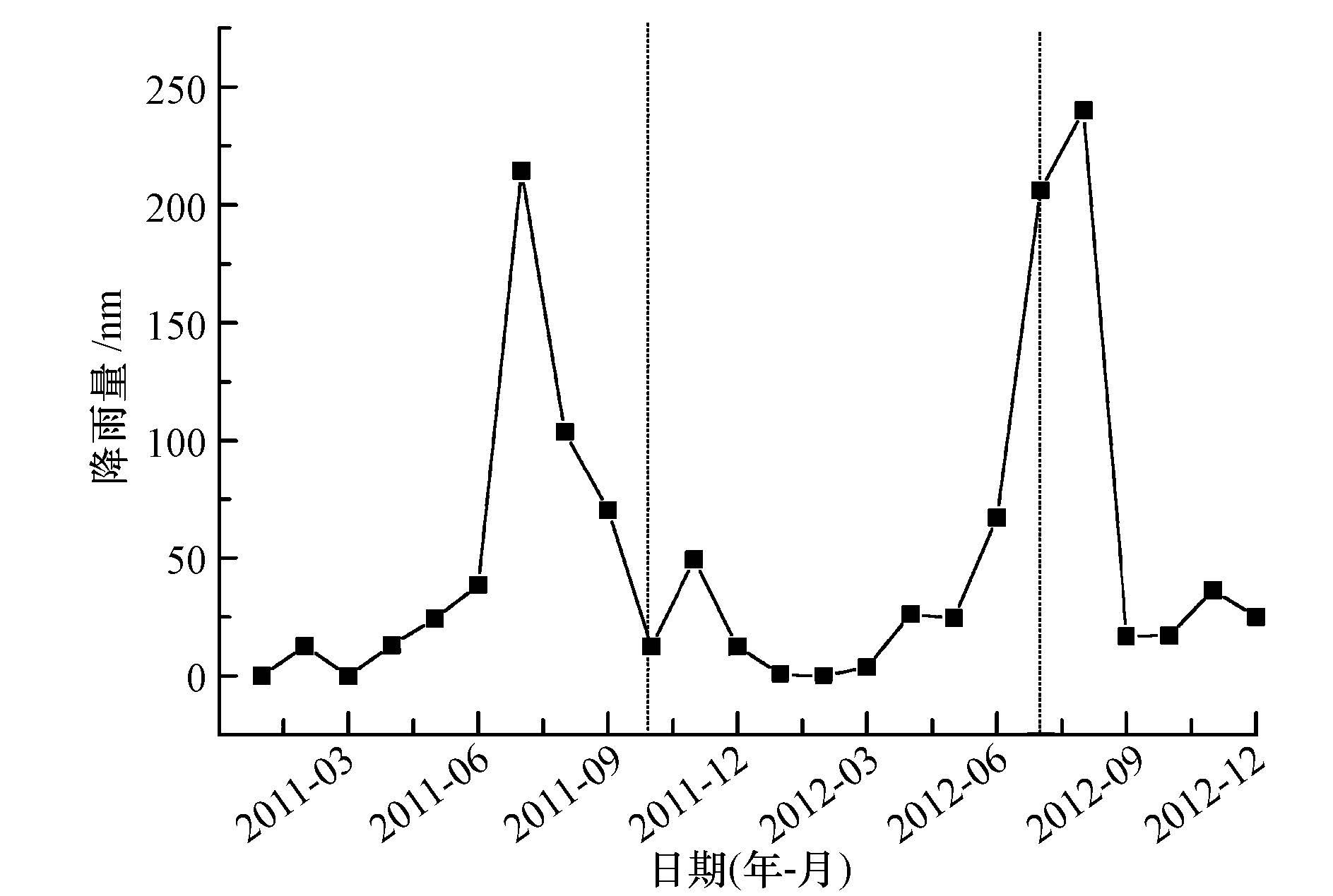 |
| 图 2 2011—2012年降水量月变化 Fig. 2 Monthly variation of rainfall from 2011 to 2012 |
总体来看,湿地土壤中汞的含量平均为0.064 mg·kg-1,变异系数67%;有机质平均含量为1.27%,变异系数为35%.而在夏季各点位总汞含量平均为0.027 mg·kg-1,变异系数为30%,有机质平均含量为0.74%,变异系数为47%,相对于秋季,各点位夏季总汞含量明显减少(平均减少57%),同时各点位的差异减小,但是有机质平均含量部分点位减少,部分增加,总体上减少了30%.湿地土壤中的汞与环境中的汞进行交换的方式主要包括:土壤和大气之间的交换、随径流或土壤孔隙水迁移、湿地植物吸收释放等.由于采样地点所在的湿地被道路分割成各个独立的部分,再加上降水少,不易发生径流迁移,因此,推测湿地土壤中汞的减少主要是由湿地土壤/植被与大气之间的交换造成的.研究认为土壤等地表所释放的汞是大气中汞自然来源的重要部分,据估算每年从土壤释放到大气的汞大约有700 t(Gustin et al., 2000),Pirrone等(2010)估算每年陆地生态系统释放的汞约为2139 t.太阳辐射对土壤中汞的释放具有重要的作用,太阳辐射可以通过光还原作用把土壤中汞还原,同时降低了土壤溶液中零价汞释放到大气中所需要的活化能(Zhang et al., 2001),光照条件下土壤汞释放通量是黑暗条件下的1.5~4.2倍(Gustin et al., 2002;Moore et al., 2005).因此,由于黄河三角洲湿地春季和初夏降水稀少、光照增强可能有利于土壤中汞的释放.Liang等(2014)对三峡土壤的模拟实验发现,经过淹水、排水周期后土壤中汞的含量大幅度减少,主要是淹水后土壤中的汞向上覆水的释放,这和本研究不同.由于黄河三角洲湿地在七月下旬和八月降水最多,导致湿地积水,汞可以通过降水、干沉降、植物分解等方式在湿地土壤中累积;而经过春季和夏初,由于湿地水分减少,有机质分解速度加快,光照增强,土壤中的汞以释放为主,从而影响到湿地土壤中汞的累积,导致黄河三角洲湿地土壤中的汞含量较小.前期的研究也发现黄河三角洲湿地土壤汞含量、有机质含量以及氮磷等元素较低(凌敏等,2010;刘志杰等,2012).同时黄河三角洲湿地土壤由来自黄土高原的沉积物发育而成(黄土汞的背景含量为0.0146 mg·kg-1)(田均良等,1991),汞的背景含量低,湿地累积较少,低于佛罗里达湿地(Rood et al., 1995)、三江平原湿地(刘汝海等,2002)、红树林湿地(丁振华等,2010).
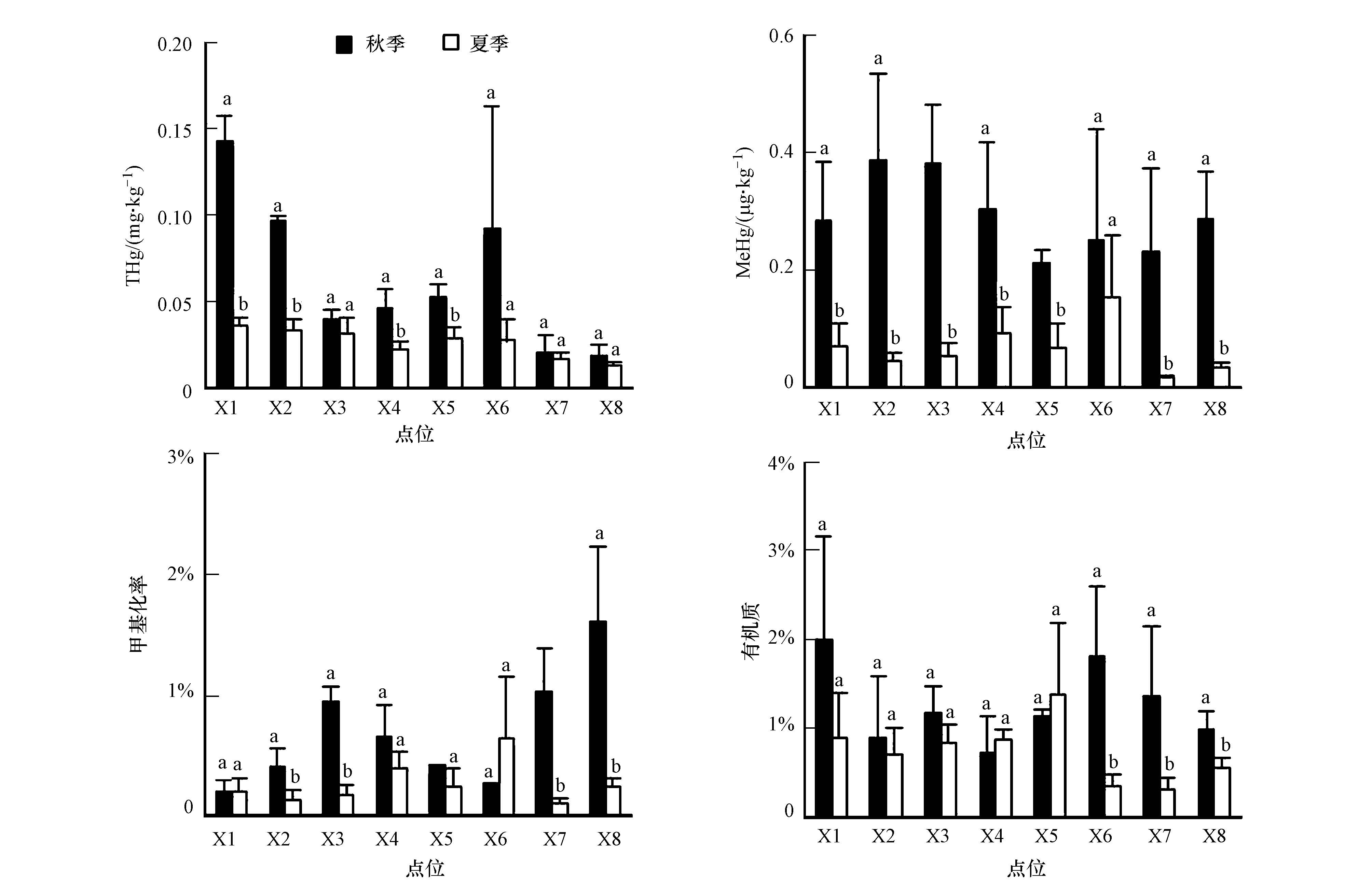 |
| 图 3 夏秋季节湿地土壤(0~10 cm)中总汞、甲基汞、甲基化率和有机质的含量对比(误差棒为0~10 cm样品的标准差,不同的字母表示夏秋在0.05水平存在显著性差异) Fig. 3 Comparisons of total mercury,methylmercury,methylation rate and organic matter content in wetlands(0~10 cm)in summer and autumn(Error bar is the deviation of samples in 0~10 cm,the different letter shows the significant difference at 0.05 level between autumn and summer) |
黄河三角洲湿地这种周期性的淹水同样也影响到湿地中甲基汞的含量,秋季各点位0~10 cm深甲基汞平均含量为0.28 μg·kg-1,变异系数为37%,夏季甲基汞平均含量为0.066 μg·kg-1,变异系数为64%.在秋季受湿地淹水影响,以及当年产生的有机物质利于微生物活动,使土壤中的甲基汞浓度较高,到夏季后平均甲基汞含量减少76%,可见干湿季节黄河三角洲湿地土壤甲基汞含量差异显著. 秋季甲基汞的含量与有机质含量相关性显著(p=0.05),而夏季也呈正相关关系但不显著.由图 3所示,秋季甲基化率在淹水较深(X3、X4)的位置甲基化率高,光板地X7的甲基化率相对较高,变异系数为69%,各点差别较大.而在夏季甲基化率在相对地势较低的X4、X6位置稍高,各点位变异系数为66%;总体上来看秋季甲基化率平均为0.69%,夏季为0.27%,大部分点位甲基化率秋季高于夏季,部分点位季节差异显著,部分不显著,可能受甲基化率垂直变化的影响.秋季和夏季甲基化率与有机质的相关性不显著,有些研究认为有机质强烈吸附二价汞而不利于甲基化(Zhu et al., 2015),而在汞矿区附近水稻土壤中有机质含量与甲基汞相关(Liu et al., 2014). 不同湿地土壤中有机质与甲基汞的关系可能不同.
3.2 夏秋季土壤中汞和甲基汞的垂直分布特征在秋季,大部分点位表层总汞含量略高(图 4a~4c),主要原因在于表层有机质含量偏高,总汞易被有机质吸附而固定,这与三江平原等湿地的垂直分布相似(刘汝海等,2002).而总汞在10 cm左右深度开始升高,然后又开始下降,这可能受历史沉积的影响.X1、X2点位总汞的浓度都要高于其它点位,主要是由于这2个点位距离道路相对较近,易受交通污染的影响而偏高,而其它3个点位在0~10 cm相差较小.而夏季0~2 cm表层总汞含量除在X3、X5略高外,其它点位都整体上表现为随深度增加而升高的趋势,夏季与秋季相比总汞在0~10 cm深度都有减少,表层减少量相对更大,这可能与土壤表层更容易受光照、温度等要素的影响有关.Dreher 与 Follmer(2004)的研究表明0~8 cm厚的土层中均可发生光还原过程.Feng等(2006)认为土壤表层0~5 cm是光还原发生的主要场所.因此湿地在秋季表现为大气汞的汇,而在春夏季为大气汞的源.
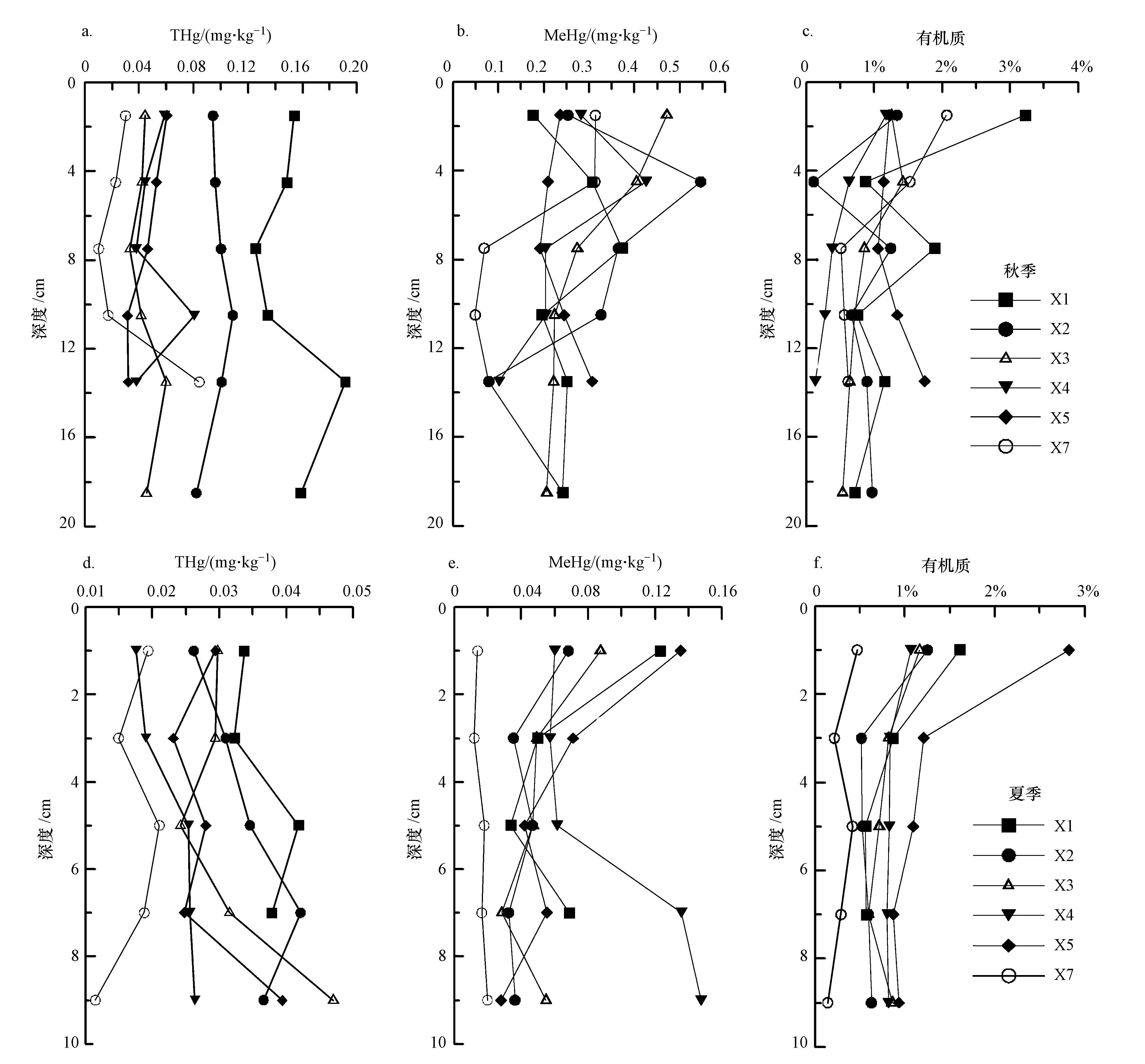 |
| 图 4 秋季(a~c)和夏季(d~f)洼地(X1~X5)/光板地(X7)中总汞、甲基汞浓度在垂直方向上的分布 Fig. 4 Vertical distribution of total mercury and methylmercury content in low-lying land(X1~X5)/bare land(X7)in autumn(a~c)and summer(d~f) |
如图 4a~4c所示,秋季甲基汞浓度的垂直变化在各点位表现不同,在水位较深的X3、X5甲基汞含量最大值出现在较浅位置,而在上覆水位较浅的地方X1、X2甲基汞最大值出现在较深的位置,可见湿地上覆水的多少影响到不同深度土壤中甲基汞的含量,甲基汞含量的最大值一般出现在0~10 cm深度,10 cm以下土壤中甲基汞含量相对较低.如图 4d~4f所示,在夏季土壤中甲基汞的含量都表现为在表层较高,随深度下降而降低,然后在底层又开始略有升高.夏季与秋季相比,甲基汞在0~10 cm各层次的含量均远低于秋季含量,夏季除了X4外没有在2~10 cm深度出现甲基汞的峰值.由于湿地X4点位地势最低,因此在10 cm深仍出现了甲基汞的峰值,受地势影响还原层可能存在.X7点位为光板地,地上植被覆盖度低,在秋季时甲基汞含量尽管小于有积水的洼地,但是含量仍然较高,特别是在0~6 cm深度,这种特点可能是由于秋季湿地地下水位较高,地下水分通过毛管作用可以到达表层,同时表层有机物质相对丰富有利于微生物甲基化,而在夏季整个剖面甲基汞含量均较低,其原因为干旱可以抑制微生物的生长,影响到湿地土壤氧化还原性质以及微生物的活性(张静茹,2014).
3.3 硫酸盐还原菌分布及对甲基汞含量的影响夏季SRB细菌含量明显低于秋季,干旱的湿地不利于SRB细菌的生长.SRB细菌的数量在垂直分布上0~2 cm含量最低,较深层次偏高.SRB细菌的垂直变化与秋季明显不同,与夏季甲基汞含量的垂直变化趋势也并不一致,由于夏季几乎没有积水,地下水盐度又很大,生物甲基汞作用比较微弱,因此,这种分布可能与甲基汞在不同深度的存在形态和分解速度有关,表层较高的有机质含量具有较强的吸附能力,可能利于甲基汞的保存.
在秋季,湿地土壤容易积水或含水率较高,植物长势茂盛,植物枯落物为土壤中微生物的生存提供了更多的营养物质,表层土壤中总细菌数的平均值为8.8×109 CFU·g-1.秋季表层土壤的硫酸盐还原菌(SRB)数量最高,平均值为7702 CFU·g-1,低于海洋沉积物中SRB的数量107 CFU·g-1(陈皓文,1998),略高于长江口的数量103 CFU·g-1(王成厚,1995).低洼湿地X1~X3,点位SRB数量由表层向下迅速减少,X4、X5先降低后升高,对于光板地X7整个剖面SRB数量都很少(图 5).各点位SRB数量差异较大,在相对地势较高的X1、X2 SRB数量最高,地势较低的X3、X4、X5点位数量较少,X4处于地势最低的位置,生长耐盐的碱蓬,SRB数量在底层反而较高,这样一种变化关系与甲基汞的垂直分布不同,而且甲基汞含量较高的地方并没有对应SRB细菌最大值.
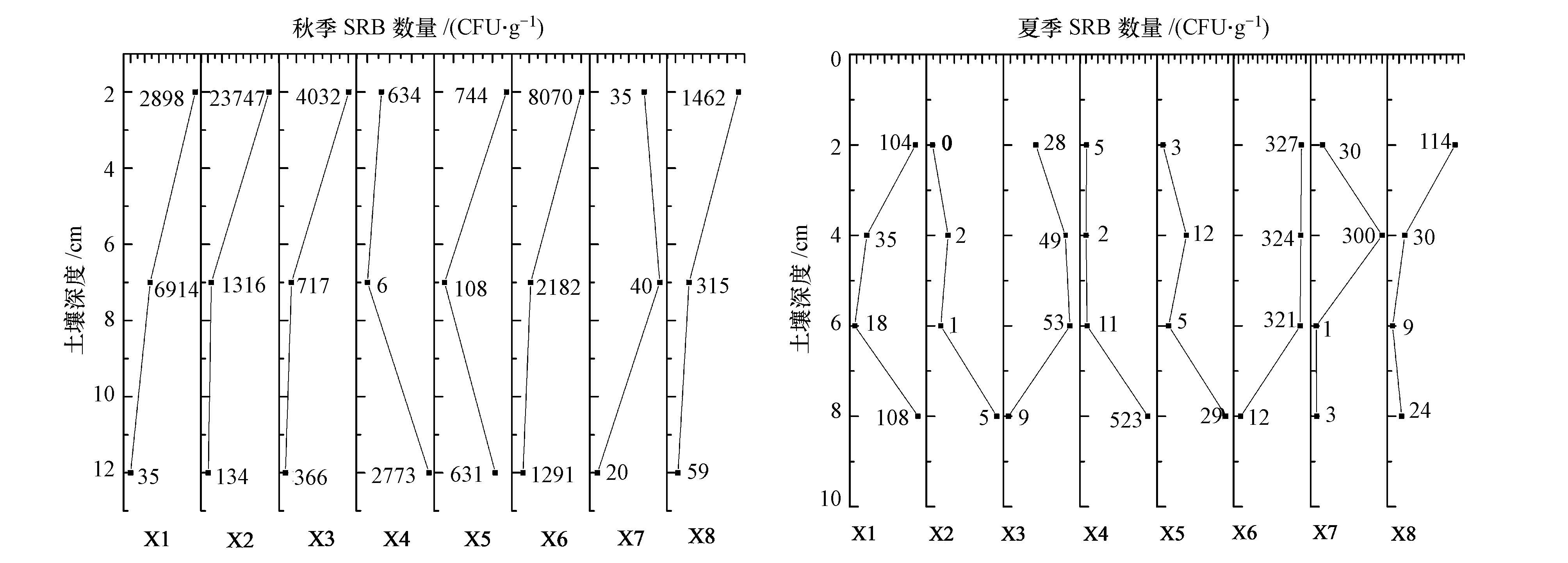 |
| 图 5 湿地土壤硫酸盐还原细菌的垂直变化 Fig. 5 Vertical variation of sulfate reducing bacteria in wetlands soil |
在本研究中,秋季甲基汞含量、甲基化率与SRB的相关性并不显著,但是在夏季甲基汞含量、甲基化率与SRB含量均呈显著相关(r=0.56,p<0.01; r=0.67,p<0.01).原因包括:一方面秋季SRB在各点位上以及垂直变化差别很大,而夏季差别要小的多,这种差异与微生物生活环境有关.在降水较多的情况下水中盐度相对下降,有利于生物的生长,但是随着水位下降,水中的盐分会逐渐在低洼处积聚,这样一种水盐运移关系反而使周围相对地势较高的地方植物生长茂密,产生较多的枯落物及合适的水分条件利于微生物生长,而在最低洼的地方(X4)反而生长着耐盐碱的碱蓬.湿地土壤SRB含量差异受淹水环境(氧化还原条件)的影响,同时还会受水中盐度、有机物质、硫酸盐含量等要素的影响.淹水环境下土壤中甲基汞含量,除了受SRB影响外,还会受到其他甲基化细菌,比如产甲烷菌和铁还原菌的影响,Hamelin等(2011)研究认为产甲烷菌是湖泊湿地甲基汞产生的主要菌种,Wu等(2011)对九龙河口红树林湿地表层及深层沉积物中发现,SRB仅占总菌的一小部分其他生物类群也可能对汞的甲基化起作用,Fleming(2006)在富含铁的河流沉积物中分离出铁还原菌,其甲基化能力超过已具有甲基化能力的硫酸盐还原菌.Parks等(2013)揭示了汞的甲基化微生物的基因,在水稻田等的研究水稻湿地汞的甲基化微生物种群结构(Liu et al., 2014).因此,需要进一步分析该湿地汞甲基化群落类型以研究其机制.
4 结论(Conclusions)1)秋季各点位总汞平均含量为0.064 mg·kg-1,夏季平均为0.027 mg·kg-1,总汞含量平均减少57%,湿地由积水到干旱过程中汞的释放量增加.
2)黄河三角洲湿地秋季各点位0~10 cm深甲基汞平均含量为0.28 μg·kg-1,夏季甲基汞平均含量为0.066 μg·kg-1,平均甲基汞含量平均减少76%.在秋季受湿地淹水影响,利于甲基汞的形成,水分减少和湿地干旱导致使土壤中的甲基汞浓度减少.
3)在垂直方向上,夏季与秋季相比总汞在0~10 cm深度都有减少,土壤中的汞发生释放,因此,湿地在秋季为大气汞的汇,而在春夏季为大气汞的源.硫酸盐还原细菌的含量秋季远高于夏季,硫酸盐还原菌、淹水环境、有机物质含量都会影响甲基汞产生和分布.
| [${referVo.labelOrder}] | 陈皓文. 1998. 海洋硫酸盐还原菌及其活动的经济重要性[J]. 黄渤海海洋, 1998, 16(4) : 64–74. |
| [${referVo.labelOrder}] | Compeau G C, Bartha R. 1985. Sulfate-reducing bacteria:principal methylators of mercury in anoxic estuarine sediment[J]. Applied and Environmental Microbiology, 50(2) : 498–502. |
| [${referVo.labelOrder}] | 丁振华, 吴浩, 刘洋, 等. 2010. 中国主要红树林湿地中甲基汞的分布特征及影响因素初探[J]. 环境科学, 2010, 31(8) : 1701–1707. |
| [${referVo.labelOrder}] | Dreher G B, Follmer L R. 2004. Mercury content of Illinois soils[J]. Water Air Soil Pollution, 156(1) : 299–325. DOI:10.1023/B:WATE.0000036824.07207.16 |
| [${referVo.labelOrder}] | Feng X, Li G, Qiu G. 2006. A preliminary study on mercury contamination to the environment from artisanal zinc smelting using indigenous methods in Hezhang County, Guizhou, China:Part 2[J]. Mercury contaminations to soil and crop[J]. Science of the Total Environment, 368(1) : 47–55. |
| [${referVo.labelOrder}] | Fleming E J, Mack E E, Green P G, et al. 2006. Mercury methylation from unexpected sources:Molybdate-inhibited fresh-water sediment and iron reducing bacterium[J]. Applied and Environmental Microbiology, 72(1) : 457–464. DOI:10.1128/AEM.72.1.457-464.2006 |
| [${referVo.labelOrder}] | Fuhrman J A, Azam F. 1980. Bacterioplankton secondary production estimates for coastal waters of British Columbia, Antarctica, and California[J]. Applied and Environmental Microbiology, 39(6) : 1085–1095. |
| [${referVo.labelOrder}] | Hamelin S, Amyot M, Barkay T, et al. 2011. Methanogens:Principal Methylators of Mercury in Lake Periphyton[J]. Environmental Science & Technology, 45(18) : 7693–7700. |
| [${referVo.labelOrder}] | Horvat M, Bloom N S, Liang L. 1993. Comparison of distillation with other current isolation methods for the determination of methyl mercury compounds in low level environmental samples:Part 1[J]. Sediments, Analytica Chimica Acta 1, 281(1) : 135–152. DOI:10.1016/0003-2670(93)85348-N |
| [${referVo.labelOrder}] | Galloway M E, Branfireun B A. 2004. Mercury dynamics of a temperate forested wetland[J]. Science of the Total Environment, 325(1) : 239–254. |
| [${referVo.labelOrder}] | Gustin M S, Lindberg S E, Austin K, et al. 2000. Assessing the contribution of natural sources to regional atmospheric mercury budgets[J]. Science of the Total Environment, 259(1) : 61–71. |
| [${referVo.labelOrder}] | Gustin, M S, Biester H, Kim C S. 2002. Investigation of the light-enhanced emission of mercury from naturally enriched substrates[J]. Atmospheric Environment, 36(20) : 3241–3254. DOI:10.1016/S1352-2310(02)00329-1 |
| [${referVo.labelOrder}] | Liang P, Zhang C, Yang Y, et al. 2014. A simulation study of mercury release fluxes from soils in wet-dry rotation environment[J]. Journal of Environmental Sciences, 26(7) : 1445–1452. DOI:10.1016/j.jes.2014.05.010 |
| [${referVo.labelOrder}] | 凌敏, 刘汝海, 王艳, 等. 2010. 黄河三角洲柽柳林场湿地土壤养分的空间异质性及其与植物群落分布的耦合关系[J]. 湿地科学, 2010, 8(1) : 92–97. |
| [${referVo.labelOrder}] | 刘汝海, 王起超, 吕宪国, 等. 2002. 三江平原湿地汞的地球化学特征[J]. 环境科学学报, 2002, 22(5) : 661–663. |
| [${referVo.labelOrder}] | 刘汝海, 王起超, 王艳, 等. 2003. 小叶章湿地开垦后汞和有机质的动态变化[J]. 农业环境科学学报, 2003, 22(6) : 647–650. |
| [${referVo.labelOrder}] | Liu Y R, Yu R Q, Zheng Y M, et al. 2014. Analysis of the Microbial Community Structure by Monitoring an Hg Methylation Gene (hgcA) in Paddy Soils along an Hg Gradient[J]. Applied and Environmental Microbiology, 80(9) : 2874–2879. DOI:10.1128/AEM.04225-13 |
| [${referVo.labelOrder}] | |
| [${referVo.labelOrder}] | Moore C, Carpi A. 2005. Mechanisms of the emission of mercury from soil:role of UV radiation[J]. Journal of Geophysical Research:Atmospheres, 110(D24) : 1–9. |
| [${referVo.labelOrder}] | Parks J M, Johs A, Podar M, et al. 2013. The genetic basis for bacterial mercury methylation[J]. Science, 339(6125) : 1332–1335. DOI:10.1126/science.1230667 |
| [${referVo.labelOrder}] | Pirrone N, Cinnirella S, Feng X, et al. 2010. Global mercury emissions to the atmosphere from anthropogenic and natural sources[J]. Atmospheric Chemistry and Physics, 10(13) : 5951–5964. DOI:10.5194/acp-10-5951-2010 |
| [${referVo.labelOrder}] | Rood B E, Gottgens J F, Delfino J J, et al. 1995. Mercury accumulationt rends in Florida Everglades and Savannas Marsh flooded soils[J]. Water, Air and Soil Pollution, 80 : 981–990. DOI:10.1007/BF01189752 |
| [${referVo.labelOrder}] | Selvendiran P, Driscoll C T, Bushey J T. 2008. Montesdeoca M R[J]. Wetland influence on mercury fate and transport in a temperate forested watershed[J]. Environmental Pollution, 154(1) : 46–55. |
| [${referVo.labelOrder}] | Sy-T0531-93. 中国石油天然气行业"油田注入水细菌分析方法-绝迹稀释法"[S] |
| [${referVo.labelOrder}] | 田均良, 李雅琦, 陈代中. 1991. 中国黄土元素背景值分异规律研究[J]. 环境科学学报, 1991, 11(3) : 253–262. |
| [${referVo.labelOrder}] | 田学智, 刘吉平. 2011. 孤立湿地研究进展[J]. 生态学报, 2011, 31(20) : 6261–6269. |
| [${referVo.labelOrder}] | Veiga M M, Meech J A, et al. 1994. Mercury pollution from deforestation[J]. Nature, 368(28) : 816–817. |
| [${referVo.labelOrder}] | 王成厚. 1995. 东海海底沉积地球化学[M]. .北京: 海洋出版社 : 158–194. |
| [${referVo.labelOrder}] | Wu H, Ding Z, Liu Y, et al. 2011. Methylmercury and sulfate-reducing bacteria in mangrove sediments from Jiulong River Estuary, China[J]. Journal of Environmental Sciences, 23(1) : 14–21. DOI:10.1016/S1001-0742(10)60368-3 |
| [${referVo.labelOrder}] | Zhang H, Lindberg S E, Marsik F J. 2001. Mercury air/surface exchange kinetics of background soils of the Tahquamenon River Watershed in the Michigan Upper Penninsula[J]. Water, Air and Soil Pollution, 126(1/2) : 151–169. DOI:10.1023/A:1005227802306 |
| [${referVo.labelOrder}] | 张静茹, 张雷一, 刘方, 等. 2014. 降雨对干旱半干旱地区土壤微生物影响研究进展[J]. 世界林业研究, 2014, 27(4) : 6–12. |
| [${referVo.labelOrder}] | 张仲胜, 吕宪国, 王起超, 等. 2011. 三江平原土地利用方式改变对湿地汞含量的影响[J]. 生态学杂志, 2011, 30(5) : 98–1003. |
| [${referVo.labelOrder}] | Zhu H, Zhong H, Evans D, et al. 2015. Effects of rice residue incorporation on the speciation, potential bioavailability and risk of mercury in a contaminated paddy soil[J]. Journal of Hazardous Materials, 293 : 64–71. DOI:10.1016/j.jhazmat.2015.03.051 |
| [${referVo.labelOrder}] | Zhu J, Wang D, Xiao L, et al. 2011. Mercury fluxes from air/surface interfaces in paddy field and dry land[J]. Applied Geochemistry, 26(2) : 249–255. DOI:10.1016/j.apgeochem.2010.11.025 |
 2017, Vol. 37
2017, Vol. 37


