2. 湖南大学环境生物与控制教育部重点实验室, 长沙 410082
2. Key Laboratory of Environmental Biology and Pollution Control, Ministry of Education, Hunan University, Changsha 410082
纳米材料由于其特殊的理化性质越来越广泛地应用于合成重要原材料、生物传感器、食品行业、灭菌和废水处理中(Nel et al.,2006;Mohanpuria et al.,2008;Deng et al.,2016; Chang et al.,2015;Gong et al.,2015).金属半导体纳米颗粒是应用最为广泛的几类纳米材料之一,其中,氧化锌纳米粒子(ZnONPs)具有化学稳定性和强的吸附能力,大量用于遮光剂和涂料等产品中(Osmond et al.,2010);氧化铜纳米粒子(CuONPs)具有良好的导电、导热、催化和抗菌性能,广泛用于化工、电子和农业等领域(Griffitt et al.,2007);硫化锌纳米粒子(ZnSNPs)具有特异的光电性能,被应用于传感器、光催化和半导体等方面(Zhang et al.,2003;Chakraborty et al.,2004;Franco et al.,2009).这些纳米粒子能在生产、使用和处理的过程中进入环境,并被环境中的动植物吸收转移产生毒性.已有研究表明,金属半导体纳米粒子能对植物的生长和代谢过程产生影响.王淑玲等(2014)研究发现,CuONPs在5 mg·L-1时就能导致水稻根系严重受损,而且这种损伤来自于释放离子和纳米结构两个方面;Suman等(2015)观察到ZnONPs的浓度和暴露时间对小球藻产生过氧化应激反应有很大影响;ZnONPs也能进入到洋葱细胞内并干扰细胞核内染色体进行有丝分裂(Kumari et al.,2011);王振红等(2011)证明了0~50 mg·L-1的ZnONPs能刺激绿豆芽的生长,促进叶绿素的合成,提高过氧化物酶的活性,而在高浓度(100~1000 mg·L-1)时则表现为抑制了绿豆芽的生长.由于ZnSNPs通常用于合成CdSe/ZnS量子点和其他化合物,因此,常常讨论由ZnSNPs组成的化合物的生物相容性(Sajimol et al.,2015;Navarro et al.,2012;Cho et al.,2007),而ZnSNPs本身的植物毒性经常被忽略.纳米粒子在植物体内的吸收迁移是通过根系吸收并向地上部分转运而实现的(杨新萍等,2013),植物对纳米粒子中金属元素的吸收来源于纳米结构和溶解于培养介质的金属离子两部分(刘涛等,2015),其在植物体内的吸收转运与纳米粒子的物化性质有关.一般认为,植物对金属元素的吸收量与纳米材料的处理浓度呈正相关(Castro-Bugallo et al.,2014).植物细胞壁是保护细胞不受外来毒物入侵的第一道防线,理论上只有粒径比壁孔小的纳米粒子才能通过细胞,但已有研究证明,纳米粒子的作用能促使细胞壁产生更大的壁孔,导致更大粒径的纳米粒子也能进入细胞(Navarro et al.,2008).水稻作为一种重要的粮食作物,有关其对金属半导体纳米粒子毒性反应与累积水平的研究数据并不全面.因此,深入研究几种常见的金属半导体纳米粒子对水稻的安全评价十分必要.本文考察了3种常见的金属半导体纳米粒子(ZnONPs、ZnSNPs和ZnONPs)对水稻幼苗生长的影响和吸收转运行为,并选取根系活力、MDA积累量和叶绿素作为影响水稻生理变化的参照因子,以期为几种常见的金属半导体纳米粒子的处理处置和农业上的安全使用提供基础数据和理论依据.
2 材料与方法(Materials and methods) 2.1 实验材料表征与水培试验CuONPs和ZnONPs均购自Sigma-Aldrich公司,厂商提供的纳米粒子粒径分别为 <100 nm和100~200 nm,ZnSNPs参考Berlier等(2006)的方法合成.水稻种子选用湖南隆平种业有限公司提供的Y两优型早稻.3种纳米粒子超声分散1 h后,制成浓度为10 mg·L-1的悬浮液,用透射电子显微镜(Tecnai G20,TEM)观察纳米粒子的外貌.超声分散1 h的3种纳米粒子悬浮液,分别加入Hoagland营养液稀释,配置成为10、50和100 mg·L-1的金属半导体纳米粒子悬浊液,对照组用蒸馏水稀释Hoagland营养液获得.用0.1 mol·L-1的NaOH溶液调节处理组和对照组的pH至6.0左右,采用马尔文动态光散射仪(Nano-ZS 90,UK,DLS)测定纳米粒子悬浮液的Zeta电位和团聚粒子的平均粒径.将上述不同浓度的纳米粒子处理组与对照组静置12 h后,在12000 r·min-1条件下离心15 min,取上清液用0.22 μm的滤膜过滤,并用原子吸收分光光度计(Perkin Elmer AA700,AAS)测Zn2+、Cu2+的溶出量.将水稻种子消毒,发芽后选取发育良好的种子转入带有小孔的塑料板中,每个塑料板盛放60粒发芽的水稻种子,然后将塑料板浮在含有400 mL纳米粒子悬浮液和对照组培养液的配套塑料盒中.各实验组设置3个平行样,为避免纳米粒子严重团聚,每3 d更换一次纳米粒子悬浮液,并测定此时悬浮液中团聚粒子的平均粒径.将塑料盒放置在培养箱中生长15 d,培养温度设定为25 ℃,每天的光照时间为16 h.培养完成后取出水稻幼苗,清洗干净,此时称量测得对照组中水稻幼苗每株质量约为0.065 g.分别测定各实验组的生长发育情况、生理水平和纳米粒子在水稻体内的吸收转运系数.
2.2 生长指数的测定本研究选取水稻地上部分(茎和叶)和根系的鲜重及长度作为考察水稻的生长发育受到纳米粒子影响的指标.将水稻幼苗的根系和地上部分分离,分别测定其鲜重和长度,将对照组的测量值设为100%,纳米粒子处理组转化成对照组的百分比.为验证纳米粒子悬浮液中溶解的金属离子对水稻幼苗的影响,实验测定了浓度为1.2、2.5、3.7 mg·L-1(依次对应10、50和100 mg·L-1的ZnSNPs悬浮液中Zn2+的溶出浓度),6.0、17.7和18.4 mg·L-1(依次对应10、50和100 mg·L-1的ZnONPs悬浮液中Zn2+的溶出浓度)的Zn2+和浓度为0.17、0.36和0.77 mg·L-1(依次对应10、50和100 mg·L-1的CuONPs悬浮液中Cu2+的溶出浓度)的Cu2+对照组水稻幼苗生长的影响.
2.3 生理水平的测定以水稻根系活力、根组织中丙二醛(MDA)的积累量及叶片中叶绿素的含量作为判断纳米粒子对水稻植物毒性的生化指标.水稻根系活力采用氯化三苯基四氮唑(TTC)还原法(Lin et al.,2009)测定:将洗净的幼根放入装有5 mL 0.4%的TTC溶液和5 mL磷酸盐缓冲液的试管中,黑暗条件培养1 h,然后将试管取出,立即加入1 mL浓度为1 mol·L-1的硫酸终止反应.用乙酸乙酯提取被还原的TTC,提取液用紫外分光光度仪(UV-2550)测定485 nm处的吸光度,根系活力用单位鲜重的根系中被还原的TTC的量表示,单位为μg·g-1·h-1.根组织中的MDA含量用硫代巴比妥酸(TBA)反应法(Baque et al.,2010)进行测定:根系在10%的三氯乙酸(TCA)中研磨,离心后取上清液与0.6%的TBA溶液反应,水浴反应15 min,用分光光度计测定波长为600和532 nm处的吸光度.叶片中叶绿素的含量采用Lichtenthaler(1987)的方法进行测定:新鲜的水稻叶片洗净称重后剪碎放入10 mL 95%的乙醇中,72 h后取出测定乙醇溶液在664.2和648.6 nm处的吸光度.
2.4 Zn和Cu在水稻幼苗中的生物积累量和生物转运系数水稻根系和地上部分洗净干燥后,分别称量干重并在石墨消解仪中消解,用原子吸收光谱仪分别测定Zn、Cu的积累水平.Zn、Cu在水稻幼苗中的生物积累量分别用Zn、Cu的总积累量与总干重之比表示;Zn、Cu在水稻幼苗中由根系向地上部分转运的生物转运系数用地上部分Zn、Cu总量与根系中Zn、Cu总量之比表示.
2.5 数据处理与分析每组实验数据均设置3组平行样,实验结果用平均值±标准误差(Mean±SD)表示,用SPSS 19.0统计软件和单因素分析方法(ANOVA)对每组数据进行组内差异检验,当p<0.05时表示具有显著性差异.
3 结果(Results) 3.1 金属氧化物纳米粒子的TEM和DLS表征及离子溶出量采用透射电子显微镜对ZnONPs、ZnSNPs和CuONPs的外观表征结果如图 1所示.TEM照片显示,ZnONPs形态和颗粒尺寸差异都比较大,形态呈球形、多面体或棒状,颗粒尺寸大部分小于100 nm,极少数大于100 nm(图 1a);CuONPs整体上呈球形,但尺寸差异也比较大(图 1b);ZnSNPs呈不规则几何形态,大部分粒径在20~40 nm范围内(图 1c).3种纳米金属氧化物在Hoagland培养液中的粒径分布、Zeta电位及Zn2+、Cu2+的溶出量如表 1所示.由表 1可知,暴露实验开始前,ZnSNPs在水中的粒径随浓度的增加而变大,由浓度为10 mg·L-1时的(1604.3±101.1)nm增加到浓度为100 mg·L-1时的(2688.0±22.6)nm;ZnONPs和CuONPs在水中的粒径随浓度变化不明显,分别在2700和200 nm左右.暴露实验进行3 d后,悬浮液中纳米粒子团聚体尺寸变小.ZnSNPs和ZnONPs悬浮液中Zeta电位的绝对值均小于10 mV,而CuONPs悬浮液中Zeta电位的绝对值大得多,处于25.5~30.6 mV之间.对照组Zn2+与Cu2+的浓度分别是(0.200±0.004)和(0.048±0.007)mg·L-1.随着浓度的增加,3种纳米粒子中的金属离子溶出量都有增加,ZnONPs组Zn2+溶出量约为在同浓度下ZnSNPs组的6倍;Cu2+溶出量远低于等浓度中Zn2+的溶出量.
 |
| 图 1 ZnONPs(a)、CuONPs(b)、ZnSNPs(c)的透射电镜图 Fig. 1 TEM images of ZnONPs(a),CuONPs(b)and ZnSNPs(c) |
| 表 1 金属氧化物纳米粒子在培养液中的粒径分布、Zeta电位和离子溶出量 Table 1 Size distribution,zeta potential and dissolved ions of the three metal oxide nanoparticles suspended in cultured nutrients |
水稻幼苗在3种纳米粒子悬浮液和对应的Zn2+和Cu2+对照组中的生长情况如图 2所示.由图 2可知,各离子对照组对地上部分鲜重无显著影响,CuONPs在浓度为10和50 mg·L-1时分别导致地上部分鲜重降低至对照组的81.4%±2.5%和78.0%±3.1%;ZnONPs仅在高浓度处理组(100 mg·L-1)导致地上部分鲜重减少到对照组的76.3%±3.3%,而低浓度的ZnSNPs(10 mg·L-1)促进了地上部分的生长,其鲜重增加到对照组的109.8%±1.3%.高浓度的Zn2+对照组(17.7和18.4 mg·L-1)使根系鲜重分别降低至对照组的71.3%±4.5%和69.4%±10.1%,而对应的ZnONPs处理组(50和100 mg·L-1)将根系鲜重分别降低至对照组的47.3%±1.2%和44.3%±0.6%,比离子对照组的抑制程度分别高出24.0%和25.1%;CuONPs和ZnSNPs对应的离子对照组对根系鲜重无显著影响,而50和100 mg·L-1的CuONPs将根系鲜重分别降低至对照组的80.4%±3.3%和87.3%±2.5%,50 mg·L-1的ZnSNPs促进根系生长,其鲜重为对照组的117.7%±3.8%.与根系鲜重规律一致,Zn2+对照组仅在高浓度(17.7和18.4 mg·L-1)时导致地上部分长度降低至对照组的85.9%±3.4%和88.3%±5.0%,而对应的ZnONPs处理组导致地上部分长度分别降至对照组的61.8%±6.7%和67.7%±5.0%,比离子对照组的抑制程度分别高出24.1%和20.6%;CuONPs和ZnSNPs及它们对应的离子对照组对地上部分长度均无显著影响.根系长度对纳米粒子和离子处理组均较为敏感,Zn2+浓度大于6.0 mg·L-1时能降低根系长度,在6.0、17.7和18.4 mg·L-1的Zn2+对照组中,根系长度依次为对照组的91.3%±2.1%、82.5%±4.2%和84.5%±5.9%,10 mg·L-1的ZnONPs对根系长度无显著影响,而在50和10 mg·L-1时分别将根系长度降低至对照组的73.8%±7.6%和84.6%±6.5%,与相应的离子对照组抑制程度相差不大;ZnSNPs处理组分别将根系长度降至对照组的85.6%±8.0%、80.0%±8.2%和66.3%±8.3%;CuONPs处理组导致根系长度分别降至86.6%±7.6%、50.6%±7.9%和63.6%±6.7%,浓度为0.77 mg·L-1的Cu2+对照组使根系长度降低至对照组的81.6%±2.5%,其减少量比相应的CuONPs处理组低18.0%.
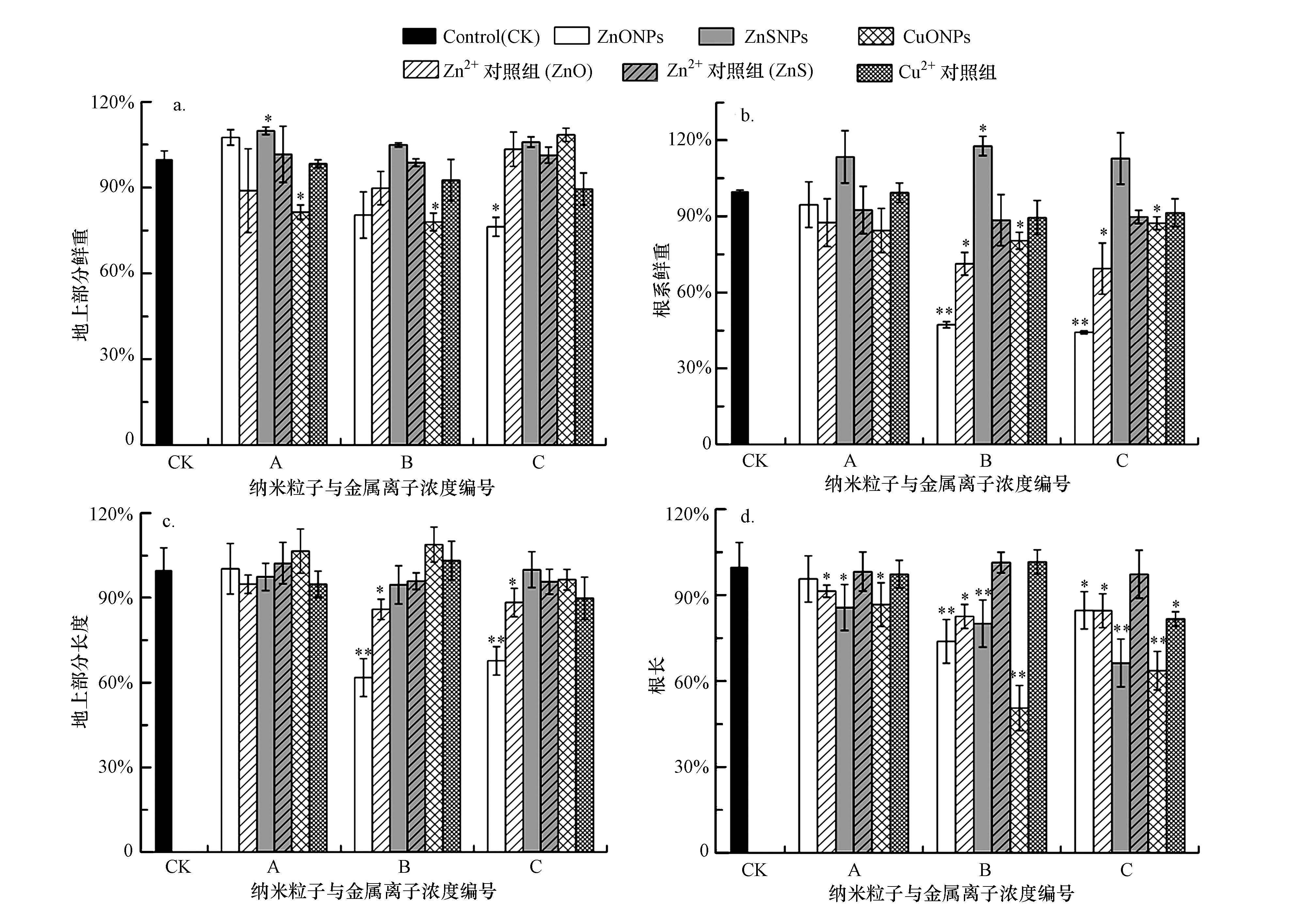 |
| 图 2 各处理组中根系和地上部分的鲜重(a,b)和长度(c,d)与对照组的百分比(浓度编号A、B、C依次对应纳米粒子(10、50、100 mg·L-1)、ZnO对应的Zn2+(6.0、17.7、18.4 mg·L-1)、ZnS对应的Zn2+(1.2、2.5、3.7 mg·L-1)、CuO对应的Cu2+(0.17、0.36、0.77 mg·L-1)的相应值;实验结果用平均值±标准偏差表示,*表示有显著差异(p<0.05),**表示有极显著差异(p<0.01),下同) Fig. 2 Percentage of fresh weight(a,b)and length(c,d)in treatments to control,which were measured in roots and shoots |
图 3反映了3种纳米材料对水稻根系活力、根细胞中MDA的积累情况和叶片中叶绿素含量的影响.图 3a显示,水稻幼苗根系活力对3种实验材料十分敏感.ZnONPs在浓度为50和100 mg·L-1时使根系活力由对照组的(710.4±4.0)μg·g-1·h-1分别降低至(132.8±80.3)和(150.0±121.7)μg·g-1·h-1;ZnSNPs在3种不同处理浓度下都显著增强了水稻根系活力,并在100 mg·L-1时使根系活力增加至对照组的2倍;CuONPs在10 mg·L-1浓度下显著增强根系活力,但当浓度提高到50和100 mg·L-1时,根系活力急剧降低.图 3b显示的是3种纳米粒子对根细胞中MDA含量(以鲜重计)的影响,反映了细胞膜受到过氧化损害的程度.ZnONPs只在50 mg·L-1时增加了MDA的含量,而ZnSNPs在50 mg·L-1时降低了MDA的含量,CuONPs对水稻根系中MDA的积累影响最为显著,当CuONPs浓度为10、50和100 mg·L-1,MDA含量分别增加到对照组的1.4、2.6和2.4倍.图 3c显示的是3种纳米粒子在不同浓度时对水稻叶片中叶绿素含量(以鲜重计)的影响,除了50和100 mg·L-1的ZnONPs和100 mg·L-1的CuONPs会显著降低叶片中的叶绿素含量外,其他处理组对叶片中叶绿素的含量没有显著影响.
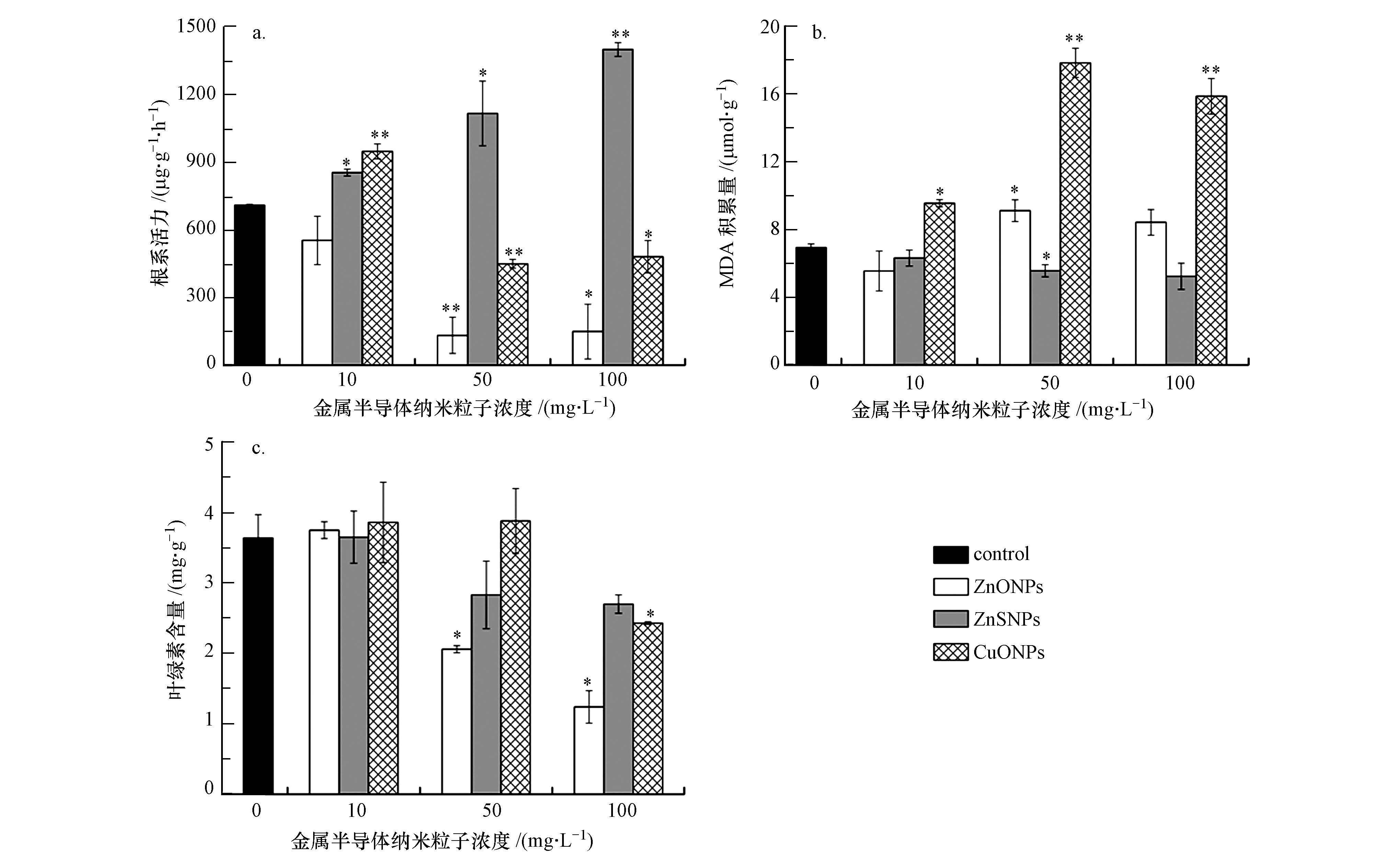 |
| 图 3 水稻幼苗在各处理组中根系活力(a)、MDA含量(b)和叶绿素含量(c)变化 Fig. 3 Changes of root vitality(a),MDA(b)and chlorophyll(c)contents in nanoparticles and control treatments |
水稻幼苗吸收Zn和Cu主要来源于两个方面,一是从培养介质中直接吸收悬浮的纳米粒子,二是吸收溶解在培养液中的金属元素离子.因此,实验同时测定了Zn2+和Cu2+对照组处理水稻幼苗中金属元素的积累量.由图 4可见,暴露在3种纳米粒子悬浮液和对应的离子对照组中的水稻幼苗对Zn、Cu的吸收量均随处理纳米粒子和金属离子浓度的升高而显著增加,且水稻幼苗对Zn的吸收量远高于对Cu的吸收.对照组中水稻幼苗对Zn和Cu元素的吸收量分别为(19.3±0.8)和(4.9±0.4)μg·g-1.在纳米粒子处理组中,ZnONPs浓度为0~50 mg·L-1时,Zn的吸收量稳定增加,当ZnONPs的浓度达到100 mg·L-1时,Zn的吸收量急剧上升到(223.6±12.6)μg·g-1,为50 mg·L-1时的2.4倍;而当ZnSNPs和CuONPs浓度升高时,水稻幼苗对金属元素Zn、Cu吸收量增加相对较平缓,没有出现在100 mg·L-1剧烈上升的现象.在离子对照组中,ZnSNPs对应的Zn2+对照组(1.2、2.5和3.7 mg·L-1)中Zn的吸收量分别为(25.6±2.5)、(39.5±1.9)和(37.8±5.1)μg·g-1,ZnONPs对应的Zn2+对照组(6.0、17.7和18.4 mg·L-1)吸收量分别为(47.5±2.7)、(105.3±14.2)和(127.9±10.3)μg·g-1,Cu2+对照组Cu的吸收量分别为(8.4±0.7)、(10.1±3.4)和(12.5±6.9)μg·g-1.
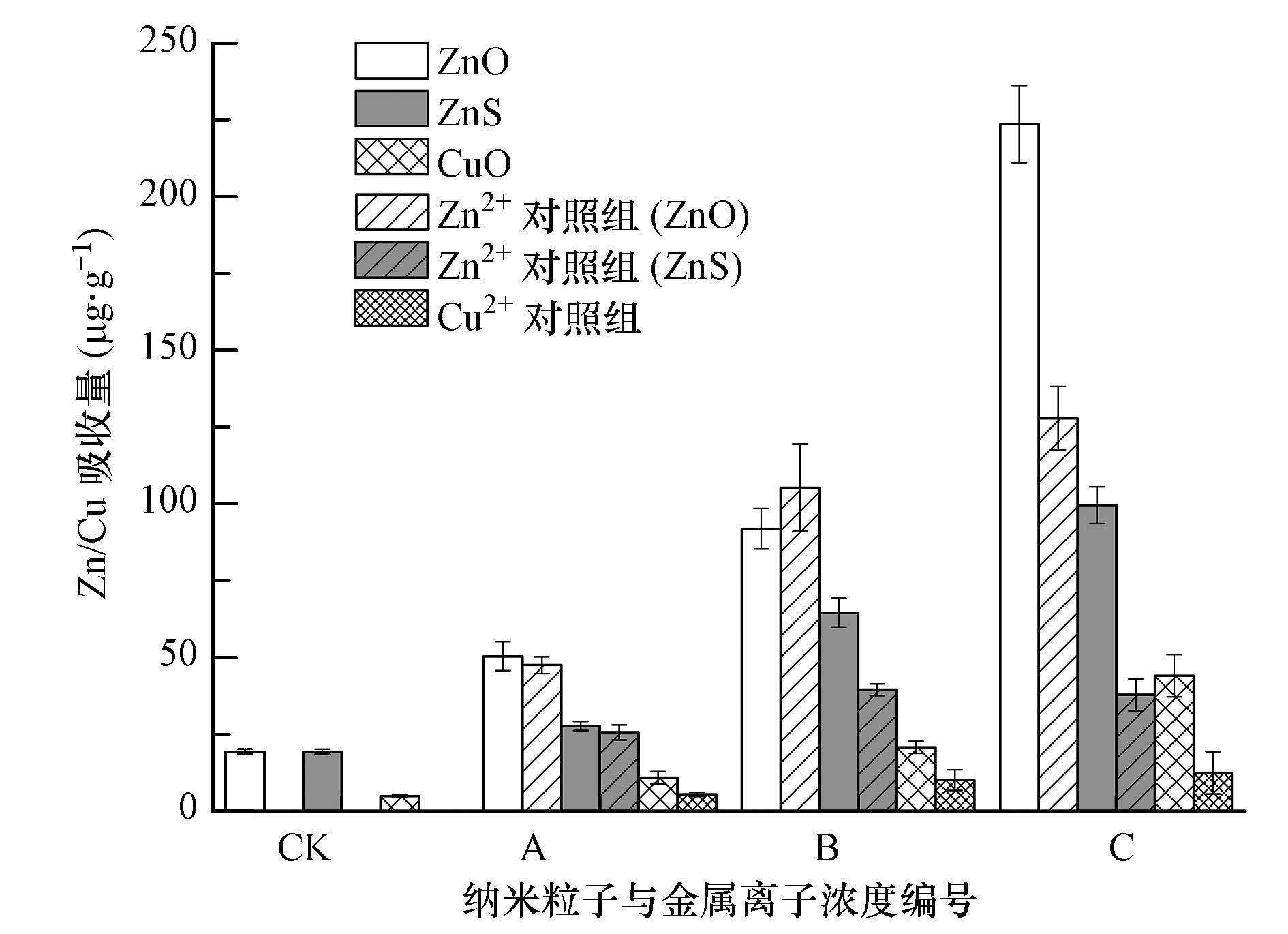 |
| 图 4 水稻幼苗对Zn和Cu的吸收(浓度编号A、B、C依次对应纳米粒子(10、50、100 mg·L-1)、ZnO对应的Zn2+(6.0、17.7、18.4 mg·L-1)、ZnS对应的Zn2+(1.2、2.5、3.7 mg·L-1)、CuO对应的Cu2+(0.17、0.36、0.77 mg·L-1)的相应值;实验结果用平均值±标准偏差表示) Fig. 4 Accumulations of Zn/Cu in rice seedlings |
表 2为3种纳米粒子中的Zn、Cu由根系转移至地上部分的转运系数(地上部分吸收总量/根系吸收总量).植物的转运系数反映了植物从生长介质中吸收重金属元素并由根部向茎叶迁移能力的大小.由表 2可知,ZnONPs和ZnSNPs的生物转运系数在2.0~2.3之间,且在0~50 mg·L-1时随浓度变化不明显,ZnONPs浓度为100 mg·L-1时,转运系数有小幅度降低,而当ZnSNPs浓度为100 mg·L-1时,转运系数增高至3.6左右;CuONPs的生物转运系数相对较低,处于0.9~1.6之间,且随CuONPs浓度升高而有变小的趋势.
| 表 2 水稻幼苗对Cu、Zn的生物转运系数 Table 2 Bio-transport factors of Cu/Zn in rice seedlings |
3种金属半导体纳米粒子都能在微酸性的植物培养液中溶解出部分金属离子,其化学性质的不同决定了它们在酸性溶液中的溶解度不同.由于ZnO和ZnS更易在酸中溶解,因此,Zn2+溶出量高于Cu2+.悬浮液的Zeta电位绝对值越高,粒子的稳定性越高,团聚粒径越小.已有研究证明,纳米粒子悬浮液的pH和离子强度对其稳定性影响较大(Badway et al.,2010).本实验各处理组pH值保持不变,当悬浮液中离子强度升高至一定水平时,电荷屏蔽作用导致悬浮液中纳米粒子的电泳迁移率降低,更易发生团聚作用,从而纳米粒子悬浮液的稳定性随之降低(Chowdhury et al.,2015).由于ZnONPs和ZnSNPs悬浮液中的离子强度远大于CuONPs,因此,ZnONPs和ZnSNPs悬浮液的稳定性更低.用纳米粒子悬浮液培养水稻3 d后,纳米粒子团聚体粒径变小.这是由于植物根系渗出液中含有醋酸、柠檬酸、苹果酸和琥珀酸等复合物(Stewart et al.,2015),这些物质能改变纳米粒子在水中的性质和存在状态.Lin等(2008)研究ZnONPs对黑麦草Lolium perenne产生毒性的作用机制时发现,12 d的培养期结束后,ZnONPs悬浮液和根系附近的团聚体粒径分别为(900±300)和(500±80)nm,即植物在培养的过程中,根系渗出液与周围的纳米粒子团聚体作用而导致团聚体的粒径变小.
纳米材料的多样性和在水中的理化性质是影响其植物毒性的重要因素,如纳米粒子种类、尺寸、在水中的团聚粒径和溶解的金属离子等.本研究发现,ZnONPs和CuONPs对水稻幼苗的影响较大;ZnSNPs在实验设置浓度下体现了促进水稻生长的作用.这是由于CuONPs悬浮液的稳定性最高,团聚粒径也相对小得多,从而导致悬浮液中的纳米粒子与水稻根系接触最充分,对水稻幼苗的影响更大.实验结果符合Lin等(2009)研究多壁碳纳米管(MWCNTs)对拟南芥细胞毒性时得出的结论,即MWCNTs悬浮液分散得越均匀,毒性越大.在ZnSNPs和ZnONPs处理组中,ZnONPs稳定性和团聚粒径与ZnSNPs相差不大,但对水稻生长的抑制程度明显高于ZnSNPs处理组.由于ZnONPs对应的离子对照组对水稻幼苗生长产生抑制作用,且主要集中在高浓度组(17.7和18.4 mg·L-1),而ZnSNPs对应的离子对照组无显著影响,说明ZnONPs溶解更多的Zn2+是毒性更大的原因之一.ZnONPs对应的离子对照组对水稻生长的抑制程度低于ZnONPs悬浮液,即ZnONPs纳米结构本身也起着降低水稻幼苗生长的作用,而ZnSNPs悬浮液表现了正向调节作用,说明纳米粒子种类的不同也对植物毒性产生了影响.离子对照组对水稻幼苗生长指数的影响表明,CuONPs与ZnSNPs溶解的金属离子浓度较低,对水稻幼苗生长影响较小或不产生影响(Kim et al.,2012),因此,CuONPs与ZnSNPs实验组对水稻生长的影响主要来自于悬浮液中的纳米粒子;而ZnONPs溶解的Zn2+浓度较高,高于6.0 mg·L-1的Zn2+对照组开始影响水稻的生长(Song et al.,2014),且抑制程度低于相应浓度的ZnONPs悬浮液造成的影响,说明ZnONPs对植物的影响来源于纳米粒子和溶解的Zn2+两方面.
许多研究指出,过氧化损伤可能是纳米粒子导致植物毒性的主要原因之一(Nair et al.,2014;von Moos et al.,2014).植物体受到外界毒物的胁迫产生过量的活性氧(ROS),ROS的积累可导致细胞膜被氧化而产生MDA.因此,细胞中MDA的含量可以反映出纳米粒子导致植物过氧化损伤的程度.本研究中ZnONPs和CuONPs处理组都增加了水稻根系细胞中MDA的含量,说明根系细胞受到ZnONPs和CuONPs的胁迫刺激而产生了过氧化伤害.ZnSNPs在50 mg·L-1时降低了MDA的含量,增加鲜重和提高根系活力,说明ZnSNPs对水稻过氧化损伤处于较低水平,水稻通过提高酶的活性和调节生理机能抵御纳米粒子的伤害(金盛杨等,2011).对比各项毒性实验指标发现,根系活力和根伸长量反应最为迅速敏感.这是因为水稻根系直接接触纳米粒子悬浮液,与植物根系接触的过程中造成根系细胞膜的破裂和堵塞(Kumari et al.,2011).粘附在根系表层的纳米粒子团聚物也会阻碍根系对水分的吸收而抑制根系活性和伸长量(袁刚强等,2015).
水稻幼苗对Zn的吸收量远远高于Cu,原因之一是ZnSNPs和ZnONPs悬浮液中Zn2+的溶出量远高于CuONPs 中Cu2+的溶出量;原因之二是植物对外界毒物具有选择性吸收的特点,黄永杰等(2006)研究水生植物对重金属的积累特性时发现,水生植物对Zn元素的富集系数远远高于Cu元素.植物的耐性是指植物特定的生理机制使得植物在其体内含有高浓度的重金属时仍能正常生长(李巧云等,2012).对比CuONPs和ZnSNPs对水稻幼苗的毒性可知,虽然水稻幼苗对Cu的吸收量远小于Zn的吸收量,但毒性强于ZnSNPs,说明水稻幼苗对Zn的耐性高于Cu.金属半导体纳米粒子悬浮液能溶解一定量的金属离子,对比纳米粒子悬浮液和离子对照组中水稻幼苗对Zn、Cu的吸收量发现,水稻幼苗在低浓度的纳米粒子悬浮液中主要体现为对溶解的金属离子的吸收,而随着纳米粒子浓度的增加,悬浮液中的团聚体逐渐增多,此时植物除了吸收溶出的金属离子外,也吸收纳米粒子.这和Zhang等(2015)和Lin等(2008)的研究结论类似,他们发现植物在ZnONPs中对Zn的积累量高于在Zn2+中的积累量,并在根系细胞质、细胞核和维管束中发现了ZnONPs团聚体.纳米粒子在水中的团聚尺寸是影响其生物吸收积累的重要因素之一(Alexandra et al.,2011).本实验对纳米粒子悬浮液团聚尺寸的测量结果表明,ZnONPs在水中的团聚尺寸随浓度增加而增大,虽然10和50 mg·L-1的ZnONPs粒径较小,但水稻幼苗对纳米粒子的积累量并不显著,而在100 mg·L-1的ZnONPs中,水稻幼苗对纳米粒子的吸收量显著增加.此实验现象说明,当水中的纳米粒子浓度足够大时,其团聚粒径增大对植物吸收积累纳米粒子影响很小.
CuONPs和100 mg·L-1的ZnONPs处理降低了水稻对金属元素的转运系数,这可能来源于以下两个原因:一是水稻幼苗自身对于高毒性的CuONPs有较强的排斥作用,抑制其在地上部分的积累;二是金属元素在植物体内的运输需要借助ATPase(ATP酶)催化ATP释放能量进行(张呈祥等,2013),CuONPs严重阻碍了水稻幼苗的生长发育,降低了ATPase的活性,从而导致水稻转运Cu2+的能力大大减弱.由于植物对Zn的耐性高于Cu,故水稻幼苗只有在高浓度的ZnONPs中才出现转运系数降低的现象.同理,100 mg·L-1的ZnSNPs处理水稻幼苗后使得根系活力明显增强,指示水稻根系的生理活性也提高了,从而促进了Zn由根系向地上部分转运.
5 结论(Conclusions)1)3种纳米粒子在不同浓度时理化性质差异很大,同浓度下ZnONPs和ZnSNPs悬浮液的稳定性低于CuONPs,团聚粒径和离子溶出量高于CuONPs.纳米粒子悬浮液培养水稻幼苗3 d 后,悬浮液中纳米粒子团聚体粒径变小.
2) ZnONPs和CuONPs浓度大于50 mg·L-1时都能抑制水稻幼苗生长及降低其生理活性,ZnSNPs在本实验浓度下体现了促进生长作用.CuONPs和ZnSNPs悬浮液溶解的金属离子浓度较低,对水稻幼苗生长影响很小或没有影响,因此,ZnSNPs和CuONPs对水稻幼苗的影响主要来自于纳米粒子;而ZnONPs溶解的Zn2+浓度更高,对植物生长有抑制作用,故ZnONPs对植物的影响来源于纳米粒子和Zn2+两方面.
3) 水稻幼苗对Zn的选择性吸收和耐性都高于Cu.水稻幼苗在低浓度的纳米粒子悬浮液中主要体现为对溶解的金属离子的吸收,而随着纳米粒子浓度的增加,悬浮液中的团聚体逐渐增多,此时植物除了吸收溶出的金属离子外,也吸收纳米粒子.
4) 水稻幼苗对Zn和Cu元素的生物转运系数分别在2.0~2.3和0.9~1.6之间,CuONPs和高浓度的ZnONPs能降低了水稻幼苗对金属元素的转运系数,而高浓度的ZnSNPs提高了转运系数.
| [${referVo.labelOrder}] | Alexandra A, Warren C W C. 2011. Effect of gold nanoparticle aggregation on cell uptake and toxicity[J]. ACS Nano, 5(7) : 5478–5489. DOI:10.1021/nn2007496 |
| [${referVo.labelOrder}] | Baque M A, Lee E J, Paek K Y. 2010. Medium salt strength induced changes in growth,physiology and secondary metabolite content in adventitious roots of Morindacitrifolia:the role of antioxidant enzymes and phenylalanine ammonia lyase[J]. Plant Cell Reports, 29(7) : 685–694. DOI:10.1007/s00299-010-0854-4 |
| [${referVo.labelOrder}] | Berlier G, Meneau F, Sankar G, et al. 2006. Synthesis and characterisation of small ZnS particles[J]. Research of Chemical Intermed, 32(7) : 683–693. DOI:10.1163/156856706778400334 |
| [${referVo.labelOrder}] | Badawy A M E, Luxton T P, Silva R G, et al. 2010. Impact of environmental conditions(pH,ionic strength,and electrolyte type) on the surface charge and aggregation of silver nanoparticles suspensions[J]. Environmental Science and Technology, 44(4) : 1260–1266. DOI:10.1021/es902240k |
| [${referVo.labelOrder}] | Castro-Bugallo A, González-Fernández A, Guisande C, et al. 2014. Comparative responses to metal oxide nanoparticles in marine phytoplankton[J]. Archives of Environmental Contamination and Toxicology, 67(4) : 483–493. DOI:10.1007/s00244-014-0044-4 |
| [${referVo.labelOrder}] | Chakraborty I, Moulik S P. 2004. Preparation and characterization of nanoscale semiconductor particles of ZnS,CdS,and PbCrO4 in polymer-surfactant gel matrix[J]. Journal of Dispersion Science and Technology, 25(6) : 849–859. |
| [${referVo.labelOrder}] | Chang Y N, Ou X M, Zeng G M, et al. 2015. Synthesis of magnetic graphene oxide-TiO2 and their antibacterial properties under solar irradiation[J]. Applied Surface Science, 343 : 1–10. DOI:10.1016/j.apsusc.2015.03.082 |
| [${referVo.labelOrder}] | Cho S J, Maysinger D, Jain M, et al. 2007. Long-term exposure to CdTe quantum dots causes functional impairments in live cells[J]. Langmuir, 23(4) : 1974–1980. DOI:10.1021/la060093j |
| [${referVo.labelOrder}] | Chowdhury I, Mansukhani N D, Guiney L M, et al. 2015. Aggregation and stability of reduced graphene oxide:complex roles of divalent cations,pH,and natural organic matter[J]. Environmental Science and Technology, 49(18) : 10886–10893. DOI:10.1021/acs.est.5b01866 |
| [${referVo.labelOrder}] | Deng C H, Gong J L, Zeng G M, et al. 2016. Graphene、|CdS nanocomposite inactivation performance toward Escherichia coli in the presence of humic acid under visible light irradiation[J]. Chemical Engineering Journal, 284 : 41–53. DOI:10.1016/j.cej.2015.08.106 |
| [${referVo.labelOrder}] | Navarro E, Baun A, Behra R, et al. 2008. Environmental behavior and ecotoxicity of engineered nanoparticles to algae,plants,and fungi[J]. Ecotoxicology, 17(5) : 372–386. DOI:10.1007/s10646-008-0214-0 |
| [${referVo.labelOrder}] | Franco A, Neves M C, Ribeiro Carrott M M L, et al. 2009. Photocatalytic decolorization of methylene blue in the presence of TiO2/ZnS nanocomposites[J]. Journal of Hazardous Materials, 161(1) : 545–550. DOI:10.1016/j.jhazmat.2008.03.133 |
| [${referVo.labelOrder}] | Gong J L, Zhang Y L, Jiang Y, et al. 2015. Continuous adsorption of Pb(II) and methylene blue by engineered graphite oxide coated sand in fixed-bed column[J]. Applied Surface Science, 330 : 148–157. DOI:10.1016/j.apsusc.2014.11.068 |
| [${referVo.labelOrder}] | Griffitt R J, Weil R, Hyndman K A, et al. 2007. Exposure to copper nanoparticles causes gill injury and acute lethality in zebrafish(Danio rerio)[J]. Environmental Science & Technology, 41(23) : 8178–8186. |
| [${referVo.labelOrder}] | 黄永杰, 刘登义, 王友保, 等. 2006. 八种水生植物对重金属富集能力的比较研究[J]. 生态学杂志, 2006, 25(5) : 541–545. |
| [${referVo.labelOrder}] | 金盛杨, 王玉军, 汪鹏, 等. 2011. 纳米氧化铜对小麦根系生理生化行为的影响[J]. 土壤, 2011, 43(4) : 605–610. |
| [${referVo.labelOrder}] | Karmali P P, Simberg D. 2011. Interactions of nanoparticles with plasma proteins:Implication on clearance and toxicity of drug delivery systems[J]. Expert Opinion on Drug Delivery, 8(3) : 343–357. DOI:10.1517/17425247.2011.554818 |
| [${referVo.labelOrder}] | |
| [${referVo.labelOrder}] | Kumari M, Khan S S, Pakrashi S, et al. 2011. Cytogenetic and genotoxic effects of zinc oxide nanoparticles on root cells of Allium cepa[J]. Journal of Hazardous Materials, 190(1) : 613–621. |
| [${referVo.labelOrder}] | Lahiani M H, Dervishi E, Chen J H, et al. 2013. Impact of carbon nanotube exposure to seeds of valuable crops[J]. ACS Applied Materials & Interfaces, 5(16) : 7965–7973. |
| [${referVo.labelOrder}] | Lichtenthaler H K. 1987. Chlorophylls and carotenoids:pigments of photosynthetic biomembranes[J]. Methods in Enzymology, 148 : 350–382. DOI:10.1016/0076-6879(87)48036-1 |
| [${referVo.labelOrder}] | Lin C, Fugetsu B, Su Y B, et al. 2009. Studies on toxicity of multi-walled carbon nanotubes on Arabidopsis T87 suspension cells[J]. Journal of Hazardous Materials, 170(2) : 578–583. |
| [${referVo.labelOrder}] | Lin D H, Xing B S. 2008. Root uptake and phytotoxicity of ZnO nanoparticles[J]. Environmental Science & Technology, 42(15) : 5580–5585. |
| [${referVo.labelOrder}] | 李巧云, 曾清如, 廖柏寒, 等. 2012. 沉水植物对沉积物中铜锌铅的富集[J]. 水土保持学报, 2012, 26(5) : 177–181. |
| [${referVo.labelOrder}] | 刘涛, 向垒, 余忠雄, 等. 2015. 水稻幼苗对纳米氧化铜的吸收及根系形态生理特征响应[J]. 中国环境科学, 2015, 35(5) : 1480–1486. |
| [${referVo.labelOrder}] | Miralles P, Johnson E, Church T L, et al. 2012. Multi-walled carbon nanotubes in alfalfa and wheat:toxicology and uptake[J]. Journal of Royal Society Interface, 9(77) : 3514–3527. DOI:10.1098/rsif.2012.0535 |
| [${referVo.labelOrder}] | Mohanpuria P, Rana N K, Yadav S K. 2008. Biosynthesis of nanoparticles:technological concepts and future applications[J]. Journal of Nanoparticle Research, 10(3) : 507–517. DOI:10.1007/s11051-007-9275-x |
| [${referVo.labelOrder}] | Nair P M G, Kim S H, Chung I M. 2014. Copper oxide nanoparticle toxicity in mung bean(Vigna radiate L[J]. ) seedlings:physiological and molecular level responses of in vitro grown plants[J].Acta Physiologiae Plantaurm, 36(11) : 2947–2958. |
| [${referVo.labelOrder}] | Navarro D A, Bisson M A, Aga D S. 2012. Investigating uptake of water-dispersible CdSe/ZnS quantum dot nanoparticles by Arabidopsis thaliana plants[J]. Journal of Hazardous Materials, 211-212 : 427–435. DOI:10.1016/j.jhazmat.2011.12.012 |
| [${referVo.labelOrder}] | Nel A, Xia T, Madler L, et al. 2006. Toxic potential of materials at the nanolevel[J]. Science, 311(5761) : 622–627. DOI:10.1126/science.1114397 |
| [${referVo.labelOrder}] | Osmond M J, McCall M J. 2010. Zinc oxide nanoparticles in modern sunscreens:an analysis of potential exposure and hazard[J]. Nanotoxicology, 4(1) : 15–41. DOI:10.3109/17435390903502028 |
| [${referVo.labelOrder}] | Sajimol A M, Anas A, Das A V, et al. 2015. Cytotoxicity and cellular uptake of ZnS:Mn nanocrystals biofunctionalized with chitosan and aminoacids[J]. Spectrochimica Acta Part A-Molecular and Biomolecular Spectroscopy, 136 : 327–333. DOI:10.1016/j.saa.2014.08.147 |
| [${referVo.labelOrder}] | Song W H, Zhang J Y, Guo J, et al. 2010. Role of dissolved zinc ion and reactive oxygen species in cytotoxicity of ZnO nanoparticles[J]. Toxicology Letters, 199(3) : 389–397. DOI:10.1016/j.toxlet.2010.10.003 |
| [${referVo.labelOrder}] | Stewart J, Hansen T, Mclean J E, et al. 2015. Salts affect the interaction of ZnO or CuO nanoparticles with wheat[J]. Environmental Toxicology and Chemistry, 34(9) : 2116–2125. DOI:10.1002/etc.v34.9 |
| [${referVo.labelOrder}] | Suman T Y, Rajasree S R R, Kirubagaran R. 2015. Evaluation of zinc oxide nanoparticles toxicity on marine algae chlorella vulgaris through flow cytometric,cytotoxicity and oxidative stress analysis[J]. Ecotoxicology and Environmental Safety, 113 : 23–30. DOI:10.1016/j.ecoenv.2014.11.015 |
| [${referVo.labelOrder}] | Villagarcia H, Dervishi E, de Silva K, et al. 2012. Surface chemistry of carbon nanotubes impacts the growth and expression of water channel protein in tomato plants[J]. Small, 8(15) : 2328–2334. DOI:10.1002/smll.v8.15 |
| [${referVo.labelOrder}] | von Moos N, Slaveykova V I. 2014. Oxidative stress induced by inorganic nanoparticles in bacteria and aquatic microalgae-state of the art and knowledge gaps[J]. Nanotoxicology, 8(6) : 605–630. DOI:10.3109/17435390.2013.809810 |
| [${referVo.labelOrder}] | 王淑玲, 张玉喜, 刘汉柱, 等. 2014. 氧化铜纳米颗粒对水稻幼苗根系代谢毒性的研究[J]. 环境科学, 2014, 35(5) : 1968–1973. |
| [${referVo.labelOrder}] | 王振红, 罗专溪, 颜昌宙, 等. 2011. 纳米氧化锌对绿豆芽生长的影响[J]. 农业环境科学学报, 2011, 30(4) : 619–624. |
| [${referVo.labelOrder}] | 杨新萍, 赵方杰. 2013. 植物对纳米颗粒的吸收、转运和毒性效应[J]. 环境科学, 2013, 34(11) : 4495–4502. |
| [${referVo.labelOrder}] | 袁刚强, 龚继来, 曾光明. 2015. 单壁碳纳米管材料对水稻幼苗的毒性效应[J]. 环境科学学报, 2015, 35(12) : 4143–4149. |
| [${referVo.labelOrder}] | 张呈祥, 陈为峰. 2013. 德国鸢尾对Cd胁迫的生理生态响应及积累特性[J]. 生态学报, 2013, 33(7) : 2165–2172. |
| [${referVo.labelOrder}] | Zhang D Q, Hua T, Xiao F, et al. 2015. Phytotoxicity and bioaccumulation of ZnO nanoparticles in Schoenoplectus tabernaemontani[J]. Chemosphere, 120 : 211–219. DOI:10.1016/j.chemosphere.2014.06.041 |
| [${referVo.labelOrder}] | Zhang H Z, Gilbert B, Huang F. 2003. Water-driven structure transformation in nanoparticles at room temperature[J]. Nature, 424(6952) : 1025–1029. DOI:10.1038/nature01845 |
 2017, Vol. 37
2017, Vol. 37


