2. 吉林省商品粮基地土壤资源可持续利用重点实验室, 长春 130118;
3. 华中科技大学环境科学与工程学院, 武汉 430074
2. Key Laboratory of Soil Resource Sustainable Utilization for Jilin Province Commodity Grain Bases, Changchun 130118;
3. School of Environmental Science and Engineering, Huazhong University of Science and Technology, Wuhan 430074
随着全球气候变暖和农业面源污染的加剧, 我国的水体富营养化问题呈现了明显的北移趋势, 北方, 尤其是东北地区的一些大型水体的局部水域不仅氮磷等营养盐含量逐年增加, 而且还会爆发水华(李永庆等, 2007; 金志民等, 2009), 对水生生态系统平衡和饮用水安全构成了严重的威胁, 成为急需解决的水环境问题之一.富营养化水体修复方法包括物理法、化学法、生物法和联合法(李明堂等, 2012; 吴睿等, 2014; 毛志刚等, 2014), 与物理和化学法相比, 生物法具有环境扰动小、无二次污染、有利于水生生态系统自我维持平衡等优点, 在富营养化水体治理方面具有广阔的应用前景(王敏等, 2013; 姜义帅等, 2013; 李明堂等, 2013).穗花狐尾藻由于具有耐寒、繁殖迅速、适应力强和快速吸收氮磷等优点, 在富营养化水体治理中得到了广泛的应用(袁桂香等, 2013; 潘静赟等, 2012).但由于我国寒区富营养化水体低温期长, 植物生长周期短, 再加上水体中悬浮和沉积的磷酸盐大部分以不溶态形式存在(任万平等, 2012;高湘等, 2015), 因此, 狐尾藻在治理寒区富营养化水体方面存在作用周期短、效果差等缺点.为克服这一缺点, 急需开发一种既可促进水体中不溶态的“死磷”变成可被生物利用的“活”磷酸, 又可提高狐尾藻的适应能力及促进其快速生长的技术.植物内生菌是存在于寄主植物组织中的一类微生物, 包括细菌和真菌, 这类微生物不会对寄主植物造成任何损害, 相反, 还会通过分泌代谢产物来促进植物的生长和提高植物对不良环境的抵抗力(Porras-Soriano et al., 2008; Pereira et al., 2016; Xu et al., 2016).同时研究还发现, 自然界中存在许多能将固定态的磷酸盐中的磷酸根离子释放出来的溶磷微生物(或称解磷微生物), 这些微生物可明显提高环境中活性磷酸盐的浓度, 促进植物的生长及其对磷的吸收量(卫星等, 2012; 白文娟等, 2014).Chen等(2012)从北京官厅水库的水生植物芦苇、菹草、睡莲和茨藻中分离获得了36株具有溶磷作用的细菌, 表明水生植物内生菌中可能蕴藏着对富营养化水体磷的迁移转化具有重要作用的微生物资源.因此, 本文试图从北方水体中常见的耐低温水生植物穗花狐尾藻中分离出具有较强溶磷能力的内生菌, 并通过研究菌株的溶磷规律和对底泥中不溶性磷的释放特征, 以期为认识富营养化水体磷生物地球化学过程中微生物的作用提供新的科学数据.
2 材料与方法(Materials and methods) 2.1 供试样品的采集、培养从长春北湖国家湿地公园采集外表健康、长势一致的穗花狐尾藻、底泥和水样, 当天运回实验室, 并完成预处理和培养.将水样用滤纸过滤后在121 ℃下灭菌30 min, 备用;利用自来水冲洗干净穗花狐尾藻, 然后再用无菌水冲洗5遍, 最后将穗花狐尾藻放在处理过的水样中培养.选择生长速度快和外表健康的植株用于内生菌的分离.
底泥样品去掉动植物残体和石块等杂物后在阴凉处自然风干, 在风干过程中要经常敲打, 防止出现大的泥块, 风干后混匀, 取1 kg底泥样品研磨后过20目筛, 一部分用于底泥基本理化性质的分析(鲁如坤, 1999), 一部分用于模拟实验.底泥的基本理化性质为:总有机碳为5.13%, 密度为2.21 g·cm-3, pH值为7.34, 总氮和总磷分别为6.14和0.95 g·kg-1.
2.2 培养基研究中主要用到的培养基为牛肉膏蛋白胨培养基和溶磷培养基.其中, 溶磷培养基的基本配方如下:葡萄糖10 g, Ca3(PO4)2 5 g, (NH4)2SO4 0.5 g, NaCl 0.3 g, KCl 0.3 g, MgSO4·7H2O 0.3 g, FeSO4·7H2O 0.03 g, MnSO4·7H2O 0.03 g, pH=7.1, 蒸馏水定容至1000 mL, 121 ℃高压灭菌20 min.加入2%的琼脂粉制备成固体培养基.
2.3 菌株SP5的分离和鉴定 2.3.1 植物表面消毒和内生菌分离将挑选出的穗花狐尾藻放入无菌水中清洗数次, 直到无菌水无明显变浑为止, 用无菌滤纸将其吸干, 依次用70%乙醇溶液浸泡2.5 min、1%次氯酸钠溶液浸泡1.5 min、0.1%氯化汞溶液中浸泡60 s, 最后用无菌水再反复冲洗5次并吸干.将植株剪切成1 cm左右的小段, 一部分纵向切开, 将切面贴合在牛肉膏蛋白胨固体培养基表面上放置, 另外一部分直接横放在培养基上, 同时取最后一次冲洗液0.2 mL涂布于牛肉膏蛋白胨培养基平板上, 将上述制备完的平板置于25 ℃恒温培养箱中培养.当冲洗液中无菌, 横放的植株小段除切面附近其他部位处未长菌, 纵切后的小段周围长满菌落时认为分离成功, 否则重新分离培养, 将3次重复操作都分离出的菌株认定为穗花狐尾藻内生菌.再将内生菌分别接种至穗花狐尾藻培养体系中培养15 d, 将对穗花狐尾藻无害且促进其生长的内生菌作用目标菌, 用于溶磷菌的筛选.将目标菌分别接种至溶磷培养基中培养5 d, 测定上清液中的溶解性正磷酸盐的含量, 将溶磷能力最大的一株菌作为目标菌, 对其进行溶磷规律和释放底泥中磷酸盐的研究.
2.3.2 菌株SP5的鉴定按照《常见细菌系统鉴定手册》进行菌落特征观察、革兰氏染色鉴定和生理生化指标测定(东秀珠等, 2001).利用法国生物梅里埃公司VITEK 2 COMPACT鉴定系统进行快速鉴定.
16S rDNA序列鉴定:按照陈庆丽等(2015)的方法进行总DNA提取和16S rRNA基因扩增, 反应体系为:10×Ex Taq Buffer 5 μL, dNTP Mixture 5 μL, 上游引物2 μL, 下游引物2 μL, 模板DNA 5 μL, Ex Taq DNA聚合酶1 μL, 灭菌ddH2O 30 μL.PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸90 s, 35个循环; 72 ℃延伸10 min, 4 ℃保存.PCR反应结束后, 将所得产物全部点样于1.2%的大孔琼脂糖凝胶上, 100 V恒压下电泳45 min, 紫外凝胶成像系统观察电泳结果, 并进行产物的纯化.采用北京百泰克生物技术有限公司的PCR产物回收试剂盒(离心柱型)对琼脂糖凝胶中分离的PCR产物进行纯化.纯化后的样品送至吉林省库美生物科技有限公司进行测序.对最终测得的菌株的16S rDNA基因构建系统发育树以确定其种属在分类系统中的位置.系统发育树构建的具体步骤为:在NCBI数据库中通过BLAST选取与测定的基因序列亲缘关系较近的模式菌株的16S rDNA基因序列, 利用ClustalX 2.1 Multiple Alignment (多序列比对排列)功能将目的基因序列与亲缘序列进行比对(Gibson et al., 1994).再用MEGA 6.0软件将比对后的序列用Neighbor-Joining Method (邻接法)进行发育树的构建, 并通过Boot-strap (自举分析)进行置信度检测, 自举数据集次数为1000 (Tamura et al., 2013).
2.4 纯培养下菌株SP5的溶磷特征研究 2.4.1 菌悬液的制备和培养条件将在-4 ℃冰箱中保存时间不超过1周的菌体细胞接种至牛肉膏蛋白胨液体培养基中, 在25 ℃活化培养48 h, 在8000 r·min-1和4 ℃下离心5 min, 去掉上清液后加入无菌水清洗2次后, 再悬浮于无菌水中, 制备成OD600为0.3左右的菌悬液, 再以2%的比例接种至培养体系中.培养条件为25 ℃和120 r·min-1, 除溶磷动力学外, 其它溶磷实验的采样时间均为培养后的第4 d.
2.4.2 溶磷动力学按照2%的接种量将菌悬液加入到溶磷培养基中培养, 在120 r·min-1和25 ℃下培养, 每隔24 h采样, 8000 r·min-1离心5 min后, 取上清液测定溶解性正磷酸盐和pH值.
2.4.3 因子响应规律研究根据氮含量相同的原则, 分别利用硝酸钠和尿素代替溶磷培养基中的硫酸铵, 进行溶磷实验, 研究氮源对菌株溶磷的影响.
利用盐酸和氢氧化钠溶液将牛肉膏蛋白胨液体培养基和溶磷培养基的pH值都调至4~10, 接种培养, 48 h后测定培养液的OD600;对于溶磷培养基, 每种pH处理都同时做不接菌的对照, 4 d后测定溶磷培养液体中的溶解性正磷酸盐浓度, 研究pH值对菌株生长和溶磷的影响.
在原溶磷培养基的基础上通过只改变碳源或只改变氮源添加量的方式, 调节溶磷培养基的碳氮比为10:1~40:1, 进行溶磷实验, 分析碳氮比和碳氮量对溶磷的影响.
分别将溶磷培养基中Mg2+、Fe3+、Mn2+的浓度提高至10倍, 进行溶磷实验, 研究共存高浓度金属离子对菌株溶磷的影响.
2.5 菌株SP5释放底泥中磷酸盐的模拟研究称取供试底泥样品20 g加入到三角瓶中, 然后加入稀释10倍的菌悬液20 mL, 同时做无菌水对照.每个处理重复3次, 在25 ℃和120 r·min-1下摇床培养第10 d时, 取部分样品测定水相中的磷酸盐, 第11 d时向剩余的三角瓶中各补充10 mL无菌水, 培养20 d后将培养物尽量倒出, 在8000 r·min-1下离心5 min, 分别收集上清液和底泥, 测定上清液中的溶解性正磷酸盐浓度.将底泥样品在阴凉处风干后研磨过20目筛, 按照磷的分级测定方法(鲍士旦, 1999)测定出铝结合的磷酸盐(Al-P)、铁结合的磷酸盐(Fe-P)、闭蓄态磷酸盐(O-P)、钙结合的磷酸盐(Ca-P)的含量, 研究分析菌株对底泥中磷酸盐的释放特征.
2.6 分析测定方法通过测定培养液在600 nm处的吸光度来表征菌体细胞的生长量.将培养体系在8000 r·min-1下离心5 min后, 用钼锑抗比色法测定上清液中溶解性正磷酸盐浓度.
利用底泥中磷的连续提取方法, 分别逐一提取待测底泥中不同形态的磷, 用钼锑抗比色法测定各种形态磷含量(鲁如坤, 1999).
2.7 数据分析文中的所有实验数据利用SPSS20.0和Excel软件进行处理, 对有关数据进行了显著性分析.
3 结果(Results) 3.1 穗花狐尾藻内生溶磷菌的分离和鉴定 3.1.1 穗花狐尾藻内生溶磷菌的分离通过组织表面消毒、切面培养和共生培养的方法从健康的穗花狐尾藻植株体内分离获得了5株数量上占明显优势的内生菌(SP1~SP5), 其溶磷能力见图 1.从图 1可以看出, 菌株SP5的溶磷能力最强(p < 0.01), 培养5 d后培养液中溶解性正磷酸盐的浓度可达到262.45 mg·L-1, 因此, 将菌株SP5定为目标菌株, 进行相关的溶磷研究.
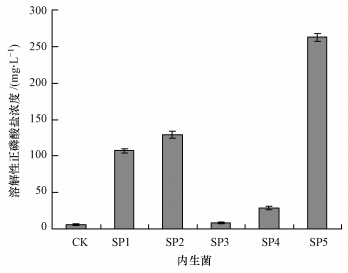 |
| 图 1 5株穗花狐尾藻内生菌对磷酸钙的溶解作用 Fig. 1 Solubilization of Ca3(PO4)2 by five strains of endophtic bacteria from Myriophyllum spicatum |
菌株SP5在牛肉膏蛋白胨固体培养基上于25 ℃培养24 h后, 可见扁平、边缘整齐、表面湿润光泽、不透明的菌落(图 2a).光学显微镜观察发现, 菌体细胞呈短杆状、无芽孢、无荚膜、革兰阴性(图 2b).VITEK 2 COMPACT GN鉴定卡的鉴定结果表明, 菌株SP5与居泉沙雷氏菌的相似度为99%(表 1).将菌株JM1的16S rRNA基因序列提交GenBank, Blast结果表明其与沙雷氏菌属中的5种菌均有98%的同源性.测序后的序列通过MEGA6.0软件用Neighbor-Joining Method (邻接法)生成了系统发育树状图(图 3).从该系统发育树可知, SP5菌株属于肠杆菌科中的沙雷氏菌属(Serratia sp.), 且与Serratia glossinae处于同一分支, 亲缘关系较近.根据16S rRNA同源性比较, 结合菌株的形态学观察和生理学特征, 可基本将分离的SP5菌株归属为沙雷氏菌属, 命名为Serratia sp. SP5.
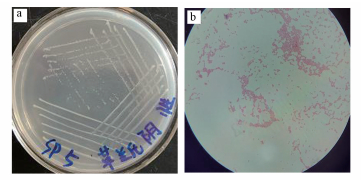 |
| 图 2 菌株SP5纯化(a)和革兰氏染色(b) Fig. 2 The purification (a) and gram staining (b) of strain SP5 |
| 表 1 菌株SP5的VITEK 2 GN鉴定结果 Table 1 Identification of strain SP5 by VITEK 2 |
 |
| 图 3 基于16S rRNA基因序列构建的系统发育树 Fig. 3 Phylogenetic tree based on the sequence of 16S rRNA |
将菌株SP5接种至溶磷培养基中培养, 每隔24 h采样分析, 结果如图 4所示.从图 4a可以看出, 菌株SP5进入培养体系后分别在24、72、96 h进入快速生长期、对数生长期和稳定期.图 4b表明, 菌株SP5在溶磷过程中会降低培养液的pH值, 培养液的最低pH值可达到4.32.从图中还可以看出, 培养液中磷酸根离子和培养液的pH值变化特征一致, 表明菌株SP5主要通过产生酸性物质促进磷酸根的释放.
 |
| 图 4 菌株SP5溶磷过程中培养液中磷酸根离子(a)及其pH值(b)随时间的变化 Fig. 4 Change of phosphate concentration (a) and pH (b) in culture medium during the solubilization of Ca3(PO4)2 by strain SP5 |
分别利用3种氮源研究了菌株的溶磷和产酸能力, 结果如图 5所示.从图中可以看出, 菌株SP5在3种氮源中对磷酸钙均具有不同程度的溶解作用, 但菌株SP5优先利用铵根离子溶磷, 其次为硝酸根离子, 而尿素则不利于菌株溶磷能力的发挥.从图 5中可以看出, 与对照相比, 菌株SP5利用铵根离子产酸能力最强(p < 0.01), 以硝酸根为氮源时产酸能力明显下降(p < 0.05), 而利用尿素时则产碱性物质.这表明菌株SP5的溶磷能力可受到氮源种类的影响, 酸性物质是其溶磷的主要物质, 但除此之外, 菌株SP5还会产生其他溶磷能力低的物质, 具体机理有待于进一步研究.
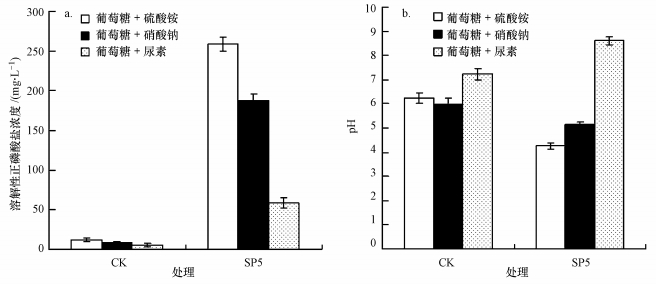 |
| 图 5 氮源对菌株SP5释放磷酸根的量(a)及培养液pH值(b)的影响 Fig. 5 Effect of nitrogen source on phosphate concentration (a) and pH (b) of culture liquid during the solubilization of Ca3(PO4)2 by strain SP5 |
分别利用牛肉膏蛋白胨液体培养基和溶磷培养基研究了pH值对菌株生长和溶磷能力的影响, 结果如图 6所示.从图 6可以看出, 适宜菌株生长的pH值范围为5~9, 表明菌株对pH值的适应能力强.从图 6中还可以看出, pH值为7时, 与对照相比, 菌株SP5对磷酸根离子的相对释放量最大, 是对照的16倍, 在酸性条件下(pH值为5和6)菌株仍然保持着溶磷能力, 但在碱性条件下菌株的溶磷能力明显下降, 当pH值为9时, 菌株溶磷能力受到明显的抑制(p < 0.01).
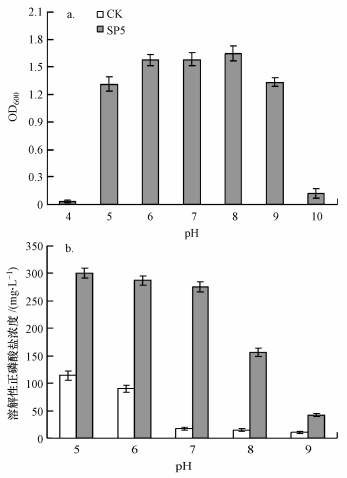 |
| 图 6 初始pH对菌株SP5生长(a)及溶磷(b)的影响 Fig. 6 Effect of initial pH on the growth of strain SP5 (a) and its solubilizing ability to Ca3(PO4)2 (b) |
为了研究高含量金属离子对内生溶磷菌SP5溶磷效果的影响, 在无机磷基础培养基其他成分含量不变的情况下, 分别将Mg2+、Fe3+、Mn2+ 3种金属离子的浓度提高至原来的10倍, 再利用相应的培养基进行溶磷实验.从图 7中可以看出, 共存高浓度的金属离子时, 菌株释放出的磷酸根离子净含量明显降低(p < 0.05).与原培养基相比, 高含量的Mg2+、Fe3+、Mn2+离子分别使得培养液中溶解性磷酸根离子的浓度下降了42.8、143.82、113.25 mg·L-1, 说明菌株的溶磷能力对Mn2+最敏感, 对Mg2+有一定的抗性.
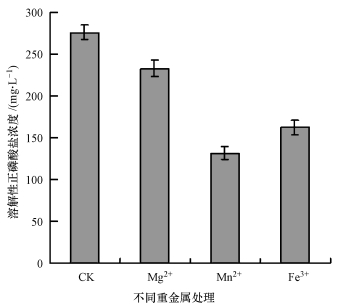 |
| 图 7 金属离子对菌株SP5溶磷的影响 Fig. 7 Effect of metal ions on Ca3(PO4)2 solubiliztion by strain SP5 |
培养基的碳氮比不仅影响着菌株的生长还可影响其生理代谢过程, 从而影响溶磷物质的产生, 因此, 本文研究了在NBRIP培养基的基础上单独改变氮源或碳源时不同碳氮比对菌株SP5溶磷的影响, 结果如图 8所示.从图中可以看出, 碳氮比及碳氮量都对菌株SP5的溶磷效果产生影响, 总的来说, 碳氮比为35:1时碳氮量对溶磷效果没有影响;碳量不变时, 随着氮含量的降低, 溶磷能力随着碳氮比的增加而逐渐增加, 但增加至35:1时不再继续增加;氮量不变时, 碳氮比在25:1~35:1时保持最佳的溶磷效果, 但碳氮比增加或降低都会减少磷酸根离子的释放量.
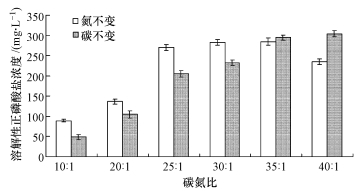 |
| 图 8 碳氮比对菌株SP5溶磷的影响 Fig. 8 Effect of C/N on Ca3(PO4)2 solubiliztion by strain SP5 |
为了研究菌株SP5对底泥中磷的释放作用, 分别在模拟培养的第10 d与第20 d采样测得上覆水中正磷酸盐浓度, 结果如图 9所示.图 9结果表明, 菌株SP5对底泥中磷酸根离子的释放具有明显的促进作用, 上覆水中磷酸盐的浓度在培养后的10和20 d分别是对照组的2.0倍和1.5倍, 培养20 d后底泥中Al-P、Fe-P的含量与对照组相比无明显降低, 而闭蓄态磷(O-P)和Ca-P分别比对照组降低了15.21%和34.87%.以上结果表明, 菌株SP5可通过释放底泥中的Ca-P来增加活性磷的含量, 可为植物吸收提供更多的可利用性磷, 从而加速底泥中磷的去除.
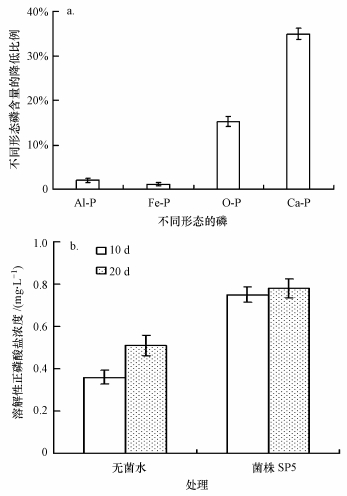 |
| 图 9 菌株SP5对底泥中不同形态磷的释放(a)及对上覆水中磷酸根离子浓度(b)的影响 Fig. 9 Release of phosphate in different forms in sediment by strain SP5(a) and its effect on the phosphate concentration in water (b) |
植物内生菌是一类寄生于健康植物组织和器官内的真菌、细菌或放线菌, 可通过固氮、溶解营养物质与致病菌进行空间和营养竞争, 以及产生水解酶、抗生素和其他活性代谢产物等过程增强植物对恶劣环境和致病菌的抵抗力及特殊功能的发挥, 因此, 在农业、环境保护、药物开发等领域被广泛应用(曹凯等, 2015; 王晓洋等, 2015; 王志伟等, 2014).目前对于植物内生菌的研究主要是集中在陆生植物, 而对于水生植物内生菌的理论和应用研究相对较少.目前学者们主要从水葫芦内分离出了32个属56株内生细菌(蓝江林等, 2008), 从北京官厅水库的水生植物芦苇、菹草、睡莲和茨藻中分离获得了12个属100株的细菌, 其中, 具有溶磷作用的菌株36株, 同时还有多株细菌具有降解萘和农药的能力(Chen et al., 2012), 从穗花狐尾藻内分离获得了一株可降解双酚A的内生菌为类芽孢杆菌属菌株(王乐乐等, 2015).狐尾藻是北方水体中常见的一种耐污、耐低温植物, 在富营养化水体修复方面具有重要的应用价值.但由于水体中的磷大部分以不溶态的形式存在于底泥或悬浮物中, 并且我国北方, 尤其是东北地区低温期长, 植物作用时间短, 因此,在富营养化水体修复方面效果较差.鉴于此, 本文试图获得一株具有溶磷作用的内生菌, 进而利用该菌促进穗花狐尾藻生长的同时还可以将水体中的不溶性磷活化出来, 增强植物的吸收量, 从而提高寒区富营养化水体植物修复效率.本文通过组织表面消毒、内生菌分离、共生培养等步骤从寒区水体中健康的穗花狐尾藻植株内分离获得了5株内生菌, 其中, 菌株SP5具有较强的溶磷能力.16S rRNA序列比对表明, 菌株SP5属于肠杆菌科中的沙雷氏菌属(Serratia sp.), 且与Serratia glossinae处于同一分支, 亲缘关系较近.于婷等(2015)从大豆土壤中分离获得了一株具有溶磷作用的沙雷氏菌, 这表明环境中沙雷氏菌在溶磷方面可能具有一定的优势; 另外有研究表明, 沙雷氏菌对植物病害还具有生防作用(钱兰娟等, 2011).菌株SP5主要通过产酸溶磷, 这和大部分溶磷菌的释磷机理一致.氮源对微生物的溶磷作用具有不同的影响, 菌株SP5溶磷的优先利用氮源为硫酸铵, 而有的微生物则以硝酸根为优选氮源(赵小蓉等, 2002).适宜菌株SP5生长的pH范围为5~9, 而最佳溶磷效果则出现在初始pH值为7, 在酸性环境中的溶磷效果好于碱性环境, 表明环境中pH的变化将会影响到菌株的溶磷效果, 其在酸性环境中的应用效果会更好.共存较高的金属离子时, 菌株SP5的溶磷能力都受到明显的影响, 其中,Mg2+的影响最小, 而Mn2+的影响最大, 这可能是金属离子与磷酸根形成沉淀或者代谢产物与重金属螯合而减少了对Ca的螯合, 进而降低了磷酸根的释放(钟传青等, 2004;Hameeda et al., 2008).培养液中碳氮比和碳氮量对溶磷影响很大, 总体而言, 碳氮比为35:1时溶磷效果做好, 大的碳氮比有利于菌株溶磷能力的发挥.研究表明, 碳氮比对微生物的生理生化过程及代谢产物会产生明显的影响(易艳梅等, 2008), 进一步说明环境条件对菌株溶磷效果的发挥会产生重要影响, 实际应用中在必要时可以通过人工干预来增强菌株SP5溶磷功能的发挥.在灭菌底泥模拟应用中发现, 菌株SP5对底泥中磷酸根离子的释放产生了非常明显的积极效果, 主要是释放了底泥中O-P和Ca-P态的磷, 而释放出的磷则可以迁移, 并且可以进入上覆水中, 这表明菌株SP5在增强寒区富营养化水体植物修复效果方面可发挥积极作用, 具有明显的应用价值.
5 结论(Conclusions)1) 从寒区富营养化水体中的健康穗花狐尾藻植株内分离获得了一株具有溶磷作用的内生菌SP5, 16S rRNA序列鉴定结果表明该菌为沙雷氏菌属.
2) 菌株SP5主要通过产生酸性物质来溶解磷酸钙, 溶磷和生长的最佳氮源为硫酸铵, 最佳碳氮比为35:1.菌株适宜生长的pH值范围较大, 但pH为7时菌株SP5对磷酸根离子的相对释放量最大.共存高浓度重金属离子时菌株释放的磷酸根会减少, 影响程度大小的顺序为Mn2+>Fe3+>Mg2+.
3) 菌株SP5对底泥中的O-P和Ca-P有较强的溶解释放能力, 从而增加液相中磷酸根离子的浓度, 为研究富营养化水体中磷的生物地球化学过程提供了新的科学数据.
| [${referVo.labelOrder}] | 白文娟, 胡蓉蓉, 章家恩, 等. 2014. 溶磷菌对玉米苗期生长和磷素吸收的影响[J]. 生态科学, 2014, 33(3) : 401–407. |
| [${referVo.labelOrder}] | 鲍士旦. 1999. 土壤农化分析[M]. 北京: 中国农业出版社 : 90–93. |
| [${referVo.labelOrder}] | 曹凯, 李远婷, 安登第, 等. 2015. 内生菌对提高植物抗旱胁迫的研究进展[J]. 生物技术通报, 2015, 31(5) : 1–6. |
| [${referVo.labelOrder}] | 陈庆丽, 景澄茗, 付韵馨, 等. 2014. 寒区水体中溶藻铜绿假单胞菌的分离和性质研究[J]. 环境科学学报, 2014, 35(3) : 692–698. |
| [${referVo.labelOrder}] | Chen W M, Tang Y Q, Mort K, et al. 2012. Distribution of culturable endophytic bacteria in aquatic plants and their potential for bioremediation in polluted waters[J]. Aquatic Biology, 15(2) : 99–110. DOI:10.3354/ab00422 |
| [${referVo.labelOrder}] | 东秀珠, 蔡妙英, 等. 2001. 常见细菌系统鉴定手册[M]. 北京: 科学出版社 . |
| [${referVo.labelOrder}] | Gibson T J, Thompson J D, Higgins D G. 1994. CLUSTAL W:improving the sensitively of progressive multiple sequence alignment through sequence weighting, position specific gap penalties and weight matrix choice[J]. Nucleic Acids Research, 22(22) : 4673–4680. DOI:10.1093/nar/22.22.4673 |
| [${referVo.labelOrder}] | 高湘, 李妍, 何怡. 2015. 湖泊底泥磷释放及磷形态变化[J]. 环境工程学报, 2015, 9(7) : 3350–3354. |
| [${referVo.labelOrder}] | Hameeda B, Harini G, Rupela O P, et al. 2008. Growth promotion of maize by phosphate solubilizing bacteria isolated from composts and macrofauna[J]. Microbiological Research, 163(2) : 234–242. DOI:10.1016/j.micres.2006.05.009 |
| [${referVo.labelOrder}] | 姜义帅, 陈灏, 马作敏, 等. 2013. 利用沉水植物生长期收割进行富营养化水体生态管理的实地研究[J]. 环境工程学报, 2013, 7(4) : 1351–1357. |
| [${referVo.labelOrder}] | 金志民, 杨春文, 金建丽, 等. 2009. 镜泊湖水质及富营养化现状调查[J]. 水资源保护, 2009, 25(6) : 56–57. |
| [${referVo.labelOrder}] | Liu Z G, C Li Y C, Zhang S A, et al. 2015. Characterization of phosphate-solubilizing bacteria isolated from calcareous soils[J]. Applied Soil Ecology, 96 : 217–224. DOI:10.1016/j.apsoil.2015.08.003 |
| [${referVo.labelOrder}] | 蓝江林, 朱育菁, 苏明星, 等. 2008. 水葫芦内生细菌的分离与鉴定[J]. 农业环境科学学报, 2008, 27(6) : 2423–2429. |
| [${referVo.labelOrder}] | 李明堂, 郝林琳, 刘梦洋, 等. 2012. 反硝化耐冷菌Acinetobacter johnonii DBP-3的低温除磷特性[J]. 环境科学学报, 2012, 32(7) : 1557–1562. |
| [${referVo.labelOrder}] | 李永庆, 韩邸勇. 2007. 从大量蓝藻出现看新立城水库水环境保护问题[J]. 吉林水利, 2007(12) : 1–2. |
| [${referVo.labelOrder}] | 鲁如坤. 1999. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社 : 176–179. |
| [${referVo.labelOrder}] | 毛志刚, 谷孝鸿, 陆小明, 等. 2014. 太湖东部不同类型湖区底泥疏浚的生态效应[J]. 湖泊科学, 2014, 26(3) : 385–392. |
| [${referVo.labelOrder}] | Park J H, Bolan N, Megharaj, et al. 2011. Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil[J]. Hazard Material, 185(2) : 829–836. |
| [${referVo.labelOrder}] | Pereira S I A, Monteiro C, Vega A L, et al. 2016. Endophytic culturable colonizing Lavandula dentata L[J]. plants:Isolation, characterization and evaluation of their plant growth-promoting activities [J]. Ecological Engineering, 87 : 91–97. |
| [${referVo.labelOrder}] | 潘静赟, 李正魁. 2012. 生物填料-沉水植物联用在河道水强化处理中的应用研究[J]. 环境工程学报, 2012, 6(9) : 2963–2968. |
| [${referVo.labelOrder}] | Porras-Soriano A, Soriano-Martín M L, Porras-Piedra A, et al. 2009. Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance to salinity in olive tress under nursery conditions[J]. Plant Physiology, 166(13) : 1350–1359. DOI:10.1016/j.jplph.2009.02.010 |
| [${referVo.labelOrder}] | 钱兰娟, 李倩, 张清霞, 等. 2011. 生防细菌L5生防相关因子的初步分析及其种类鉴定[J]. 植物病理学报, 2011, 41(3) : 295–300. |
| [${referVo.labelOrder}] | Ryan R P, Germaine K, Franks A, et al. 2008. Bacterial endophytes:recent development and applications[J]. FEMS Microbiology Letters, 278(1) : 1–9. DOI:10.1111/fml.2008.278.issue-1 |
| [${referVo.labelOrder}] | 任万平, 李晓秀, 张汪寿. 2012. 沉积物中磷形态及影响其释放的环境因素研究进展[J]. 环境污染与防治, 2012, 34(9) : 53–60. |
| [${referVo.labelOrder}] | Tamura K, Stecher G, Peterson D, et al. 2013. MEAG6:molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology Evolution, 30(12) : 2725–2729. DOI:10.1093/molbev/mst197 |
| [${referVo.labelOrder}] | 王乐乐, 张国森, 耿超, 等. 2015. 湖尾澡降解双酚A内生菌的分离鉴定及降解特性[J]. 环境科学与技术, 2015, 38(12) : 16–21. |
| [${referVo.labelOrder}] | 王晓洋, 李明堂, 景澄茗, 等. 2015. 植物内生菌在环境污染修复中的应用研究进展[J]. 广州化工, 2015, 43(10) : 8–10. |
| [${referVo.labelOrder}] | 王志伟, 陈永敢, 王庆璨, 等. 2014. 中国植物内生微生物研究的发展和展望[J]. 微生物学通报, 2014, 41(3) : 482–496. |
| [${referVo.labelOrder}] | 卫星, 徐鲁荣, 张丹, 等. 2015. 一株耐硝酸盐的巨大芽孢杆菌溶磷特性研究[J]. 环境科学学报, 2015, 35(7) : 2052–2058. |
| [${referVo.labelOrder}] | 吴睿, 张晓松, 戴江玉, 等. 2014. 3种人工载体净化富营养化水体能力的比较[J]. 湖泊科学, 2014, 26(5) : 682–690. |
| [${referVo.labelOrder}] | Xu J Y, Han Y H, Chen Y S, et al. 2016. Arsenic transformation and plant growth promotion characteristics of As-resistant endophytic bacteria from As-hyperaccumulator Pteris vittata[J]. Chemosphere, 144 : 1233–1240. DOI:10.1016/j.chemosphere.2015.09.102 |
| [${referVo.labelOrder}] | 易艳梅, 黄为一. 2008. 产多糖溶磷细菌对难溶性Ca-P的活化特性[J]. 南京农业大学学报, 2008, 31(2) : 49–54. |
| [${referVo.labelOrder}] | 于婷, 王春红, 张婷婷, 等. 2015. 沙雷氏菌(Serratia marcescens) Yj1的分离鉴定及菌体有机磷降解酶的分离纯化[J]. 生物科技通报, 2015, 31(7) : 180–187. |
| [${referVo.labelOrder}] | 虞伟斌, 杨兴明, 沈其荣, 等. 2010. K3解磷菌的解磷机理及其对缓冲容量的响应[J]. 植物营养与肥料学报, 2010, 16(2) : 354–361. |
| [${referVo.labelOrder}] | 袁桂香, 符辉, 钟家有, 等. 2013. 铵胁迫对狐尾藻(Myriophyllum spicatum)和金鱼藻(Ceratophyl-lum demersum)生物量分配和形态的影响[J]. 湖泊科学, 2013, 25(5) : 729–734. |
| [${referVo.labelOrder}] | 赵小蓉, 林启美, 李保国. 2002. C、N源及C/N比对微生物溶磷的影响[J]. 植物营养与肥料学报, 2002, 8(2) : 197–204. |
| [${referVo.labelOrder}] | 钟传青, 黄为一. 2004. 磷细菌P17对不同来源磷矿粉的溶磷作用及机制[J]. 土壤学报, 2004, 41(6) : 931–937. |
 2016, Vol. 36
2016, Vol. 36


