磺胺类药物是应用最早的一类人工合成的抗菌药物, 属于广谱抗菌药物, 因其抗菌谱广、疗效强、方便安全等优点被广泛用于人体和动物(张芊芊, 2015), 磺胺抗生素在被人或动物服用后, 仅20%~40%能被吸收并发挥药效, 其余大部分药物在1~2 d内以母体或代谢产物形式随排泄物直接排出(刘运涛等, 2014), 含有磺胺类药物的排泄物进入到自然环境或污水处理厂中.由于磺胺类在污水处理厂中去除效率有限, 并不能完全去除, 未经去除的抗生素最终扩散到地表水、地下水或沉积物, 最终对人类健康和环境生态系统造成危害(白杨, 2012).如何将其从环境中有效的去除成为急需解决的研究课题, 对于磺胺嘧啶的去除, 目前除了生化法和高级氧化法之外, 非破坏性的吸附法由于成本低、操作简单以及不产生高毒性降解产物受到青睐(王雪, 2013).
氧化石墨烯, 作为具有单原子层厚度的二维结构的新型碳材料, 由于其具有巨大的比表面积(Yu et al., 2014), 氧化石墨烯的芳基结构也有利于通过π-π堆叠作用对疏水类物质产生相互作用(Tang et al., 2013);因此, 近年来已经有大量研究对氧化石墨烯或氧化石墨烯基复合材料的吸附性能进行研究, Sharma等研究石墨烯及氧化石墨烯对亚甲基蓝的吸附(Sharma et al.., 2013), Ghadim等研究GO对于四环素的最大吸附量为323 mg·g-1, 吸附过程为以物理吸附为主的吸热自发反应, 符合Langmiur模型(Ghadim Ehsan Ezzatpour et al., 2013).但是由于氧化石墨烯在水中粒径小、吸附剂回收困难的特点, 因此可以通过对氧化石墨烯表面负载磁性粒子, 使其能够在外加磁场的作用下达到吸附剂与水体的快速分离.Lin等研究磁性氧化石墨烯对四环素吸附, 其最大吸附量为31.9 mg·g-1(Lin et al., 2013), Tang等研究磁性石墨烯对于喹诺酮的吸附, 最大吸附量为18.22 mg·g-1(Tang et al., 2013).但存在磁性/Fe3O4易损耗而减少材料稳定性, 壳聚糖作为甲壳素的部分脱乙酰基化产物, 由于无刺激性、无毒性, 被广泛的应用于医药、食品、环保以及农业等领域(沈子清, 2014), 通过在磁性石墨烯表面引入壳聚糖, 即可以增大吸附量又可以防止Fe3O4的损耗, 从而增强材料稳定性.
目前三元复合材料的制备中, 范露露等制备磁性氧化石墨烯壳聚糖, 乳化交联的方法, 通过甲醛制备出复合材料(范露露, 2013)、Ye等通过戊二醛的交联作用(Ye et al., 2014)多步制备出磁性壳聚糖/氧化石墨烯, Duan等在交联剂戊二醛的作用下制备β-环糊精改性氧化石墨烯磁性壳聚糖(Duan et al., 2015).已有文献中报道的合成方法采用共沉淀或溶剂热方法首先制备出Fe3O4粒子并对磁性粒子进行包覆, 再利用有机溶剂作为交联剂进行磁性壳聚糖与氧化石墨烯结合, 步骤复杂并且有毒溶剂不够安全环保.因此本文介绍一种简单有效的方法, 一步溶剂热法温和制备氧化石墨烯/磁性壳聚糖复合材料, 并考察了三元材料对磺胺嘧啶的吸附性能.
2 材料与方法(Materials and methods) 2.1 原料所用原料为石墨粉、浓硫酸、高锰酸钾、硝酸钠、浓盐酸、30%H2O2 、六水氯化铁(FeCl3·6H2O)、乙二醇、醋酸钠、乙酸、均购于北京化工厂;磺胺嘧啶、壳聚糖购于阿拉丁试剂(上海)有限公司.所有试剂均为分析纯, 实验用水为去离子水.
2.2 材料制备 2.2.1 氧化石墨烯的制备氧化石墨烯的制备通过改良的hummers方法(Hummers et al., 1958), 向23 mL的浓硫酸中加入1 g的石墨粉, 在室温下搅拌24 h, 然后向其中加入500 mg NaNO3, 静置5 min, 待其完全溶解后, 在冰浴条件下向悬浊液中投加3 g的高锰酸钾, 并保持体系温度不高于20 ℃.此后, 将悬浊液加热至35~40 ℃, 保持30 min后向其中加入3 mL的去离子水, 再过5 min后加入40 mL的去离子水, 然后水浴条件下加热至98 ℃, 保持1 h之后加入100 mL去离子水以及10 mL 30%H2O2以终止反应.在室温下对悬浊液持续搅拌5 min后离心分离, 并用5%的盐酸清洗后用去离子书清洗至中性.随后, 对形成的氧化石墨进行持续30 min的超声剥离, 将剥离后的悬浊液离心分离, 蒸干后即为氧化石墨烯.
2.2.2 磁性壳聚糖/氧化石墨烯的制备0.1 g的GO加入到70 mL的乙二醇中, 通过超声波细胞粉碎仪超声分散20 min形成澄清溶液, 将0.16 g的FeCl3·6H2O加入到混合溶液超声15 min, 再将0.62 g NaOAc·3H2O加入到上述溶液剧烈搅拌20 min, 然后, 加入已经溶解于5 mL(2%)乙酸的0.1 g壳聚糖, 形成的混合溶液搅拌30 min, 放入水热反应釜, 在185 ℃、6 h条件下, 冷却至室温, 乙醇和去离子水洗涤, 50 ℃真空干燥10 h.
2.3 材料表征通过JEM-2100F透射电子显微镜(日本JEOL)观察样品形貌;D8 ADVANCE X射线衍射仪(德国Bruker)测定材料的晶型结构;Spectrum One傅里叶变换红外光谱仪(美国PE)进行材料表面官能团分析;通过PHI5700 ESCA X射线光电子能谱仪(美国物理电子)测定各元素种类和价态;Nano-Z Zeta电位分析仪(英国Malvern)可以测量粒径在3.8 nm~100 μm范围内颗粒的Zeta电位;采用Perkin Elmer Pyris Diamond型热重分析仪(美国Pkerkin-Elmer公司)在空气氛围中10 ℃·min-1升温速率条件下从室温加热至800 ℃, 分析样品各组分含量;磁滞曲线采用振动样品磁强计Squid-VSM(美国量子公司)采用ACQUITY UPLC高效液相色谱仪(美国Waters)测定磺胺嘧啶的浓度, 液相条件:检测波长270 nm, 流动相为乙腈-0.1%甲酸(Shi et al., 2014), 比例为15:85;采用5300DV电感耦合等离子光谱发生仪(美国PE)测量重金属铁离子浓度.
2.4 磺胺嘧啶的吸附实验 2.4.1 吸附动力学向25 mL浓度为20 mg·L -1的磺胺嘧啶溶液中加入30 mg吸附剂, 在吸附过程中, 每个时间隔点(0.5、1、2、4、6、8、12、18、24、28 h)取样, 迅速用磁铁分离吸附剂, 再用0.22 μm的过滤膜过滤后, 通过高效液相色谱仪测定磺胺嘧啶的含量.
2.4.2 吸附等温线和吸附热力学准确称量30 mg的吸附剂和25 mL的磺胺嘧啶溶液, 浓度分别为5、10、20、40、60、80、100 mg·L -1, 加入到50 mL的锥形瓶中, 分别于295、303、313 K以150 r·min-1的速度恒温震荡24 h.用磁铁分离, 取上清液并通过0.22 μm的过滤膜过滤后, 通过高效液相色谱仪进行磺胺嘧啶的测定.
2.4.3 不同pH对吸附的影响分别取25 mL浓度为20 mg·L -1的磺胺嘧啶溶液加入50 mL的锥形瓶中, 向其中加入30 mg的吸附剂, 用0.1 mol·L-1的HCl和0.1 mol·L-1的NaOH溶液将混合液的pH值调至2~9之间, 放入恒温水浴振荡器中, 在303 K以150 r·min-1的速度恒温震荡足够时间, 吸附平衡后用磁铁分离, 取上清液并通过0.22 μm的过滤膜过滤后, 通过高效液相色谱仪进行磺胺嘧的测定.
3 结果与讨论(Results and discussion) 3.1 GO/CS/Fe3O4化学组成、形貌和磁性能分析图 1为CS、GO、GO/CS/Fe3O4的FTIR图谱.GO曲线中几个特征吸收峰说明氧化石墨烯的成功制备, 1618 cm-1的特征吸收峰对应sp2碳骨架结构上C—C键的伸缩振动, 1735和3400 cm-1位置处对应的是—COOH的C—O伸缩振动和O—H伸缩振动(Chen et al., 2014), 1052和1380 cm-1处特征吸收峰分别为C—O—C、C—OH的弯曲振动.GO/CS/Fe3O4的FTIR表征结果显示除了不仅具有丰富的含氧官能团外, 而且在580 cm-1对应的Fe—O特征峰表明Fe3O4在复合材料中的合成(Duan et al., 2015);在1590和1636cm-1两个特征吸收峰分别表示—NHCO—中的—NH2中的N—H弯曲振动和C—O伸缩振动(范露露, 2013), 因为GO不含N, 可以看到复合材料3368 cm-1位置的—NH2吸收峰减弱而—NHCO—的峰得到加强, 说明壳聚糖上的—NH2已经和GO表面的—COOH反应生成—NHCO—, 以及在2954 cm-1处壳聚糖的特征吸收峰, 说明复合材料中壳聚糖的存在.在1380 cm-1位置的C—OH振动吸收峰由于壳聚糖的覆盖作用使其吸收强度减弱.
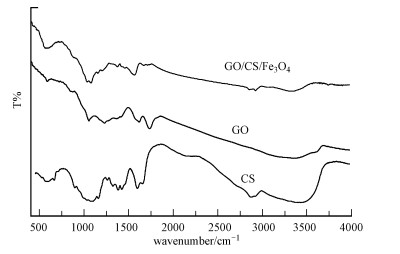 |
| 图 1 CS、GO、GO/CS/Fe3O4的FTIR图 Fig. 1 FTIR spectra of CS、GO、GO/CS/Fe3O4 |
图 2为CS、GO、GO/CS/Fe3O4的XRD图谱.出现在15°~30°区间较宽的峰是无定形态的壳聚糖(CS)样品的衍射峰;GO/CS/Fe3O4复合材料中与Fe3O4的出现衍射峰位置相符, Fe3O4 6个衍射峰为(2θ=30.2°, 35.5°, 43.2°, 53.4°, 57.3°和62.7°)(Kong et al., 2011), 符合标准的Fe3O4 X射线衍射数据, 说明复合材料中包含四氧化三铁磁性粒子.
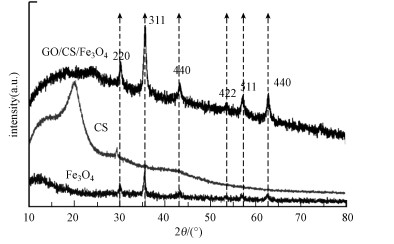 |
| 图 2 CS、Fe3O4、GO/CS/Fe3O4的XRD图 Fig. 2 XRD patterns of CS、GO、GO/CS/Fe3O4 |
图 3a、3b分别为GO/CS/Fe3O4的XPS表征图以及Fe2p能谱图, 通过XPS对SGO/CS/Fe3O4元素种类进行分析并且进一步确定磁性复合材料中Fe元素的价态.在图 3a中285和530 eV的电子结合能位置的特征峰峰对应的是C1s和O1s(Li et al., 2012), 在710 eV结合能附近显著的特征峰对应的是GO/CS/Fe3O4中的Fe2p, 证明了复合材料中碳、氧和铁元素的存在.图 3b为GO/CS/Fe3O4中的Fe2p能谱图, 在电子结合能分别为711.12和724.79 eV的位置有两个独立的响应特征峰, 分属Fe2p3/2和Fe2p1/2(Sun et al., 2015), 而γ-Fe2O3的Fe2p3/2和Fe2p1/2电子结合能分别为710.34和724.02 eV, 该结果证明了制备的复合材料中磁性粒子不是以γ-Fe2O3晶相存在而是以Fe3O4晶相形式存在.
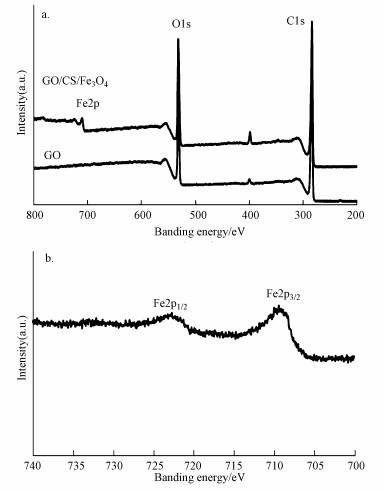 |
| 图 3 GO/CS/Fe3O4的XPS谱图(a), GO/CS/Fe3O4的Fe2p能谱图(b) Fig. 3 XPS spectra of (a) wide scan of GO/CS/Fe3O4, (b)Fe2p of GO/CS/Fe3O4 |
图 4为GO/CS/Fe3O4的热重分析图.测试时在空气氛围中从室温逐渐升温到800 ℃, 升温速率为10 ℃·min-1, 从室温加热到165 ℃的质量损失为材料中表面水和结合水的失重;从165至325 ℃的质量损失为壳聚糖的失重, 在285 ℃壳聚糖分解速率达到最大(侯文龙等, 2013), 壳聚糖的聚合物单元裂解, 进行分解燃烧, 含量大约为16.19%;从325到410 ℃的质量损失为氧化石墨烯含氧官能团的燃烧导致, 从410到800 ℃的质量变化由于石墨烯碳骨架的燃烧, 氧化石墨烯的含量大约为21.66%, 其余的为四氧化三铁的含量, 大约为17.54%.
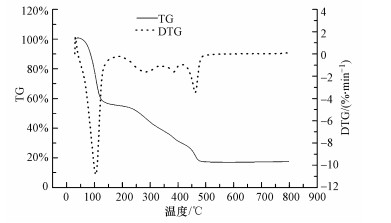 |
| 图 4 GO/CS/Fe3O4的TGA分析曲线 Fig. 4 Thermo gravimetric analysis (TGA) of GO/CS/Fe3O4 |
图 5为GO/CS/Fe3O4的TEM图, 从图中可以看出通过改良的hummers方法制备的氧化石墨烯呈二维的片层结构.四氧化三铁粒子均匀负载于氧化石墨烯表面, 这是由于四氧化三铁晶核生长过程以氧化石墨烯表面的含氧官能团作为成核位点, 并且形成的磁性纳米颗粒的直径大约为10 nm, 通过放大图观察到四氧化三铁粒子表面覆盖有壳聚糖.
 |
| 图 5 GO/CS/Fe3O4的TEM图像 Fig. 5 TEM images of the Graphene oxide/magnetite chitosan nanocomposite |
图 6为GO/CS/Fe3O4的磁滞回线, 如图所示磁滞曲线呈典型的S型, 该磁性复合材料的磁饱和强度为20.91 emu·g-1, 与Tang等制备的RGO/Fe3O4的磁饱和强度为12.6 emu·g-1(Tang et al., 2013), Duan等制备的环糊精改性壳聚糖磁性氧化石墨烯饱和磁化强度为18.9 emu·g-1(Duan et al., 2015)相比, 表明制备出来的磁性复合材料具有很强的磁性.并且磁滞回线过原点, 且以原点为中心, 几乎没有剩磁现象, 表明氧化石墨烯/磁性壳聚糖具有优良的磁性能.图 6中为GO/CS/Fe3O4水中分散图以及磁分离效果实验现象图.从图中可以看到氧化石墨烯/磁性壳聚糖吸附剂在水中可以有较好的分散效果, 并且在外加磁场的作用下, 可以在10 s完成吸附剂与水体的快速分离, 撤掉外加磁场后摇匀混合水体, 复合材料又能良好分散于水溶液中, 说明复合材料具有良好的磁性和在水中易于分散的特点.将磁分离后的液体经硝酸处理后, 用ICP-OES进行检测, 结果表明液体中未检出铁离子, 说明壳聚糖的引入增强了复合材料的稳定性, 并且由于壳聚糖相对于十二烷基苯磺酸钠(Zhu et al., 2011)具有无刺激性、无毒性的优点使复合材料具有良好的应用前景.
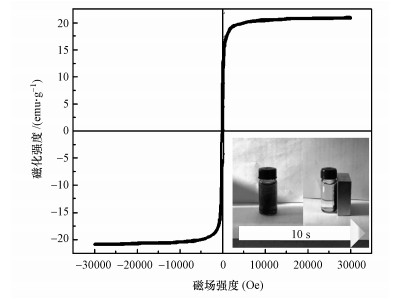 |
| 图 6 GO/CS/Fe3O4的磁滞曲线 Fig. 6 The magnetization hysteresis loop of GO/CS/Fe3O4 |
图 7为不同温度下吸附剂对磺胺嘧啶吸附动力学影响, 从图中可以看到随着温度的升高, 吸附剂对磺胺嘧啶的吸附平衡时间缩短, 在313 K时, 只需要12 h就可以达到吸附平衡, 说明吸附反应为吸热反应, 温度升高有利于吸附反应的进行.
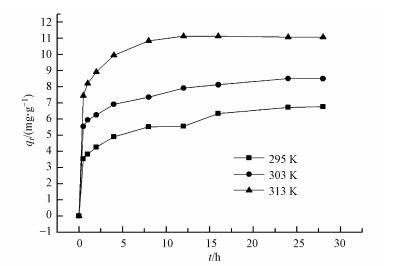 |
| 图 7 不同温度下GO/CS/Fe3O4对磺胺嘧啶吸附动力学影响 Fig. 7 The effect of temperature for sulfadiazine sorption onto GO/CS/Fe3O |
本研究分别使用拟一级和拟二级吸附反应速率模型对不同温度下GO/CS/Fe3O4吸附磺胺嘧啶的动力学进行模拟.拟一级动力学公式和拟二级动力学公式如下:
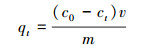
|
(1) |
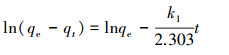
|
(2) |
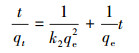
|
(3) |
式中, c0和ct分别为初始溶液中磺胺嘧啶的浓度和t时刻溶液中磺胺嘧啶的浓度, v是溶液体积, m是吸附剂质量;qe和qt分别为平衡吸附能力和t时刻的吸附能力, k1 、k2为拟一级、拟二级反应速率常数, h(k2qe2)为初试吸附速率.
拟合后所得到的曲线和模型参数如图 8和表 1所示, 拟一级动力学拟合后的直线相关性r12与1相差较大, 而拟二级动力学相关性r22接近1, 说明GO/CS/Fe3O4吸附磺胺嘧啶更加符合拟二级动力学吸附模型, 并且h值随着温度的升高而增大, 即吸附初速率增加, 说明吸附过程为吸热反应, 温度升高有利于反应的进行.
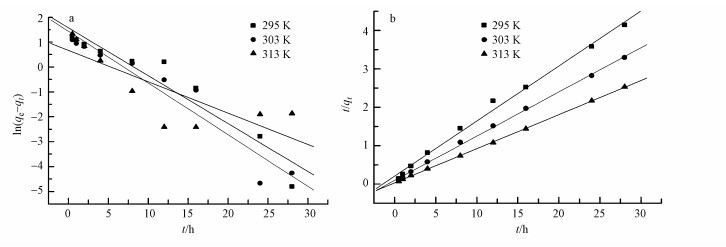 |
| 图 8 不同温度下GO/CS/Fe3O4吸附磺胺嘧啶的拟一级(A)、拟二级(B)动力学模型 Fig. 8 Pseudo first-order (A) and Pseudo second-order (B)kinetic model for sulfadiazine sorption onto GO/CS/Fe3O4 at various temperatures |
| 表 1 不同温度下GO/CS/Fe3O4吸附磺胺嘧啶的吸附动力学模型参数 Table 1 Adsorption kinetic model rate constants for sulfadiazine sorption onto GO/CS/Fe3O4 at different temperatures |
阿伦尼乌斯方程可用来计算吸附反应的活化能, 其表达式如下:
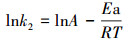
|
(4) |
式中, k2为假二级反应速率常数(g·mg-1·min-1), A为指前因子, Ea为反应活化能, R(8.314 J·mol-1·K-1)为理想气体常数(J·mol-1), T绝对热力学温度(K).以lnk2对1/T作图, 由直线的斜率确定GO/CS/Fe3O4吸附水中磺胺嘧啶的吸附活化能Ea为37.49 kJ·mol-1.这说明此吸附过程中物理吸附占主导地位.
3.4 吸附等温线本研究采用Langmuir、Freundlich、Temkin 3种等温线模型拟合吸附实验数据, 进而研究吸附平衡时吸附质分子在液相和固相中的分配.3种等温线方程表达式如下:
Langmuir:
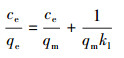
|
(5) |
Freundlich:
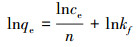
|
(6) |
Temkin:
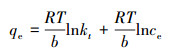
|
(7) |
式中, Ce(mg·L-1)为吸附平衡浓度, qe和qm分别为平衡和最大吸附量, Kf和n 均是吸附模型Freundlich常数(mg·g-1).KL为Langmuir等温线常数(L·mg-1).以Ce/qe对Ce作图, 由斜率和截距分别确定qm和KL.
Langmuir等温线模型为理想模型, 吸附为单层吸附, 吸附中心作用力相同, 被吸附的分子或原子之间不存在相互作用, Freundlich模型假设吸附剂表面能量是不均匀的, Temkin等温线用于描述基于正负电荷的静电力的化学吸附过程, 拟合后的模型如图 9所示, 模型参数见表 2.比较各个模型拟合后的参数, 由于Langmuir的R2比其他等温线模型拟合度高, 所以GO/CS/Fe3O4对磺胺嘧啶的吸附过程更适合用Langmuir等温线模型描述, 即磺胺嘧啶在吸附剂表面为单层吸附, 通常认为氧化石墨烯与芳香族类化合物以π-π堆叠作用作为吸附的主导作用(Wang et al., 2013), 并且在295、303、313 K时最大吸附量为分别为53.30、60.56、79.23 mg·g-1.有些研究者制备的磁性碳复合材料对磺胺嘧啶最大吸附量为28.57 mg·g-1(毛景2013), GO/Fe3O4对强力霉素的最大吸附量为45.5 mg·g-1(Lin et al., 2013), TCPP/Fe3O4-GO对磺胺嘧啶最大吸附量为28.3 mg·g-1(Shi et al., 2015), 与文献报道中其他吸附剂对磺胺嘧啶最大吸附量相比, 本研究中GO/CS/Fe3O4对磺胺嘧啶最大吸附量增加, 原因是该复合材料为二维平面结构与磁性碳材料相比具备不容易发生孔道堵塞的优点以及壳聚糖的加入使其吸附量增加.从材料经济性分析, 在二元磁性氧化石墨烯材料的基础上增加的壳聚糖成本为0.44元·g-1, 综合考虑磺胺嘧啶吸附量和壳聚糖的经济性, 本研究所提出的制备方法在成功地控制了材料成本的前提下最大程度的提高了材料的吸附性能.
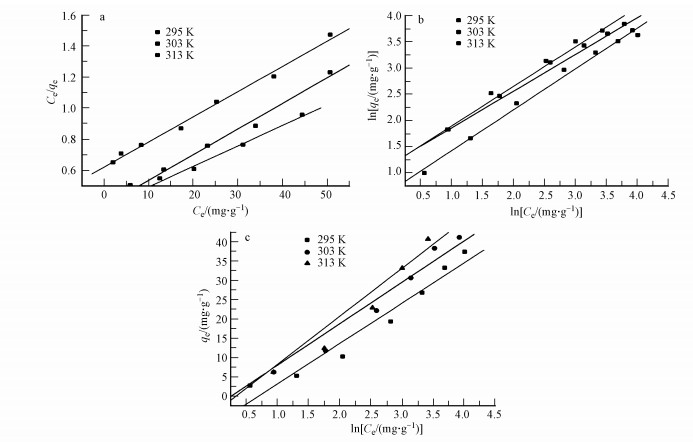 |
| 图 9 GO/CS/Fe3O4对磺胺嘧啶Langmuir(a), Freundlich(b), Temkin(c)等温线模型 Fig. 9 Linearized Langmuir (a), Freundlich (b), and Temkin (c) isotherms for sulfadiazine sorption onto GO/CS/Fe3O4 at different temperatures |
| 表 2 GO/CS/Fe3O4吸附磺胺嘧啶Langmuir, Freundlich, Temkin等温线模型参数 Table 2 Langmuir, Freundlich, and Temkin isotherm model parameters for adsorption of sulfadiazine on GO/CS/Fe3O4 |
此外, 通过Freundlich等温线拟合后得到n均大于1, 说明吸附过程易于进行.Temkin等温线模型有较好的拟合度, 说明GO/CS/Fe3O4吸附磺胺嘧啶过程中存在静电力的作用.
3.5 吸附热力学热力学可以描述GO/CS/Fe3O4吸附磺胺嘧啶过程的能量变化, 通过吸附热力学分析可以了解吸附过程的驱动力和方向, 推断和了解吸附过程中的微观变化.根据van′t Hoff方程:
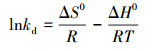
|
(8) |
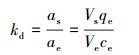
|
(9) |
式中ΔH0表示标准焓变(kJ·mol-1), ΔS0表示标准熵变(kJ·mol-1·K-1).以lnKd对1/T作图得到拟合线, 由直线斜率和截距确定ΔH0和ΔS0值.as和ae分别为吸附质在吸附平衡时于吸附剂相和溶液相中的活性; Vs和Ve分别为吸附剂在相应两相中的活性系数.当吸附质在溶液中的浓度接近为零时, Vs和Ve近似一致, 则Kc (L·g-1)为吸附平衡时吸附质在吸附剂上的吸附量和溶液中的浓度ce的比值(巢艳红, 2014):
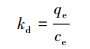
|
(10) |
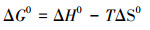
|
(11) |
以lnKd对1/T作图得到拟合线, 由直线斜率和截距确定ΔH0和ΔS0值.根据式(9)可计算出ΔG0的值, 不同温度下热力学参数见表 3.从表 3中可以看到, 所有温度下ΔG0均小于零, 并且随着温度升高吉布斯自由能的绝对值增大, 说明该吸附过程为自发的吸热反应, 并且随着温度升高, 自发趋势增加.化学吸附的吸附热与一般化学反应的热效应相同, 在40~400 kJ·mol-1之间, GO/CS/Fe3O4吸附磺胺嘧啶的ΔH0为24.79 kJ·mol-1, 小于40 kJ·mol-1说明物理吸附存在于GO/CS/Fe3O4吸附磺胺嘧啶的过程中;ΔS0为0.09 kJ·mol-1·K-1, 正值表示该吸附为不可逆的吸附过程.
| 表 3 不同温度下GO/CS/Fe3O4吸附磺胺嘧啶热力学参数 Table 3 Thermodynamic parameters for adsorption of sulfadiazine sorption onto GO/CS/Fe3O4 at different temperatures |
由于磺胺嘧啶为两性化合物, 随溶液pH值变化在水中的存在形态有阳离子形态、中性分子形态和阴离子形态(孔晶晶等, 2008), 同时溶液pH值也会影响吸附剂表面电性.本研究设置pH值变化范围为2~9时, 通过吸附剂Zeta电位和对磺胺嘧啶吸附量变化关系, 考察静电作用是否存在于GO/CS/Fe3O4与磺胺嘧啶之间.图 10中可以看到不同pH值下GO/CS/Fe3O4的Zate电位发生变化, GO/CS/Fe3O4的等电点为7.2.在pH值介于2~7.2时, 氧化石墨烯/磁性壳聚糖表面带正电, pH值介于7.2~9时, 氧化石墨烯/磁性壳聚糖表面带负电.当pH < 7.2时, 由于吸附剂表面壳聚糖上主链丙烯酸脂的羧酸盐发生质子化(Sereshti et al., 2015), 使其表面带正电, 当pH>7.2时, 其表面官能团发生去质子化, 使吸附剂表面带负电.图 10中磺胺嘧啶吸附量显示先增加后逐渐减小的趋势, 磺胺嘧啶吸附量在8.24~10.10 mg·g-1, 在pH=3时qm=10.10 mg·g-1为最大吸附量.这是由于磺胺嘧啶的pKa1=1.57, pKa2=6.5(Kazemi et al., 2016), 当溶液pH值大于pKa1时, 部分磺胺嘧啶发生去质子化反应, 存在形态为中性分子和阴离子形态, 由于此时吸附剂表面带正电并且Zeta电位值最大, GO/CS/Fe3O4与磺胺嘧啶分子间静电吸附作用使其吸附量增加;随着溶液pH大于3, GO/CS/Fe3O4Zeta电位值逐渐减小, 使吸附量逐渐降低.当溶液pH值大于pKa2, 磺胺嘧啶分子发生去质子化反应全部以阴离子形态存在, 此时GO/CS/Fe3O4表面Zeta电位为负电, 磺胺嘧啶与吸附剂之间存在静电排斥, 同时抑制吸附剂与吸附质的π-π堆叠作用, 导致吸附剂对磺胺嘧啶吸附量减小.此外, 有文献报道认为氧化石墨烯对芳香环类有机物的吸附作用机制主要为π-π电子共轭作用和范德华力作用(Yu et al., 2015).已有研究证明氧化石墨烯通过较强的π-π电子共轭作用吸附磺胺嘧啶(Shi et al., 2015)、四环素(Lin et al., 2013)、喹诺酮类以及苯系化合物(徐婧, 2013).GO/CS/Fe3O4复合材料中由于氧化石墨烯片层结构中也存在大量的可移动π电子, 可通过π-π电子共轭作用与磺胺嘧啶分子苯环中的大π键形成较强结合力, 增强吸附作用.即π-π电子共轭效应及静电吸附是复合材料对磺胺嘧啶的吸附过程的主导作用力.
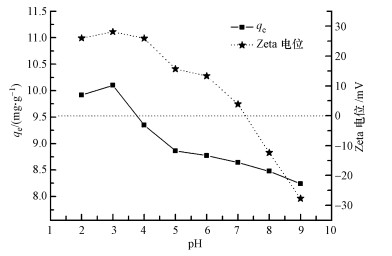 |
| 图 10 不同pH下GO/CS/Fe3O4的Zeta电位和磺胺嘧啶吸附量关系曲线 Fig. 10 The surface charge of GO/CS/Fe3O4 and sulfadiazine adsorption capacity onto GO/CS/Fe3O4 with the different pH |
所以, 结合图 10可以看出当pH=3时Zeta电位正值最大, 此时静电力作用最强;随着pH增大Zeta电位正值逐渐减小, 吸附剂当pH>6时, Zeta电位迅速降低, 降至pH=7.2之后时复合材料带负电, 吸附剂与磺胺嘧啶存在静电排斥作用, 而此时吸附量的存在则是由于π-π电子共轭作用.说明当pH < 3时, 静电力在吸附过程中占主导地位;当3 < pH < 7.2时, 吸附过程是由静电力与π-π电子共轭作用共同控制;当pH>7.2时, 说明π-π电子共轭作用则成为控制吸附过程的主导因素.综上所述, 若待处理水体中离子态污染物成分较高的情况, 可以通过将pH控制在7.2以上, 从而使得复合材料通过利用π-π电子共轭作用选择性吸附芳香类有机物实现其对磺胺嘧啶的吸附;若待处理水体中非离子态有机污染物浓度较高, 可以通过将pH控制在酸性条件, 使复合材料带正电, 利用静电力作用吸附磺胺嘧啶.
4 结论(Conclusions)1) 通过一步溶剂热法制备出GO/CS/Fe3O4三元复合材料, 复合材料具有丰富的含氧官能团, 氧化石墨烯片层上均匀负载四氧化三铁磁性粒子, 并且直径大约为10 nm, 磁性粒子上覆盖壳聚糖, 在外加磁场的作用下, 磁性材料具有良好的磁分离效果.
2) 通过不同pH条件下吸附剂Zeta电位分析和对磺胺嘧啶吸附量分析吸附机理, 证明π-π电子共轭效应及静电吸附是复合材料吸附磺胺嘧啶过程中的主导作用力.
3) 吸附动力学实验表明, GO/CS/Fe3O4对磺胺嘧啶的吸附过程符合拟二级动力学模型, 温度为313 K时, 12 h达到吸附平衡, 平衡吸附量为11.15 mg·g-1;吸附等温线模型符合Langmuir, 为单层吸附, 在295、303、313 K温度下, 最大吸附量分别为53.30、60.56、79.2 mg·g-1;热力学参数表明吸附反应是以物理吸附为主的自发的吸热反应.
| [${referVo.labelOrder}] | 白杨. 2012.污水厂中磺胺类抗生素的去除效率与残留特征[D].哈尔滨:哈尔滨工程大学 http://cdmd.cnki.com.cn/article/cdmd-10217-1012517742.htm |
| [${referVo.labelOrder}] | 巢艳红. 2014.几种新型吸附剂的设计、制备及其对水中抗生素污染物的吸附性能研究[D].镇江:江苏大学 http://cdmd.cnki.com.cn/article/cdmd-10299-1015551844.htm |
| [${referVo.labelOrder}] | Chao Y, Zhu W, Wu X, et al. 2014. Application of graphene-like layered molybdenum disulfide and its excellent adsorption behavior for doxycycline antibiotic[J]. Chemical Engineering Journal , 243 (5) : 60–67. |
| [${referVo.labelOrder}] | Duan H, Li L, Wang X, et al. 2015. β-Cyclodextrin/chitosan-magnetic graphene oxide-surface molecularly imprinted polymer nanocomplex coupled with chemiluminescence biosensing of bovine serum albumin[J]. RSC Advances , 5 (84) : 68397–68403. DOI:10.1039/C5RA11061K |
| [${referVo.labelOrder}] | 范露露.2013.基于壳聚糖的磁性吸附剂的制备及在水处理中的应用[D].济南:济南大学 http://cdmd.cnki.com.cn/article/cdmd-10427-1014162036.htm |
| [${referVo.labelOrder}] | Ghadim E E, Manouchehri F, Soleimani G, et al. 2013. Adsorption properties of tetracycline onto graphene oxide: equilibrium, kinetic and thermodynamic studies[J]. PloS One , 8 (11) : e79254–e79254. DOI:10.1371/journal.pone.0079254 |
| [${referVo.labelOrder}] | 侯文龙, 杨婷, 杨越冬.2013. 马来酰化壳聚糖的红外光谱与热重分析[J]. 理化检验(化学分册) , 2013, 10 : 1163–1165. |
| [${referVo.labelOrder}] | Hummers Jr W S, Offeman R E. 1958. Preparation of graphitic oxide[J]. Journal of the American Chemical Society , 80 (6) : 1339–1339. DOI:10.1021/ja01539a017 |
| [${referVo.labelOrder}] | Kazemi E, Dadfarnia S, Shabani A M H, et al. 2016. Iron oxide functionalized graphene oxide as an efficient sorbent for dispersive micro-solid phase extraction of sulfadiazine followed by spectrophotometric and mode-mismatched thermal lens spectrometric determination[J]. Talanta , 147 : 561–568. DOI:10.1016/j.talanta.2015.10.033 |
| [${referVo.labelOrder}] | 孔晶晶, 裴志国, 温蓓, 等.2008. 磺胺嘧啶和磺胺噻唑在土壤中的吸附行为[J]. 环境化学 , 2008, 27 (6) : 736–741. |
| [${referVo.labelOrder}] | Kong L R, Lu X F, Bian X J, et al. 2011. Constructing carbon-coated Fe3O4microspheres as antiacid and magnetic support for palladium nanoparticles for catalytic applications[J]. ACS Applied Materials & Interfaces , 3 (1) : 35–42. |
| [${referVo.labelOrder}] | Li J, Zhang S W, Chen C L, et al. 2012. Removal of Cu(II) and Fulvic Acid by Graphene Oxide Nanosheets Decorated with Fe3O4 Nanoparticles[J]. ACS Applied Materials & Interfaces , 4 (9) : 4991–5000. |
| [${referVo.labelOrder}] | Lin Y X, Xu S, Li J. 2013. Fast and highly efficient tetracyclines removal from environmental waters by graphene oxide functionalized magnetic particles[J]. Chemical Engineering Journal , 225 (6) : 679–685. |
| [${referVo.labelOrder}] | 刘运涛, 杨力, 蒋心科, 等.2014. 活性炭对磺胺嘧啶的吸附行为研究[J]. 农业与技术 , 2014, 34 (3) : 241–243. |
| [${referVo.labelOrder}] | 毛景. 2013.高比表面积磁性碳材料的制备以及对磺胺类抗生素的吸附性能研究[D].南京:南京理工大学 http://cdmd.cnki.com.cn/article/cdmd-10288-1013166006.htm |
| [${referVo.labelOrder}] | Chen M L, Min J Q, Pan S D, et al. 2014. Surface core-shell magnetic polymer modified graphene oxide-based material for 2, 4, 6-trichlorophenol removal[J]. RSC Advances , 4 (108) : 63494–63501. DOI:10.1039/C4RA14150D |
| [${referVo.labelOrder}] | Qin S L, Su L Q, Wang P, et al. 2015. Rapid and selective extraction of multiple sulfonamides from aqueous samples based on Fe3O4-chitosan molecularly imprinted polymers[J]. Analytical Methods , 7 (20) : 8704–8713. DOI:10.1039/C5AY01499A |
| [${referVo.labelOrder}] | Sereshti H, Samadi S, Asgari S, et al. 2015. Preparation and application of magnetic graphene oxide coated with a modified chitosan pH-sensitive hydrogel: an efficient biocompatible adsorbent for catechin[J]. RSC Advances , 5 (13) : 9396–9404. DOI:10.1039/C4RA11572D |
| [${referVo.labelOrder}] | Sharma P, Hussain N, Borah D J, et al. 2013. Kinetics and Adsorption Behavior of the Methyl Blue at the Graphene Oxide/Reduced Graphene Oxide Nanosheet-Water Interface: A Comparative Study[J]. Journal of Chemical & Engineering Data , 58 (12) : 3477–3488. |
| [${referVo.labelOrder}] | Sheshmani S, Ashori A, Hasanzadeh S. 2014. Removal of Acid Orange 7 from aqueous solution using magnetic graphene/chitosan: A promising nano-adsorbent[J]. International Journal of Biological Macromolecules , 68 (7) : 218–224. |
| [${referVo.labelOrder}] | Shi P, Ye N. 2014. Magnetite-graphene oxide composites as a magnetic solid-phase extraction adsorbent for the determination of trace sulfonamides in water samples[J]. Analytical Methods , 6 (24) : 9725–9730. DOI:10.1039/C4AY02027H |
| [${referVo.labelOrder}] | Shi P, Ye N. 2015. Investigation of the adsorption mechanism and preconcentration of sulfonamides using a porphyrin-functionalized Fe3O4 -graphene oxide nanocomposite[J]. Talanta , 143 : 219–225. DOI:10.1016/j.talanta.2015.05.013 |
| [${referVo.labelOrder}] | Sun J P, liang Q L L, Han Q, et al. 2015. One-step synthesis of magnetic graphene oxide nanocompositeand its application in magnetic solid phase extraction of heavy metal ions from biological samples[J]. Talanta , 132 : 557–563. DOI:10.1016/j.talanta.2014.09.043 |
| [${referVo.labelOrder}] | Tang Y L, Guo H G, Xiao L, et al. 2013. Synthesis of reduced graphene oxide/magnetite composites and investigation of their adsorption performance of fluoroquinolone antibiotics[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects , 424 (17) : 74–80. |
| [${referVo.labelOrder}] | 沈子清. 2014.纳米磁性壳聚糖吸附剂的制备及其性能研究[D].上海:上海交通大学 |
| [${referVo.labelOrder}] | Wang T S, Liu Z H, Lu M M, et al. 2013. Graphene-Fe3O4 nanohybrids: Synthesis and excellent electromagnetic absorption properties[J]. Journal of Applied Physics , 113 (2) : 024314–024314. DOI:10.1063/1.4774243 |
| [${referVo.labelOrder}] | 王雪. 2013.磁性石墨烯复合材料的制备及在持久性污染物处理中的应用[D].武汉:湖北大学 http://cdmd.cnki.com.cn/article/cdmd-10512-1013379095.htm |
| [${referVo.labelOrder}] | 徐婧.2013.高比表面共轭材料的合成和环境净化性能研究[D].北京:清华大学 http://cdmd.cnki.com.cn/article/cdmd-10003-1014020767.htm |
| [${referVo.labelOrder}] | Ye N S, Xie Y L, Shi P Z, et al. 2014. Synthesis of magnetite/graphene oxide/chitosan composite and its application for protein adsorption[J]. Materials Science & Engineering C , 45 (45) : 8–14. |
| [${referVo.labelOrder}] | Yu J G, Yu L Y, Yang H, et al. 2015. Graphene nanosheets as novel adsorbents in adsorption, preconcentration and removal of gases, organic compounds and metal ions[J]. Science of the Total Environment , 502 : 70–79. DOI:10.1016/j.scitotenv.2014.08.077 |
| [${referVo.labelOrder}] | 张芊芊. 2015.中国流域典型新型有机污染物排放量估算、多介质归趋模拟及生态风险评估[D].广州:中国科学院研究生院(广州地球化学研究所) http://www.cnki.com.cn/Article/CJFDTOTAL-DQHJ201303003.htm |
 2016, Vol. 36
2016, Vol. 36


