2. 中国海洋大学环境科学与工程学院, 青岛 266100
2. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100
大气沉降是陆源物质进入海洋的重要途径,其携带的化学组分对海洋生态系统有着极其重要影响(Jickells et al.,2005;Moore et al.,2013).一方面,大气物质沉降可以为海洋浮游植物提供可利用的N、P营养盐及Fe、Zn等痕量元素,促进其生长(Duce et al.,2008;Mahowald et al.,2008),另一方面,其携带的Cu、Ni、Pb等重金属和一些有毒有害的有机化合物可能产生毒性作用,从而抑制浮游植物生长(Paytan et al.,2009;Echeveste et al.,2010).已有研究显示,大气物质沉降与海洋初级生产力之间具有相关关系,如Tan等(2011)利用卫星资料发现1998—2008年亚洲沙尘爆发频率与南黄海和东海的叶绿素、初级生产力之间有显著的相关性.Shi等(2012;2013)利用现场观测数据发现伴随降雨的强沙尘暴事件与黄海春季水华的发生具有因果关系.在黄海和红海进行的现场培养实验发现沙尘或者雨水添加能够促进浮游植物的生长,但有时也会抑制浮游植物的生长(Liu et al.,2013;Paytan et al.,2009).可见,海洋初级生产过程对大气物质沉降的响应复杂.目前有关大气物质沉降对海洋浮游植物生长的促进作用已有一定认识,但抑制作用的研究结果较少,且无论促进或抑制作用的机理均不明确.
黄海是西北太平洋的陆架边缘海,毗邻东亚大陆,处于亚洲沙尘源区和华北城市群的下风带上,不仅是中国近海中受沙尘影响概率最大的海区(Zhang and Gao,2007),而且也受到陆源大气污染物的显著影响(Zhang et al.,2007),尤其是近年来京津冀地区重污染及灰霾天气频繁出现,携带大量污染物的灰霾颗粒沉降入海后可能会对黄海生态系统带来负面影响.因此,本文利用2014年春季黄海航次,开展了沙尘和灰霾添加的现场培养实验,以认识沙尘和灰霾颗粒沉降对海洋浮游植物生长影响的异同及其可能的作用机理.
2 实验部分(Experimental methods) 2.1 培养装置与实验方案于2014年4月29日—5月18日随“东方红2号”科学调查船在南黄海北部B07站(36°59.95′N,123°10.21′E)和中部H10站(34.96°57.86′N,124°00.10′E)开展了2次船基围隔培养实验(图 1).培养周期分别为9 d和10 d.培养实验共设计了8组(表 1),所添加的沙尘和营养盐浓度参照文献(Liu et al.,2013),每组设2个平行样,在16个20 L聚碳酸酯培养桶(Nalgene)中完成.使用Sea Bird 911-CTD采水器采集表层海水,经200 μm筛绢过滤后分装到各培养桶中,并分别添加沙尘、灰霾颗粒以及不同种类的营养盐混合均匀.培养桶置于循环水槽内,利用现场表层海水循环实现控温培养.培养过程中,B07站培养实验的温度为8~10 ℃;H10站的为11~14 ℃.于培养的第0 d及第2 d至培养结束的每天早8:00取样分析.每次分别在每个培养桶中取150 mL水样经0.45 μm酸洗过的醋酸纤维滤膜过滤,滤液于-20 ℃冷冻保存用于营养盐分析;取200 mL水样经GFF膜过滤,滤膜用于总叶绿素分析;取300 mL水样依次经过20、2、0.2 μm孔径的滤膜过滤,滤膜用于分级叶绿素的分析.叶绿素样品膜用90%丙酮萃取后采用Trilogy叶绿素荧光仪在现场进行测定,营养盐样品带回实验室采用QuAAtro营养盐自动分析仪进行测定.文中讨论的叶绿素和营养盐浓度为2个平行样品的平均值.
 |
| 图 1 培养实验期间船舶的航迹(注:箭头表示船舶航行方向,星号和三角分别代表H10和B07站位的培养实验,其中红色符号分别代表 2个取水站位(培养的第0 d),黑色星号/三角+数字1~10代表相应站位培养实验进行的天数及船舶到达的位置,背景为培养期间海表温度) Fig. 1 Cruise track of the incubation experiment |
| 表 1 船基围隔培养实验参数 Table 1 Treatment to the microcosm experimental bottles |
培养实验中,所用沙尘为2011年5月在内蒙古浑善达克沙地(42°22′28″N,112°58′34″E)采集的表层土壤,经20 μm筛网过筛后在实验室进行了人工老化处理(Guieu et al.,2010);灰霾颗粒为2014年1月16日青岛灰霾天时(PM2.5=141)采集的总悬浮颗粒物.沙尘和灰霾颗粒中营养盐浓度采用ICS-1100离子色谱仪(美国戴安公司)进行分析,溶解态的Fe、Cu、Zn等微量元素浓度采用7500c ICP-MS(美国安捷伦公司)进行分析(贲孝宇等,2015;Wang et al.,2013).比较沙尘和灰霾颗粒的化学组成,可以看出灰霾颗粒中溶出的氮组分浓度远高于沙尘中的浓度,PO43-浓度在沙尘和灰霾颗粒中均很低.沙尘颗粒中溶解态Fe的浓度明显高于灰霾颗粒,但Cu、Zn、Pb、As等人为污染元素浓度远低于灰霾颗粒(表 2).
| 表 2 沙尘和灰霾颗粒中营养盐和溶解态微量元素的浓度 Table 2 Concentrations of nutrients and dissolved trace metals in dust and haze particles |
分别于2014年4月29日和5月9日在H10站和B07站取表层水开始培养实验,B07站初始NO3-+NO2-和PO43-浓度分别为3.20 μmol·L-1和0.10 μmol·L-1,明显高于H10站,2个站位的N/P差别很大,分别为32和9(表 3).B07站和H10站初始叶绿素a浓度为1.78和2.59 μg·L-1,B07站低于H10站,但二者均高于2007年南黄海春季未发生水华时的浓度0.1~0.8 μg·L-1(Ren et al.,2011).B07站以微微型浮游植物占主导,为50.6%,其次是微型浮游植物为35.7%,小型浮游植物仅占13.7%;H10站微微型和微型浮游植物贡献相当,约为36%,小型浮游植物的贡献略低,约为27%.
| 表 3 培养实验站位的初始状况 Table 3 Initial parameters of the incubation experiments at B07 and H10 stations |
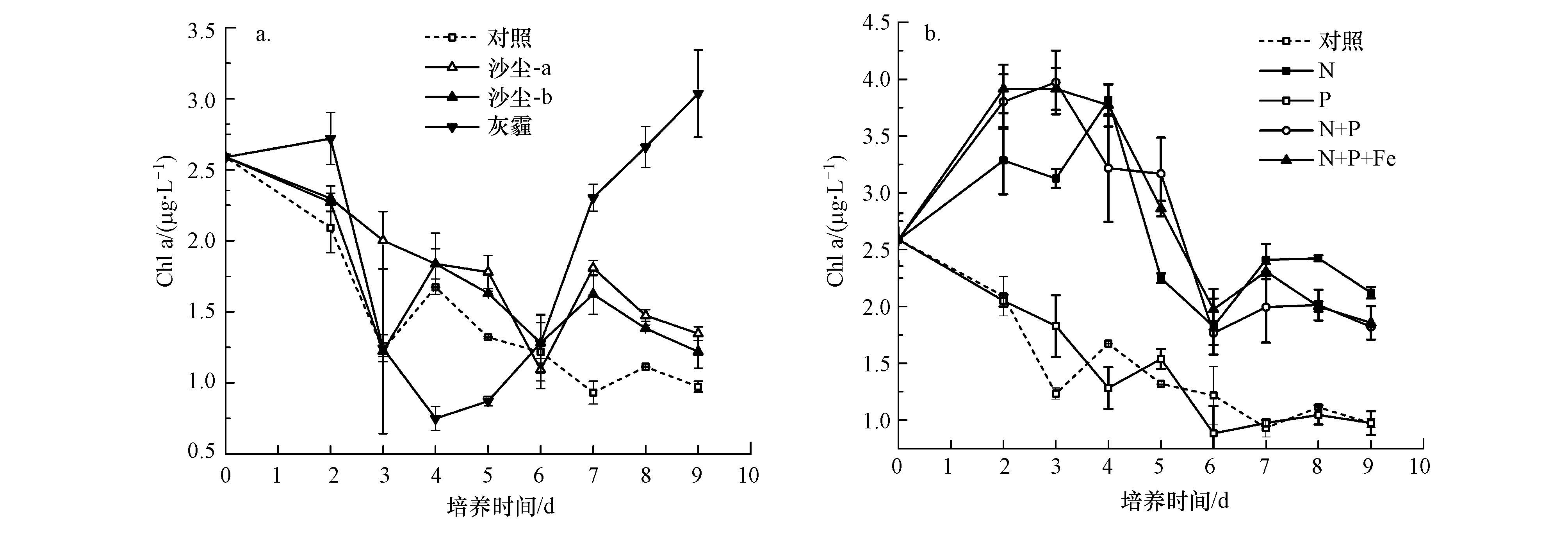
沙尘和灰霾颗粒的添加对B07站浮游植物生长的影响显著不同(图 2).与对照组相比,沙尘添加促进了浮游植物的生长,在培养过程中沙尘组中叶绿素a浓度始终高于对照组,二者均在培养的第3 d叶绿素a浓度达到最大值,沙尘组比对照组中的浓度高约10%.灰霾颗粒的添加对浮游植物生长的影响复杂.在培养初期,灰霾组叶绿素a浓度明显低于对照组,仅为对照组叶绿素a浓度的50%左右,在培养的第4、5 d,灰霾组的叶绿素a浓度达到峰值,略高于对照组相应的浓度,但低于对照组的峰值.之后,灰霾组中叶绿素a浓度迅速下降,明显低于对照组,但培养的最后2 d,前者的浓度略高于后者.总体而言,培养过程中灰霾组叶绿素的平均浓度为2.4 μg·L-1,较之对照组降低12%,呈现一定抑制作用.由表 2可见,灰霾组溶出的N营养盐浓度远高于沙尘组,溶出的P基本相当,但二者对浮游植物的影响却呈现相反的结果,这可能是灰霾组中较高浓度的Cu、Zn、Pb、As等人为污染元素带来的毒性作用.Paytan等(2009)在红海进行的培养实验中发现沙尘中的Cu能够对微微型真核生物和聚球藻产生毒性作用,抑制其生长.Jordi等(2012)在地中海西部的培养实验中也发现气溶胶中高浓度的Cu可以抑制浮游植物的生长.Echeveste等(2010)在大西洋东北部的培养实验中发现,有机物污染物如芘和菲有毒性作用,可以抑制浮游植物的生长.因此,随着我国重污染事件的日益增多,可能导致更多的灰霾颗粒沉降入海,其对近海浮游植物生长产生的负面影响将不可忽视.
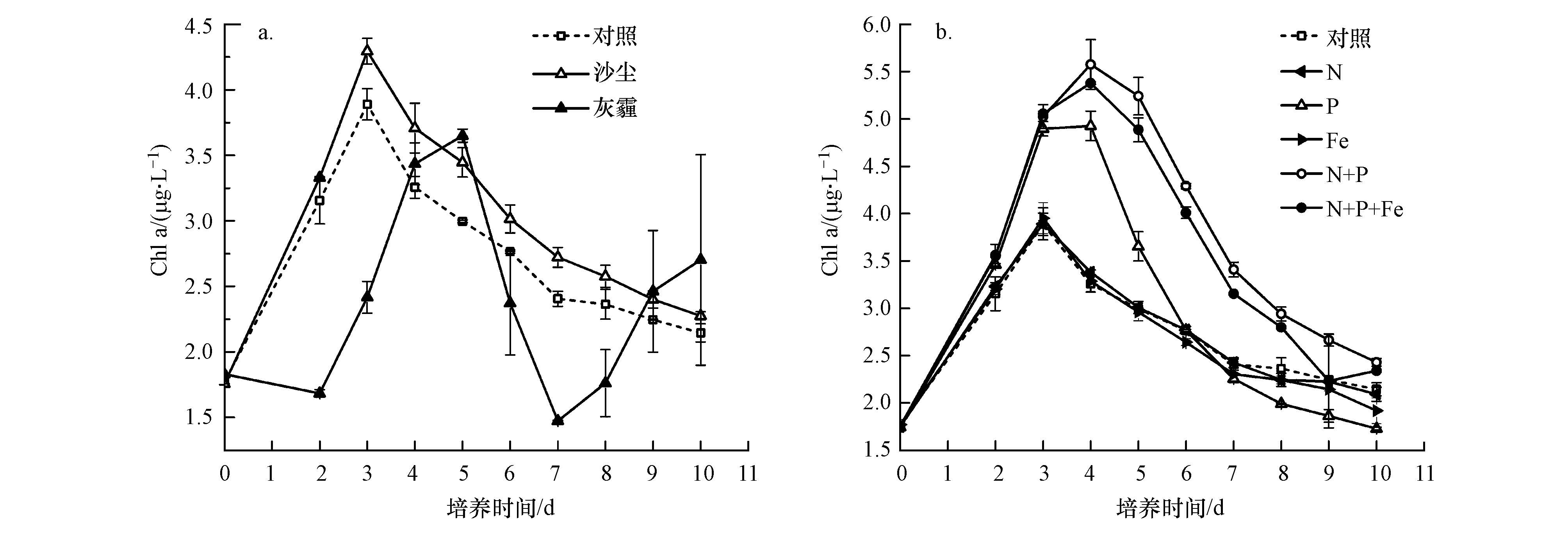 |
| 图 2 B07站培养实验中不同处理组叶绿素a浓度的响应(a.为沙尘和灰霾组,b.为营养盐组)(注:上下误差线分别为2个平行样品的测定值,以下图均相同.) Fig. 2 Response of Chl a concentrations to the addition of different treatment methods during the incubation experiments at B07 station(a. asian dust and haze,b. nutrients) |
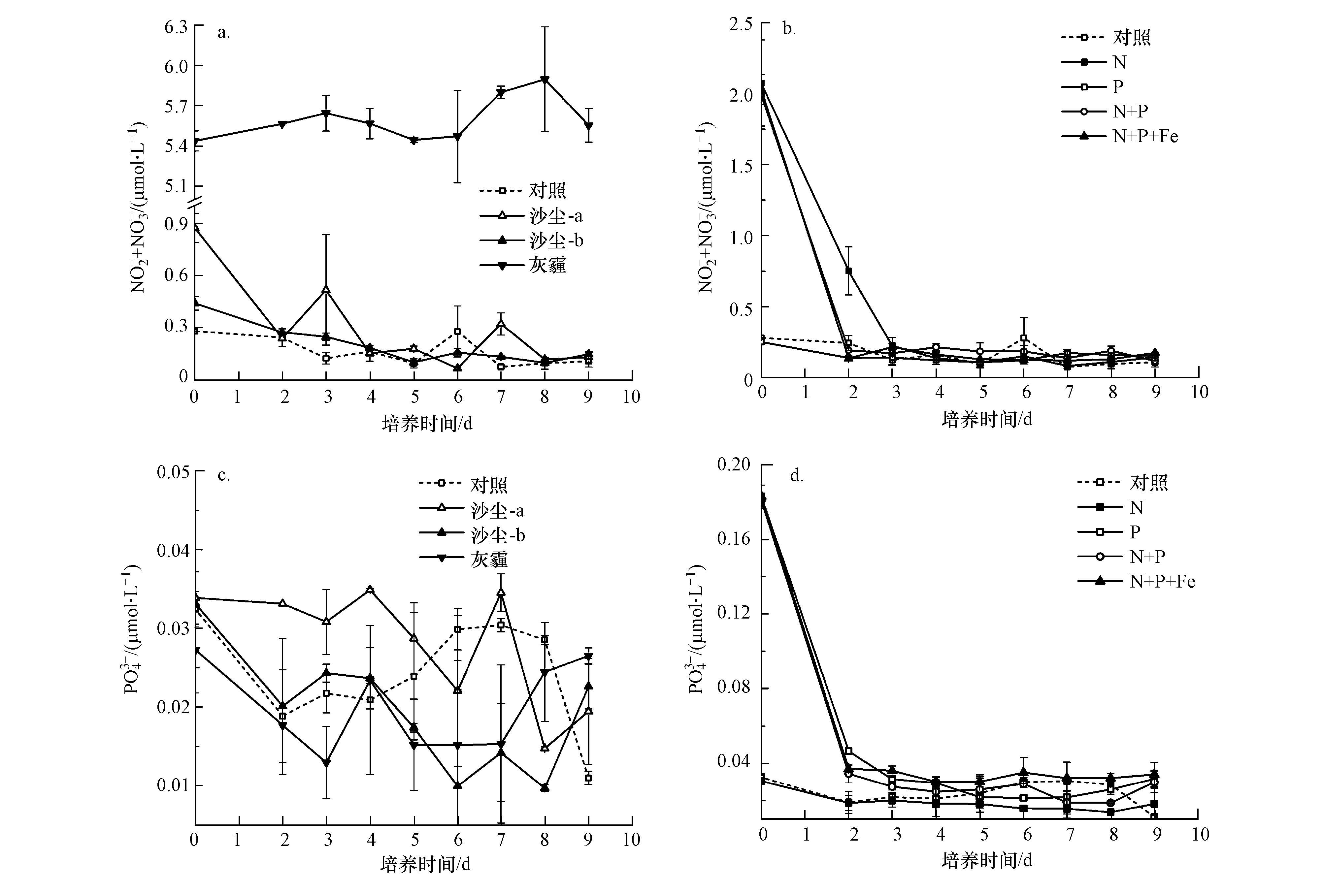
N、P、Fe等营养盐添加对浮游植物生长影响的结果显示(图 2),单独加N和加Fe组均与对照组无显著差异,没有引起叶绿素a浓度的显著增加(ANOVA,p>0.1),但加P组、N+P组和N+P+Fe组明显促进浮游植物生长(ANOVA,p<0.05,2~9 d),且N+P组和N+P+Fe组的促进作用相当(ANOVA,p>0.1),明显强于单独加P组.这些结果与B07站初始营养盐状况有关,培养初始海水中DIN(NO2-+NO3-)营养盐的浓度较高,为3.2 μmol·L4-1,N/P为32,浮游植物生长主要表现为P限制.单独加N和加Fe组与对照组相似,在培养的第3 d达到叶绿素a浓度峰值,约为3.9 μg·L-1.相应地,PO3-浓度均在培养的前3 d急剧下降,第4 d时基本耗竭,维持在检出限水平直至实验结束;DIN浓度在培养的前4 d迅速下降,第5 d之后浓度变化不大,至实验末期加Fe组和对照组仍维持在0.5 μmol·L4-1左右的浓度水平,加N组则维持在2 μmol·L-1左右的浓度水平(图 3).如图 2b所示,加P组中,叶绿素a浓度在第3~4 d达到峰值,约为4.9 μg·L-1,为对照组峰值浓度的1.3倍.N+P和N+P+Fe组中叶绿素a浓度在第3~5 d达到峰值,为5.5 μg·L-1左右,约为对照组峰值浓度的1.4倍.加P组中,因P的添加缓解了P限制问题,使N组分被浮游植物充分利用,DIN浓度在培养的前4 d迅速下降,第4 d之后N组分基本耗竭,PO3-浓度也在培养的第4 d基本耗竭.N+P和N+P+Fe组中,因N的同时添加,DIN浓度在培养的第4 d仍为1.5 μg·L4-1左右,至第6 d时基本耗竭,PO3-浓度在培养的第4 d基本耗竭.总体而言,B07站浮游植物对P添加的响应最为敏感,在加P的基础上同时加N,浮游植物对这部分N有响应,但在加P、加N的基础上再加Fe,则浮游植物对这部分Fe基本无响应.在高营养盐、低叶绿素(HNLC)海区,Fe可以促进浮游植物的生长,改变初级生产过程和群落结构(Boyd et al.,2010),而在B07站位浮游植物对单独加入Fe也无响应,可能是由于B07站位距陆地较近,海水中Fe浓度因受陆源物质输入的影响显著而具有较高的水平.
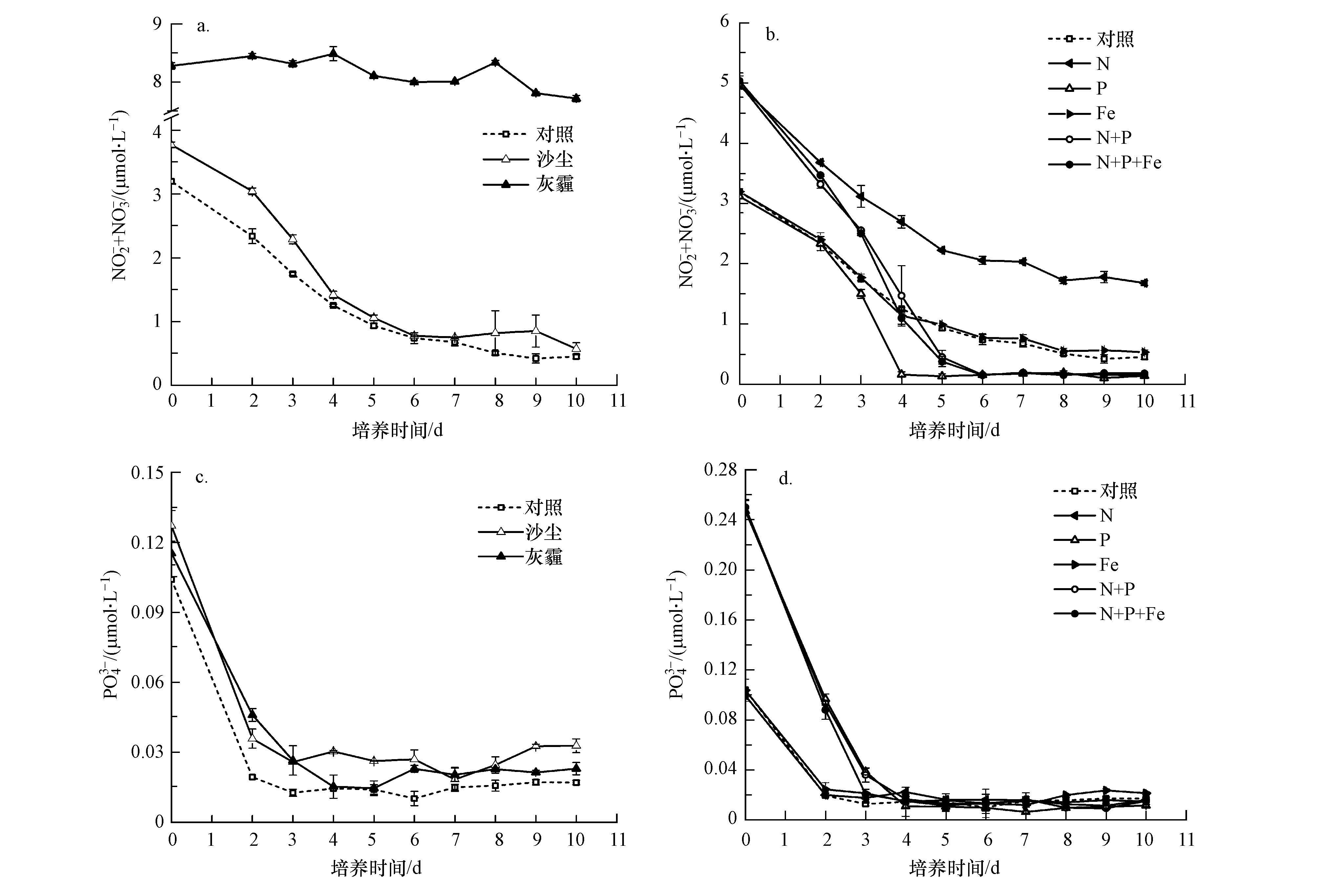 |
| 图 3 B07站培养实验中不同实验组营养盐浓度的变化(a、b. DIN的浓度变化,c、d. PO43-的浓度变化) Fig. 3 Variations of nutrient concentrations during the incubation experiment at B07 station(a,b. variations of DIN concentration; c,d. variations of PO43- concentration) |
沙尘组中,沙尘加入后N、P和Fe的理论溶出浓度分别为1.12、0.008和17 nmol·L4-1,沙尘溶出的N、P浓度均低于加N、P组,而Fe浓度则高于加Fe组.尽管沙尘组溶出P浓度较低,但这些P仍然对P限制起到一定的缓解作用,培养的第3 d叶绿素a浓度达到最大值,比对照组高0.4 μg·L-1,而P此时基本被耗竭,N则在培养的前4 d迅速下降,第5 d之后至培养结束维持在0.6~0.8 μmol·L-1,略高于对照组剩余的N浓度,这表明沙尘溶出的部分N也支持了浮游植物的生长.灰霾组中PO3-浓度变化趋势和对照组几乎一致,但因灰霾溶出的N浓度较高,且该组浮游植物生长主要受到抑制作用,因此,在培养过程中N浓度维持在较高水平,仅略有降低.
根据Liu(2013)提出的评估N向叶绿素a的转化效率(CEI)公式,计算了不同培养组的CEI值.
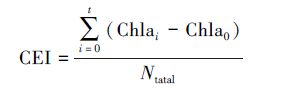
|
式中,t为培养天数(d),Chlai为第i天时叶绿素a的浓度(μg·L-1),Chla0为第0 d时叶绿素a的浓度(μg·L-1),Ntotal为海水中初始N浓度与添加N浓度之和(μg·L-1).结果表明对照、沙尘和灰霾组中CEI分别为1.77、2.26和1.15,加N、Fe、P、N+P和N+P+Fe组中CEI分别是1.77、1.66、2.21、3.68和3.34.沙尘组中CEI明显高于对照组,与加P组的相当,表明沙尘组和加P组具有相似的N向叶绿素a的转化效率,但沙尘中溶出的P浓度明显低于加P组,因此沙尘组中较高转化效率下支持的浮游植物生长是由N和P共同作用的结果.灰霾组中CEI明显低于对照组,显示灰霾添加对生物生长的抑制作用.加N+P和N+P+Fe组中的CEI相当,高于加P组,且这3组的CEI均高于对照组,但加N组和Fe组的CEI与对照组基本一致,这些结果与前述营养盐添加对浮游植物生长影响的结果一致.
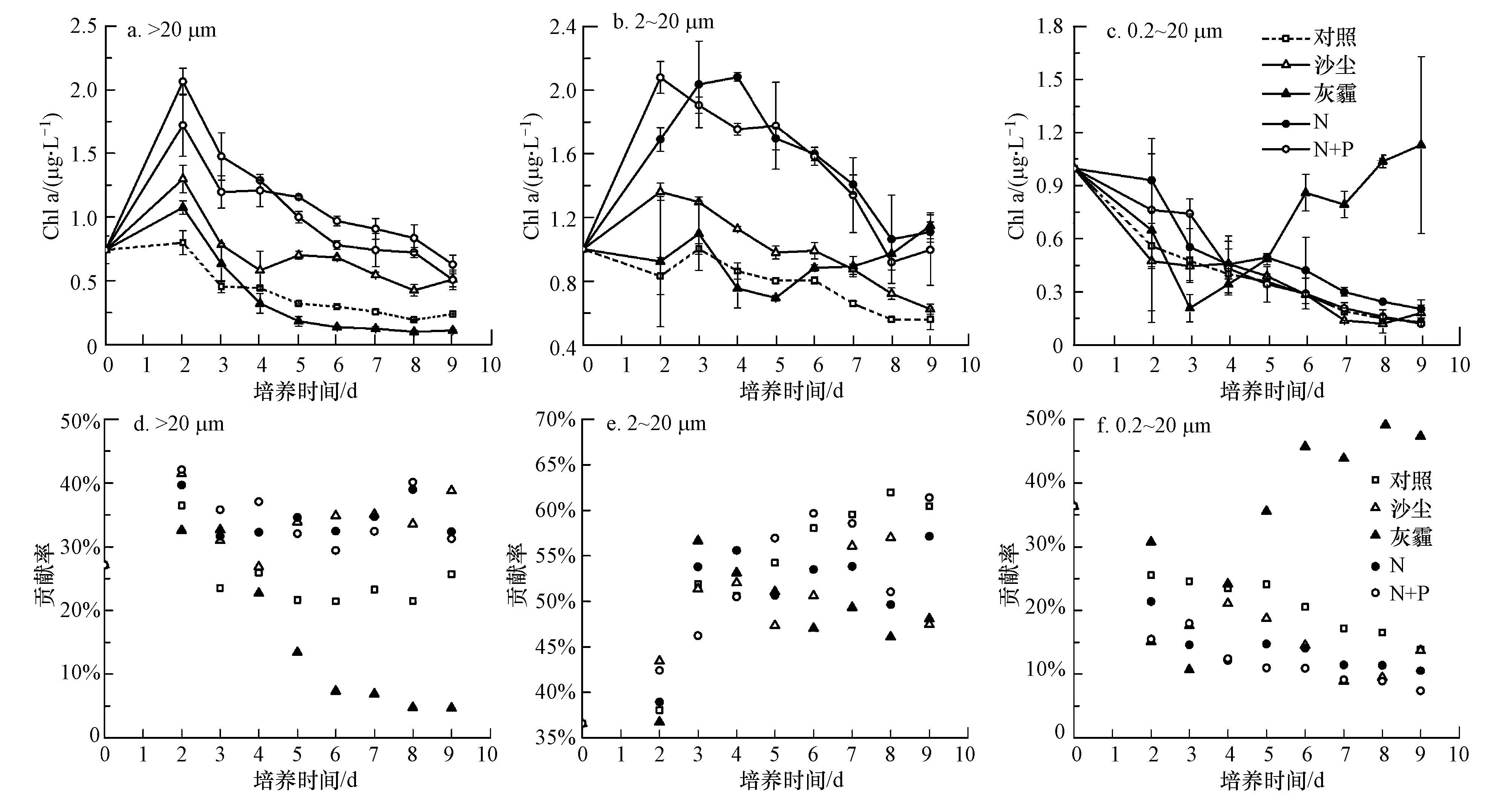
3.1.2 分粒径叶绿素a浓度变化B07站初始海水中小型、微型和微微型浮游植物的叶绿素a浓度分别为0.22、0.56和0.80 μg·L-1,以微微型浮游植物为主,其相对贡献为51%(图 4).对照组培养结束时仍以微微型浮游植物为主,占46%,微型和小型浮游植物分别为35%和19%.沙尘组中,小型和微型浮游植物生长明显高于对照组,但微微型浮游植物生长与对照组无显著差异,表明沙尘添加带来的营养盐主要促进了小型、微型浮游植物生长.灰霾组中,与对照组相比小型和微型浮游植物的生长明显受到抑制,且小型浮游植物受抑制更为显著,培养后期叶绿素a浓度降至对照组的5%左右.微微型浮游植物对灰霾添加响应复杂,在培养的前3 d主要受到抑制作用,之后则呈现一定的促进作用.这可能是由于培养后期微微型浮游植物对灰霾带来的有毒有害物质有了一定的适应性,且培养后期P耗竭的寡营养状况更有利于微微型浮游植物的竞争性增长,因为小粒级的浮游植物具有较大比表面积,在贫营养时相对于较大粒级的浮游植物更容易吸收营养盐(Froneman et al.,2004).加N和加Fe组中不同粒级浮游植物的生长与对照组无显著差异,而加P、N+P和N+P+Fe组均对小型和微型浮游植物有促进作用,对微微型浮游植物的促进作用不显著,这是因为较大粒级的浮游植物在有充足的光照和营养盐的情况下,会有较高的光合作用速率(Tamigneaux et al.,1999).
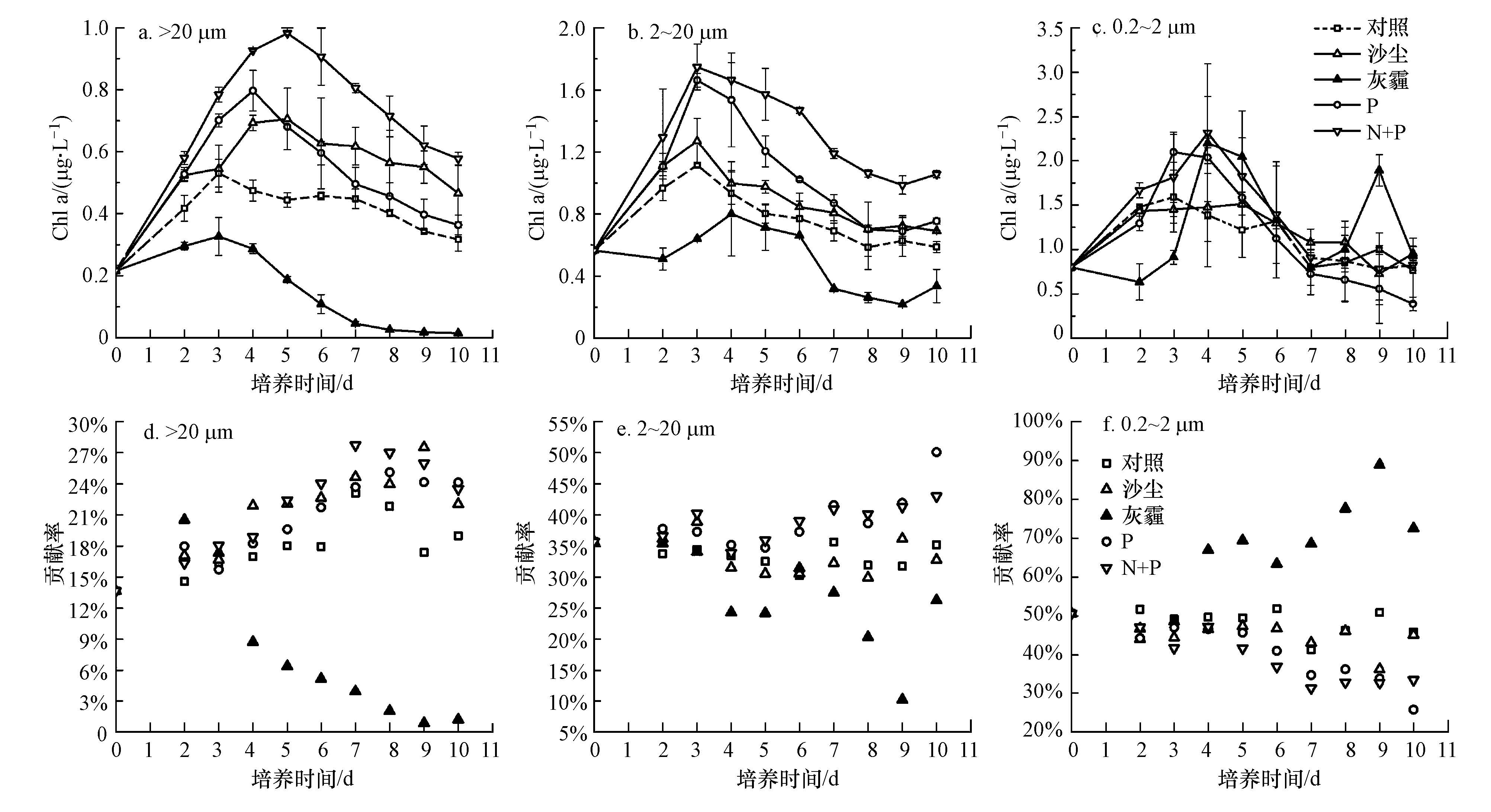 |
| 图 4 B07站不同培养组中小型、微型和微微型浮游植物叶绿素a浓度的响应及其相对贡献(a、b、c.小型、微型和微微型浮游植物叶绿素a浓度变化,d、e、f.小型、微型和微微型浮游植物叶绿素a浓度对总叶绿素贡献比例)(注:N+P+Fe实验组与N+P数据基本吻合,在图中未画出.) Fig. 4 Response of size-fractionated chlorophyll a concentration and its relative proportions in different addition experiments at B07 station(a,b,c. Chlorophyll a concentration of micro-,nano- and picophytoplankton; d,e,f. Contribution of micro-,nano- and picophytoplankton to total chlorophyll a concentration) |
与B07站初始海水中N、P营养盐含量较高,叶绿素a浓度为1.78 μg·L-1,对照组中浮游植物在培养前期处于指数生长期不同,H10站初始海水中N、P营养盐含量较低,仅为0.28和0.03 μmol·L-1,初始叶绿素a浓度较高,为2.59 μg·L-1(表 3),对照组中叶绿素a浓度在整个培养过程中不断下降,显示该站位因营养盐耗竭浮游植物生长正处于衰败期(图 5).沙尘组中,叶绿素a浓度在培养过程中也逐渐降低,但与对照组相比不同方式添加的沙尘均可以促进浮游植物小幅增长,且一次添加和分次添加的结果无显著差异.灰霾组中,灰霾添加对浮游植物的影响整体上呈现先抑制后促进的作用.培养的前5 d,灰霾组叶绿素a平均浓度为1.40 μg·L-1,低于对照组的1.58 μg·L-1,呈现一定抑制作用,第6 d起灰霾组叶绿素a浓度逐渐升高,培养的最后4 d的平均浓度为2.32 μg·L-1,明显高于对照组的1.06 μg·L-1,呈现促进作用,这与B07站灰霾组在培养过程中总体呈现抑制作用不同.分析其原因可能是由于在培养后期浮游植物对灰霾中的有毒有害物质有了一定的适应性,加之H10站浮游植物生长主要受氮限制,而灰霾颗粒中溶出的较高浓度氮能一定程度上缓解氮限制问题,从而在培养后期对浮游植物生长起到促进作用.
 |
| 图 5 H10站培养实验中不同处理组叶绿素a浓度的响应(a.沙尘和灰霾组,b.营养盐组) Fig. 5 Response of Chl a concentrations to the addition of different treatment methods during the incubation experiments at H10 station(a. Asian dust and haze,b. nutrients) |
与对照组相比,N、N+P和N+P+Fe组对浮游植物的促进作用均十分显著(ANOVA,p<0.05),培养的前4 d叶绿素a浓度呈升高趋势,第5 d之后叶绿素a浓度开始下降,但仍显著高于对照组.与B07站相似,加N+P和N+P+Fe组叶绿素a浓度变化基本一致,二者高于加N组.单独加P组与对照组无显著差异(ANOVA,p>0.1),表明该站位浮游植物生长主要受到N营养盐限制.加N组中,N添加缓解了N限制问题,DIN浓度在培养的第3 d迅速下降至0.2 μmol·L4-1,之后N浓度基本不变,相应地PO3-浓度在第2 d后基本接近检出限(图 6).N+P和N+P+Fe组,在加N基础上再加P,使体系中N组分更充分的利用,因此DIN浓度相比单独加N组下降更迅速,在第2 d即降至0.2 μmol·L4-1左右,PO3-浓度在前3 d迅速下降,之后维持在0.03 μmol·L-1左右至实验结束.
 |
| 图 6 H10站培养实验中不同实验组营养盐浓度的变化(a、b. DIN的浓度变化;c、d. PO43-的浓度变化) Fig. 6 Variations of nutrient concentrations during the incubation experiments at H10 station(a,b. Variations of DIN concentration; c,d. Variations of PO43- concentration) |
培养过程中,对照组、沙尘组和灰霾组中P营养盐浓度均很低,在检测限附近;对照组中N营养盐浓度维持在0.1 μmol·L3-1的较低水平,沙尘组中沙尘溶出N的浓度为1.12 μmol·L-1,但N浓度在第2 d即降至0.3 μmol·L-1,之后维持在0.2 μmol·L-1左右,这表明沙尘添加促进浮游植物生长的主控因子是沙尘中溶出的氮.灰霾组中N浓度始终维持在较高水平,约为5.5 μmol·L-1,这是由于灰霾中的有毒有害物质对浮游植物生长有一定的抑制作用,因此体系中氮的消耗也受到抑制,培养后期灰霾对浮游植物生长有一定促进作用,但NO-/ NO2-组分浓度仍然变化不大,这可能是由于灰霾中溶出的NH4+浓度也较高,浮游植物在生长过程中会优先利用NH4+的缘故(Rorsenberg et al.,1984).
3.2.2 分粒径叶绿素a浓度变化H10站初始海水中小型、微型和微微型浮游植物的叶绿素a浓度分别为0.74、1.00和1.00 μg·L-1,微型和微微型浮游植物对3者叶绿素a总浓度的贡献基本相当,为36%,小型浮游植物的贡献为28%(图 7).对照组中,不同粒径浮游植物的叶绿素a浓度在培养过程中均不断下降,但微型浮游植物所占比例不断增大,至培养结束时达到62%.不同添加方式的沙尘组中,不同粒级的浮游植物生长无显著差异,与B07站相似,小型和微型浮游植物生长明显高于对照组,但微微型浮游植物生长与对照组无明显差异,表明沙尘添加带来的营养盐主要促进了小型、微型浮游植物生长.灰霾组中,灰霾的添加对所有粒级浮游植物生长都有微弱的抑制作用,第6 d至培养结束,对小型浮游植物的生长仍为抑制作用,但对微型和微微型浮游植物的生长起促进作用,且对微微型的促进作用更为明显.加P组中不同粒级浮游植物的生长与对照组无显著差异,而加N、N+P和N+P+Fe组均对小型和微型浮游植物有促进作用,对微微型浮游植物的促进作用不显著,这些结果与B07站的相似.
 |
| 图 7 H10站不同培养组中小型、微型和微微型浮游植物叶绿素a浓度的响应及其相对贡献(a、b、c.小型、微型和微微型浮游植物叶绿素a浓度变化,d、e、f.小型、微型和微微型浮游植物叶绿素a浓度对总叶绿素贡献比例)(注:N+P+Fe实验组与N+P数据基本吻合,在图中未画出) Fig. 7 Response of size-fractionated chlorophyll a concentration and its relative proportions in different addition experiments at H10 station(a,b,c. Chlorophyll a concentration of micro-,nano- and picophytoplankton; d,e,f. Contribution of micro-,nano- and picophytoplankton to total chlorophyll a concentration) |
1 ) 2014年春季南黄海北部B07站表层海水初始N/P为32,浮游植物生长对P添加的响应显著,而对N的添加基本无响应,表明该站位浮游植物生长主要受P限制;南黄海中部H10站表层海水初始N/P为9,浮游植物生长对N添加的响应显著,而对P的添加基本无响应,说明该站位浮游植物生长主要受N限制.
2 ) 沙尘添加在B07站和H10站均显著促进浮游植物的生长,且主要促进小型和微型浮游植物生长,对微微型浮游植物生长无明显促进作用.在B07站的促进作用是由沙尘溶出的N和P协同作用的结果,在H10站的促进作用主要是由沙尘溶出的N作用的结果.
3) 灰霾颗粒添加在B07站对浮游植物生长总体呈现抑制作用,且主要对小型和微型浮游植物生长抑制作用明显,对微微型浮游植物则为先抑制后促进;在H10站对浮游植物的影响整体呈现先抑制后促进的作用,培养前期对各粒径浮游植物均有抑制作用,培养后期对微型和微微型浮游植物有促进作用.灰霾颗粒的抑制作用可能是其高浓度Cu、Pb、As、Cd等重金属元素造成的,促进作用主要是由溶出的N造成的.
| [${referVo.labelOrder}] | 贲孝宇, 石金辉, 仇帅, 等. 2015. 青岛大气气溶胶中铁的溶解度及其影响因素[J]. 环境科学学报, 2015, 35(1) : 65–71. |
| [${referVo.labelOrder}] | Boyd P W, Mackie D S, Hunter K A. 2010. Aerosol iron deposition to the surface ocean-modes of iron supply and biological responses[J]. Marine Chemistry, 120(1) : 128–143. |
| [${referVo.labelOrder}] | Duce R A, LaRoche J, Altieri K, et al. 2008. Impacts of atmospheric anthropogenic nitrogen on the open ocean[J]. Science, 320(5878) : 893–897. DOI:10.1126/science.1150369 |
| [${referVo.labelOrder}] | Echeveste P, Dachs J, Berrojalbiz N, et al. 2010. Decrease in the abundance and viability of oceanic phytoplankton due to trace levels of complex mixtures of organic pollutants[J]. Chemosphere, 81(2) : 161–168. DOI:10.1016/j.chemosphere.2010.06.072 |
| [${referVo.labelOrder}] | Froneman P W, Pakhomov E A, Balarin M G. 2004. Size-fractionated phytoplankton biomass, production and biogenic carbon flux in the eastern Atlantic sector of the Southern Ocean in late austral summer 1997-1998[J]. Deep Sea Research Part II:Topical Studies in Oceanography, 51(22) : 2715–2729. |
| [${referVo.labelOrder}] | Guieu C, Dulac F, Desboeufs K, et al. 2010. Large clean mesocosms and simulated dust deposition:a new methodology to investigate responses of marine oligotrophic ecosystems to atmospheric inputs[J]. Biogeosciences, 7(9) : 2765–2784. DOI:10.5194/bg-7-2765-2010 |
| [${referVo.labelOrder}] | Jickells T D, An Z S, Andersen K K, et al. 2005. Global iron connections between desert dust, ocean biogeochemistry, and climate[J]. Science, 308(5718) : 67–71. DOI:10.1126/science.1105959 |
| [${referVo.labelOrder}] | Jordi A, Basterretxea G, Tovar Sánchez A, et al. 2012. Copper aerosols inhibit phytoplankton growth in the Mediterranean Sea[J]. Proceedings of the National Academy of Sciences, 109(52) : 21246–21249. DOI:10.1073/pnas.1207567110 |
| [${referVo.labelOrder}] | Liu Y, Zhang T R, Shi J H, et al. 2013. Responses of chlorophyll a to added nutrients, Asian dust, and rainwater in an oligotrophic zone of the Yellow Sea:Implications for promotion and inhibition effects in an incubation experiment[J]. Journal of Geophysical Research:Biogeosciences, 118(4) : 1763–1772. DOI:10.1002/2013JG002329 |
| [${referVo.labelOrder}] | Mahowald N, Jickells T D, Baker A R, et al. 2008. Global distribution of atmospheric phosphorus sources, concentrations and deposition rates, and anthropogenic impacts[J]. Global Biogeochemical Cycles, 22(4) . DOI:10.1029/2008GB003240 |
| [${referVo.labelOrder}] | Moore C M, Mills M M, Arrigo K R, et al. 2013. Processes and patterns of oceanic nutrient limitation[J]. Nature Geoscience, 6(9) : 701–710. DOI:10.1038/ngeo1765 |
| [${referVo.labelOrder}] | Paytan A, Mackey K R M, Chen Y, et al. 2009. Toxicity of atmospheric aerosols on marine phytoplankton[J]. Proceedings of the National Academy of Sciences, 106(12) : 4601–4605. DOI:10.1073/pnas.0811486106 |
| [${referVo.labelOrder}] | Ren J L, Zhang G L, Zhang J, et al. 2011. Distribution of dissolved aluminum in the Southern Yellow Sea:Influences of a dust storm and the spring bloom[J]. Marine Chemistry, 125(1) : 69–81. |
| [${referVo.labelOrder}] | Rosenberg G, Probyn T A, Mann K H. 1984. Nutrient uptake and growth kinetics in brown seaweeds:response to continuous and single additions of ammonium[J]. Journal of Experimental Marine Biology and Ecology, 80(2) : 125–146. DOI:10.1016/0022-0981(84)90008-X |
| [${referVo.labelOrder}] | Shi J H, Gao H W, Zhang J, et al. 2012. Examination of causative link between a spring bloom and dry/wet deposition of Asian dust in the Yellow Sea, China[J]. Journal of Geophysical Research:Atmospheres (1984-2012), 117(D17) . DOI:10.1029/2012JD017983 |
| [${referVo.labelOrder}] | Shi J H, Zhang J, Gao H W, et al. 2013. Concentration, solubility and deposition flux of atmospheric particulate nutrients over the Yellow Sea[J]. Deep Sea Research Part II:Topical Studies in Oceanography, 97 : 43–50. DOI:10.1016/j.dsr2.2013.05.004 |
| [${referVo.labelOrder}] | Tamigneaux E, Legendre L, Klein B, et al. 1999. Seasonal dynamics and potential fate of size-fractionated phytoplankton in a temperate nearshore environment (Western Gulf of St Lawrence, Canada)[J]. Estuarine, Coastal and Shelf Science, 48(2) : 253–269. DOI:10.1006/ecss.1999.0416 |
| [${referVo.labelOrder}] | Tan S C, Shi G Y, Shi J H, et al. 2011. Correlation of Asian dust with chlorophyll and primary productivity in the coastal seas of China during the period from 1998 to 2008[J]. Journal of Geophysical Research:Biogeosciences (2005-2012), 116(G2) . DOI:10.1029/2010JG001456 |
| [${referVo.labelOrder}] | Wang L, Qi J H, Shi J H, et al. 2013. Source apportionment of particulate pollutants in the atmosphere over the Northern Yellow Sea[J]. Atmospheric Environment, 70 : 425–434. DOI:10.1016/j.atmosenv.2012.12.041 |
| [${referVo.labelOrder}] | Zhang G S, Zhang J, Liu S M. 2007. Characterization of nutrients in the atmospheric wet and dry deposition observed at the two monitoring sites over Yellow Sea and East China Sea[J]. Journal of Atmospheric Chemistry, 57(1) : 41–57. DOI:10.1007/s10874-007-9060-3 |
| [${referVo.labelOrder}] | Zhang K, Gao H W. 2007. The characteristics of Asian-dust storms during 2000-2002:From the source to the sea[J]. Atmospheric Environment, 41(39) : 9136–9145. DOI:10.1016/j.atmosenv.2007.08.007 |
 2017, Vol. 37
2017, Vol. 37


