2. 哈尔滨工业大学市政环境工程学院, 哈尔滨 150090
2. School of Municipal and Environmental Science and Engineering, Harbin Institute of Technology, Harbin 150090
随着化工行业、农业的快速发展, 大量卤代有机化合物(Halogenated Organic Compounds, HOCs), 如三氯乙烯、有机氯农药等, 被排入环境并经自然循环及环境中生物化学等途径转化而普遍分布于水体、大气、土壤等环境介质中(Vinayak et al., 2015; Lu et al., 2015; 张倩等, 2010).绝大多数HOCs具有较高毒性、环境持久性及生物累积性, 对人体和自然界中的生物体构成了威胁, 具有潜在的生态风险, 因此, 需要对这类污染物进行有效控制(Bond et al., 2015; Muir et al., 2006; Schwarzenbach et al., 2010).
HOCs化学结构中的碳卤键(C-X)是其具有持久性与毒性的主要原因, 因此, 脱卤是实现HOCs有效降解与脱毒的关键步骤.C-X具有较高键能, 且在诱导效应上属于吸电子基团(Muir et al., 2006), 从而增加了HOCs的化学稳定性, 因此, 常规的方法很难实现其有效降解脱毒.目前主要方法有高级氧化法(Tang et al., 2012; Lin et al., 2012; 范聪剑等, 2015; Waldemer et al., 2007)、电化学法(Martinez Huitle et al., 2009)、光化学法(Chang et al., 2011; 张峰振等, 2014)等.基于羟基自由基原理的高级氧化法不易使HOCs中的C-X有效断裂, 能耗较高, 氧化剂使用量较大(Tang et al., 2012), 且易产生一些毒性产物, 如溴酸盐、氯酸盐等(Waldemer et al., 2007).电化学法去除效果较好, 但需消耗大量电能, 且受电极材料限制大.光化学法主要利用光催化或光解产生活性物种(eCB-、hVB+等)的特性, 实现HOCs脱卤(张峰振等, 2014), 但其效能主要取决于催化剂特定的材料组成与结构.还原脱卤是实现HOCs有效降解与脱毒的可行途径之一.以零价金属还原(Zhuang et al., 2010; Wang et al., 2010; Zhang et al., 2004)为代表的还原体系可以实现HOCs的高效脱卤, 但其效率和大规模应用仍受零价金属严格的使用条件(如pH值、溶解氧、胶体颗粒物等)、纳米金属易聚团、易氧化失活及长期运行稳定性等限制.
水合电子(eaq-)是目前已知活性最强的还原物种之一, 氧化还原电位为-2.9 V (Siefermann et al., 2011), 能与绝大多数HOCs发生反应(Buxton et al., 1988; Song et al., 2013), 进攻C-X, 使之断裂释放卤离子, 从而实现还原脱卤.常用的eaq-产生方式有电子束辐照、真空紫外辐照、部分阴离子的光电离或电子转移溶剂过程(CTTS)等(Jones et al., 2003; Gonzalez et al., 2004; Qu et al., 2010).目前使用最多的电离辐射与激光脉冲因设备昂贵且具有一定的风险性, 限制了其大规模应用(Jones et al., 2003).此外, 产生的eaq-易被溶解氧捕获而明显降低其还原效率(Qu et al., 2010).亚硫酸根离子(SO32-)在紫外光辐照下, 激发活化后通过光电离方式释放eaq-, 具有较高的量子产率(Sauer et al., 2004), 反应过程具体如式(1)所示(Fischer et al., 1996).SO32-能通过链式反应快速消耗水中溶解氧(Neta et al., 1988), 从而减少eaq-的额外消耗(Li et al., 2012;2014).此外, SO32-的氧化产物SO42-在一定浓度范围内基本无害.
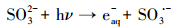
|
(1) |
Li等(2012;2014)提出了SO32-/UV还原体系, 并通过研究体系中特征模型化合物的降解动力学与路径, 从而揭示了该体系的eaq-产生机理与效率.SO32-/UV体系被用于氯乙烯、全氟化合物等污染物的还原降解(Liu et al., 2013; Song et al., 2013).在SO32-/UV体系中, HOCs的脱卤效率不仅取决于体系中eaq-的生成效率, 还受污染物化学结构特性决定, 包括其直接光解特性和其与eaq-的反应动力学.目前关于SO32-/UV体系的研究主要集中于eaq-的产生及污染物降解机理, 从物质结构角度评价SO32-/UV体系的脱卤效能有待进一步研究.
卤代芳香化合物一般更易直接光解并且会生成大量链式卤代中间产物(胡春等, 1998), 考虑到完全脱卤的必要性, 本研究选取7种典型卤乙酸(3种氯乙酸、3种溴乙酸和1种碘乙酸)为目标物, 分别从不同卤素取代种类、卤代程度及实际地表水质本底影响等角度考察SO32-/UV体系的脱卤效能.主要研究:①直接光解脱卤效能及动力学;②SO32-/UV体系的脱卤效能;③卤素性质影响;④卤化程度影响;⑤实际水质本底影响.
2 材料和方法(Materials and methods) 2.1 化学试剂卤乙酸、亚硫酸钠、硼酸、氢氧化钠、氢氧化钾均购自Sigma-Aldrich, 为ACS规格.其余试剂均购自上海国药集团, 为分析纯.所有溶液用电阻率为18.2 MΩ·cm的Milli-Q超纯水配制.Na2SO3溶液现用现配, 以防Na2SO3氧化变质.
2.2 实验步骤柱状光反应器盛放溶液体积0.8 L, 中心位置竖直放置1支低压汞灯作为紫外光源(GPH212T5L, 功率10 W, 波长253.7 nm, 无臭氧).用KI/KIO3法(Rahn et al., 1997)测出通过反应器的平均光强度为(2.98±0.02)× 10-6 einstein·s-1(对应平均光强度约6.27 mW·cm-2)(Li et al., 2012).实验前紫外灯先预热至少15 min, 以保证紫外光的稳定输出.通过水浴循环控制反应溶液温度在(25.0±0.5)℃.实验前反应溶液用高纯氮气曝气15 min以排出溶解氧.所有实验至少重复2次, 结果取平均值及标准差.
根据之前研究, 当SO32-/UV体系pH在6.0~8.7时, 一氯乙酸(MCAA)的降解效率随pH值的升高明显加快, pH>8.7则促进缓慢, 在pH=9.2时效能基本达到最大, 进一步提高pH对其动力学影响不明显(Li et al., 2012; 2014).为得到更好的脱卤效果, 纯水实验中用10 mmol·L-1硼酸缓冲溶液控制pH值为9.2(硼酸缓冲溶液无明显干扰);为反映该体系对实际地表水的脱卤效能, 地表水不调节pH值.
地表水分别取自长江(南京段)与钱塘江(杭州段), 并用醋酸纤维膜(0.45 μm)过滤, 避光保存备用(48 h内), 水质分析结果如表 1所示.地表水实验前将水样搅拌0.5 h, 与空气充分平衡, 溶解氧约为7.8 mg·L-1.
| 表 1 地表水水质 Table 1 Surface water quality |
无机阴离子及有机酸均用离子色谱(Dionex ICS-3000)分析(Li et al., 2012), 其配置为:色谱柱为Dionex AS19(4 mm×250 mm), 自动进样器为AS40, 自动再生膜抑制器ASRS400, 电导检测器CD.采用30 mmol·L-1的KOH溶液为淋洗液, 设置流速1.0 mL·min-1, 抑制器电流75 mA.一碘乙酸(MIAA)在碱性条件下会与SO32-发生碱催化水解反应(Croue et al., 1989), 为尽量减少影响, MIAA取样后立即在离子色谱上检测.溶液pH值采用pH计(Sartorius, PB-10)测定.地表水的UV254吸光度采用紫外可见分光光度计(Varian, Cary 300)测定, 总有机碳及总氮采用总有机碳分析仪(Shimadzu, TOC-L)测定(Li et al., 2014).
3 结果与讨论(Results and discussion) 3.1 卤乙酸的直接光解 3.1.1 直接光解的降解效果及动力学分析分析了7种卤乙酸(HAAs)的直接光解特性, 结果如图 1a所示.从图 1a可见, 一氯乙酸(MCAA)降解很慢, 20 min内(对应UV剂量约为7524 mJ·cm-2)其光解效率低于1.0%(Li et al., 2012), 而二氯乙酸(DCAA)、三氯乙酸(TCAA)在20 min内的降解率分别约为5.0%和13.8%.一溴乙酸(MBAA)有较明显的直接光解, 20 min内降解了约37.8%, 二溴乙酸(DBAA)在10 min内(对应UV剂量3762 mJ·cm-2)降解了约92.9%, 三溴乙酸(TBAA)则在4 min内(对应UV剂量1505 mJ·cm-2)完全降解.一碘乙酸(MIAA)在10 min内降解了约43.6%.可见, HAAs直接光解效率受卤素取代种类的影响, 并遵循氯乙酸 < 溴乙酸 < 碘乙酸的顺序;且卤化程度越高, 直接光解越快.这主要与目标物的摩尔消光系数有关, 本质上由分子结构性质决定(Xiao et al., 2014).
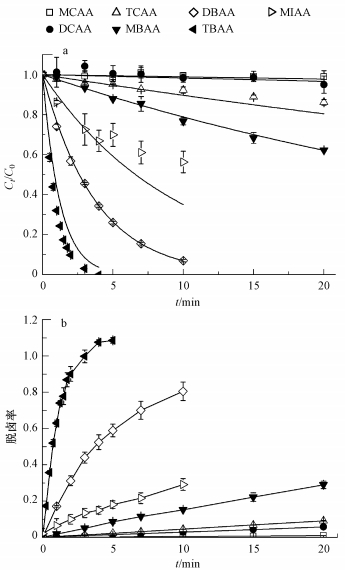 |
| 图 1 HAAs的直接光解(a.降解, b.脱卤;[HAAs]0=50 μmol·L-1, 25 ℃, pH=9.2) Fig. 1 Direct photolysis of HAAs (a.degradation, b.dehalogenation) |
直接光解的机理为, HAAs吸收紫外光子, 激发导致C-X断裂, 生成X·自由基(Chang et al., 2011).一般情况下, 稀溶液中的污染物直接光解符合一级动力学模型(Chen et al., 2010), 具体见式(2).利用式(2)分析了各HAAs的直接光解动力学, 结果如图 1a(图中曲线)和表 2所示.从表 2可见, HAAs直接光解的速率为碘乙酸>溴乙酸>氯乙酸, 且随卤化程度升高而增大.
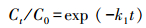
|
(2) |
式中, Ct和C0分别表示反应t时刻及初始时刻的目标物浓度(mol·L-1), k1为一级动力学速率常数(min-1).
| 表 2 7种HAAs直接光解动力学拟合结果 Table 2 Direct photolysis kinetic constants of seven HAAs under UV irradiation |
分析了7种HAAs直接光解的脱卤效能, 结果如图 1b所示.定义脱卤率η为释放的卤离子数量与总HAAs上取代的卤原子数量之比, 具体可通过式(3)计算.
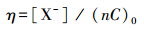
|
(3) |
式中, η为HAAs的脱卤率, [X-]为释放的卤离子浓度(mol·L-1), C0为HAAs初始浓度(mol·L-1), n为HAAs的卤素取代数量.
从图 1b可见, 脱卤效率按氯乙酸 < 溴乙酸 < 碘乙酸的顺序加快, 且卤化程度越大, 脱卤效率越高.对比图 1a可知, 对于卤化程度较高的HAAs, 其脱卤效率低于降解效率(如DBAA在10 min内的脱卤率为80.5%, 降解率为92.9%), 说明其直接光解过程中生成了部分卤代中间产物, 要实现完全脱卤, 需更长的辐照时间.
3.2 SO32-/UV体系中卤乙酸的降解及脱卤分析了MCAA在SO32-/UV体系中的降解及脱卤情况, 结果如图 2所示.由图 2可见, 在SO32-/UV体系中MCAA快速降解的同时释放Cl-.根据氯平衡计算([MCAA]+[Cl-]), 可知MCAA在体系中只生成了Cl-, 而无其他含氯有机中间产物生成.最后MCAA完全降解, 说明其在体系中实现了完全脱氯.这是SO32-受紫外光激发产生的强还原性eaq-还原MCAA脱氯的结果(Li et al., 2012), 具体如式(4)所示(Buxton et al., 1988).

|
(4) |
 |
| 图 2 MCAA在SO32-/UV中的降解及Cl-的生成([MCAA]0=50 μmol·L-1, [SO32-]0=1.0 mmol·L-1, 25 ℃, pH=9.2虚线代表零级动力学模型拟合) Fig. 2 Degradation of MCAA and generation of Cl- in the sulfite/UV process |
而式(1)中与eaq-同时产生的SO3· -还原性很弱(Neta et al., 1988), 是一种选择性弱氧化剂, 主要参与快速的化合反应, 生成SO32-、SO42-、S2O62-等含硫化合物(Fischer et al., 1996).在SO32-/UV体系中加入eaq-强捕获剂N2O, 几乎完全抑制了MCAA的降解, 说明SO3· -对脱卤基本无贡献(Li et al., 2012).
动力学分析结果表明, 图 2中MCAA的降解及Cl-的生成规律均符合表观零级动力学.其中, Cl-的释放动力学可用式(5)表示.

|
(5) |
式中, Ct表示Cl-的浓度(mol·L-1);k0为零级动力学速率常数(mol·L-1·s-1).利用式(5)拟合Cl-的释放过程, 通过反应(4)生成Cl-的速率约为3.21 μmol·L-1·min-1(图 2).
进一步分析反应(4)的动力学, 关键在于eaq-的分析.eaq-可通过闪光光解或激光射解的方式直接检测其在700 nm处的吸收加以定量分析(Sauer et al., 2004), 而本文根据eaq-存在时间极短暂(Buxton et al., 1988), 可以基于稳态假设, 用式(6)表示eaq-的稳态浓度(Li et al., 2014).
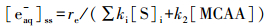
|
(6) |
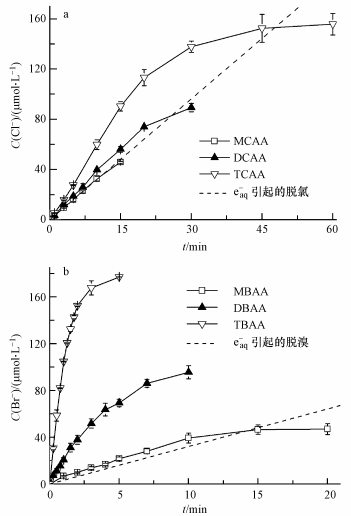
式中, [eaq-]ss为eaq-的稳态浓度(mol·L-1), re为eaq-生成速率(mol·L-1·s-1), ki为捕获剂消耗eaq-的二级速率常数(L· mol-1·s-1), [S]i为捕获剂浓度(mol·L-1), k2为MCAA消耗eaq-的二级速率常数(L·mol-1·s-1), [MCAA]为一氯乙酸的浓度(mol·L-1).体系中除MCAA外, 可能捕获的eaq-物种有H+、HSO3-及部分中间产物.因MCAA直接光解可忽略不计(图 1a), 并由式(6)推导, MCAA脱氯动力学可用式(7)表示.从式(7)可知, 若∑ki[S]i ≪ k2[MCAA], 式(7)可简化为式(8).

|
(7) |
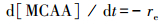
|
(8) |
图 2及动力学分析已表明, MCAA的脱氯为表观零级反应, 与式(8)相符, 也即在此条件下, 50 μmol·L-1的MCAA几乎完全捕获了体系中生成的eaq-并释放出了等计量比的Cl-, 其他物种对eaq-的竞争可忽略不计.因此, 可以通过Cl-的生成速率间接表征eaq-的生成及还原脱卤效能.
在SO32-/UV体系中, 对于其他易直接光解的HAAs来说, 其降解过程至少应包括eaq-还原降解与直接光解两部分贡献, 因此,其实际脱卤速率应该高于3.21 μmol·L-1·min-1.
3.3 卤素性质影响分析了不同卤素取代HAAs在体系中的降解特性及脱卤效能, 结果如图 3所示.由eaq-引起的降解脱卤曲线根据图 2中Cl-的释放曲线拟合, 即降解速率约为3.21 μmol·L-1·min-1.从图 3a可见, MCAA的降解曲线与eaq-引起的还原降解曲线接近, 说明其降解几乎完全取决于eaq-的还原作用, 而MBAA、MIAA的降解明显快于eaq-的还原降解, 说明除了eaq-的贡献, 还有较快的直接光解.从图 3b可见, MCAA的脱卤几乎完全取决于eaq-的还原作用, 而MBAA、MIAA脱卤效率明显高于eaq-引起的脱卤, 说明直接光解有较大的贡献.
 |
| 图 3 HAAs在SO32-/UV中的降解及脱卤(a.降解, b.脱卤;[HAAs]0=50 μmol·L-1, [SO32-]0=1.0 mmol·L-1, 25 ℃, pH=9.2) Fig. 3 Degradation and dehalogenation of HAAs in the sulfite/UV process (a.degradation, b.dehalogenation) |
SO32-/UV体系中, 由于HAAs与eaq-均接近扩散(二级速率常数均大于109 L· mol-1·s-1), 因此, eaq-对各种HAAs的还原脱卤贡献差异不大.但不同卤素取代的HAAs直接光解特性差异巨大, 所以造成了该体系中, HAAs的降解与脱卤速率按氯乙酸、溴乙酸、碘乙酸的顺序而加快.
3.4 卤化程度影响分析了卤化程度对HAAs在体系中降解的影响, 结果如图 4所示.从图 4a可见, MCAA、DCAA和TCAA在SO32-/UV中的降解效率基本接近, 且与eaq-还原降解的贡献基本吻合, 说明其直接光解的作用较小, 降解主要由eaq-还原引起.氯取代程度对氯乙酸的降解无明显影响.
 |
| 图 4 HAAs在SO32-/UV中的降解(a.氯乙酸, b.溴乙酸;[HAAs]0=50 μmol·L-1, [SO32-]0=1.0 mmol·L-1, 25 ℃, pH=9.2) Fig. 4 Degradation of HAAs in the sulfite/UV process (a. CAAs, b. BAAs) |
而图 4b表明, 溴乙酸在SO32-/UV体系中降解既有eaq-的贡献, 又有明显的直接光解作用, 且溴化程度越高, 直接光解作用越明显(表 2).当MBAA、DBAA和TBAA发生完全降解时, eaq-还原所占贡献的比重依次下降, 分别约为77.0%、51.4%和25.7%.
进一步分析了卤化程度对HAAs脱卤的影响, 结果如图 5所示.从图 5a可知, 3种氯乙酸在SO32-/UV体系中的降解速率虽然接近(图 4a), 但脱氯的速率不同(TCAA>DCAA>MCAA).MCAA的脱氯几乎完全依靠eaq-的还原作用, 而DCAA和TCAA有小部分直接光解的贡献;此外, DCAA和TCAA降解过程中生成的含氯中间产物也可能会发生明显的光解而脱氯.DCAA和TCAA完全脱氯所需时间大约是MCAA的2~3倍, 说明其脱氯可能主要是eaq-的还原引起.因体系中SO32-消耗速率慢(60 min内消耗约17%)(Li et al., 2012), 在一定光强度下, 生成eaq-的速率变化不大, 由eaq-还原引起Cl-释放的速率也基本不变, 因此, 理论上在一定时间内, 脱氯量与辐照时间基本成正比(图 2).DCAA和TCAA氯代程度较高, 其脱氯主要仍取决于eaq-的生成, 因此, 彻底脱氯需更长时间.
 |
| 图 5 HAAs在SO32-/UV中的脱卤(a.氯乙酸, b.溴乙酸;[HAAs]0=50 μmol·L-1, [SO32-]0=1.0 mmol·L-1, 25 ℃, pH=9.2) Fig. 5 Dehalogenation of HAAs in the sulfite/UV process (a.CAAs, b.BAAs) |
从图 5b可见, 溴乙酸的溴化程度越高, 脱溴速率越快.溴乙酸的脱卤效率明显高于氯乙酸, 这是因为其直接光解引起的脱卤速率更大.其中, DBAA和TBAA的脱卤主要可能是直接光解引起的, 过程中即使生成含溴中间产物, 也能快速光解.
虽然卤代程度的增加有利于加快HAAs和eaq-的反应, 但体系中生成的eaq-几乎完全被HAAs捕获(接近扩散速率), 故卤化程度对eaq-还原作用的影响不大.因此, 卤化程度对HAAs在体系中的降解与脱卤主要是通过影响其直接光解的特性实现的.
3.5 实际地表水中SO32-/UV体系的脱卤效能以MCAA为模型化合物, 分别考察了SO32-/UV体系在长江和钱塘江水中的脱卤效能, 实验结果见图 6.从图 6可见, 实际水质本底中, SO32-/UV体系仍具有明显的脱卤效能:75 min内, 长江水本底中, 50 μmol·L-1的MCAA脱卤率高于99.0%;钱塘江水中, MCAA的脱卤率约为78.2%.实际水质本底中脱卤效率降低主要由以下原因造成:①pH接近中性, 使部分eaq-转化为H·, 如式(9)所示;②溶解氧、有机碳、硝酸盐和亚硝酸盐等电子受体与MCAA竞争并消耗eaq-, 如式(10)~(12)所示.由于SO32-的保护作用, 溶解氧对eaq-的消耗影响较小(Neta et al., 1988), 而长江水和钱塘江水中NO3-含量均较高(表 1), 应该是抑制脱卤的主要原因, 钱塘江水中TOC及NO3-含量高于长江水, 且pH也略低, 因此, 脱卤效率更低.
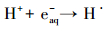
|
(9) |
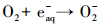
|
(10) |
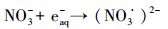
|
(11) |
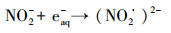
|
(12) |
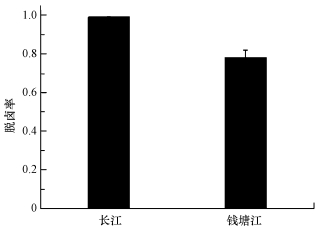 |
| 图 6 实际地表水中SO32-/UV对MCAA的脱卤([MCAA]0=50 μmol·L-1, [SO32-]0=2 mmol·L-1, 25 ℃, 反应时间75 min) Fig. 6 Dehalogenation of MCAA in surface water by the sulfite/UV process |
1) HAAs的直接光解符合一级动力学, 直接光解速率及脱卤效率遵循氯乙酸 < 溴乙酸 < 碘乙酸的顺序且随卤化程度的增加而加快.
2) SO32-/UV体系对HAAs有明显的降解与脱卤作用, 且至少包括直接光解与eaq-还原两种途径, 其中, eaq-还原作用可以实现HOCs的完全脱卤.
3) 卤素取代种类主要决定HAAs的直接光解特性, 从而影响HAAs在体系中的脱卤效能.HAAs在体系中的脱卤效率随着氯乙酸 < 溴乙酸 < 碘乙酸的顺序而增加.
4) 卤化程度越高, HAAs的降解及脱卤速率越快;直接光解慢的HAAs, 其脱卤效率主要取决于eaq-的生成速率;直接光解快的HAAs, 则主要取决于直接光解效率.
5)在实际地表水中, SO32-/UV体系仍具有较好的脱卤效能.
| [${referVo.labelOrder}] | Bond T, Templeton M R, Kamal N H M, et al. 2015. Nitrogenous disinfection byproducts in English drinking water supply systems: Occurrence, bromine substitution and correlation analysis[J]. Water Research, 85 : 85–94. DOI:10.1016/j.watres.2015.08.015 |
| [${referVo.labelOrder}] | Buxton G V, Greenstock C L, Helman W P, et al. 1988. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O-) in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 17(2) : 513–886. DOI:10.1063/1.555805 |
| [${referVo.labelOrder}] | Chang H J, Dietrich A M, Tanko J M. 2011. Simultaneous degradation of disinfection byproducts and earthy-musty odorants by the UV/H2O2 advanced oxidation process[J]. Water Research, 45(8) : 2507–2516. DOI:10.1016/j.watres.2011.02.006 |
| [${referVo.labelOrder}] | Chen B, Lee W, Westerhoff P K, et al. 2010. Solar photolysis kinetics of disinfection byproducts[J]. Water Research, 44(11) : 3401–3409. DOI:10.1016/j.watres.2010.03.014 |
| [${referVo.labelOrder}] | Croue J P, Reckhow D A. 1989. Destruction of chlorination byproducts with sulfite[J]. Environmental Science & Technology, 23(11) : 1412–1419. |
| [${referVo.labelOrder}] | 范聪剑, 刘石军, 刘哲, 等. 2015. 过硫酸盐技术去除水中有机污染物的研究进展[J]. 环境科学与技术, 2015, 38(6P) : 136–141. |
| [${referVo.labelOrder}] | Fischer M, Warneck P. 1996. Photodecomposition and photo-oxidation of hydrogen sulfite in aqueous solution[J]. Journal of Physical Chemistry, 100(37) : 15111–15117. DOI:10.1021/jp953236b |
| [${referVo.labelOrder}] | Gonzalez M G, Oliveros E, Worner M, et al. 2004. Vacuum-ultraviolet photolysis of aqueous reaction systems[J]. Journal of Photochemistry and Photobiology C, 5(3) : 225–246. DOI:10.1016/j.jphotochemrev.2004.10.002 |
| [${referVo.labelOrder}] | 胡春, 刘星娟, 李爽. 1998. ZnO催化剂对苯胺光降解的研究[J]. 环境科学学报, 1998, 18(1) : 81–85. |
| [${referVo.labelOrder}] | Jones C G, Joseph S, Mohamad A S, et al. 2003. Dechlorination of polychlorinated biphenyls in industrial transformer oil by radiolytic and photolytic methods[J]. Environmental Science & Technology, 37(24) : 5773–5777. |
| [${referVo.labelOrder}] | Li X, Fang J, Liu G, et al. 2014. Kinetics and efficiency of the hydrated electron-induced dehalogenation by the sulfite/UV process[J]. Water Research, 62(10) : 220–228. |
| [${referVo.labelOrder}] | Li X, Ma J, Liu G, et al. 2012. Efficient reductive dechlorination of monochloroacetic acid by sulfite/UV process[J]. Environmental Science & Technology, 46(13) : 7342–7349. |
| [${referVo.labelOrder}] | Lin Y C, Panchangam S C, Chang C Y, et al. 2012. Removal of perfluorooctanoic acid and perfluorooctane sulfonate via ozonation under alkaline condition[J]. Journal of Hazardous Materials, 243(4) : 272–277. |
| [${referVo.labelOrder}] | Liu X, Yoon S, Batchelor B, et al. 2013. Degradation of vinyl chloride (VC) by the sulfite/UV advanced reduction process (ARP): Effects of process variables and a kinetic model[J]. Science of the Total Environment, 454-455C(5) : 578–583. |
| [${referVo.labelOrder}] | Lu J, Shao J, Liu H, et al. 2015. Formation of halogenated polyaromatic compounds by laccase catalyzed transformation of halophenols[J]. Environmental Science & Technology, 49(14) : 8550–8557. |
| [${referVo.labelOrder}] | Martinez-Huitle C A, Brillas E. 2009. Decontamination of wastewaters containing synthetic organic dyes by electrochemical methods: A general review[J]. Applied Catalysis B Environmental, 87(3) : 105–145. |
| [${referVo.labelOrder}] | Muir D C G, Howard P H. 2006. Are there other persistent organic pollutants? A challenge for environmental chemists[J]. Environmental Science & Technology, 40(23) : 7157–7166. |
| [${referVo.labelOrder}] | Neta P, Huie R E, Ross A B. 1988. Rate constants for reactions of inorganic radicals in aqueous solution[J]. Journal of Physical & Chemical Reference Data, 17(3) : 1027–1284. |
| [${referVo.labelOrder}] | Qu Y, Zhang C, Li F, et al. 2010. Photo-reductive defluorination of perfluorooctanoic acid in water[J]. Water Research, 44(9) : 2939–2947. DOI:10.1016/j.watres.2010.02.019 |
| [${referVo.labelOrder}] | Rahn R O. 1997. Potassium iodide as a chemical actinometer for 254nm radiation: Use of lodate as an electron scavenger[J]. Photochemistry & Photobiology, 66(4) : 450–455. |
| [${referVo.labelOrder}] | Sauer M C, Crowell R A, Shkrob I A. 2004. Electron photodetachment from aqueous anions[J]. 1.Quantum yields for generation of hydrated electron by 193 and 248 nm laser photoexcitation of miscellaneous inorganic anions[J].Journal of Physical Chemistry A, 108(25) : 5490–5502. |
| [${referVo.labelOrder}] | Schwarzenbach R P, Egli T, Hofstetter T B, et al. 2010. Global water pollution and human health[J]. Annual Review of Environment & Resources, 35(1) : 109–136. |
| [${referVo.labelOrder}] | Siefermann K R, Bernd A. 2011. The hydrated electron: A seemingly familiar chemical and biological transient[J]. Angewandte Chemie International Edition, 50(23) : 5264–5272. DOI:10.1002/anie.201006521 |
| [${referVo.labelOrder}] | Song Z, Tang H, Wang N, et al. 2013. Reductive defluorination of perfluorooctanoic acid by hydrated electrons in a sulfite-mediated UV photochemical system[J]. Journal of Hazardous Materials, 262(22) : 332–338. |
| [${referVo.labelOrder}] | Tang H, Xiang Q, Lei M, et al. 2012. Efficient degradation of perfluorooctanoic acid by UV-Fenton process[J]. Chemical Engineering Journal, 184(3) : 156–162. |
| [${referVo.labelOrder}] | Vinayak A, Jie L, Imran R, et al. 2015. Complexity of naturally produced polybrominated diphenyl ethers revealed via mass spectrometry[J]. Environmental Science & Technology, 49(3) : 1339–1346. |
| [${referVo.labelOrder}] | Waldemer R H, Tratnyek P G, Johoson R L, et al. 2007. Oxidation of chlorinated ethenes by heat-activated persulfate: Kinetics and products[J]. Environmental Science & Technology, 41(3) : 1010–1015. |
| [${referVo.labelOrder}] | Wang X, Ning P, Liu H, et al. 2010. Dechlorination of chloroacetic acids by Pd/Fe nanoparticles: Effect of drying method on metallic activity and the parameter optimization[J]. Applied Catalysis B: Environmental, 94(1/2) : 55–63. |
| [${referVo.labelOrder}] | Xiao Y, Fan R, Zhang L, et al. 2014. Photodegradation of iodinated trihalomethanes in aqueous solution by UV 254 irradiation[J]. Water Research, 49(1) : 275–285. |
| [${referVo.labelOrder}] | 张峰振, 吴超飞, 胡芸, 等. 2014. 卤代有机物的光化学降解[J]. 化学进展, 2014, 26(6) : 1079–1098. |
| [${referVo.labelOrder}] | Zhang L, Arnold W A, Hozalski R M, et al. 2004. Kinetics of haloacetic acid reactions with Fe (0)[J]. Environmental Science & Technology, 38(24) : 6881–6889. |
| [${referVo.labelOrder}] | 张倩, 杨晓波, 周达诚, 等. 2010. 加氯消毒过程中纯细菌物质生成消毒副产物研究[J]. 环境科学学报, 2010, 30(2) : 314–320. |
| [${referVo.labelOrder}] | Zhuang Y, Ahn S, Luthy R G. 2010. Debromination of polybrominated diphenyl ethers by nanoscale zerovalent iron: Pathways, kinetics, and reactivity[J]. Environmental Science & Technology, 44(21) : 8236–8242. |
 2016, Vol. 36
2016, Vol. 36


