随着人类长期对金属矿产资源的开采、加工、利用, 采矿、冶炼、电镀等行业向环境排放了大量的含重金属“三废”, 造成了严重的土壤重金属污染.随着时间的推移, 土壤重金属污染对人类所产生的影响日益凸显, 其中以Pb污染的影响最为深远, 严重威胁着生态安全和人体健康(雷鸣等, 2010;杨刚等, 2011;杨彦等, 2014).针对土壤Pb污染, 原位控制技术被证明是一种行之有效的方法(Chen et al., 2000;Garbisu and Alkorta, 2001;Wu et al., 2004;Guo et al., 2006).在众多原位控制技术中, 植物修复因安全、经济、可靠、修复彻底、利于土壤功能的恢复、具有较好的生态与经济效益而得到广泛应用(Japenga et al., 2007;Xiao et al., 2008;Yu et al., 2008).不断有实践表明, 具有超富集功能的草本植物在用于修复土壤重金属污染时存在生物量小、修复周期长、需反复种植收割等局限.因此, 研究生物量较大的木本植物对重金属的耐性及富集效应具有重要意义.
旱柳(Salix matsudana Koidz)作为一种重要的木本能源植物, 对多种重金属表现出很强的耐性, 用于修复土壤重金属污染的潜力巨大, 引起了研究人员的广泛关注.杨卫东(2008)研究了Cd胁迫对旱柳膜透性、抗氧化酶活性、内肽酶变化、光合作用、矿质营养吸收的影响及Cd在旱柳亚细胞的分布与存在形态, 在此基础上, 杨卫东等(2014a, b)还研究了Cd胁迫对旱柳幼苗的生长、低分子量巯基化合物含量、抗坏血酸-谷胱甘肽循环、谷胱甘肽代谢的影响, 系统的解析了旱柳对Cd的积累、忍耐与解毒生理机制. 贾中民等(2013)通过营养液培养试验比较研究了垂柳和旱柳对Cd的积累及生长光合响应, 研究发现旱柳对Cd的耐受、积累、转移能力均大于垂柳, 用于修复土壤Cd污染的潜力较大. 朱宇恩等(2011)通过水培试验研究了Cu在旱柳体内的迁移特征, 研究表明Cu主要积累在旱柳的根部, Cu胁迫抑制了旱柳对Ca、Mg的吸收, 进而抑制叶绿素的合成, 导致生物量下降. Yu和Gu(2007)通过水培试验研究了旱柳对Cr(Ⅲ)的积累、转移及代谢响应特征, 初步揭示了旱柳对Cr(Ⅲ)耐性与解毒生理机制, 同时也证实旱柳能够用于修复水体或土壤Cr(Ⅲ)污染. Yang等(2015a)通过转基因改良了旱柳对Cu的抗性, 研究发现基因Tamarix hispida ThMT3的过表达可以提高旱柳对Cu的耐性, 并有利于旱柳不定根的诱导. Yang等(2015b)通过分子生物学手段研究了旱柳根、叶对Cd胁迫转录组和生理响应机制, 结果表明, 当旱柳根受到Cd胁迫时, 细胞壁周边会形成一定厚度的胼胝质, 以增加对Cd的耐受性, 同时还发现旱柳转录组和生理对Cd胁迫的响应表现出组织特异性.
然而, 旱柳对Pb的耐性、富集特征、胁迫响应等科学问题尚不十分明确.为此, 本文通过盆栽模拟试验研究了旱柳对Pb的耐性和富集、转运特征, 分析了旱柳根、茎、叶的生理生化、微观结构、官能团组成、矿质元素吸收对不同含量Pb胁迫的响应, 研究结果可为旱柳在土壤重金属污染修复中的应用及其改良提供可能的理论依据.
2 材料与方法(Materialandmethods) 2.1 供试土壤与植物供试土壤采自中南林业科技大学校内生态站附近实验林地, 采集地属亚热带季风性湿润气候, 年均气温16.8 ℃, 年均降雨量1450.8 mm, 土壤类型为酸性黏质红壤.供试土壤基本理化性质: pH5.2, 含水率2.71%, 有机质16.12 g·kg-1, 阳离子交换容量(CEC) 12.46 cmol·kg-1.土壤采集后, 剔除植物根茎、新生体、未腐化的植物枯枝落叶等杂物.
供试植物(Salix matsudana Koidz)旱柳采用2年生扦插苗, 选择长势一致的旱柳枝条(约15 cm)进行水培生根, 生根后进行移栽, 扦插枝条取自中南林业科技大学芦头试验林场.
2.2 盆栽试验取1.6273 g Pb(NO3)2加超纯水配制成1000 mg·L-1的Pb标准溶液, 取适量Pb标准溶液喷洒于4组供试土壤, 反复搅拌、混匀, 使土壤Pb含量分别达到200、600、1000、1200 mg·kg-1, 处理编号依次为Pb200、Pb600、Pb1000、Pb1200, 以清洁土壤喷洒等量超纯水为空白对照(CK), 置于通风处自然风干、熟化15 d(期间定时搅拌).待熟化完成后, 将模拟Pb污染土壤装入上口径29 cm的花盆中, 每个土壤Pb含量梯度设3个重复, 贴好标签.同时将生根的旱柳扦插苗移栽于盆中, 每盆4~5株, 并加入适量肥料(尿素、K2HPO4).试验过程为平衡蒸发量和维持植物生长, 定期浇水, 并防治病虫害.为防Pb的流失, 每个花盆底部放置塑料盘, 将浇水时流出的溶液倒回花盆, 培养时间为180 d.
2.3 样品采集与分析旱柳样品预处理及根长、株高、生物量测定:培养180 d后收获旱柳, 对采集的旱柳植株先用自来水将根系洗净, 再用20 mmol·L-1 Na2-EDTA交换15 min, 用以去除根系表面吸附的Pb离子, 而后用超纯水仔细清洗, 用滤纸吸干表面水分, 用卷尺测定株高, 用游标卡尺测定根长, 然后分根、茎、叶剪开, 分别称其鲜重, 称完鲜重后的根、茎、叶样品按照相关方法分析其他项目.
旱柳样品Pb含量测定:取旱柳根、茎、叶鲜样置于烘箱, 于90 ℃杀青30 min, 再于60 ℃烘干至恒重, 而后剪碎、研磨, 过1 mm尼龙筛.取过筛样品1.000 g, 采用湿法(HNO3-HClO4)消解, 用AA-7002型原子吸收分光光度计测定.
旱柳样品生理生化指标测定:用分光光度法测定叶绿素的含量(黄秋婵和韦友欢, 2009);用硫代巴比妥酸法测定丙二醛(MDA)含量(郑炳松, 2006);用氯化硝基氮蓝四唑(NBT)光化还原抑制法测定超氧化物歧化酶(SOD)活性(李合生, 2006);用过氧化氢分解法测定过氧化氢酶(CAT)活性(刘砚韬等, 2013);用愈创木酚比色法测定过氧化物酶(POD)活性(李合生, 2006);用考马斯亮蓝法(Bradford法)测定可溶性蛋白的含量(张立军和樊金娟, 2007).
旱柳样品微观结构、微量元素分布与官能团构成分析:用配备了X射线能谱仪(energy-dispersive X-ray analyser, EDAX, 型号PV9900)的Philips扫描透射电镜(STEM, 型号CM12)分析旱柳样品的微观结构和微量元素分布;用傅立叶红外光谱仪((FTIR, 型号TRAffinity-1))分析旱柳样品官能团的组成.
2.4 数据分析耐性系数(Tolerance Index, TI)为处理组旱柳株高、根长、鲜重和生长量与对照组相应数值比值的平均值(Wilkins, 1978).富集系数(Bioconcentration Factors, BCF)=Cplant/Csoil, 其中, Cplant和Csoil分别为植物体内Pb含量和土壤Pb含量(mg·kg-1).转移系数(Translocation Factors, TF)计算公式为TF根→地上=C地上/C根, TF根→茎=C茎/C根, TF茎→叶=C叶/C茎, 其中, C地上、C根、C茎和C叶分别为植物地上部分、根、茎、叶的Pb含量(mg·kg-1).
数据用Excel和SPSS13.0软件进行统计分析, 5%水平下LSD多重比较检验平均值之间的差异显著性, 所有测定数据以平均值±标准差表示.
3 结果与讨论(Resultsanddiscussion) 3.1 旱柳对Pb的耐性分析不同含量Pb对旱柳生长情况的影响及耐受性分析结果见表 1.由表可知, 随着土壤Pb含量的不断升高, 旱柳的株高、根长、鲜重和生长量均呈现先略微增加而后明显减少的趋势.当土壤含量处于较低水平时(≤600 mg·kg-1), 旱柳的株高和根长与对照相比没有明显差异, 但鲜重和生长量却有显著增加(p < 0.05), Pb含量为600 mg·kg-1时的鲜重和生长量较对照分别增加了27.9%和19.4%.说明中低含量的Pb不但没有对旱柳产生毒害作用, 反而促进了旱柳的生长, 这与刘秀梅等(2002)、孙健等(2007)、闵焕等(2010)、Patra等(1994)、Begonia等(1998)研究结果一致.促进生长的原因可能是进入旱柳体内的Pb能促进旱柳对部分微量元素的吸收和诱导部分碳水化合物的大量表达(如多糖、功能蛋白), 从而促进了旱柳的生长.当土壤Pb含量处于较高水平时(≥1000 mg·kg-1), 旱柳的生长受到了明显的抑制, 株高、根长、鲜重、生长量均显著性减少(p < 0.05), Pb含量为1000 mg·kg-1时的株高、根长、鲜重、生长量较对照分别减少33.84%、32.75%、28.95%和53.79%, 继续增加Pb含量至1200 mg·kg-1, 旱柳的生长情况变化不显著.说明当土壤Pb含量超过1000 mg·kg-1时, 旱柳便会受到明显毒害, 使旱柳出现矮化, 抑制根的生长, 并导致生物量严重下降. Pb对旱柳产生毒害并抑制其生长的原因可能与Pb交联细胞壁胶层中的果胶、抑制根系酸分泌、干扰激素调控等有关.
| 表 1 不同含量Pb胁迫对旱柳生长的影响 Table 1 Influence of different Pb contents stress on Salix matsudana Koidz growth |
根据植物生长和生物量指标计算出的耐性指数可以反映植物对重金属的耐性大小.有研究依据耐性指数大小将重金属耐性植物分为敏感型(TI < 35)、中等耐受性(35≤TI≤60)和高耐受性(TI>60)3种类型(Lux et al., 2004).据此划分, 当土壤Pb含量为中(600 mg·kg-1)、低(200 mg·kg-1)水平时, 即在旱柳没有受到明显Pb毒害的情况下, 旱柳对Pb的耐性指数TI(%)分别可达90.37和108.32, 属于Pb高耐受性植物. 刘秀梅等(2002)研究发现, 草本植物山野豌豆、草木樨、酸模、披碱草、紫苜蓿、羽叶鬼针草对Pb均表现出不同程度的耐性, 在低浓度(200 mg·L-1)Pb胁迫下, 草木樨、酸模、紫苜蓿、羽叶鬼针草的耐性指数均超过100, 其中酸模和羽叶鬼针草的耐性指数可达140, 在中浓度(800 mg·L-1)Pb胁迫下, 酸模和羽叶鬼针草的耐性指数仍然可达120以上. 聂俊华等(2004)研究表明香根草、绿叶苋菜、裂叶荆芥、羽叶鬼针草、紫穗槐和苍耳对Pb均表现出较强的耐性, 在受到500 mg·kg-1Pb胁迫时, 耐性指数均大于100.由此可见, 单从耐性指数来看, 旱柳对Pb的耐性不及羽叶鬼针草、绿叶苋菜、紫穗槐等铅超富集植物.但依据刘秀梅等(2002)提出的植物对重金属耐性临界值的确定方法可得旱柳对Pb的耐性上限和下限分别可达1235.3 mg·kg-1和7105.3 mg·kg-1, 从耐受限值来看, 旱柳对Pb所表现出耐性是相当可观的.
3.2 旱柳对Pb的富集与转运特征分析旱柳根、茎、叶Pb含量及Pb在旱柳体内的富集与转运系数见表 2.由表可知, 旱柳对铅的富集系数相当高, 均值达到7.5773, 最大值接近9, 远大于1, 单从富集系数来看, 旱柳对Pb的富集能力很强, 高于铅超富集植物羽叶鬼针草(王红旗等, 2005)和小鳞苔草(胡宗达等, 2007).随着土壤Pb含量的不断升高, 旱柳根、茎、叶Pb含量不断增加, 其中根增加最为显著(p < 0.05), 而茎、叶均表现为中低含量(≤600 mg·kg-1)时增加显著(p < 0.05), 高含量(≥1000 mg·kg-1)时增加不明显.研究同时发现, 当土壤Pb含量处于同一水平时, 旱柳根、茎、叶Pb含量大小排序为根>茎>叶.说明Pb进入旱柳植株体内后主要富集在根部, 这与重金属元素在大部分耐性木本植物体内赋存规律类似(陈岩松等, 2007;Turnau et al., 2001;Unterbrunner et al., 2007;Dong et al., 2007). Pb在旱柳体内的转运系数同样反映了上述现象, 根向地上部分的转运系数范围为0.4247~0.8130, 根向茎的转运系数范围为0.7095~0.9683, 茎向叶的转运系数范围为0.0328~0.4095, 转运系数均小于1, 说明旱柳对Pb的转运能力较弱, 不及羽叶鬼针草(刘秀梅等, 2002)、绿叶苋菜(聂俊华等, 2004)、金丝草(侯晓龙等, 2012)等铅超富集植物, 这也成为应用旱柳修复Pb污染土壤主要限制性因素.目前尚无关于Pb在旱柳根部富集机理方面的文献报道, 但有研究发现当旱柳受到Cu胁迫时, 根系细胞壁会合成大量的葡聚糖, 形成防御层, 用于截留Cu离子, 限制其跨膜运输(Yang et al., 2015a).同时也有大量研究表明, 离子转运器的类型与表达直接影响植物根系重金属离子的跨膜运输., 通常情况下, 重金属含量过高会抑制对应离子转运器的表达(Pence et al., 2000;Thomine et al., 2000;Eren and Argüello, 2004;Papoyan and Kochian, 2004).因此, Pb在旱柳根部的富集可能与细胞壁的束缚、Pb离子转运器的表达相关.
| 表 2 旱柳根、茎、叶Pb含量及富集与转移系数 Table 2 Pb contents in roots, stems and leaves and bioconcentration and translocation factors of Salix matsudana Koidz |
不同含量Pb胁迫下旱柳叶绿素和根、茎、叶丙二醛(MDA)的含量变化情况见表 3.从表中可知, 随着Pb含量的不断升高, 叶绿素的含量呈现先增加后减少的趋势.当Pb含量处于较低水平时(≤600 mg·kg-1), 叶绿素含量随着Pb含量的升高而不断增加, 且增加显著(p < 0.05).表明较低水平含量的Pb能够促进叶绿素的合成, 这与闵焕等(2010)、Kaznina等(2005)研究结果一致, 原因可能是低水平含量的Pb能够促进叶片对与叶绿素合成有关的矿质元素的吸收.当Pb含量较高时(≥1000 mg·kg-1), 叶绿素含量与空白相比有所下降, 但不显著.由此可见, Pb胁迫对叶绿素的合成基本没有影响, 在培养过程中, 也未发现叶片出现失绿的情况, 这也充分证实了上述叶绿素的分析结果.尽管Pb对旱柳叶绿素的含量影响不大, 但仍可以通过抑制旱柳光能吸收、电子传递和CO2固定等光合作用过程来影响其生长, 最终表现为生物量严重下降(钱永强等, 2011).
| 表 3 不同含量Pb胁迫下旱柳叶绿素和根、茎、叶丙二醛的含量 Table 3 Contents of chlorophyll and malondialdehyde in roots, stems, and leaves of Salix matsudana Koidz under different Pb contents stress |
丙二醛(MDA)是膜脂过氧化最重要的产物之一, 它的产生能够加剧膜的损伤, 导致细胞内电解质外渗量增加, 严重时会影响线粒体呼吸链复合物及线粒体内关键酶的活性, 引起蛋白质、核酸等生命大分子的的交联聚合.因此, 可以通过MDA的含量了解Pb胁迫下旱柳根、茎、叶细胞膜的膜脂过氧化程度和膜系统的受损程度.由表 3可知, 随着Pb含量的不断提高, 旱柳根、茎、叶中的MDA的含量均表现出不同程度的增加, 且均以Pb含量600 mg·kg-1为界, 低于600 mg·kg-1时, 增加不显著, 超过600 mg·kg-1时, 显著增加(p < 0.05).由此可见, 当Pb含量超过600 mg·kg-1时, 旱柳各组织细胞会产生明显的膜脂过氧化作用, 导致细胞膜受损, 进而会对线粒体、叶绿体等细胞器产生毒害, 干扰旱柳正常的生理过程, 抑制旱柳生长.
重金属胁迫能导致植物体内产生大量的活性氧自由基(ROS), 如羟基自由基(·OH)、过氧化氢(H2O2)等, ROS能与脂类、蛋白质、色素和核酸等生物大分子发生作用, 导致膜脂过氧化、细胞膜损伤和酶失活.而木本植物体内以超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)为主的酶促抗氧化系统均可在一定范围内清除过多的ROS, 保护细胞免受毒害, 维持机体自由基代谢平衡.如图 1所示, 随着Pb含量的不断提高, 旱柳根、茎、叶中的SOD、CAT、POD的含量均表现为先增加后减少.对于SOD(图 1a), 根、茎、叶中的含量分别在Pb含量为200、600、600 mg·kg-1时达到峰值, 与空白相比增加显著(p < 0.05), 而后不断下降.对于CAT(图 1b), 根、茎、叶中的含量均在Pb含量为600 mg·kg-1时达到峰值, 与空白相比增加显著(p < 0.05), 而后不断下降.对于POD(图 1c), 根、茎、叶中的含量均在Pb含量为200 mg·kg-1时达到峰值, 与空白相比增加显著(p < 0.05), 而后严重下降.从中可以看出, 当Pb含量≤600 mg·kg-1时, 抗氧化酶系统基本能清除因Pb胁迫产生的过量ROS, 维持旱柳体内的自由基代谢平衡, 使细胞免受毒害, 旱柳能够正常生长.但当Pb含量超过600 mg·kg-1时, 机体内的ROS产生量超出了抗氧化酶的清除能力, 自由基代谢平衡被打破, 没有被清除的ROS对细胞产生了毒害作用, 抑制了旱柳的生长.这也充分验证了Pb胁迫对旱柳生长的影响及MDA含量的分析结果, 说明土培条件下, 旱柳对Pb的耐性阈值为600 mg·kg-1.
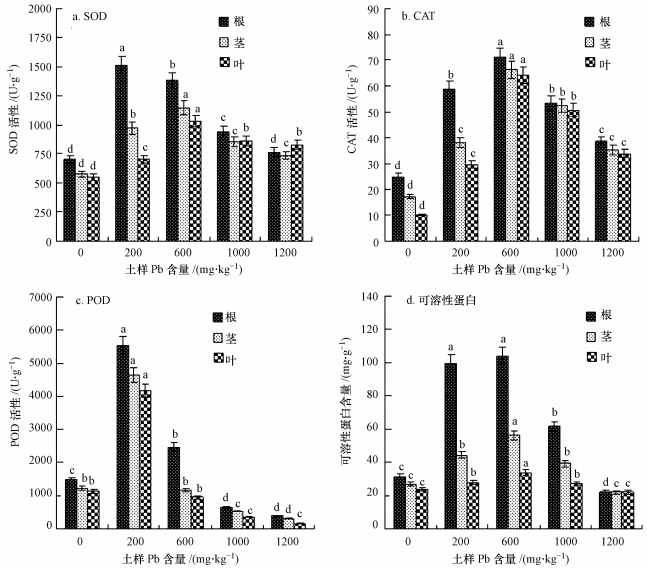 |
| 图 1 不同含量Pb胁迫下旱柳根、茎、叶(a)超氧化物歧化酶(SOD)、(b)过氧化氢酶(CAT)、(c)过氧化物酶(POD)、的活性和(d)可溶性蛋白的含量 Fig. 1 Activity of (a) superoxide dismutase, (b) catalase, (c) peroxidase and the contents of (d) soluble protein in roots, stems and leaves of Salix matsudana Koidz under different Pb contents stress |
可溶性蛋白含量的高低在很大程度上决定着旱柳各组织细胞解毒能力大小, 这是因为植物对重金属的主要解毒机制就是与金属硫蛋白(MTs)或植物螯合肽(PCs)结合, 形成重金属结合肽, 以减少对细胞的毒害(谭万能等, 2006;郝瑞芝等, 2012).而金属硫蛋白和植物螯合肽均可以通过可溶性蛋白来反映.不同Pb含量胁迫下旱柳根、茎、叶中的可溶性蛋白(图 1d)的含量所反映出了规律与抗氧化酶相似, 也是在Pb含量为600 mg·kg-1时达到最大值, 而后严重下降.说明当Pb含量超过600 mg·kg-1时, 金属硫蛋白和植物螯合肽的表达受到抑制, 不能结合更多的Pb, 导致细胞遭受毒害, 进而抑制生长.
3.3.2 不同组织微观结构响应采用扫描透射电镜(STEM)分析比较了空白与Pb含量为1000 mg·kg-1时的旱柳根、茎、叶微观结构, 结果见图 2.
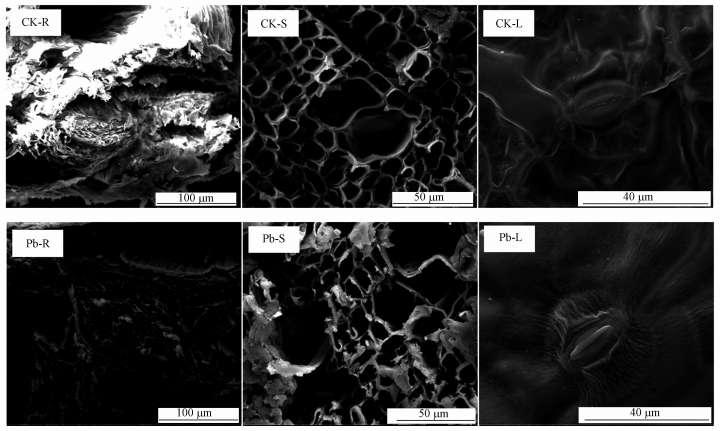 |
| 图 2 Pb胁迫对旱柳根、茎、叶微观结构的影响 Fig. 2 Influence of Pb contents stress on microstructure of roots, stems and leaves of Salix matsudana Koidz |
由空白对照组根系(CK-R)和1000 mg·kg-1Pb处理组根系(Pb-R)的STEM可知, 对照组根系呈乳白色, 表面光洁, 基本无附着物.处理组根系大部分区域发黑, 多处萎蔫并出现结晶体, 这些结晶体大部分为Pb.说明过量的Pb积累在根部, 导致了严重的膜脂过氧化和膜损伤, 细胞液渗透量增加, 细胞水分失衡, 发生脱水, 导致根系发黑、萎蔫.这也佐证了前述Pb胁迫时根系生长和MDA含量的分析结果.由空白对照组茎(CK-S)和1000 mg·kg-1Pb处理组茎(Pb-S)的STEM可知, 对照组茎部结构明朗、完整, 导管无堵塞, 而处理组茎部发生了不同程度的变形, 部分导管发生堵塞.说明过量的Pb也对茎部的细胞结构造成了破坏, 致使导管变形、堵塞, 阻碍了水分和营养物质的传输, 进而抑制了叶绿素及部分碳水化合物的合成, 这也充分验证了前述叶绿素含量的分析结果.叶绿素和碳水化合物合成的抑制最终导致旱柳生物量的下降.由空白对照组叶片(CK-L)和1000 mg·kg-1Pb处理组叶片(Pb-L)的STEM可知, 对照组与处理组叶片之间的差异最为明显.对照组叶片表面光滑、无褶皱, 气孔结构完整.而处理组叶面及气孔周边发生了非常明显的褶皱, 这验证了实际观测结果, 即在受到高含量Pb胁迫时, 旱柳叶片会发生不同程度的卷曲.此外, 处理组气孔结构也受到了明显的破坏, 妨碍了叶片对CO2的吸收利用, 导致旱柳光合作用不能正常进行, 进而导致旱柳生物量严重下降.
3.3.3 不同组织官能团组成响应采用TRAffinity-1型傅立叶红外光谱仪(FTIR)分析了不同含量Pb胁迫对旱柳根、茎、叶官能团组成的影响, 结果见图 3.由图可知, 3600~3700 cm-1波数范围内出现的吸收峰对应的是羟基(O—H).对于根系(图 3a), 该范围内出现了2个明显的吸收峰, 分别对应2类羟基. 3699.47 cm-1处吸收峰对应的为自由羟基, 从图中可以看出, 当Pb含量由0提高至600 mg·kg-1时, 该处吸收峰不断减弱, 但不明显, 说明根系Pb胁迫产生的羟基自由基得到了有效的清除, 但当Pb含量超过600 mg·kg-1后, 该处吸收峰明显增强, 说明根系细胞受到毒害, 无法清除过量的羟基自由基. 3622.32 cm-1处吸收峰对应的为连生羟基, 此类羟基可能是多糖类生物大分子物质所携带的羟基, 该处吸收峰的出现在很大程度上可以说明旱柳根系在受到Pb胁迫时会合成大量的多糖类物质(如葡聚糖), 集聚在细胞壁周围, 用以截留Pb离子, 限制其跨膜运输, 由图可知, 该处吸收峰随着Pb含量的提高越来越弱, 说明Pb胁迫会抑制根系多糖类物质的合成, 限制多糖类物质对细胞的保护作用.对于茎和叶, 通过与根系红外光谱对比分析(图 3d)可知, 3600~3700 cm-1波数范围内无明显吸收峰, 说明Pb胁迫所造成的膜脂过氧化主要集中发生在旱柳根系., 也进一步说明Pb胁迫主要对旱柳根系产生毒害.
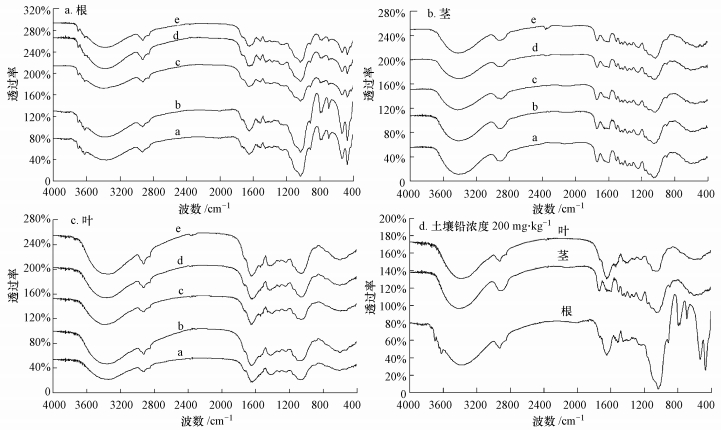 |
| 图 3 不同含量Pb胁迫对旱柳根、茎、叶官能团的影响(a. CK, b.200 mg·kg-1, c.600 mg·kg-1, d.1000 mg·kg-1, e.1200 mg·kg-1) Fig. 3 Influence of different Pb contents stress on functional groups of roots, stems and leaves of Salix matsudana Koidz (a. CK, b.200 mg·kg-1, c.600 mg·kg-1, d.1000 mg·kg-1, e.1200 mg·kg-1) |
2852.72 cm-1处吸收峰对应的是巯基(S—H).对于根系(图 3a), 该处吸收峰随着Pb含量的提高由弱变强, 说明旱柳根系受到Pb胁迫后会大量合成金属硫蛋白(MTs), MTs是一种富含Cys残基的低分子金属结合蛋白, Cys残基携有巯基, 能与重金属结合, 形成无毒或者低毒的络合物(谭万能, 等, 2006).叶片(图 3c)存在相似的规律, 说明叶片细胞也能合成MTs, 用以解除Pb的毒害, 而茎(图 3b)无此吸收峰, 说明茎对Pb的解毒方式可能与根、茎不同.
1651.07 cm-1和1035.77 cm-1处吸收峰分别对应的是羰基(CO)和碳氧键(C—O), 此2处吸收峰的存在, 结合羟基吸收峰, 基本可以断定机体内存在有机酸.对于根系(图 3a), 随着Pb含量的提高, 此2处吸收峰在Pb含量低于200 mg·kg-1时有所增强, 在Pb含量超过200 mg·kg-1后明显减弱.说明Pb胁迫会抑制根系有机酸的分泌, 而有机酸可以络合Pb, 降低Pb的毒性, 解除Pb对旱柳的毒害. 图 3c表明叶中也存在一定数量的有机酸, 但有机酸特征吸收峰随Pb含量的变化不明显, 说明Pb对叶片的毒害可能更多地表现在对光合作用的影响上.从图 3b可以看出, 茎中有机酸的特征吸收峰并不明显, 同样说明茎解除Pb毒害的机制有别于根和叶, 值得进一步深究.
3.3.4 不同组织矿质元素吸收响应用X射线能谱仪(energy-dispersive X-ray analyser, EDAX)分析了旱柳在受到不同含量(CK、600、1000 mg·kg-1)Pb胁迫后根(R)、茎(S)、叶(L)中微量元素的分布情况, 结果见图 4.
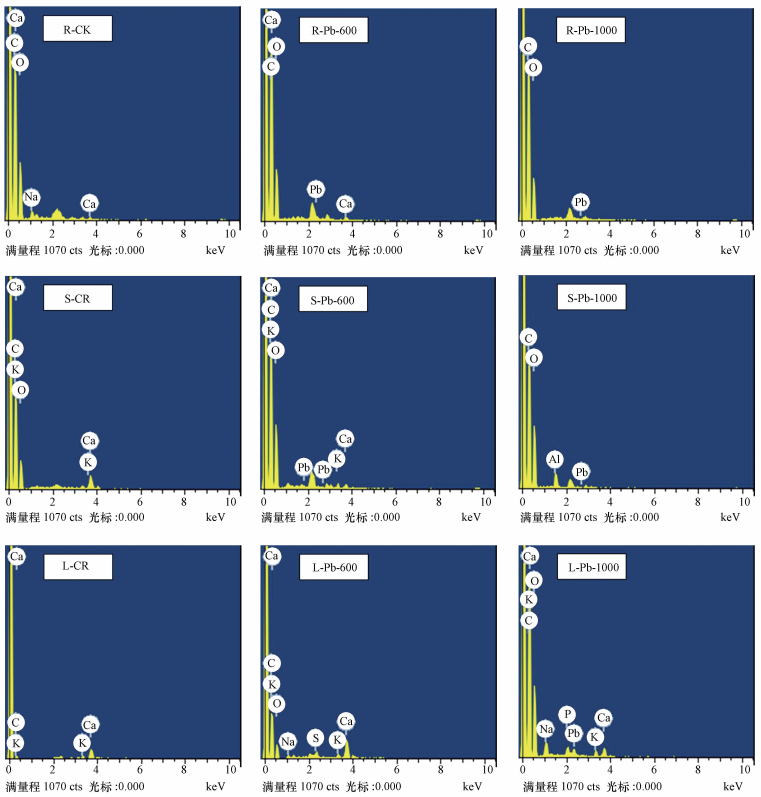 |
| 图 4 不同含量Pb胁迫对旱柳根、茎、叶矿质元素吸收的影响 Fig. 4 Influence of different Pb contents stress on mineral element absorption of roots, stems and leaves of Salix matsudana Koidz |
从图中可以看出, 低含量(600 mg·kg-1)的Pb对旱柳根、茎、叶中的矿质元素的含量基本没有影响, 在一定程度上还促进叶片对Ca、K、Na等矿质元素的吸收, 有利于旱柳的生长, 特别是促进了叶片对S的吸收, 有助于叶片合成金属硫蛋白, 用以解除Pb毒害, 保证旱柳正常生长.这也充分解释了为什么低含量Pb胁迫时旱柳根、茎、叶细胞中的SOD)、CAT、POD活性较高.高含量(1000 mg·kg-1)的Pb明显抑制了根、茎对Ca、K吸收, 而Ca的缺失会导致根、茎变得坚硬, 容易分裂、破败, 使导管发生堵塞, 妨碍了水分与营养物质的传输, 这在STEM分析结果(图 2)中得到了证实.水分和营养物质的缺失会严重影响部分功能蛋白(如抗氧化酶)的合成, 也是导致酶活性下降的可能原因之一, 同时还会使叶片发生褶皱、卷曲.由此可见, Pb胁迫干扰了旱柳对矿质元素的吸收和利用, 不利于旱柳的生长.当然Pb胁迫对矿质元素吸收的干扰机制十分复杂, 仅通过能谱分析还难以诠释全部, 值得进一步深究.
4 结论(Conclusions)1) 旱柳对Pb的耐性、富集、转运研究结果表明, 较低含量(≤600 mg·kg-1)的Pb对旱柳的生长有促进作用, 高含量(≥1000 mg·kg-1)的Pb则明显抑制旱柳的生长.旱柳对Pb的耐性指数TI(%)可达108.32, 属Pb高耐受性植物.旱柳对Pb的富集能力很强, 富集系数均值可达7.5773, 而对Pb的转运能力较弱, 转运系数均小于1, Pb主要富集在旱柳根部, 无法充分利用丰富的地上生物量, 限制了其在重金属污染土壤修复中的应用.
2) 旱柳对Pb胁迫生理生化响应分析结果表明, 低含量Pb胁迫不影响叶绿素的合成, 对细胞的损伤也不大, 而高含量Pb胁迫会明显抑制叶绿素的合成, 并导致严重的膜脂过氧化和膜损伤, 对细胞产生明显的毒害作用.抗氧化酶及可溶性蛋白能够对低含量Pb胁迫做出积极有效的响应, 但无法解除高含量Pb胁迫对旱柳产生的毒害.
3) STEM分析结果表明, Pb胁迫会使根系发黑、萎蔫, 茎部导管破败、堵塞, 叶片褶皱、卷曲, 破坏气孔结构. FTIR分析结果表明, Pb胁迫会使导致膜脂过氧化和膜损伤的自由羟基增多, 而使对Pb具有络合、螯合作用的连生羟基、巯基、羰基数量减少. EDAX分析结果表明, Pb胁迫会抑制大量元素Ca、K的吸收, 同时干扰其他矿质元素的吸收利用.
| [${referVo.labelOrder}] | Begonia G B, Davis C D, Begonia M F T, et al. 1998. Growth responses of Indian mustard [Brassica juncea (L.) Czern.] and its phytoextraction of lead from a contaminated soil[J]. Bulletin of Environmental Contamination and Toxicology , 61 (1) : 38–43. DOI:10.1007/s001289900726 |
| [${referVo.labelOrder}] | Chen H M, Zheng C R, Tu C, et al. 2000. Chemical methods and phytoremediation of soil contaminated with heavy metals[J]. Chemosphere , 41 (1/2) : 229–234. |
| [${referVo.labelOrder}] | 陈岩松, 吴若菁, 庄捷, 等.2007. 木本植物重金属毒害及抗性机理[J]. 福建林业科技 , 2007, 34 (1) : 50–55. |
| [${referVo.labelOrder}] | Dong J, Mao W H, Zhang G P, et al. 2007. Root excretion and plant tolerance to cadmium toxicity-a review[J]. Plant Soil and Environment , 53 (5) : 193–200. |
| [${referVo.labelOrder}] | Eren E, Argüello J M. 2004. Arabidopsis HMA2, a divalent heavy metal-transporting PIB-type ATPase, is involved in cytoplasmic Zn2+ homeostasis[J]. Plant Physiology , 136 (3) : 3712–3723. DOI:10.1104/pp.104.046292 |
| [${referVo.labelOrder}] | Garbisu C, Alkorta I. 2001. Phytoextraction: a cost-effective plant-based technology for the removal of metals from the environment[J]. Bioresource Technology , 77 (3) : 229–236. DOI:10.1016/S0960-8524(00)00108-5 |
| [${referVo.labelOrder}] | Guo G L, Zhou Q X, Ma L Q. 2006. Availability and assessment of fixing additives for the in situ remediation of heavy metal contaminated soils: A review[J]. Environmental Monitoring and Assessment , 116 (1/3) : 513–528. |
| [${referVo.labelOrder}] | 郝瑞芝, 余洋, 武佳叶, 等.2012. 树木对重金属的抗性机理研究进展[J]. 中国农学通报 , 2012, 28 (10) : 6–12. |
| [${referVo.labelOrder}] | 侯晓龙, 常青山, 刘国锋, 等.2012. Pb超富集植物金丝草(Pogonatherum crinitum)、柳叶箬(Lsache globosa)[J]. 环境工程学报 , 2012, 6 (3) : 989–994. |
| [${referVo.labelOrder}] | 胡宗达, 杨远祥, 朱雪梅, 等.2007. Pb, Zn对超富集植物(小鳞苔草)抗氧化酶活性的影响[J]. 水土保持学报 , 2007, 21 (6) : 86–91. |
| [${referVo.labelOrder}] | 黄秋婵, 韦友欢.2009. 阳生植物和阴生植物叶绿素含量的比较分析[J]. 湖北农业科学 , 2009, 48 (8) : 1923–1924. |
| [${referVo.labelOrder}] | Japenga J, Koopmans G F, Song J, et al. 2007. A feasibility test to estimate the duration of phytoextraction of heavy metals from polluted soils[J]. International Journal of Phytoremediation , 9 (2) : 115–132. DOI:10.1080/15226510701232773 |
| [${referVo.labelOrder}] | 贾中民, 王力, 魏虹, 等.2013. 垂柳和旱柳对镉的积累及生长光合响应比较分析[J]. 林业科学 , 2013, 49 (11) : 51–59. |
| [${referVo.labelOrder}] | Kaznina N M, Laidinen G F, Titov A F, et al. 2005. Effect of lead on the photosynthetic apparatus of annual grasses[J]. Biology Bulletin , 32 (2) : 147–150. DOI:10.1007/s10525-005-0022-5 |
| [${referVo.labelOrder}] | 雷鸣, 曾敏, 王利红, 等.2010. 湖南市场和污染区稻米中As、Pb、Cd污染及其健康风险评价[J]. 环境科学学报 , 2010, 30 (11) : 2314–2320. |
| [${referVo.labelOrder}] | 李合生. 2006. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社: 164 -169. |
| [${referVo.labelOrder}] | 刘秀梅, 聂俊华, 王庆仁.2002. 6种植物对Pb的吸收与耐性研究[J]. 植物生态学报 , 2002, 26 (5) : 533–537. |
| [${referVo.labelOrder}] | 刘砚韬, 王振伟, 张伶俐.2013. 过氧化氢酶活性测定的新方法[J]. 华西药学杂志 , 2013, 28 (4) : 403–405. |
| [${referVo.labelOrder}] | Lux A, Šottníková A, Opatrná J, et al. 2004. Differences in structure of adventitious roots in Salix clones with contrasting characteristics of cadmium accumulation and sensitivity[J]. Physiologia Plantarum , 120 (4) : 537–545. DOI:10.1111/ppl.2004.120.issue-4 |
| [${referVo.labelOrder}] | 闵焕, 祖艳群, 李元.2010. Pb胁迫对圆叶无心菜(Arenaria rotumdifolia Bieberstein)生长和生理特征的影响[J]. 农业环境科学学报 , 2010, 29 (增刊) : 15–19. |
| [${referVo.labelOrder}] | 聂俊华, 刘秀梅, 王庆仁.2004. Pb(铅)富集植物品种的筛选[J]. 农业工程学报 , 2004, 20 (4) : 255–258. |
| [${referVo.labelOrder}] | Papoyan A, Kochian L V. 2004. Identification of Thlaspi caerulescens genes that may be involved in heavy metal hyperaccumulation and tolerance. Characterization of a novel heavy metal transporting ATPase[J]. Plant Physiology , 136 (3) : 3814–3823. DOI:10.1104/pp.104.044503 |
| [${referVo.labelOrder}] | Patra J, Lenka M, Panda B B. 1994. Tolerance and co-tolerance of the grass Chloris barbata Sw. to mercury, cadmium and zinc[J]. New Phytologist , 128 (1) : 165–171. DOI:10.1111/nph.1994.128.issue-1 |
| [${referVo.labelOrder}] | Pence N S, Larsen P B, Ebbs S D, et al. 2000. The molecular physiology of heavy metal transport in the Zn/Cd hyperaccumulator Thlaspi caerulescens[J]. Proceedings of the National Academy of Sciences of the United States of America , 97 (9) : 4956–4960. DOI:10.1073/pnas.97.9.4956 |
| [${referVo.labelOrder}] | 钱永强, 周晓星, 韩蕾, 等.2011. Cd2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响[J]. 生态学报 , 2011, 31 (20) : 6134–6142. |
| [${referVo.labelOrder}] | 孙健, 铁柏清, 钱湛, 等.2007. 单一重金属胁迫对灯心草生长及生理生化指标的影响[J]. 土壤通报 , 2007, 38 (1) : 121–127. |
| [${referVo.labelOrder}] | 谭万能, 李志安, 邹碧.2006. 植物对重金属耐性的分子生态机理[J]. 植物生态学报 , 2006, 30 (4) : 703–712. |
| [${referVo.labelOrder}] | Thomine S, Wang R C, Ward J M, et al. 2000. Cadmium and iron transport by members of a plant metal transporter family in Arabidopsis with homology to Nramp genes[J]. Proceedings of the National Academy of Sciences of the United States of America , 97 (9) : 4991–4996. DOI:10.1073/pnas.97.9.4991 |
| [${referVo.labelOrder}] | Turnau K, Przyłowicz W J, Mesjasz-Przybyłowcz J. 2001. Heavy metal distribution in Suillus luteus mycorrhizas-as revealed by micro-PIXE analysis[J]. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms , 181 (1/4) : 649–658. |
| [${referVo.labelOrder}] | Unterbrunner R, Puschenreiter M, Sommer P, et al. 2007. Heavy metal accumulation in trees growing on contaminated sites in Central Europe[J]. Environmental Pollution , 148 : 107–114. DOI:10.1016/j.envpol.2006.10.035 |
| [${referVo.labelOrder}] | 王红旗, 李华, 陆泗进.2005. 羽叶鬼针草对Pb的吸收特性及修复潜力[J]. 环境科学 , 2005, 26 (6) : 143–147. |
| [${referVo.labelOrder}] | Wilkins D A. 1978. The measurement of tolerance to edaphic factors by means of root growth[J]. New Phytologist , 80 (3) : 623–633. DOI:10.1111/nph.1978.80.issue-3 |
| [${referVo.labelOrder}] | Wu L H, Luo Y M, Xing X R, et al. 2004. EDTA-enhanced phytoremediation of heavy metal contaminated soil with Indian mustard and associated potential leaching risk[J]. Agriculture, Ecosystems & Environment , 102 (3) : 307–318. |
| [${referVo.labelOrder}] | Xiao W L, Luo C L, Chen Y H, et al. 2008. Bioaccumulation of heavy metals by wild plants growing on copper mine spoils in China[J]. Communications in Soil Science and Plant Analysis , 39 (3/4) : 315–328. |
| [${referVo.labelOrder}] | 杨刚, 沈飞, 钟贵江, 等.2011. 西南山地铅锌矿区耕地土壤和谷类产品重金属含量及健康风险评价[J]. 环境科学学报 , 2011, 31 (9) : 2014–2021. |
| [${referVo.labelOrder}] | Yang J L, Chen Z, Wu S Q, et al. 2015a. Overexpression of the Tamarix hispida ThMT3 gene increases copper tolerance and adventitious root induction in Salix matsudana Koidz[J]. Plant Cell, Tissue and Organ Culture (PCTOC) , 121 (2) : 469–479. DOI:10.1007/s11240-015-0717-3 |
| [${referVo.labelOrder}] | Yang J L, Li K, Zheng W, et al. 2015b. Characterization of early transcriptional responses to cadmium in the root and leaf of Cd-resistant Salix matsudana Koidz[J]. BMC Genomics , 16 (1) : 705. DOI:10.1186/s12864-015-1923-4 |
| [${referVo.labelOrder}] | 杨卫东. 2008.柳树对镉积累、忍耐与解毒生理机制初步研究[D].北京:中国林业科学研究院. 53-60 http://cdmd.cnki.com.cn/article/cdmd-82201-2008136685.htm |
| [${referVo.labelOrder}] | 杨卫东, 李廷强, 丁哲利, 等.2014a. 镉对旱柳幼苗生长及低相对分子质量巯基化合物含量的影响[J]. 浙江大学学报(农业与生命科学版) , 2014a, 40 (5) : 559–567. |
| [${referVo.labelOrder}] | 杨卫东, 李廷强, 丁哲利, 等.2014b. 旱柳幼苗抗坏血酸-谷胱甘肽循环及谷胱甘肽代谢对镉胁迫的响应[J]. 浙江大学学报(农业与生命科学版) , 2014b, 40 (5) : 551–558. |
| [${referVo.labelOrder}] | 杨彦, 李晓芳, 王琼, 等.2014. 基于人体健康模型(IEUBK、ALM)的温岭地区土壤环境铅基准值研究[J]. 环境科学学报 , 2014, 34 (7) : 1808–1817. |
| [${referVo.labelOrder}] | Yu X Z, Gu J D. 2007. Accumulation and distribution of trivalent chromium and effects on hybrid willow (Salix matsudana Koidz×alba L.) metabolism[J]. Archives of Environmental Contamination and Toxicology , 52 (4) : 503–511. DOI:10.1007/s00244-006-0155-7 |
| [${referVo.labelOrder}] | Yu X Z, Gu J D, Xing L Q, et al. 2008. Differences in uptake and translocation of hexavalent and trivalent chromium by two species of willows[J]. Ecotoxicology , 17 (8) : 747–755. DOI:10.1007/s10646-008-0224-y |
| [${referVo.labelOrder}] | 张立军, 樊金娟. 2007. 植物生理学实验教程[M]. 北京: 中国农业大学出版社: 67 -69. |
| [${referVo.labelOrder}] | 郑炳松. 2006. 现代植物生理生化研究技术[M]. 北京: 气象出版社: 90 -91. |
| [${referVo.labelOrder}] | 朱宇恩, 赵烨, 徐东昱, 等.2011. 旱柳(Salix matsudana Koidz)体内Cu迁移特征的水培模拟研究[J]. 环境科学学报 , 2011, 31 (12) : 2740–2747. |
 2016, Vol. 36
2016, Vol. 36


