高级氧化法(AOPs)是废(污)水深度处理领域的研究热点,相较其他深度处理方法具有反应速率快、设备简单易操作、便于联合使用等特点(Ergas et al.,2006;Pera Titus et al.,2004; Hua et al.,1997).在高级氧化工艺中,通常由加入氧化剂、催化剂或借助紫外光、超声波等途径产生大量的羟基自由基(·OH),利用其无选择性高氧化能力(2.80 V)对废水中难降解有机污染物进行分解(Gogate et al.,2004; Xu et al.,2013).因此,对比研究不同AOPs的·OH产率对选择废(污)水深度处理方法具有重要意义.
在诸多高级氧化法中,臭氧(O3)为清洁试剂,真空紫外光(VUV)和超声波(US)为物理辐照,均不产生二次污染,因而在去除难降解有机物方面倍受关注.其中,O3氧化法除O3分子直接与有机物反应外,同时也能发生链式反应产生·OH(徐新华等,2003; Ciardelli et al.,2001).低压汞灯(即VUV灯)可同时辐照185和254 nm波长的紫外光作用于水体,水分子吸收185 nm波段的紫外光后发生均裂反应(式(1))和光化电离反应(式(2))产生·OH,量子产率Φ分别是0.33和0.045(Zoschke et al.,2014).US一般作为高级氧化辅助手段,产生协同作用提高氧化效率,也可通过“空化”作用产生·OH(式(3))(Zhou et al.,2014; Gultekin et al.,2006).
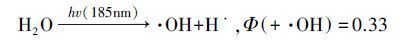
|
(1) |
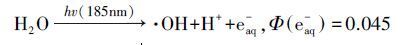
|
(2) |
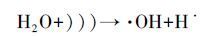
|
(3) |
在之前的研究中发现,上述3种氧化方法单独氧化印染废水尾水时,由于残留有机物浓度很低,致使推动力不足,矿化度不高(Feiyue et al.,2013; 李文杰等,2014).而有研究表明,O3、VUV和US之间的两两组合能体现出协同效应,从而提高有机物分解效率.如有研究利用UV、O3处理市政尾水,反应150 min后,UV/O3联合使用的DOC去除率达90%,较O3单独氧化效率提高了54%(Gong et al.,2008).李文杰等(2014)采用VUV/US氧化印染废水尾水,最优条件下较VUV和US单独氧化的DOC去除率分别提高了10%和22%.Lesko等(2006)在研究US和O3对苯酚的氧化机理时,发现了二者的协同效应,TOC去除效率较O3单独处理提升了43%.但这些研究均以有机物去除率比较为基础,并未从产·OH量的本质上揭开产生该效应的原因.
由于·OH的存在时间仅为10-10 s级别,因而难以直接测定其浓度.任学昌等(2008)研究表明,以水杨酸(SA)为分子探针,在适宜条件下,SA可捕捉·OH生成中间产物2,3-二羟基苯甲酸(2,3-DHBA)或2,5-二羟基苯甲酸(2,5-DHBA),再用HPLC联合荧光检测器检测中间产物即可观察高级氧化过程中·OH的变化.综上,本实验构建VUV-US-O3三元氧化体系,以SA为分子模型,利用HPLC和荧光检测器测定SA及其羟基化产物的变化,从而避开废水中有机物的差异影响,通过比较各体系产·OH量的差异来分析阐明三元氧化体系的协同作用机理.
2 材料与方法(Materials and methods) 2.1 试剂SA和2,5-DHBA为麦克林试剂,乙酸、乙酸纳、乙腈均为国产分析纯,HPLC流动相用水为Milli-Q Advantage A 10制备的超纯水.
2.2 实验装置由有机玻璃定制而成的三元氧化体系反应装置如图 1所示.反应发生在高为210 mm、内径为96 mm的圆柱形反应容器中,功率为100 W,声能密度约2 W·cm-2的超声波振子(南京艾科天喜)置于玻璃反应器底部,以纯水为传播介质发射600 Hz超声波.功率为15 W的低压汞灯(广州三晟)外包石英管套,垂直浸没于水中,发射光强约25 mW·cm-2.O3由臭氧发生器(CH-ZTW3G)电击产生,通过多孔曝气头通入水中,流量为1 L·min-1,浓度为12 mg·L-1.SA溶液由隔膜泵泵入循环管路,在25 ℃恒温水浴中保持恒温.
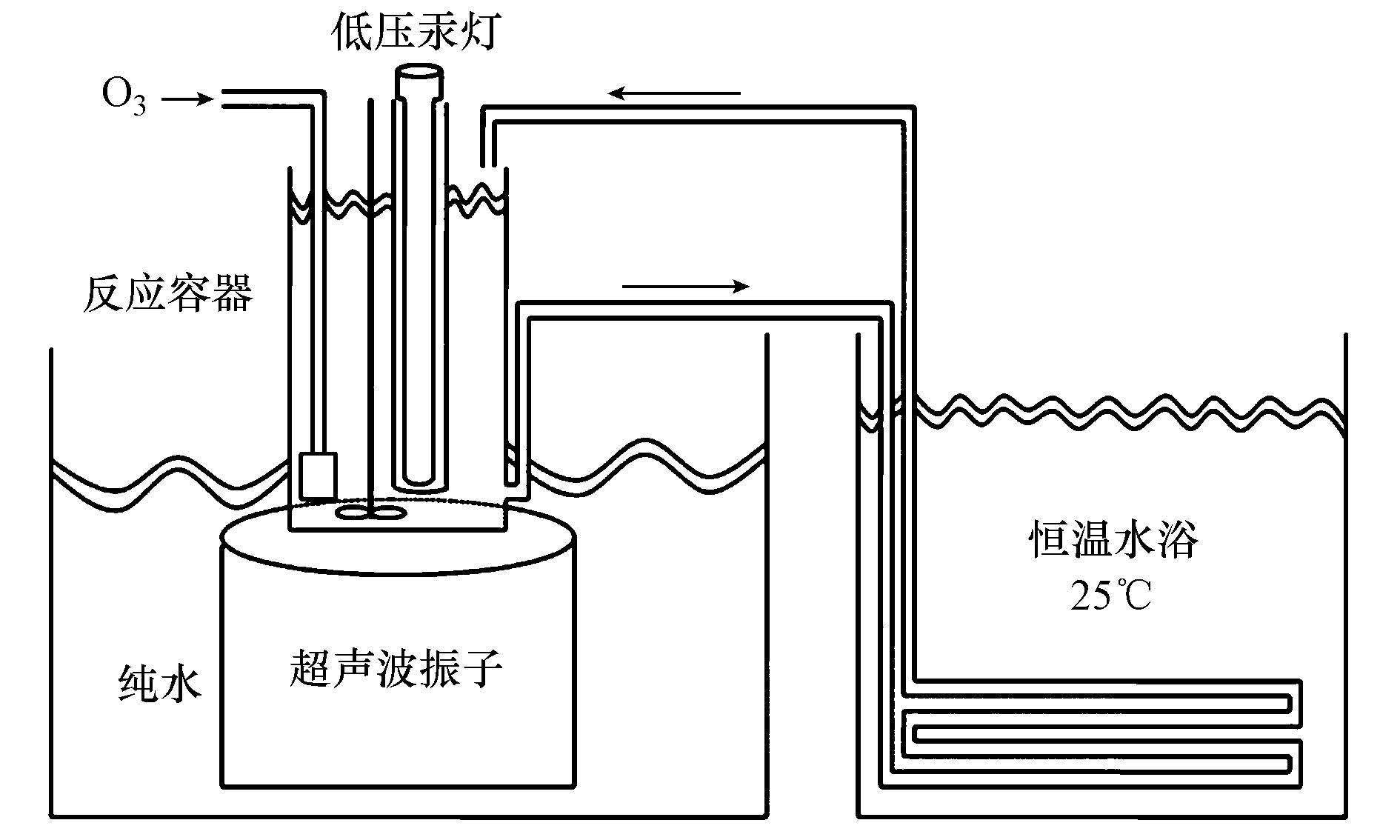 |
| 图 1 实验装置示意图 Fig. 1 The device of Multi-oxidation system |
实验前,分别开启O3反应器和VUV灯运行10 min稳定与预热,再将1 L初始浓度为80 mg·L-1(0.58 mmol·L-1)的SA溶液倒入反应器中,开启循环水泵和搅拌浆后启动超声振动仪,反应计时并分别在5、10、30、60、90 、120 min时取样.每组进行3次平行实验取平均值.
2.3 分析方法 2.3.1 色谱条件SA及其羟基化产物(2,5-DHBA)浓度由Waters e2695高效液相色谱仪(HPLC)和Waters 2475荧光检测器联用检测,流动相为10%的乙腈和90%的乙酸-乙酸钠(30 mmol·L-1,pH=4.9),流速为1.2 mL·min-1;激发波长和检测波长分别为237和431 nm.在该色谱条件下,SA和2,5-DHBA的停留时间分别为8.17和3.82 min.
图 2为SA及其羟基化产物的HPLC色谱图,由图可知,SA和2,5-DHBA可达到基线分离,避开实际样品中的杂质干扰,且在实验过程中仅检测到2,5-DHBA为SA唯一的羟基化产物,表明以SA为分子探针研究AOPs中·OH产率是可行的.
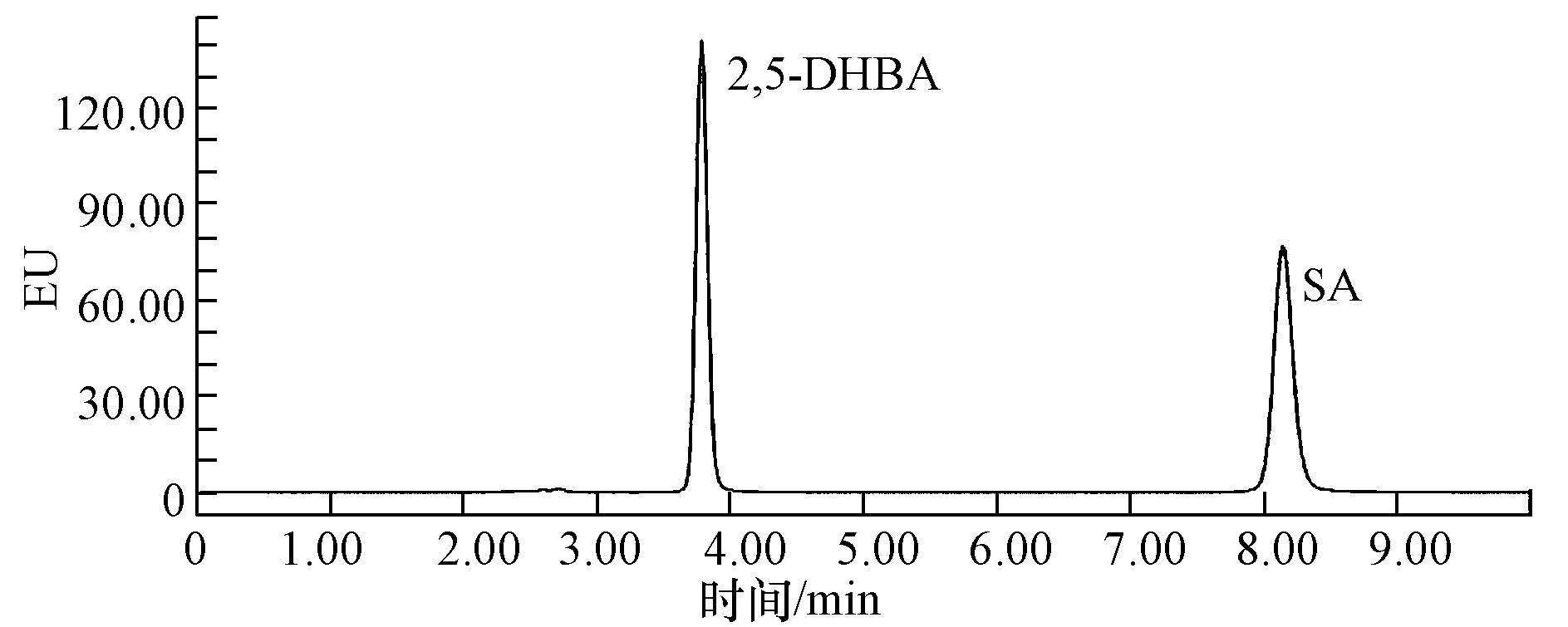 |
| 图 2 SA及其羟基化产物色谱图 Fig. 2 The chromatogram of SA and 2,5-DHBA |
精确配置一系列浓度在1~150 μmol·L-1的SA和2,5-DHBA混合标准溶液,通过HPLC测定相应的峰面积(S),并与对应浓度C(μmol·L-1)进行线性回归,得到标准工作曲线(式(4)、(5)和图 3),拟合结果表明,该工作曲线可决系数较高,SA测定·OH浓度实验结果稳定可靠.
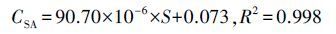
|
(4) |
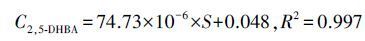
|
(5) |
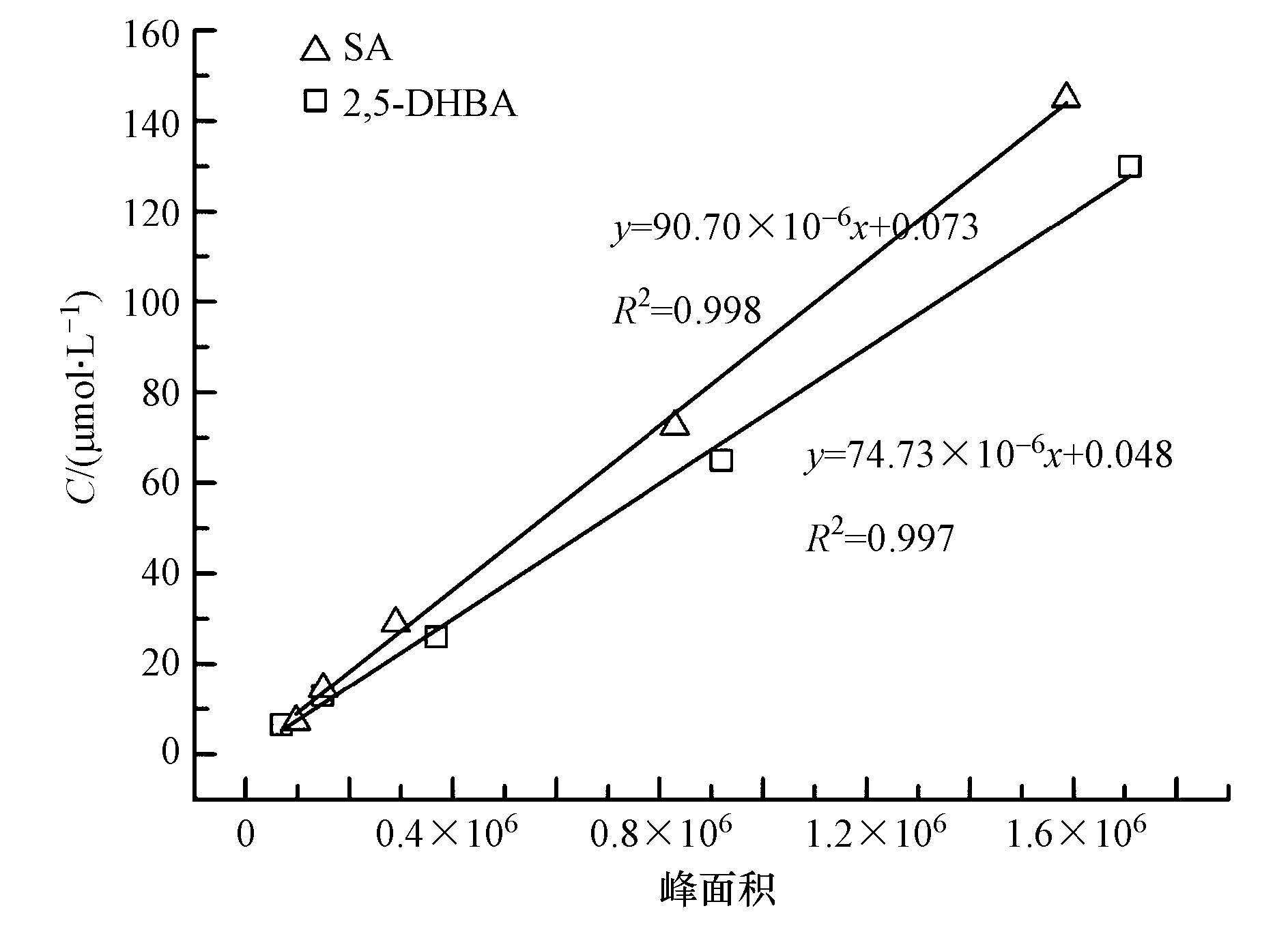 |
| 图 3 SA和2,5-DHBA的标准工作曲线图 Fig. 3 The working curves of SA and 2,5-DHBA standard samples |
3 种氧化法(VUV、US、O3)及其联合工艺(VUV/O3、VUV/US、US/O3、VUV/US/O3)对SA的去除效果如图 4所示.由图 4可见,3种单独氧化法对SA氧化能力大小排序为:O3>VUV>US,在O3和VUV氧化下,SA去除率随着反应进程逐渐增高,120 min时分别为36.06%和50.69%.而US一般作为辅助氧化法对SA的氧化效能则不明显,120 min内去除率仅为8.60%.
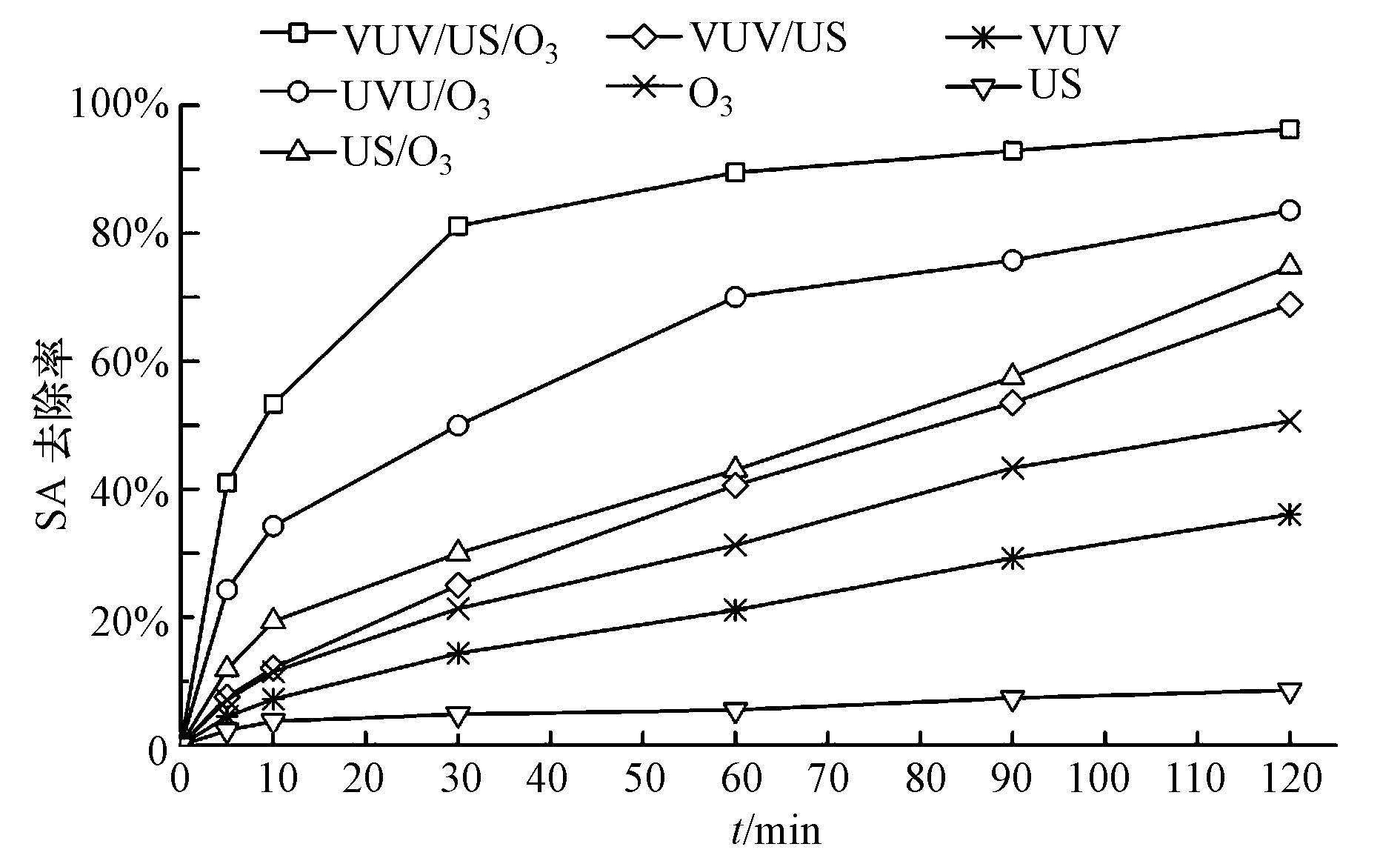 |
| 图 4 各氧化法及其联合工艺(VUV-US-O3)对SA的去除效果 Fig. 4 The removal rates of SA by VUV-US-O3 system |
各组合工艺对SA的去除效率随反应进程均体现出逐步提高的趋势,氧化能力大小排序为:VUV/US/O3> VUV/O3>US/O3>VUV/US,120 min时的去除效率分别为96.27%、83.57%、74.80%、68.88%.进一步分析可以得到,VUV联合O3后,SA去除率较VUV和O3单独氧化分别提高了47.51%和32.90%;VUV联合US后较VUV和US单独氧化效率分别提高了32.82%和60.28%;而将US辅助O3氧化后,SA去除率则较O3和US单独处理分别提高了24.13%和66.20%.可见,VUV、US、O3两两间的二元组合对SA的氧化均表现出明显的协同增效作用.此外,再将US与VUV/O3联合组成的VUV/US/O3三元氧化体系较VUV/O3二元体系的氧化能力亦得到了明显的提高,120 min内SA的去除效率增加了12.70%,体现了VUV/O3与US之间的协同效应.根据VUV、O3的氧化原理,VUV对SA去除率的贡献可来源于VUV通过光解H2O产生的·OH氧化和吸收紫外光光能破坏有机物结构(Azrague et al.,2005; Lau et al.,2007),O3对SA的降解应与O3直接氧化和O3分解产生的·OH有关(Steahelin et al.,1982;1985).为此,判断协同效应是由于自由基产量的增加还是与氧化性质的改变有关,需要进一步实验分析.
3.2 三元氧化体系中羟基化产物2,5-DHBA的变化本文通过测定三元氧化体系中SA分子探针捕捉·OH后生成的羟基化产物2,5-DHBA的变化判断各氧化法的氧化途径,对比联合工艺的·OH产生效率,深入探究协同效应的原理.
3.2.1 VUV/US体系中2,5-DHBA浓度的变化图 5是在VUV/US联合工艺中氧化SA过程中,其羟基化产物2,5-DHBA的浓度变化曲线图.由图 5可见,VUV/US和VUV氧化均可产生一定量的·OH,30 min时测得2,5-DHBA最高浓度分别为7.51和5.22 μmol·L-1.反应30 min后,羟基化产物的浓度开始下降,直至120 min时VUV/US联合工艺中仅检测到0.97 μmol·L-1的2,5-DHBA.这是由于反应一段时间后,溶液中SA浓度降低,而产生的·OH无选择性,进一步氧化分解了已产生的2,5-DHBA.US单独氧化SA时产生的羟基化产物非常少,测得2,5-DHBA浓度最多仅为0.33 μmol·L-1,表明US的氧化能力一般,在实际应用中应只能作为辅助氧化手段.
 |
| 图 5 VUV/US体系中2,5-DHBA浓度的变化 Fig. 5 The generation of 2,5-DHBA in VUV/US process |
比较VUV/US和VUV、US单独氧化SA所产生的羟基化产物浓度,发现VUV耦合US后2,5-DHBA产量较VUV单独辐照有明显的增加.US在反应中通过空化效应形成无数“空化气泡”,在气泡内部水分子被瞬时高温(4200~5000 K)热解,并在气相中形成·OH和·H,同时在气液界面上由·OH组合形成H2O2并溶于液相中(式(3)、(6)),在VUV辐照下,产生的H2O2发生分解(式(7)),即提高了VUV体系中·OH的产量,表明该体系的协同效应与·OH产量的增加有密切关系(Xin et al.,2013; Yang et al.,2013).
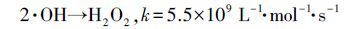
|
(6) |
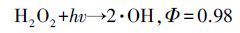
|
(7) |
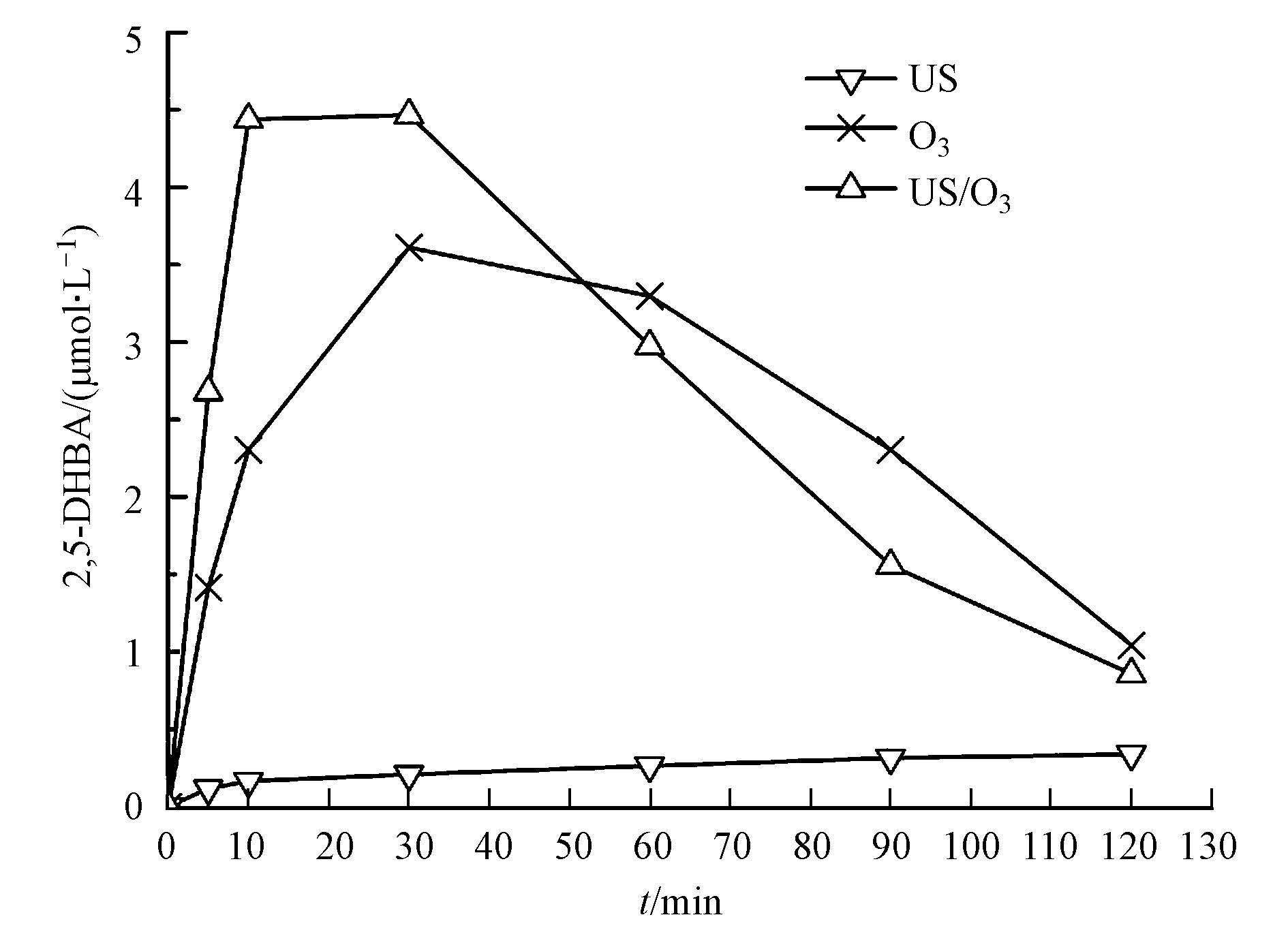
图 6为US/O3体系中2,5-DHBA浓度的变化曲线.由图 6可见,O3通过自分解产生的·OH经SA捕获后,所生成的2,5-DHBA浓度经检测最高为30 min时的3.61 μmol·L-1,30 min后,O3开始进一步氧化羟基化产物,致使2,5-DHBA浓度逐渐下降,至120 min时仅为0.85 μmol·L-1.加入US辅助氧化后,2,5-DHBA浓度在5、10、30 min时分别提高了1.26、2.14、0.86 μmol·L-1;而在60 min后US/O3体系的2,5-DHBA生成量低于O3单独氧化,这应与·OH对2,5-DHBA的自氧化有关.在US辐射下,O3在SA水溶液中的传质速率升高,一方面是由于US的混流作用,另一方面液相中的O3被US产生的空化气泡分解,增加了传质动力,同时形成了一条新的反应途径增加了·OH的产率(式(8)、(9))(Adewuyi,2005; Weavers et al.,1998).综上,可以推测US/O3的协同原因是US促进了O3分解,增加了·OH的产量.
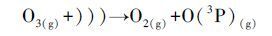
|
(8) |
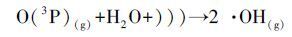
|
(9) |
 |
| 图 6 US/O3体系中2,5-DHBA浓度的变化 Fig. 6 The generation of 2,5-DHBA in US/O3 process |
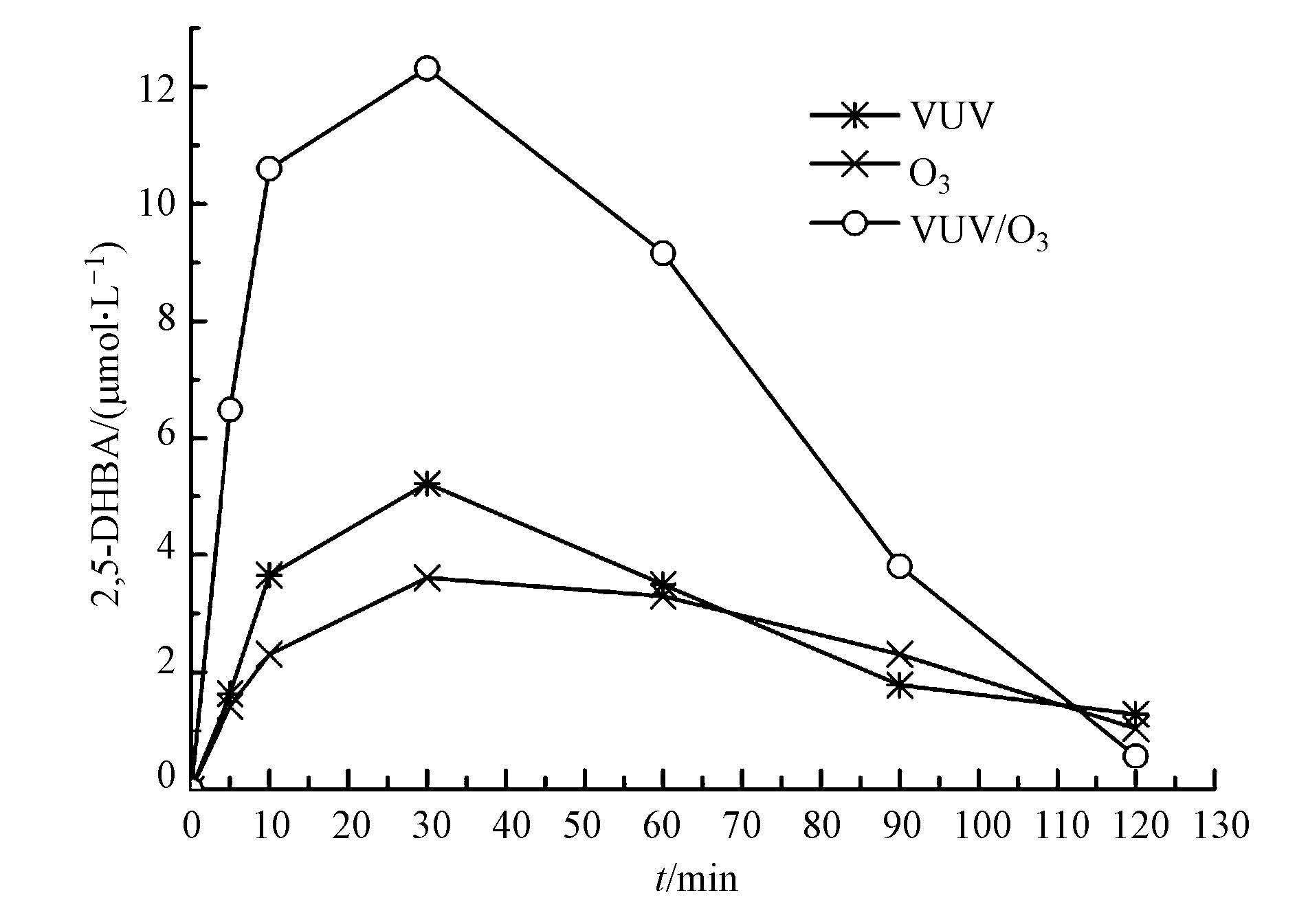
图 7为VUV/O3体系中2,5-DHBA浓度的变化曲线.由图 7可见,VUV/O3联合氧化SA时,2,5-DHBA浓度在前30 min迅速升高,相比O3和VUV单独使用可知,VUV极大地加速了O3中的·OH产率.30 min后,羟基化产物开始被进一步氧化,检测到的2,5-DHBA浓度开始下降.VUV/O3体系中2,5-DHBA浓度最高为12.31 μmol·L-1,相比VUV/US体系(7.51 μmol·L-1)和US/O3体系(4.46 μmol·L-1)的·OH产率更高,这说明US对O3的强化效果不如VUV对O3的分解.VUV灯发射的紫外光中254 nm波段的紫外光占80%(Masschelein et al.,2002),该波段的紫外光虽然仅具有杀毒作用,但可以将O3分子光解为O2和O(1D)(式(10)),其中,O(1D)很活泼,与H2O反应后生成H2O2(式(11)),而适量的过氧化物在吸收短波长的紫外光时非常敏感,会立即分解产生·OH(式(7))(Garoma et al.,2004; Reisz et al.,2003; Catalkaya et al.,2007).因而VUV/O3体系中O3被光解后形成大量的·OH是产生协同作用的主要原因.
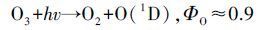
|
(10) |
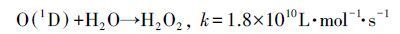
|
(11) |
 |
| 图 7 VUV/O3体系中2,5-DHBA浓度的变化 Fig. 7 The generation of 2,5-DHBA in VUV/O3 process |
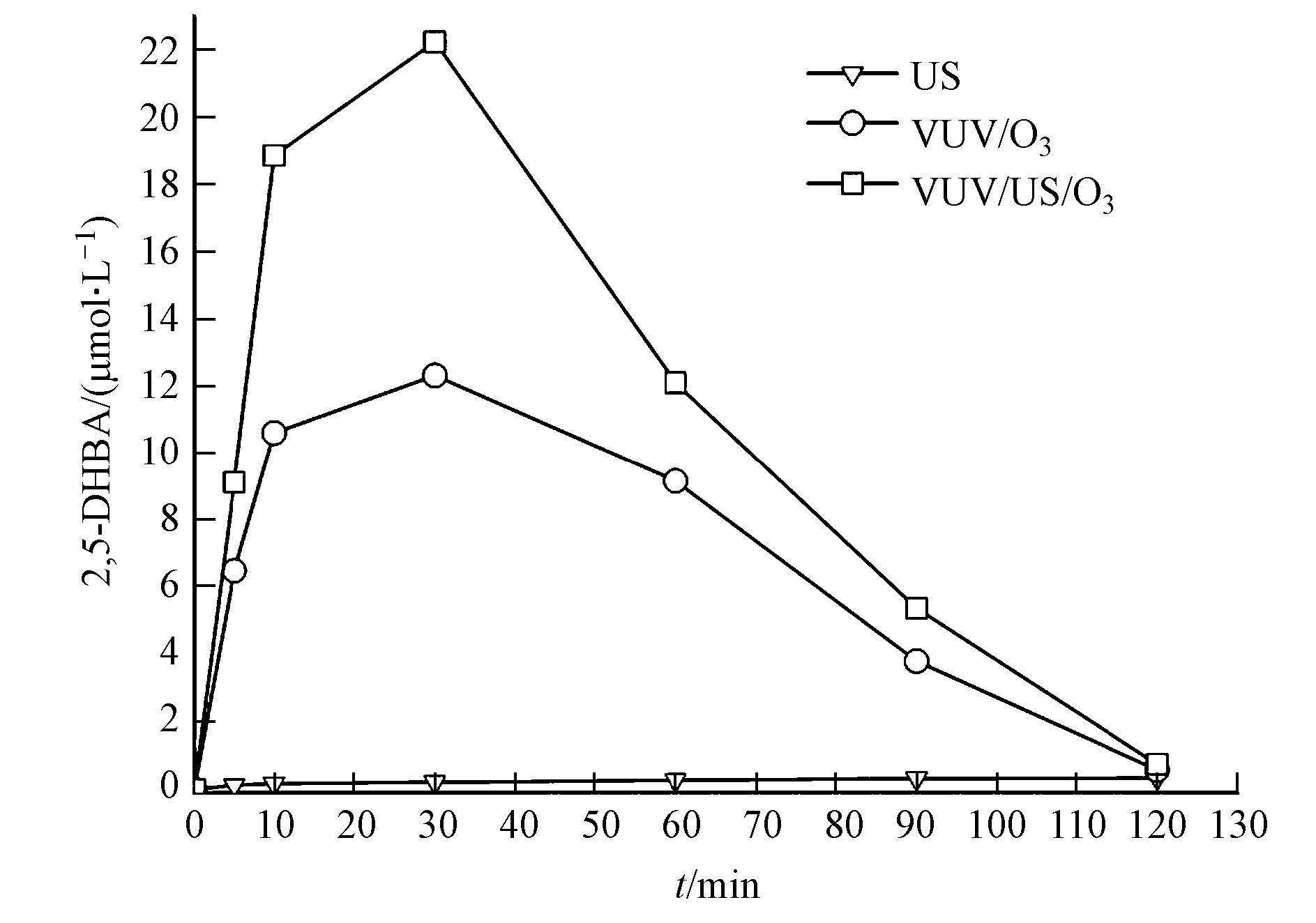
图 8为VUV/US/O3体系中羟基化产物的生成速率曲线.由图 8可见,将US作为辅助AOPs加入·OH产率最高的VUV/O3体系后,·OH的产率有了更进一步的提高,曲线变化趋势与VUV/O3相似,测得最高2,5-DHBA浓度为22.24 μmol·L-1,较VUV/O3体系提高了9.93 μmol·L-1,这与VUV、US、O3两两间的协同作用有着密切关系.一方面US和VUV同时分解O3使得传质速率增加,让更多的O3分子进入液相参与反应;另一方面O3分解后产生的大量H2O2在VUV辐照下分解产生了更多的·OH,提高了VUV/US/O3三元氧化体系的氧化能力(Kidak et al.,2007).
 |
| 图 8 VUV/US/O3体系中2,5-DHBA浓度的变化 Fig. 8 The generation of 2,5-DHBA in VUV/US/O3 process |
1) 三元氧化体系中氧化能力排序为VUV/US/O3>VUV/O3>US/O3>VUV/US>O3>VUV>US,120 min内对应的SA去除率分别为96.27%、83.57%、74.80%、68.88%、50.67%、36.06%、8.60%,组合体系显示出了明显的协同效应.
2) 二元氧化体系VUV/O3、US/O3、VUV/US的2,5-DHBA浓度最高分别为12.32、7.51、4.47 μmol·L-1,而VUV、US、O3单独氧化产生的羟基化产物浓度仅分别为5.22、0.34、3.61 μmol·L-1,比较可知,二元氧化体系(VUV/O3、US/O3、VUV/US)的协同效应主要来源于·OH产率的增加.其中,VUV/O3的·OH产能最高,因而,其协同氧化效能最强.
3) 将US引入VUV/O3体系中,构成的三元氧化体系VUV/US/O3能有效地将2,5-DHBA的最高浓度从12.32 μmol·L-1提高至22.24 μmol·L-1.
| [1] | Adewuyi Y G. 2005. Sonochemistry in environmental remediation.1.Combinative and hybrid sonophotochemical oxidation processes for the treatment of pollutants in water[J]. Environmental Science & Technology , 39 (10) : 3409–3420. |
| [2] | Azrague K, Bonnefille E, Pradines V, et al. 2005. Hydrogen peroxide evolution during V-UV photolysis of water[J]. Photochemical & Photobiological Sciences , 4 (5) : 406–408. |
| [3] | Catalkaya E C, Kargi F. 2007. Color,TOC and AOX removals from pulp mill effluent by advanced oxidation processes: A comparative study[J]. Journal of Hazardous Materials , 139 (2) : 244–253. DOI:10.1016/j.jhazmat.2006.06.023 |
| [4] | Ciardelli G, Ranieri N. 2001. The treatment and reuse of wastewater in the textile industry by means of ozonation and electroflocculation[J]. Water Research , 35 (2) : 567–572. DOI:10.1016/S0043-1354(00)00286-4 |
| [5] | Ergas S J, Therriault B M, Reckhow D A. 2006. Evaluation of water reuse technologies for the textile industry[J]. Journal of Environmental Engineering-Asce , 132 (3) : 315–323. DOI:10.1061/(ASCE)0733-9372(2006)132:3(315) |
| [6] | Feiyue Q, Xianbo S, Yongdi L. 2013. Removal characteristics of organics in bio-treated textile wastewater reclamation by a stepwise coagulation and intermediate GAC/O3 oxidation process[J]. Chemical Engineering Journal , 214 : 112–118. DOI:10.1016/j.cej.2012.09.130 |
| [7] | Garoma T, Gurol M D. 2004. Degradation of tert-butyl alcohol in dilute aqueous solution by an O3/UV process[J]. Environmental Science & Technology , 38 (19) : 5246–5252. |
| [8] | Gogate P R, Pandit A B. 2004. A review of imperative technologies for wastewater treatment Ⅱ: hybrid methods[J]. Advances in Environmental Research , 8 (3/4) : 553–597. |
| [9] | Gong J L, Liu Y D, Sun X B. 2008. O3 and UV/O3 oxidation of organic constituents of biotreated municipal wastewater[J]. Water Research , 42 (4/5) : 1238–1244. |
| [10] | Gultekin I, Ince N H. 2006. Degradation of aryl-azo-naphthol dyes by ultrasound,ozone and their combination: Effect of alpha-substituents[J]. Ultrasonics Sonochemistry , 13 (3) : 208–214. DOI:10.1016/j.ultsonch.2005.03.002 |
| [11] | Hua I, Hoffmann M R. 1997. Optimization of ultrasonic irradiation as an advanced oxidation technology[J]. Environmental Science & Technology , 31 (8) : 2237–2243. |
| [12] | Kidak R, Ince N H. 2007. Catalysis of advanced oxidation reactions by ultrasound: A case study with phenol[J]. Journal of Hazardous Materials , 146 (3) : 630–635. DOI:10.1016/j.jhazmat.2007.04.106 |
| [13] | Lau T K, Chu W, Graham N. 2007. Reaction pathways and kinetics of butylated hydroxyanisole with UV,ozonation,and UV/O3 processes[J]. Water Research , 41 (4) : 765–774. DOI:10.1016/j.watres.2006.11.021 |
| [14] | Lesko T, Colussi A J, Hoffmann M R. 2006. Sonochemical decomposition of phenol: Evidence for a synergistic effect of ozone and ultrasound for the elimination of total organic carbon from water[J]. Environmental Science & Technology , 40 (21) : 6818–6823. |
| [15] | 李文杰, 洪添, 胡勇有, 等.2014. VUV/US耦合深度处理印染废水尾水的研究[J]. 环境科学学报 , 2014, 34 (7) : 1689–1695. |
| [16] | Masschelein W J. 2002. Ultraviolet Light in Water and Wastewater Sanitation[M]. Boca Raton,Fla: Lewis Publishers . |
| [17] | Pera Titus M, Garcia Molina V, Banos M A, et al. 2004. Degradation of chlorophenols by means of advanced oxidation processes: a general review[J]. Applied Catalysis B-Environmental , 47 (4) : 219–256. DOI:10.1016/j.apcatb.2003.09.010 |
| [18] | Reisz E, Schmidt W, Schuchmann H P, et al. 2003. Photolysis of ozone in aqueous solutions in the presence of tertiary butanol[J]. Environmental Science & Technology , 37 (9) : 1941–1948. |
| [19] | 任学昌, 史载锋, 孔令仁, 等.2008. TiO2薄膜光催化体系中羟基自由基的水杨酸分子探针法测定[J]. 环境科学学报 , 2008, 28 (4) : 705–709. |
| [20] | Staehelin J, Hoigne J. 1982. Decomposition of ozone in water: Rate of initiation by hydroxide ions and hydrogen peroxide[J]. Environ Scl Technol , 16 (10) : 676–681. DOI:10.1021/es00104a009 |
| [21] | Staehelin J, Hoigne J. 1985. Decomposition of ozone in water in the presence of organic solutes acting as promoters and inhibitors of radical chain reactions[J]. Environmental Science & Technology , 19 (12) : 1206–1213. |
| [22] | Weavers L K, Hoffmann M R. 1998. Sonolytic decomposition of ozone in aqueous solution: Mass transfer effects[J]. Environmental Science & Technology , 32 (24) : 3941–3947. |
| [23] | 徐新华, 赵伟荣. 2003. 水与废水的臭氧处理[M]. 北京: 化学工业出版社 . |
| [24] | Xu L J, Chu W, Graham N. 2013. Sonophotolytic degradation of dimethyl phthalate without catalyst: Analysis of the synergistic effect and modeling[J]. Water Research , 47 (6) : 1996–2004. DOI:10.1016/j.watres.2013.01.015 |
| [25] | Xin J, Zifu L, Lanlan X, et al. 2013. Synergistic effect of ultrasonic pre-treatment combined with UV irradiation for secondary effluent disinfection[J]. Ultrasonics Sonochemistry , 20 (6) : 1384–1389. DOI:10.1016/j.ultsonch.2013.03.010 |
| [26] | Yang S W, Sun J, Hu Y Y, et al. 2013. Effect of vacuum ultraviolet on ultrasonic defluorination of aqueous perfluorooctanesulfonate[J]. Chemical Engineering Journal , 234 : 106–114. DOI:10.1016/j.cej.2013.08.073 |
| [27] | Zhou T, Wu X H, Mao J, et al. 2014. Rapid degradation of sulfonamides in a novel heterogeneous sonophotochemical magnetite-catalyzed Fenton-like (US/UV/Fe3O4/oxalate) system[J]. Applied Catalysis B-Environmental , 160 : 325–334. |
| [28] | Zoschke K, Bornick H, Worch E. 2014. Vacuum-UV radiation at 185 nm in water treatment-A review[J]. Water Research , 52 : 131–145. DOI:10.1016/j.watres.2013.12.034 |
 2016, Vol. 36
2016, Vol. 36


