2. 中国科学院苏州纳米技术与纳米仿生研究所, 苏州 215123;
3. 苏州科技学院, 苏州 215009;
4. 苏州环境监测中心, 苏州 215004
2. Suzhou Institute of Nano-Tech and Nano-Bionics, Chinese Academy of Sciences, Suzhou 215123;
3. Suzhou University of Science and Technology, Suzhou 215009;
4. Suzhou Environmental Monitor Center, Suzhou 215004
PM2.5是指大气中直径小于或等于2.5 μm的颗粒物, 也称为入肺颗粒物.由于它能通过肺泡直接进入循环系统, 对人体危害极大.已经有大量流行病学证据表明(Pope III et al., 2002; Nafstad et al., 2004; Turner et al., 2011; Hystad et al. 2013) , PM2.5有急性与慢性健康效应.急性健康效应体现在高PM2.5暴露增加患急性呼吸道疾病与心脑血管疾病的风险, 慢性毒性体现在PM2.5可能诱发肺癌、慢性阻塞性肺疾病.
PM2.5粒径小, 且富含大量的有害、有毒物质, 能够直接进入肺泡被巨噬细胞吞噬, 并永远停留在肺泡里, 可对人的呼吸系统造成最直接的危害, 引发多种疾病(MacNee, 2001; Lin et al., 2012).PM2.5中含有多种成分, 包括有机物、无机盐离子和重金属颗粒等.有研究指出, 可吸入颗粒物中包含许多种有机物(如多环芳香烃类, PAHs), 而这些有机污染物大多已经被证实对人体健康有很大的影响(Lin et al., 2007);PM2.5中的某些过渡金属和盐离子也可引起细胞毒性, 造成细胞炎症反应和氧化应激等现象(Lloyd et al., 1999; Gali et al., 2015).这些不同组分所造成的影响可能会引发多种疾病, 其对慢性肺疾病患者的影响更大, 尤其是对于慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease, COPD)患者(Thaw et al., 2008).
COPD是一种慢性气道炎症性疾病, 其发病率居当今世界各类疾病的前列.有研究表明, COPD发病的原因主要是蛋白酶-抗胰蛋白酶的失衡所致(Morse, 1978; Silverman et al., 2009), 其中, 酯酶抑制剂1(Serpina-1) 能抑制多种蛋白酶, 该基因是目前公认的COPD候选基因, α1胰蛋白酶抑制剂(α1-antitrypsin, AAT)可以通过抑制胰蛋白酶、中性粒细胞弹性蛋白酶及其他蛋白水解酶来保护肺泡及周边细胞(KNOELL et al., 1998), Serpina-1和AAT蛋白表达量的变化会影响蛋白酶-抗胰蛋白酶之间的平衡, 故这些抑制剂和COPD的发生有密切的关系.PM2.5表面负载的PAH和过渡金属等物质可以造成细胞内ROS的累积, 导致AAT氧化为Ox-AT(Oxidized AT), 从而造成蛋白酶-抗胰蛋白酶的失衡, 使保护细胞完整性和抑制中性粒细胞的能力减弱(Li et al., 2009), 促发炎症反应, 从而增加COPD发生的概率.
虽然有很多研究已经表明PM2.5的暴露与COPD的发生呈一定的相关性, 但PM2.5引发COPD的发病机制尚未完全阐明.为此, 本研究利用体外培养方式将BEAS-2B细胞暴露于大气PM2.5的不同组分中, 通过检测细胞活性及COPD主要标志蛋白表达量的变化, 探讨PM2.5的不同组分对COPD标志物的影响及作用机制, 以期为研究大气PM2.5与COPD患病机制奠定基础, 并为COPD预防提供科学参考.
2 材料与方法(Materials and methods) 2.1 仪器和试剂 2.1.1 主要试剂噻唑蓝(MTT)、碘化丙啶(PI)、2′, 7′-二氯二氢荧光素的二醋酸酯(DCFH-DA)荧光探针(Sigma-Aldrich公司, 美国);LDH试剂盒(南京建成生物技术有限公司);β-acting、HRP标记山羊抗小鼠、HRP标记山羊抗兔(碧云天生物技术研究所);Bax抗体、Bcl-2抗体、AAT抗体(ImmunoWay, 美国);HO-1抗体(Cell Signaling, 美国);ECL化学发光显色试剂盒液(Thermo, 美国); LHC-9培养基、TRIzol试剂(Life Technologies, 美国);SuperQuickRT cDNA第一链成试剂盒、UltraSYBR Mixture(With Rox)试剂(康为试剂);ELISA试剂盒(上海优选生物科技有限公司).
2.1.2 主要仪器PM2.5空气大流量采样器(流量为1.13 m3·min-1, Tisch Environmental, 美国);CO2恒温细胞培养箱(Thermo, 美国);Victor X4酶标仪(Perkin Elmer, 美国);实时定量PCR仪(Applied Biosystems, 美国);LAS-4000型荧光/化学发光成像分析仪(FUJIFILM, 日本).
2.2 PM2.5样品的采集和处理 2.2.1 PM2.5样品采集PM2.5采集于苏州市工业园区中科院苏州纳米所顶楼室外(距离地面约20 m), 采集时间为2013年12月13—22日.用大流量采样器(流量为1.13 m3·min-1)采集样品于玻璃纤维滤膜(Whatman, 美国)上, 每隔24 h更换滤膜, 连续采集10 d, 滤膜保存于4 ℃, 备用.
2.2.2 PM2.5样品处理PM2.5中有机组分的提取:取20.32 cm×25.4 cm玻璃纤维滤膜, 用打孔器打40个孔(直径约1 cm)后, 于CH2Cl2润洗过的玻璃瓶中, 用适量的CH2Cl2作为提取剂, 冰浴超声抽提20 min, 重复3次;将提取液合并后进行旋蒸至1~2 mL, CH2Cl2清洗3次后, 氮气下吹干;称重后, 用DMSO配制成一定浓度的待测样品液, 根据样品稀释倍数计算总PM2.5浓度, 保存备用.
PM2.5中水相组分的提取:取20.32 cm×25.4 cm玻璃纤维滤膜, 剪碎后放入棕色广口瓶中, 加入适量无菌去离子水淹没样品膜, 冰浴超声抽提20 min, 重复3次;将样品膜取出后, 水提液转移至称重过的50 mL离心管中于-20 ℃冰冻过夜, 然后将样品进行冷冻干燥;称重后, 计算水提物的质量, 将获得的水提物用LHC-9培养基配制成一定浓度的样品液, 根据样品稀释倍数计算总PM2.5浓度, 保存备用.
2.3 细胞培养利用LHC-9培养基, 将正常人肺上皮细胞(BEAS-2B)在37 ℃条件下置于5%的CO2细胞培养箱中培养, 当细胞生长面积达到培养皿的 80%以上时, 加入胰蛋白酶进行消化处理, 收集细胞悬液于10 mL离心管中, 1000~1200 r·min-1 离心5 min后, 用新的培养液混悬沉淀细胞, 然后按1∶3的比例, 在同样的条件下继续传代培养, 部分细胞用于MTT等相关实验.
2.4 MTT实验采用MTT分析法(Mosmann et al., 1983)分析细胞的成活率.具体步骤为:将部分收集的细胞接种于96孔板中, 每孔约5000~8000个细胞, 加入100 μL不同浓度的PM2.5有机提取液或水相提取液, 在培养箱中暴露24~48 h后, 再加入100 μL浓度为5 μg·mL-1的MTT试剂, 继续培养4 h;然后弃去培养液, 加入二甲基亚砜(DMSO)溶液150 μL, 振荡10 min;最后用酶标仪测定波长在490 nm处的吸亮度(OD), 记录数据, 分析细胞的成活率.另外, 同时设定空白对照组和平行实验组(n=3) .
2.5 Western Blot法检测BEAS-2B细胞在PM2.5中暴露24 h后, 利用Western Blot方法检测相关蛋白的表达量(Deng et al., 2013).具体步骤为:倾去培养基, 用PBS(pH=7.0) 清洗3遍, 将细胞裂解后, 获得可溶性的蛋白, 并用BSA作为标准品, 对蛋白质进行定量;然后将变性蛋白经含有12%丙烯酰胺的SDS-PAGE电泳分离, 印迹转移至PVDF膜上, 用5%脱脂奶在室温下封闭2 h, 将封闭液吸去, PBS漂洗后加入一抗, 室温孵育过夜;TBS-T清洗3次后, 加入二抗孵育1 h, 漂洗后加ECL显色液, 用LAS-4000型化学发光成像分析仪显色曝光.使用Quantuty One软件进行蛋白条带定量分析(n=3) .
2.6 单细胞凝胶电泳参考 MTT试验中染毒剂量(Gualtieri et al., 2010)的结果, 同时设置 100 μmol·L-1的过氧化氢(H2O2)为阳性对照组.在PM2.5中暴露细胞24 h后, 将0.8%的正常熔点琼脂糖浇注到磨砂粗面载玻片上, 盖上盖玻片, 使胶展开, 4 ℃固化10 min;取适量的单细胞悬液和0.8%的低熔点凝胶混匀, 滴加到第一层胶上, 覆盖盖玻片, 4 ℃冰箱固化10 min, 待冷却凝固后轻轻移去盖玻片, 浸入新鲜配制的细胞裂解液中, 4 ℃裂解1 h, 用少量冰冷的PBS缓冲液轻轻冲洗3次, 置入装有预冷电泳液的电泳槽中, 避光静置40 min;调节电泳仪至电压23 V, 改变电泳液量使电流达 280 mA, 4 ℃下电泳20 min后, 取出琼脂凝胶在PBS 缓冲液中洗10 min, 晾干;向琼脂凝胶上滴加 30 μL碘化丙啶染色液, 荧光显微镜下拍照记录实验结果(n=3) .
2.7 氧化应激实验细胞暴露于PM2.5中24 h后, 弃去培养液, PBS清洗2次, 加入用无血清的培养液稀释的2′, 7′-二氯二氢荧光素的二醋酸酯(DCFH-DA)10 μmol·L-1, 于37 ℃、5% CO2培养箱中避光孵育30 min, PBS清洗3次后使用荧光显微镜观察, 并拍照(n=3) .
2.8 实时荧光定量PCR(RT-qPCR)检测BEAS-2B细胞在PM2.5中暴露 24 h后, 用Trizol法(Hummon et al., 2007)提取RNA, 并用逆转录试剂盒形成第一链成cDNA, 然后经UltraSYBR Mixture(With Rox)试剂盒和ABI 7500 Real-Time PCR System进行qPCR分析.mRNA表达量以甘油醛-3-磷酸脱氢酶(GAPDH)为内参, 通过2-ΔΔCt得到, 其中, ΔCt=ΔCt目的基因-ΔCt内参基因, ΔΔCt=ΔCt剂量组-ΔCt对照组(Gualtieri et al., 2012)(n=3) .实验所使用的引物序列如表 1所示.
2.9 ELISA实验细胞暴露于PM2.5中24 h后, 取上清, 3000 r·min-1离心10 min去除颗粒和聚合物, 根据ELISA试剂盒的使用说明来检测Ox-AT的表达水平, 并利用酶标仪测定波长在450 nm处的吸亮度(OD)(n=3) .
| 表 1 RT-qPCR所需mRNA引物序列 Table 1 Primers used for quantitative real-time PCR assays |
实验数据以平均值±标准差(Means±SD)表示, 应用SPSS13.0软件对数据结果进行统计学分析, 两样本均数间比较采用t 检验, p<0.05为差异有统计学意义.*p<0.05, 表示与对照相比, 具有显著差异;**p<0.01, 表示与对照相比, 具有极显著差异.
3 结果(Results) 3.1 PM2.5对人肺上皮细胞存活率的影响采用MTT法检测了BEAS-2B细胞分别暴露于PM2.5中的有机相成分和水溶性成分中24和48 h后的细胞存活率, 结果如图 1所示.在PM2.5不同组分作用下, PM2.5浓度和处理时间与细胞存活率成负相关.在处理BEAS-2B细胞24 h后(图 1a), 细胞存活率与PM2.5浓度呈剂量-效应关系, 浓度越高, 细胞存活率降低越明显;与对照组相比, 有机相在10 μg·mL-1时细胞存活率就有明显下降(p<0.05) , 水相PM2.5在20 μg·mL-1时细胞存活率开始显著降低, 同时, 在相同浓度下PM2.5的有机相造成的细胞死亡率大于PM2.5的水相.在PM2.5处理细胞48 h后(图 1b), 细胞存活率的下降更为明显, 在400 μg·mL-1的有机相处理后, 细胞的存活率仅有5%左右.结果表明, PM2.5的不同组分对细胞也造成了不同程度的影响, 甚至死亡, 时间越长效果越明显, 并且有机相的PM2.5对细胞存活率的影响高于水相.为进一步探讨PM2.5对细胞的影响, 分别选择PM2.5不同组分的低浓度组(10 μg·mL-1)和高浓度组(100 μg·mL-1)对细胞处理24 h后进行相关检测分析.
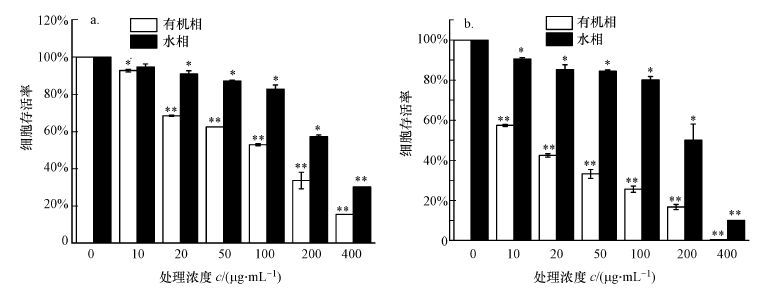 |
| 图 1 PM2.5处理对BEAS-2B细胞存活率影响(a.24 h, b.48 h;n=3, 与对照组相比, *p<0.05, **p<0.01) Fig. 1 Effect of different concentrations of PM2.5 in 24 h(a)and 48 h(b)on viability of BEAS-2B cell |
肺上皮细胞的紧密连接可以形成肺部屏障系统, 使大分子物质难以通过, 而小分子物质和水分子可以自由透过.紧密连接蛋白的缺失或不足, 可导致肺部屏障系统的破坏, 进而会改变肺部的通透性, 引起肺部的损伤或肺部疾病.利用Western Blot法检测了紧密连接蛋白(ZO)表达量的变化, 结果发现, 当PM2.5对BEAS-2B细胞处理24 h后, 紧密连接蛋白ZO-1和ZO-2表达量均随PM2.5浓度的升高而出现明显的降低(图 2a).PM2.5有机相组分在浓度为10 μg·mL-1染毒24 h后, ZO-1、ZO-2两种蛋白表达与对照组相比均没有明显变化, 而在高浓度(100 μg·mL-1)下两种蛋白表达量都有显著下降(p<0.05) ;水相组分和有机相组分的结果相似, 且两种等浓度的组分之间对细胞紧密连接蛋白表达量的影响没有明显差异(图 2b、2c).
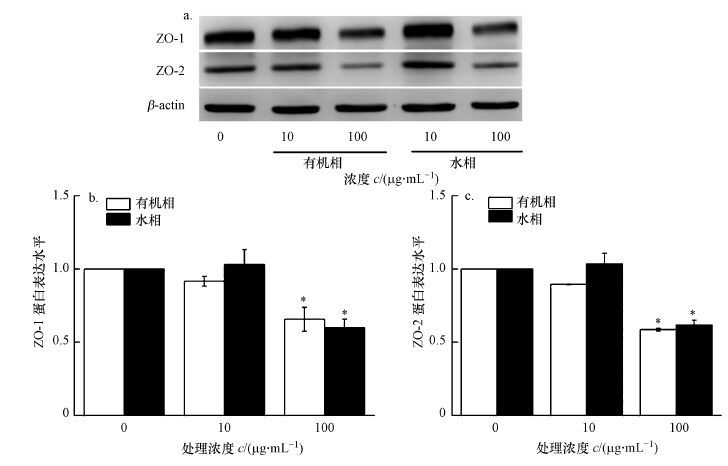 |
| 图 2 细胞在不同组分的PM2.5中暴露24 h后紧密连接蛋白表达情况(a)及ZO-1(b)和ZO-2(c)蛋白表达量的Western Blot分析(与对照相比, *p< 0.05) Fig. 2 Effect of 24 h exposure to PM2.5 extracts on ZO expression in BEAS-2B cells(a)and Western Blot assay for ZO-1(b)and ZO-2(c)expression |
采用单细胞凝胶电泳实验检测了BEAS-2B细胞暴露于PM2.5中24 h后DNA的损伤情况, 结果显示(图 3), PM2.5浓度越大对细胞DNA损伤越严重, 实验分别设置阴性对照组(图 3a)和阳性对照组(图 3f).与阴性对照组相比, 10 μg·mL-1有机相PM2.5处理细胞后, 拖尾现象较为明显, DNA断裂严重(图 3b), 说明此浓度下有机相的PM2.5对细胞DNA造成了明显的损伤;在高浓度(100 μg·mL-1)有机相PM2.5处理细胞后损伤更加明显(图 3c);PM2.5的水相在低浓度(10 μg·mL-1)下拖尾现象并不明显(图 3d), 而在100 μg·mL-1时拖尾较长(图 3e), 表明DNA损伤较为严重.
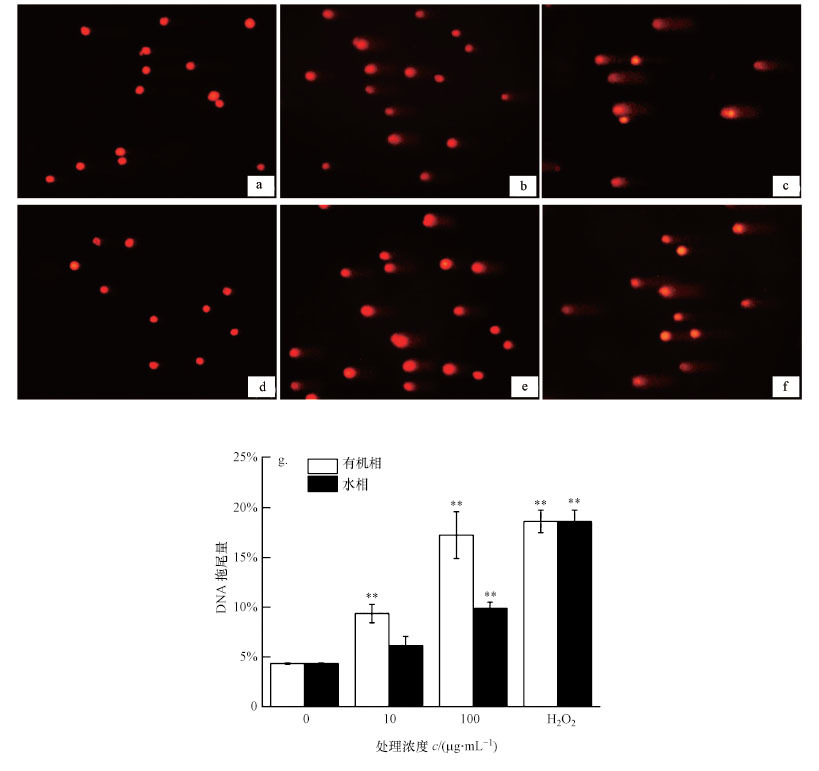 |
| 图 3 不同组分PM2.5对BEAS-2B细胞DNA损伤的影响(a.阴性对照组, b.有机相10 μg·mL-1, c.有机相100 μg·mL-1, d.水相10 μg·mL-1, e.水相100 μg·mL-1, f.阳性对照100 μmol·L-1 H2O2, g.定量分析;n=3, 与空白对照组相比, *p < 0.05, **p < 0.01, 放大倍数100倍) Fig. 3 Effect of 24 h exposure to PM2.5 on DNA damage of BEAS-2B cells(a.negative control, b.10 μg·mL-1 organic component, c. 100 μg·mL-1 organic component, d.10 μg·mL-1 water-soluble component, e.100 μg·mL-1 water-soluble component, f.positive control(100 μmol·L-1 H2O2)) |
不同浓度的PM2.5组分对BEAS-2B细胞处理后, TNF-α、IL-1β和IL-8三种炎症因子mRNA表达量检测的结果如图 4所示.PM2.5的有机相处理细胞后, 炎症因子TNF-α的mRNA表达量与有机相的浓度成剂量依赖关系(图 4a), 在高浓度(100 μg·mL-1)时有更显著的变化(p<0.05) ;IL-1β和IL-8两种炎症因子表达量均与TNF-α结果类似(图 4b、4c).而细胞在PM2.5的水相处理后, 只有IL-1β炎症因在100 μg·mL-1 PM2.5水相组分作用下表达量显著增加(图 4b), 其他炎症因子和对照组相比, 均未表现出显著性差异.
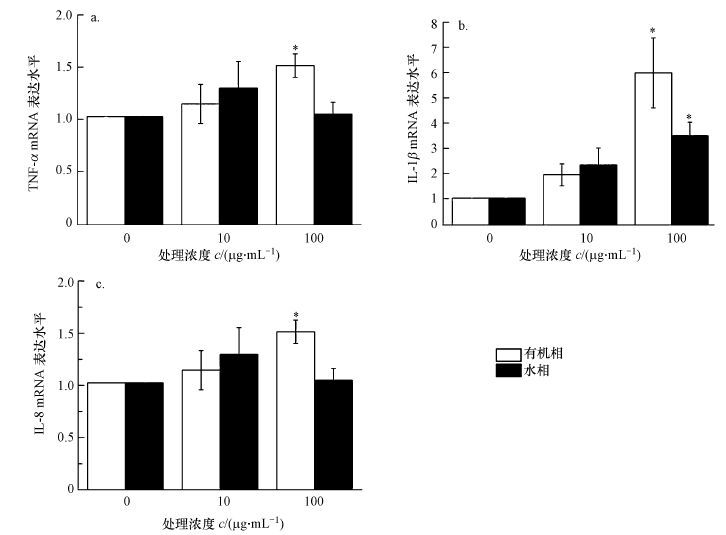 |
| 图 4 肺上皮细胞在PM2.5的不同组分中暴露24 h后炎症因子表达变化情况(a.TNF-α, b.IL-1β, c.IL-8;n=3, 与对照组相比, *p < 0.05) Fig. 4 Effect of 24 h exposure to PM2.5 on expression level of inflammation factors of BEAS-2B cells(a.TNF-α, b.IL-1β, c.IL-8) |
采用DCFH-DA荧光探针技术检测了不同组分、不同浓度的PM2.5对细胞进行染毒24 h后, 细胞内ROS积累情况, 实验结果见图 5.由图 5的荧光照片可知, 阴性对照组(图 5a)细胞内ROS水平很低, 而阳性对照组(图 5f)细胞内ROS水平明显增加;在加入PM2.5后, 细胞内ROS有所上升(图 5b~e), 且细胞内ROS随PM2.5浓度升高而增加;比较PM2.5水相和有机相作用, 有机相在低浓度(10 μg·mL-1)下细胞内ROS水平并没有显著变化, 而在高浓度下(100 μg·mL-1)(图 5c)ROS有明显上升;同样, 水相在低浓度(10 μg·mL-1)时(图 5d), ROS并没有明显升高, 而在高浓度(100 μg·mL-1)时(图 5e), ROS有显著性增加, 且水相的氧化应激变化情况高于有机相(图 5g).
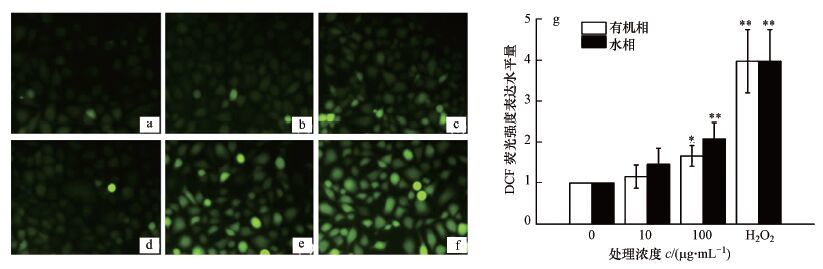 |
| 图 5 PM2.5不同组分对肺上皮细胞氧化应激水平的影响(a.阴性对照组, b.有机相10 μg·mL-1, c.有机相100 μg·mL-1, d.水相10 μg·mL-1, e.水相100 μg·mL-1, f.阳性对照100 μmol·L-1 H2O2, g.定量分析;n=3, 与阴性对照组相比, *p < 0.05, 放大倍数100倍) Fig. 5 Effect of 24 h exposure to PM2.5 on the ROS level of BEAS-2B cells(a.negative control, b.10 μg·mL-1 organic component, c. 100 μg·mL-1 organic component, d.10 μg·mL-1 water-soluble component, e.100 μg·mL-1 water-soluble component, f.positive control(100 μmol·L-1 H2O2)) |
利用qPCR方法检测了Serpina-1基因表达量, 结果见图 6a.由图可知, PM2.5的有机相处理细胞后并未出现显著性变化, 而仅在PM2.5的高浓度水相处理后检测到Serpina-1的mRNA表达量有显著性降低(p<0.05) ;其次, 利用Western Blot法检测了AAT蛋白表达量的变化(图 6b), 结果显示, PM2.5可以造成AAT蛋白表达量的下降, PM2.5的有机相无论是高浓度还是低浓度处理BEAS-2B细胞后, AAT蛋白表达与对照组相比均未有显著性变化, 而水相组分在低浓度(10 μg·mL-1)时AAT蛋白未见明显变化, 但在高浓度(100 μg·mL-1)下AAT表达量显著下降(图 6c), 这与利用qPCR检测Serpina-1的情况一致;另外, 也用ELISA法检测了Ox-AT蛋白的表达(图 6d), 结果显示, PM2.5的有机相无论在高浓度还是低浓度下所产生的Ox-AT并未与对照组有显著性差异, 但100 μg·mL-1 PM2.5的水相组分可导致细胞上清液中Ox-AT表达水平明显增加.
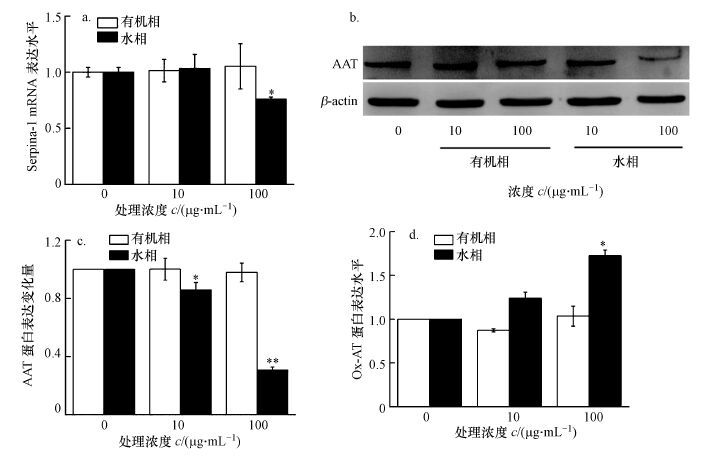 |
| 图 6 肺上皮细胞暴露于PM2.524 h后COPD相关生物基因和蛋白表达变化情况(a.Serpina-1 mRNA, b.AAT蛋白表达, c.AAT蛋白定量, d.细胞上清液中Ox-AT蛋白表达水平;n=3, 与阴性对照组相比, *p<0.05, **p<0.01) Fig. 6 Effect of 24 h exposure of PM2.5 extracts on the levels of predictive biomarkers of BEAS-2B cells for COPD(a.Serpina-1 mRNA expression, b.AAT expression, c.Quantitative analysis of AAT expression, d.Ox-AT expression) |
近年来, 有大量文献(Levy et al., 2000; Boldo et al., 2006; Hung et al., 2012)报道PM2.5浓度上升与人类呼吸系统疾病的发病率密切相关.本研究探讨了PM2.5的不同组分对肺上皮细胞可能造成的影响, 从而从细胞和分子水平研究了PM2.5与COPD疾病发病的关系.研究结果表明, PM2.5能引起氧化应激, 产生炎症反应, 降低或抑制细胞紧密连接蛋白的表达, 同时也导致COPD相关基因和蛋白的表达发生改变, 进一步会造成肺上皮细胞的凋亡, 影响肺部屏障系统, 从而增加COPD的患病率.另外, PM2.5成分不同所造成的影响程度也存在一定的差异.
有文献报道, PM2.5会造成肺上皮细胞A549细胞的活性降低(徐雯等, 2013; Zhang et al., 2007), 小鼠巨噬细胞RAW 264.7 LDH漏出率也随PM2.5浓度的增加而增加(Pozzi et al., 2003).这些研究结果表明, PM2.5可对肺上皮细胞造成活性降低和细胞死亡, 且与剂量呈正相关.由于肺上皮屏障系统是抵御PM2.5的第一道防线, 紧密连接蛋白ZO-1和ZO-2表达量下降, 会导致肺部屏障通透性改变, 导致肺部系统非常容易被感染(Fink et al., 2005).BEAS-2B细胞在100 μg·mL-1 PM2.5中暴露24 h后, 紧密连接蛋白ZO-1和ZO-2表达量都明显降低, 这可能是由于蛋白质的表达被抑制或细胞死亡造成的.
PM2.5也可造成细胞DNA损伤.PM2.5的有机相在10 μg·mL-1时就对细胞DNA造成了明显的损伤, 而PM2.5的水相成分在低浓度下未见明显差异, 但在100 μg·mL-1时有显著性差异.有研究表明(曹强等, 2008; Bonetta et al., 2009), PM2.5的有机组分可以造成肺上皮细胞A549 DNA断裂和氧化应激反应, 并且有机相可以明显造成细胞DNA损伤, 而PM2.5的水相主要造成细胞氧化应激反应, 有机相中PAH成分和水相中金属成分是造成DNA损伤和氧化应激效应的主要原因.也有研究证明, PM2.5可以增加人体血液内的8-OHdG, 形成基因的氧化损伤(Sørensen et al., 2003).
PM2.5可以促进细胞释放炎症因子, 引起炎症反应(Yang et al., 2014).本研究检测了IL-1β、TNF-α和IL-8三种炎症因子mRNA表达水平, 结果显示, 有机相的PM2.5对细胞进行染毒后炎症因子释放量明显高于水相PM2.5.这与DNA损伤结果一致, 可能是因为有机相PM2.5中的PAH成分相较于水相成分更容易引起炎症效应, 并造成细胞基因的损伤.
现在普遍认为COPD的发生主要是由于α1-抗胰蛋白酶缺乏造成.AAT的缺乏导致蛋白酶活性增高, 肺的结构蛋白特别是弹性蛋白被降解, 使肺部结构破坏, 甚至导致肺气肿(Abboud, 2008).而酯酶抑制剂1基因(Serpina-1) 能抑制多种蛋白酶, 是目前普遍公认的COPD候选基因.据报道, 约1%~2%的COPD是由Serpina 遗传缺陷所引起(Ganrot et al., 1967).除此之外, AAT蛋白也可被体内活性氧氧化为Ox-AT, 导致AAT蛋白缺乏, 引发COPD(Li et al., 2009).本研究证实了PM2.5可以造成细胞氧化应激效应, 水相PM2.5造成的氧化应激效应明显高于有机相PM2.5;同时, 当BEAS-2B细胞在水相PM2.5处理24 h后, AAT蛋白表达和Serpina-1基因的变化都有显著性降低, 且检测到上清液中Ox-AT蛋白水平也在高浓度水相PM2.5下明显增加.这说明水相PM2.5是通过增加细胞ROS水平, 使AAT蛋白氧化为Ox-AT.这可能和水相PM2.5中的成分有关, 水相PM2.5中含有大量的NO3-、NH4+、SO42-.大量研究结果(Hoek et al., 2000;Rutgers et al., 2000;Corradi et al., 2003)证明, 吸烟可以增加COPD的患病率, 正是因为烟雾中含有大量此类氮氧化合物和硫化物, 吸入人体后可以改变呼出冷凝液(EBC)的pH值和体内相关内环境, 引发细胞活性氧的增加和相关炎症反应, 进而引发COPD呼吸疾病和肺部疾病.
5 结论(Conclusions)PM2.5可以造成细胞活性下降, 引发炎症反应和氧化应激, 抑制紧密连接蛋白的表达, 且PM2.5的不同组分所造成的损伤程度不同.其中, PM2.5的有机相组分在细胞活性、炎症反应、基因损伤及紧密连接蛋白的表达方面的影响均高于水相组分, 而水相组分对细胞造成的损伤主要表现在氧化应激, 且氧化应激和AAT蛋白表达密切相关, 故氧化应激可能是影响COPD相关蛋白和基因表达的重要因素.
| [1] | Abboud R T, Vimalanathan S. 2008. Pathogenesis of COPD.Part I.The role of protease-antiprotease imbalance in emphysema[J]. International Journal of Tuberculosis & Lung Disease the Official Journal of the International Union Against Tuberculosis & Lung Disease , 12 (4) : 361–367. |
| [2] | Boldo E, Medina S, Le Tertre A, et al. 2006. Apheis: Health impact assessment of long-term exposure to PM2.5 in 23 European cities[J]. European Journal of Epidemiology , 21 (6) : 449–458. DOI:10.1007/s10654-006-9014-0 |
| [3] | Bonetta S, Gianotti V, Bonetta S, et al. 2009. DNA damage in a549 cells exposed to different extracts of PM2.5 from industrial, urban and highway sites[J]. Chemosphere , 77 (7) : 1030–1034. DOI:10.1016/j.chemosphere.2009.07.076 |
| [4] | 曹强, 钱孝琳, 张澍, 等.2008. 大气细颗粒物水溶成分和非水溶成分的细胞毒性[J]. 环境科学学报 , 2008, 28 (6) : 1167–1172. |
| [5] | Corradi M, Pesci A, Casana R, et al. 2003. Nitrate in exhaled breath condensate of patients with different airway diseases[J]. Nitric Oxide , 8 (1) : 26–30. DOI:10.1016/S1089-8603(02)00128-3 |
| [6] | Deng X, Rui W, Zhang F, et al. 2013. PM2.5 induces nrf2-mediated defense mechanisms against oxidative stress by activating pik3/akt signaling pathway in human lung alveolar epithelial a549 cells[J]. Cell Biology and Toxicology , 29 (3) : 143–157. DOI:10.1007/s10565-013-9242-5 |
| [7] | Fink M P, Delude R L. 2005. Epithelial barrier dysfunction: A unifying theme to explain the pathogenesis of multiple organ dysfunction at the cellular level[J]. Critical Care Clinics , 21 (2) : 177–196. DOI:10.1016/j.ccc.2005.01.005 |
| [8] | Gali N K, Yang F, Jiang S Y, et al. 2015. Spatial and seasonal heterogeneity of atmospheric particles induced reactive oxygen species in urban areas and the role of water-soluble metals[J]. Environmental Pollution , 198 : 86–96. DOI:10.1016/j.envpol.2015.01.001 |
| [9] | Ganrot P, Laurell CB, Eriksson S. 1967. Obstructive lung disease and trypsin inhibitors in α1-antitrypsin deficiency[J]. Scandinavian Journal of Clinical and Laboratory Investigation , 19 (3) : 205–208. DOI:10.3109/00365516709090627 |
| [10] | Gualtieri M, Longhin E, Mattioli M, et al. 2012. Gene expression profiling of a549 cells exposed to milan PM2.5[J]. Toxicology Letters , 209 (2) : 136–145. DOI:10.1016/j.toxlet.2011.11.015 |
| [11] | Gualtieri M, Øvrevik J, Holme J A, et al. 2010. Differences in cytotoxicity versus pro-inflammatory potency of different pm fractions in human epithelial lung cells[J]. Toxicology in Vitro , 24 (1) : 29–39. DOI:10.1016/j.tiv.2009.09.013 |
| [12] | Hoek G, Brunekreef B, Verhoeff A, et al. 2000. Daily mortality and air pollution in the netherlands[J]. Journal of the Air & Waste Management Association , 50 (8) : 1380–1389. |
| [13] | Hummon A B, Lim S R, Difilippantonio M J, et al. 2007. Isolation and solubilization of proteins after trizol© extraction of rna and DNA from patient material following prolonged storage[J]. Biotechniques , 42 (4) : 467–472. DOI:10.2144/000112401 |
| [14] | Hung L J, Tsai S S, Chen P S., et al. 2012. Traffic air pollution and risk of death from breast cancer in Taiwan: Fine particulate matter(PM2.5) as a proxy marker[J]. Aerosol Air Qual Res , 12 : 275–282. |
| [15] | Hystad P, Demers P A, Johnson K C, et al. 2013. Long-term residential exposure to air pollution and lung cancer risk[J]. Epidemiology , 24 (5) : 762–772. DOI:10.1097/EDE.0b013e3182949ae7 |
| [16] | Knoell D L, Ralston D R, Coulter K R, et al. 1998. Alpha 1-antitrypsin and protease complexation is induced by lipopolysaccharide, interleukin-1 β, and tumor necrosis factor-α in monocytes[J]. American Journal of Respiratory and Critical Care Medicine , 157 (1) : 246–255. DOI:10.1164/ajrccm.157.1.9702033 |
| [17] | Levy J I, Hammitt J K, Spengler J D. 2000. Estimating the mortality impacts of particulate matter:What can be learned from between-study variability?[J]. Environmental Health Perspectives , 108 (2) : 109–117. DOI:10.1289/ehp.00108109 |
| [18] | Li Z, Alam S, Wang J, et al. 2009. Oxidized α1-antitrypsin stimulates the release of monocyte chemotactic protein-1 from lung epithelial cells: Potential role in emphysema[J]. American Journal of Physiology-Lung Cellular and Molecular Physiology , 297 (2) : 388–400. DOI:10.1152/ajplung.90373.2008 |
| [19] | Lin C H, Chang L W, Wei Y H, et al. 2012. Electronic microscopy evidence for mitochondria as targets for cd/se/te-based quantum dot 705 toxicity in vivo[J]. The Kaohsiung Journal of Medical Sciences , 28 (7) : 53–62. DOI:10.1016/j.kjms.2012.05.011 |
| [20] | Lin C H, Huang C C, Wang T W, et al. 2007. Disparity in the induction of glutathione depletion, ros formation, poly(adp-ribose) polymerase-1 activation, and apoptosis by quinonoid derivatives of naphthalene in human cultured cells[J]. Chemico-biological Interactions , 165 (3) : 200–210. DOI:10.1016/j.cbi.2006.12.005 |
| [21] | Lloyd D R, Phillips D H. 1999. Oxidative DNA damage mediated by copper(Ⅱ), iron(Ⅱ) and nickel(Ⅱ) fenton reactions: Evidence for site-specific mechanisms in the formation of double-strand breaks, 8-hydroxydeoxyguanosine and putative intrastrand cross-links[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis , 424 (1) : 23–36. |
| [22] | MacNee W. 2001. Oxidative stress and lung inflammation in airways disease[J]. European Journal of Pharmacology , 429 (1) : 195–207. |
| [23] | Morse J O. 1978. Alpha1-antitrypsin deficiency[J]. New England Journal of Medicine , 299 (20) : 1099–1105. DOI:10.1056/NEJM197811162992003 |
| [24] | Mosmann T. 1983. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays[J]. Journal of Immunological Methods , 65 (1) : 55–63. |
| [25] | Nafstad P, Håheim L L, Wisløff T, et al. 2004. Urban air pollution and mortality in a cohort of norwegian men[J]. Environmental Health Perspectives , 112 (5) : 610–615. DOI:10.1289/ehp.6684 |
| [26] | Pope Ⅲ C A, Burnett R T, Thun M, et al. 2002. Lung cancer, cardiopulmonary mortality, and long-term exposure to fine particulate air pollution[J]. Jama , 287 (9) : 1132–1141. DOI:10.1001/jama.287.9.1132 |
| [27] | Pozzi R, De Berardis B, Paoletti L, et al.2003.Inflammatory mediators induced by coarse(PM2.5~10) and fine(PM2.5) urban air particles in raw 264.7 cells[J].Toxicology, 183(1):243-254 |
| [28] | Rutgers S R, Postma D S, Ten Hacken N H, et al. 2000. Ongoing airway inflammation in patients with copd who do not currently smoke[J]. Thorax , 55 (1) : 12–18. DOI:10.1136/thorax.55.1.12 |
| [29] | Sørensen M, Autrup H, Hertel O, et al.2003.Personal exposure to PM2.5 and biomarkers of DNA damage[J].Cancer Epidemiology Biomarkers & Prevention, 12(3):191-196 |
| [30] | Silverman E, Sandhaus R.2009.Clinical practice.Alpha1-antitrypsin deficiency[J].The New England Journal of Medicine, 360(26):2749-2757 |
| [31] | Thaw S, Donohue J F, Ghio A J. 2008. Ambient air pollution particles and the acute exacerbation of chronic obstructive pulmonary disease[J]. Inhalation Toxicology , 20 (1) : 25–29. DOI:10.1080/08958370701758759 |
| [32] | Turner M C, Krewski D, Pope Ⅲ C A, et al. 2011. Long-term ambient fine particulate matter air pollution and lung cancer in a large cohort of never-smokers[J]. American Journal of Respiratory and Critical Care Medicine , 184 (12) : 1374–1381. DOI:10.1164/rccm.201106-1011OC |
| [33] | 徐雯, 江俊康, 杨北平, 等.2013. 不同粒径汽车尾气颗粒物对A549细胞毒性作用的比较[J]. 环境科学学报 , 2013, 33 (12) : 3407–3412. |
| [34] | Yang L, Liu G, Lin Z, et al. 2016. Pro-inflammatory response and oxidative stress induced by specific components in ambient particulate matter in human bronchial epithelial cells[J]. Environmental Toxicolog , 31 (8) : 923–936. DOI:10.1002/tox.v31.8 |
| [35] | Zhang Z, Che W, Liang Y, et al. 2007. Comparison of cytotoxicity and genotoxicity induced by the extracts of methanol and gasoline engine exhausts[J]. Toxicology in Vitro , 21 (6) : 1058–1065. DOI:10.1016/j.tiv.2007.04.001 |
 2016, Vol. 36
2016, Vol. 36


