2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
2. The Key Lab of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006
湿地植物-沉积物微生物燃料电池(P-SMFC)是利用植物光合作用能合成葡萄糖等有机物的特点,从而在沉积物燃料电池中引入植物进行强化产电,阳极置于底泥中,阴极置于上覆水中,利用阳极附近产电菌的催化作用,将植物根系分泌的有机物氧化分解成二氧化碳并产生电能(Kaku et al,2008; Schamphelaire et al,2008).为了提高微生物燃料电池的产电特性,改善其对污染物的修复效果,人们就微生物燃料电池做过很多相关研究,如研究植物根系分泌物对系统产电的影响(Kaku et al,2008; Esteve Nuñez et al ,2009; Chen et al,2012)、不同植物种类对系统产电的影响(Timmers et al,2010;Venkata Mohan et al,2011;Hubenova et al,2012;Hubenova et al,2012;Bombelli et al,2013;Bombelli et al,2013)、阳极微生物群落的分析 (De Schamphelaire et al,2010; Quan et al,2012; Timmers et al,2012)、阴阳极材料的改进和修饰(Zhang et al,2012; Wen et al,2013)、沉积物修复等.
在微生物燃料电池阳极生物膜微生物群落分析的研究方面,人们主要集中于对产电微生物及微生物燃料电池的群落结构的研究.目前已研究发现的产电微生物主要是变形菌门和厚壁菌门的细菌,包括泥细菌Geobacter sulfurreducens、希瓦氏菌Shewanella putrefactions、铁还原红螺菌Rhodofoferax ferrireducens等(李冲,2011).Timmers等(2012)用高通量测序的方法对植物-沉积物微生物燃料电池的阳极生物膜群落多样性进行了分析,结果表明,微生物燃料电池阳极上端有54%的细菌属于Ruminococcaceae属,Clostridiaceae属占20%;下端有36%的细菌属于Comamonadaceae,10%为Rhodocyclaceae,13%为Clostridiaceae.Aelterman等(2006)对串联MFC中单体的微生物群落多样性进行了分析,其结果证实了Proteobacteria 纲的细菌是一类重要的产电细菌.而有关植物的引入对阳极微生物群落结构影响的研究较少.
微生物燃料电池在修复河流底泥及产电的过程中,微生物的催化氧化起决定性作用,其微生物种类及群落结构都对微生物燃料电池的产电作用有显著影响.另一方面,沉积物微生物燃料电池中植物的引入能够改变底泥中氧化还原电位,并且植物根系所营造的环境必定也会对阳极生物膜微生物群落结构产生影响.风车草(Clinopodium Urticifolium)和短叶茳芏(Cyperus Malaccensis)为两种常见的莎草科湿地挺水植物,根系发达,且均为须根植物,其中,短叶茳芏在珠江河口河岸常见自然分布.目前已有诸多关于利用风车草和短叶茳芏进行植物修复的研究(刘士哲等,2004; Basumatary et al,2012).基于此,本研究选用风车草或短叶茳芏两种植物结合受污染河涌底泥构建湿地植物-沉积物微生物燃料电池(P-SMFC),同时构建无植物的沉积物微生物燃料电池(SMFC)作为对照,比较不同处理组产电性能的不同,并对3个电极处理组的阳极生物膜进行细菌与古菌的高通量测序,分析其群落多样性及不同处理组之间群落结构的差异,以期了解植物的引入对阳极生物膜微生物群落结构及多样性的影响.
2 实验材料与方法(Materials and methods) 2.1 SMFC的构建与运行以39 L的PE 白色圆桶为容器(底部直径30 cm,顶部直径40 cm,高40 cm),底质深度15 cm,水深5 cm左右.阳极由两片活性碳纤维毡(10 cm×10 cm×2 mm)和一片铜箔(10 cm×10 cm×0.5 mm)组成,埋于桶内7~8 cm深处,加入人工配制的50 mmol·L-1氯化钠溶液,阴极为一个石墨圆盘(直径10 cm,厚1 cm),置于上覆水表层,离底泥表层4 cm,连接阴极的导线从石墨盘中央穿出.选取采集种内大小一致的湿地植物短叶茳芏和风车草,每桶5颗,种植于底质中,位于阳极45度角下方,在阴、阳极之间连接1000 Ω外接电阻,以铜导线作为电子导流体,形成闭合回路,以此构建风车草与短叶茳芏两个植物-沉积物微生物燃料电池,分别简称为PSM1处理组和PSM2处理组;同样连接电极但不种植植物,构建了无植物微生物燃料电池,简称为SM处理组;共3组微生物燃料电池.每个处理组设置3个平行,S1、S2、S3为PSM1处理组,S4、S5、S6为SM处理组,S7、S8、S9为PSM2处理组.
2.2 电压采集方法将Keithley 2700数据采集器的2个输入端口连接到P-MFC的两极,通过USB接口连接到计算机上,以此对系统产生的电压进行在线自动采集,输出电压每隔180 s自动采集1次.
2.3 微生物群落结构分析 2.3.1 基因组DNA提取反应结束后,立刻从反应器中取出碳毡阳极,用经过灭菌的剪刀在碳刷的不同位置剪下适量的碳毡.剪下的碳毡放入灭菌的去离子水中轻轻涮洗,以除去上面附着的非电极微生物或杂质.用剪刀将纤维剪碎,采用MOBIO PowerSoil DNA Isolation Kit 对样品进行基因组DNA 提取.得到的DNA用琼脂糖电泳检测,采用Nanodrop 2000 测定提取的基因组DNA 浓度.
2.3.2 目的片段的PCR扩增对于细菌,扩增片段为16S rDNA V3+V4 区,片段大小480 bp 左右(带有barcode);PCR 引物:338F 5′-ACTCCTACG GGAGGCAGCA-3′;806R 5′-GGACTACHVGGGTW TCTAAT-3′.
对于古菌,扩增片段为古菌16S rDNA,片段大小470 bp 左右(带有barcode);PCR 引物:349F 5′-GYGCASCAGKCGMGAAW-3′;806R 5′-GGACTACVS GGGTATCTAAT-3′.
通过软件将目的条带和Marker 进行亮度比对,得出目的条带浓度c≥10 ng·μL-1(Marker为DL2000,样品和Marker上样量均为3 μL),总量满足测序需求.
2.3.3 Illumina高通量测序采用Illumina Miseq PE300测序平台对采集的样品进行高通量测序.
2.3.4 生物信息分析生物信息分析分为初级信息分析和高级信息分析,其中,初级信息分析包括数据建库、质量控制、序列划分、物种组成、稀疏曲线及OUT表分析等;高级信息分析包含α多样性分析、β多样性分析和系统发育树.
2.4 统计分析本研究以Excel2007(Microsoft Inc.,USA)办公软件整理原始数据,并结合Origin8.5(Origin Lab,USA)软件绘制图表,采用SPSS19.0(IBM Inc.,USA)软件对数据进行分析.
3 结果与讨论(Results and discussion) 3.1 P-SMFC的产电特性本系统在整个运行过程中,PSM1、SM、PSM2处理组获得的最大输出电压分别为0.69、0.63、0.66 V,输出平均电压分别为0.32、0.24、0.28V;对3个处理组的输出电压进行显著性分析得出,PSM1处理组输出电压显著高于PSM2处理组,而PSM2处理组输出电压则显著高于SM处理组,说明植物能够强化系统的产电作用.通过拟合极化曲线线性部分的斜率估算出PSM1、SM和PSM2处理组的内阻分别为602、498和636 Ω,其所对应的最大输出功率密度分别为10.74、7.90和10.05 mW·m-2,在同一电流密度下,PSM1和PSM2处理组输出功率密度要显著高于SM处理组.结果显示,产电系统中植物的存在使得输出最大电压略有增大,平均电压显著增大,最大输出功率密度明显提高.
3.2 细菌群落多样性分析 3.2.1 α多样性指数分析OTUs(Operational Taxonomic Units)是微生物学研究中最常见的术语之一,通常将所有的序列按照97%的序列相似性进行OTU的挑选,认为一个OTU可能表示一个菌种.如表 1所示,本实验PSM1、SM、PSM2处理组测序所得的总序列分别为 31207、33759、28611,将所有的序列按照97%的序列相似性进行OTU的挑选,所得到的OTU分别为6767、6566、6259.
| 表 1 细菌群落α生物多样性分析 Table 1 Bacteria community alpha diversity analysis |
α生物多样性指的是每个样品内部的生物多样性的情况,表征指标有很多,这里主要计算3个指标,包括Chao1指数、Shannon指数及PD whole tree值.Chao1指数反映样品中群落的丰富度,即简单指群落中物种的数量(OTU数目),而不考虑群落中每个物种的丰度情况,数值越大,说明样品中物种越丰富.表 1中PSM1、SM、PSM2处理组的Chao1指数分别为12426、12391、12505,即种群种类为PSM2处理组>PSM1处理组>SM处理组,说明植物的存在有助于阳极生物膜各类微生物的生长.Shannon指数、PD whole tree值反映群落的多样性,Shannon指数及PD whole tree值越大,说明样品群落多样性越高.本次测序所得结果(表 1)显示,PSM1、SM、PSM2处理组的Shannon指数分别为9.95、9.70、10.16,PD whole tree值分别为326、317、328.两种指数均表现为:PSM2处理组的群落多样性要高于PSM1处理组,而PSM1处理组要高于SM处理组,说明植物的引入有助于产电系统中阳极生物膜细菌群落多样性的增加.
3.2.2 细菌群落结构分析图 1a为门水平的细菌分类.在3个处理组中,所测得的已知的序列隶属于20个门,分别为WPS-2、Fusobacteria梭杆菌门、WWE1、 Tenericutes软壁菌门、OP11 、WS6、 Verrucomicrobia疣微菌门、WS5 、Synergistetes互养菌门、Chlorobi绿菌门、Acidobacteria 酸杆菌门(嗜酸菌)、Spirochaetes螺旋体门、OP8、OD1、Actinobacteria放线菌门、Bacteroidetes拟杆菌门、Firmicutes厚壁菌门、Nitrospirae硝化螺旋菌门、Chloroflexi绿弯菌门、Proteobacteria变形菌门.PSM1、SM、PSM2处理组中都以Proteobacteria变形菌门的相对丰度最高,分别为36.19%、36.44%、33.18%,成为优势菌群.其次为Chloroflexi绿弯菌门,相对丰度分别为19.45%、20.37%、20.58%;Bacteroidetes拟杆菌门相对丰度分别为7.31%、7.65%、10.49%;Firmicutes厚壁菌门相对丰度分别为8.45%、7.50%、9.32%; Actinobacteria放线菌门相对丰度分别为2.93%、2.38%、3.39%.另外,在图 1a中可以看出,PSM1处理组的Nitrospirae硝化螺旋菌门的相对丰度要显著高于SM及PSM2处理组,风车草的引入显著增加了系统中Nitrospirae硝化螺旋菌门的数量,系统中不同植物的引入对微生物群落结构产生了影响.
 |
| 图 1 门水平(a)和属水平(b)细菌分类(相对丰度≥1%) Fig. 1 Bacterial classification of phylum level(a)and genus level(b) |
图 1b所示为细菌在属水平的分类,在3个处理组中,所测得的已知的序列隶属于17个属,分别为Desulfosporosinus脱硫芽孢弯曲菌属、硫酸盐还原菌的主要属、Blvii28、Sulfuricurvum、Methylomonas甲基单胞菌属、Chlorobaculum绿棒菌属、Syntrophomonas食丁酸盐产氢产乙酸菌、Syntrophus互营菌属、Treponema密螺旋体属、Thiothrix丝硫细菌属、E6、Thiobacillus硫杆菌属、Anaerolinea厌氧绳菌属、WCHB1-05、Clostridium梭菌属、Longilinea长绳菌属、GOUTA19、Geobacter土杆菌属(一类产电微生物(张翼峰,2008)).其中,以土杆菌属Geobacter的相对丰度最高,在PSM1、SM、PSM2处理组中分别达到11.50%、14.33%、8.53%.其次为WCHB1-05、Longilinea、Clostridium、Anaerolinea 4种菌属,相对丰度均在1.5%以上.从图 1b中可以明显看出,PSM1处理组中GOUTA19的相对丰度要显著高于SM、PSM2处理组,达到8.74%,而SM、PSM2处理组仅分别为0.41%及0.09%.可以看出,系统中不同植物的引入会对微生物群落结构产生影响.
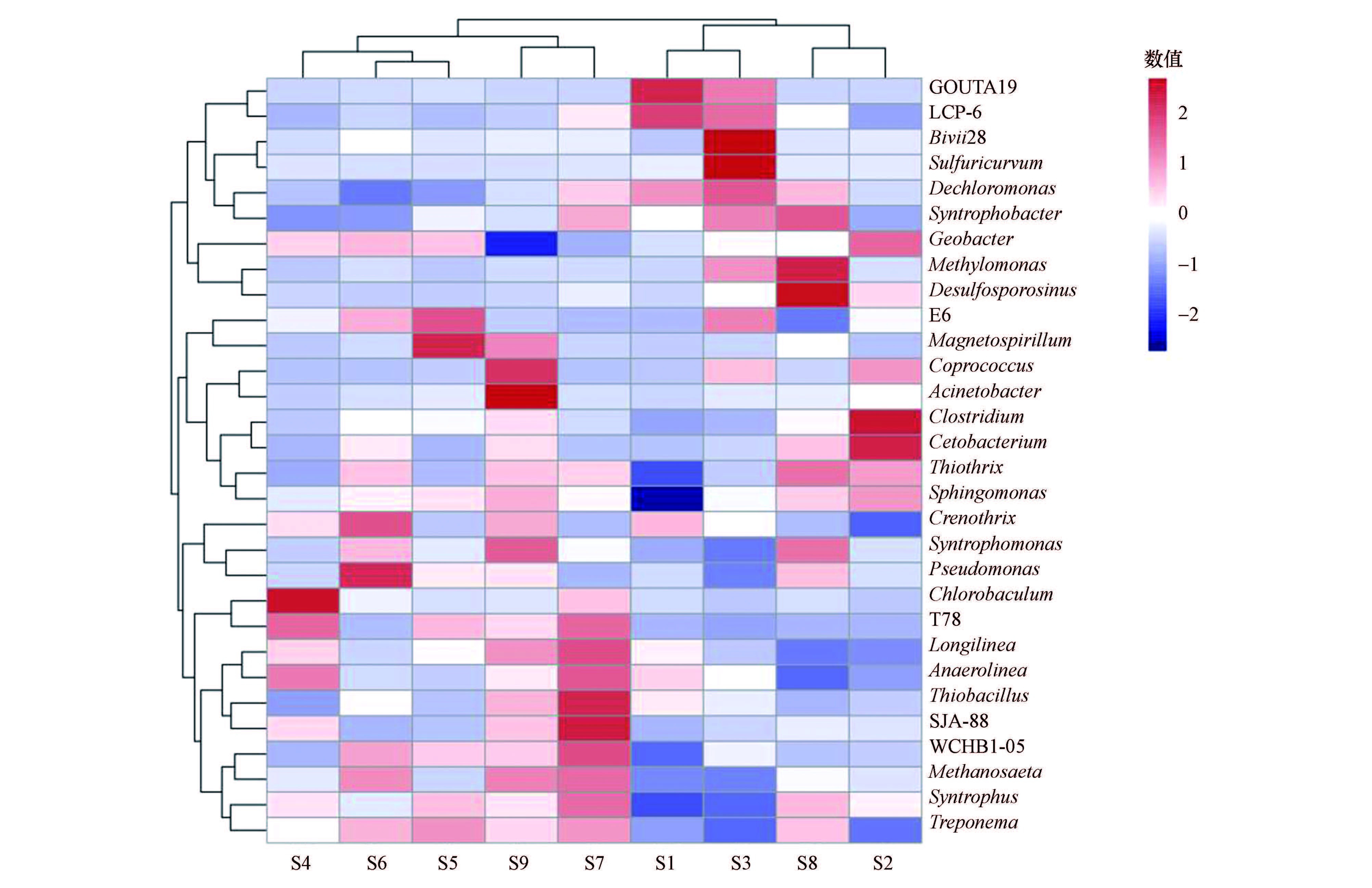
3.2.3 物种热图分析Heatmap是以颜色梯度来代表数据矩阵中数值的大小并能根据物种或样品丰度信息或样品丰度相似性进行聚类的一种图形展示方式.聚类结果加上样品的处理或取样环境分组信息,可以直观地通过颜色梯度及相似程度观察到相同处理或相似环境样品的聚类情况,并直接反映了样品的群落组成的相似性和差异.对在属水平上相对丰度值排在前30位的属进行聚类分析,结果如图 2所示,其中,纵向聚类表示所有物种在不同样品间表达的相似情况,距离越近,枝长越短,说明样品的物种组成及丰度越相似;横向为系统发育树.
从图 2可以看出,PSM1处理组中属于ε-变形菌门的GOUTA19、LCP-6、Blvii28、Sulfuricurvum,以及Dechloromonas、Syntrophobacter食丁酸盐产氢产乙酸菌相对丰度较高,为PSM1 的优势菌群;而PSM2中Geobacter土杆菌属(变形菌门)、E6、Magnetospirillum趋磁细菌、Crenothrix泉发菌属(铁细菌)、Syntrophomonas互营单胞菌属、Pseudomonas假单胞菌属(γ-变形菌纲)、Chlorobaculum绿棒菌属、T78、Longilinea长绳菌属、Anaerolinea厌氧绳菌属、WCHB1-05、Methanosaeta 鬃毛甲烷菌、Syntrophus互营菌属、Treponema密螺旋体属菌群的相对丰度最高,其群落结构与PSM1处理组不同,存在显著差异;SM处理组中相对丰度较高的菌群为Magnetospirillum趋磁细菌、Coprococcus粪球菌属、Acinetobacter不动杆菌属、Chlorobaculum绿棒菌属、T78、Longilinea长绳菌属、Anaerolinea厌氧绳菌属、Thiobacillus丝硫细菌属、SJA-88、WCHB1-05、Methanosaeta鬃毛甲烷菌、Syntrophus互营菌属、Treponema密螺旋体属,其群落结构和PSM1、PSM2均不一样.由此看出,PSM1、SM、PSM2处理组之间的微生物群落结构差异较大,不同植物种类会对阳极生物膜微生物群落结构产生不同影响.
3.3 古菌群落多样性分析 3.3.1 α多样性指数分析如表 2所示,本实验PSM1、SM、PSM2处理组测序所得的总序列分别为2982、1588、3276,将所有的序列按照97%的序列相似性进行OTU的挑选,所得到的OTU分别为392、269、376,其中,PSM2处理组获得了最大的OUT,样品中种群种类也相应较多.
表 2中PSM1、SM、PSM2处理组的Chao1指数分别为535.05、517.65、507.05,即PSM1处理组的种群种类数>SM处理组> PSM2处理组.由Shannon指数及PD whole tree值可以看出,两种指数均表现出PSM1处理组的古菌群落多样性要高于PSM2处理组,而PSM2处理组要高于SM处理组,说明植物的引入有助于系统中古菌群落多样性的增加,且风车草相比短叶茳芏而言,更能增加系统的古菌群落的多样性.
 |
| 图 2 细菌群落物种相对丰度聚类图(属水平) Fig. 2 The relative abundance of bacteria community species clustering figure |
| 表 2 古菌群落α生物多样性分析 Table 2 Archaea community alpha diversity analysis |
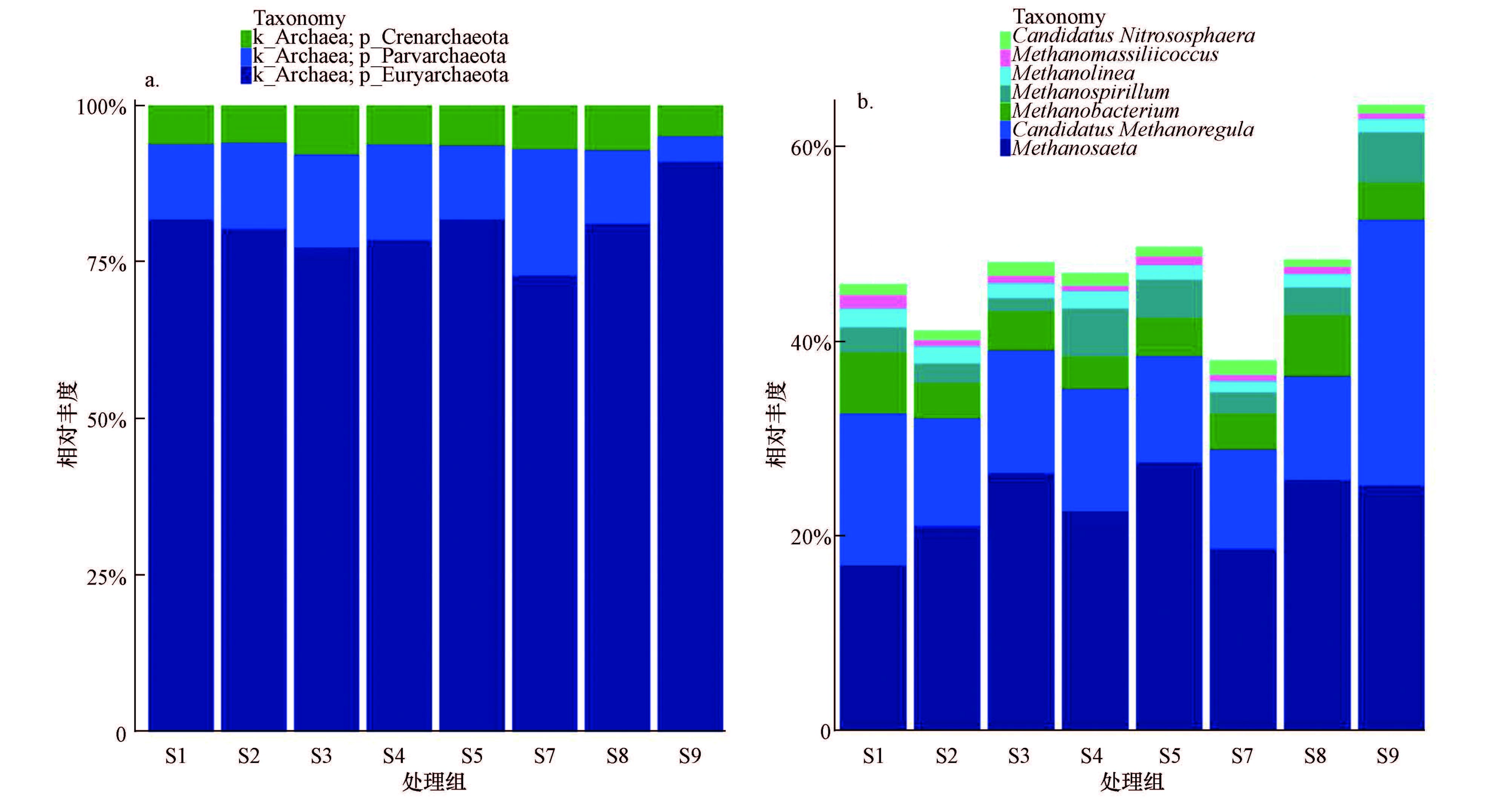
图 3a为门水平的古菌分类,其中,S6未能检测出序列信息.在3个处理组中,所测得的已知的序列隶属于3个门,分别为Crenarchaeota泉古菌门、Parvarchaeota(假定上的嗜酸生物)(Petitjean et al,2015)、Euryarchaeota广古菌门.PSM1、SM、PSM2处理组中都以Euryarchaeota广古菌门的相对丰度最高,分别为79.83%、80.20%、81.67%,成为优势菌群.Crenarchaeota及Parvarchaeota相对丰度分别在6%和13%左右.
图 3b为古菌在属水平的分类上,在3个处理组中,所测得的已知的序列隶属于7个属,分别为Candidatus Nitrososphaera氨氧化古菌(Candidatus表示这种有机体或生物体虽可定义描述但却不能培养,可以称为“暂定种”)、Methanomassiliicoccus、Methanolinea甲烷绳菌属、Methanospirillum甲烷螺菌属、Methanobacterium甲烷杆菌属、Candidatus Methanoregula、Methanosaeta甲烷鬃菌属.其中以Methanosaeta的相对丰度最高,在PSM1、SM、PSM2处理组中分别达到21.43%、25.00%、23.16%,植物构成组丰度偏低;其次为Candidatus Methanoregula,相对丰度分别为13.05%、11.73%、16.02%,植物构成组丰度偏高.从图 3b中可以明显看出,已检测出的基因序列中,除了有少部分氨氧化类古菌的序列,其余序列都为产甲烷类古菌序列,其相对丰度总和达到30%以上.
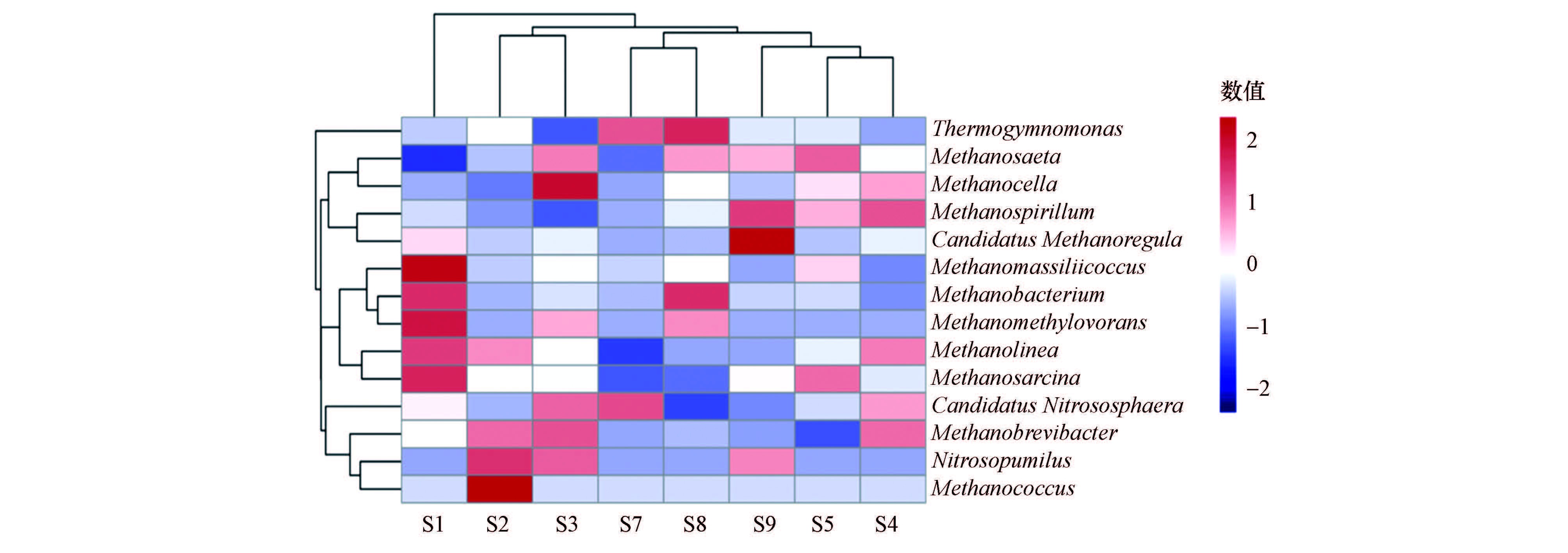
3.3.3 物种热图分析对各层级物种相对丰度进行排序,选取排序在前30位的物种(不足30个的则选取所有物种)进行聚类分析,结果如图 4所示,其中,纵向聚类表示所有物种在不同样品间表达的形似情况,距离越近,枝长越短,说明样品的物种组成及丰度越相似;横向为物种的系统发育树.由图 4中可知,系统阳极生物膜主要的古菌类群有Thermogymnomonas热裸单胞菌属、Methanosaeta甲烷鬃菌属、Methanocella产甲烷胞菌属、Methanospirillum甲烷螺菌属、Candidatus Methanoregula、Methanomassiliicoccus、Methanobacterium甲烷杆菌属、Methanomethylovorans甲烷食甲基菌属、Methanolinea甲烷绳菌属、Methanosarcina甲烷八叠球菌属、Candidatus Nitrososphaera、Methanobrevibacter甲烷短杆菌属、Nitrosopumilus亚硝化侏儒菌属、Methanococcus甲烷球菌属.
 |
| 图 3 门水平(a)和属水平(b)古菌分类(相对丰度≥1%) Fig. 3 Archaea classification of phylum level(a)and genus level(b) |
 |
| 图 4 古菌群落物种相对丰度聚类图(属水平) Fig. 4 The relative abundance of archaea community species clustering figure |
PSM1处理组中以Methanomassiliicoccus、Methanobacterium甲烷杆菌属、Methanomethylovorans甲烷食甲基菌属、Methanolinea甲烷绳菌属、Methanosarcina甲烷八叠球菌属、Candidatus Nitrososphaera、Methanobrevibacter甲烷短杆菌属、Nitrosopumilus亚硝化侏儒菌属、Methanococcus甲烷球菌属的相对丰度较高;而PSM2处理组中以Thermogymnomonas热裸单胞菌属、Methanosaeta甲烷鬃菌属、Methanocella产甲烷胞菌属、Methanospirillum甲烷螺菌属、Candidatus Methanoregula相对丰度较高;SM处理组中相对丰度较高的菌群为Methanosaeta甲烷鬃菌属、Methanocella产甲烷胞菌属、Methanospirillum甲烷螺菌属、Methanolinea甲烷绳菌属、Methanosarcina甲烷八叠球菌属、Candidatus Nitrososphaera、Methanobrevibacter甲烷短杆菌属,3个处理组中群落结构各自不同,微生物群落结构差异较大.
4 结论(Conclusions)1) 系统运行过程中,PSM1、SM、PSM2处理组分别获得0.69、0.63、0.66 V的最大输出电压,输出平均电压分别为0.32、0.24、0.28 V.3个处理组的内阻分别为602、498和636 Ω,其所对应的最大输出功率密度分别为10.74、7.90和10.05 mW·m-2.产电系统中植物存在使得输出最大电压略有增大,平均电压显著增大,最大输出功率密度明显提高.
2) 植物的引入及不同植物之间均会对微生物燃料电池系统中的细菌群落结构产生影响.植物的存在一方面有助于阳极生物膜各类微细菌的生长,另一方面有助于产电系统中阳极生物膜细菌群落多样性的增加.3个处理组中都以Proteobacteria变形菌门为优势菌群,其次为Chloroflexi绿弯菌门,在所有菌属中以土杆菌属Geobacter的相对丰度最高,在PSM1、SM、PSM2处理组中分别达到11.50%、14.33%、8.53%.
3) 植物的引入有助于系统中古菌群落多样性的增加,且风车草相比短叶茳芏而言,更能增加系统的古菌群落的多样性.系统中风车草和短叶茳芏的引入对阳极古菌群落结构产生了显著影响,3个处理组中群落结构各自不同,微生物群落结构差异较大.3个处理组中都以Euryarchaeota广古菌门的相对丰度最高,在PSM1、SM、PSM2处理组中分别达到79.83%、80.20%、81.67%,成为优势菌群,其中以甲烷八叠球菌目Methanosarcinales的 Methanosaeta属、甲烷杆菌目Methanobacteriales的Candidatus Methanoregula属的相对丰度最高,为其优势菌属.
| [1] | Aelterman P, Rabaey K, Pham H T, et al. 2006. Continuous electricity generation at high voltages and currents using stacked microbial fuel cells[J]. Environmental Science & Technology , 40 (10) : 3388–3394. |
| [2] | Basumatary B, Bordoloi S, Sarma H P. 2012. Crude oil-contaminated soil phytoremediation by using Cyperus brevifolius(Rottb) Hassk[J]. Water,Air,& Soil Pollution , 223 (6) : 3373–3383. |
| [3] | Bombelli P, Iyer D M R, Covshoff S, et al. 2013. Comparison of power output by rice (Oryza sativa) and an associated weed (Echinochloa glabrescens) in vascular plant bio-photovoltaic (VP-BPV) systems[J]. Applied Microbiology and Biotechnology , 97 (1) : 429–438. DOI:10.1007/s00253-012-4473-6 |
| [4] | Chen Z, Huang Y, Liang J, et al. 2012. A novel sediment microbial fuel cell with a biocathode in the rice rhizosphere[J]. Bioresource Technology , 108 : 55–59. DOI:10.1016/j.biortech.2011.10.040 |
| [5] | Esteve Nuñez A, Reija A, Moreno Garzón F, et al. 2009. Harvesting bioelectricity from natural environments: microbial fuel cell fuelled by rice plants[J]. New Biotechnology , 25 : S280. DOI:10.1016/j.nbt.2009.06.1011 |
| [6] | De Schamphelaire L, Cabezas A, Marzorati M, et al. 2010. Microbial community analysis of anodes from sediment microbial fuel cells powered by rhizodeposits of living rice plants[J]. Applied and Environmental Microbiology , 76 (6) : 2002–2008. DOI:10.1128/AEM.02432-09 |
| [7] | Hubenova Y, Mitov M. 2012. Conversion of solar energy into electricity by using duckweed in direct photosynthetic plant fuel cell[J]. Bioelectrochemistry , 87 : 185–191. DOI:10.1016/j.bioelechem.2012.02.008 |
| [8] | Kaku N, Yonezawa N, Kodama Y, et al. 2008. Plant/microbe cooperation for electricity generation in a rice paddy field[J]. Applied Microbiology and Biotechnology , 79 (1) : 43–49. DOI:10.1007/s00253-008-1410-9 |
| [9] | 李冲.2011.微生物燃料电池利用养殖废水产电特性,微生物群落分析及产电菌分离[D].广州:华南理工大学.1-74 http://epub.cnki.net/kns/detail/detail.aspx?QueryID=29&CurRec=1&recid=&FileName=1012298723.nh&DbName=CMFD2012&DbCode=CMFD&pr= |
| [10] | 刘士哲, 林东教, 唐淑军, 等.2004. 利用漂浮植物修复系统栽培风车草,彩叶草和茉莉净化富营养化污水的研究[J]. 应用生态学报 , 2004, 15 (7) : 1261–1265. |
| [11] | Petitjean C, Deschamps P, López García P, et al. 2015. Rooting the domain archaea by phylogenomic analysis supports the foundation of the new kingdom proteoarchaeota[J]. Genome Biology and Evolution , 7 (1) : 191–204. DOI:10.1093/gbe/evu274 |
| [12] | Quan X, Quan Y, Tao K. 2012. Effect of anode aeration on the performance and microbial community of an air-cathode microbial fuel cell[J]. Chemical Engineering Journal , 210 : 150–156. DOI:10.1016/j.cej.2012.09.009 |
| [13] | Schamphelaire L D, Bossche L V D, Dang H S, et al. 2008. Microbial fuel cells generating electricity from rhizodeposits of rice plants[J]. Environmental Science & Technology , 42 (8) : 3053–3058. |
| [14] | Timmers R A, Strik D P, Hamelers H V, et al. 2010. Long-term performance of a plant microbial fuel cell with Spartina anglica[J]. Applied Microbiology and Biotechnology , 86 (3) : 973–981. DOI:10.1007/s00253-010-2440-7 |
| [15] | Timmers R A, Rothballer M, Strik D P, et al. 2012. Microbial community structure elucidates performance of Glyceria maxima plant microbial fuel cell[J]. Applied Microbiology and Biotechnology , 94 (2) : 537–548. DOI:10.1007/s00253-012-3894-6 |
| [16] | Venkata Mohan S, Mohanakrishna G, Chiranjeevi P. 2011. Sustainable power generation from floating macrophytes based ecological microenvironment through embedded fuel cells along with simultaneous wastewater treatment[J]. Bioresource Technology , 102 (14) : 7036–7042. DOI:10.1016/j.biortech.2011.04.033 |
| [17] | Wen Z, Ci S, Mao S, et al. 2013. TiO2 nanoparticles-decorated carbon nanotubes for significantly improved bioelectricity generation in microbial fuel cells[J]. Journal of Power Sources , 234 : 100–106. DOI:10.1016/j.jpowsour.2013.01.146 |
| [18] | Zhang Y, Sun J, Hu Y, et al. 2012. Bio-cathode materials evaluation in microbial fuel cells: a comparison of graphite felt,carbon paper and stainless steel mesh materials[J]. International Journal of Hydrogen Energy , 37 (22) : 16935–16942. DOI:10.1016/j.ijhydene.2012.08.064 |
| [19] | 张翼峰.2008.不同底物的微生物燃料电池阳极菌群及其产电特性分析[D].大连:大连理工大学.1-72 http://cdmd.cnki.com.cn/article/cdmd-10141-2009041283.htm |
 2016, Vol. 36
2016, Vol. 36


