2. 福建农林大学安溪茶学院, 福州 350002
2. Anxi Tea College, Fujian Agriculture and Forestry University, Fuzhou 350002
生态系统碳循环与当前全球气候变暖密切相关,是全球变化研究的一个重要领域(Vitousek,1994).CO2作为生态系统碳输出的重要途径,自1750年以来其浓度增加了40%,达到了391 ppm(IPCC,2013),对其产生与排放的研究一直是全球变化研究的关键环节.土壤有机碳作为全球碳循环中重要的碳库,其矿化、分解是控制土壤CO2释放的主要途径(Batson et al.,2015).自工业革命以来,由于化石燃料的燃烧、工业发展、土地利用变化及农业施肥等人类活动的影响,活性氮、硫排放明显增加(Gauci et al.,2008;Gundale et al.,2014).特别是我国氮、硫沉降不断增强,已成为继欧美之后世界第三大氮、硫沉降区(Liu et al.,2013;肖胜生等,2014).氮、硫沉降持续增强为土壤碳循环和有机碳矿化研究带来了新的推动力,同时也赋予其新的研究内涵.
研究已证实,湿地是重要的CO2汇,是地球陆地表面碳密度最高的生态系统(Scholz et al.,2007).湿地生态系统土壤有机碳矿化对于氮、硫输入的响应研究目前开展较少,且不同湿地的响应特征存在很大差异.马力等(2009)研究了长期施肥(26 a)对水稻土有机碳矿化动态的影响,发现不同施肥条件均促进了有机碳的矿化,并且有机肥处理的最大矿化速率高于化肥处理.李英臣等(2011)研究发现,氮输入对不同类型湿地土壤有机碳矿化速率和累计矿化量均存在抑制作用,并且随氮输入量的增大,氮的抑制作用在不同湿地有所差异.Neff等(2002)对科罗拉多高山苔原13C、14C的同位素研究发现,氮输入尽管加快了湿地土壤中轻组有机碳分解,但却抑制了重组有机碳分解过程.硫输入对土壤有机碳矿化的影响主要是通过硫酸盐还原作用来实现的,硫酸盐还原过程可促使的有机碳分解速率约占总分解速率的50%(Jorgensen,1982),伴随着明显的CO2产生(Chambers et al.,2011).目前,氮、硫输入对湿地有机碳矿化的研究主要集中在水稻田、泥炭地和淡水湿地,而且结论不尽一致.有关外源氮、硫输入及其耦合作用对滨海湿地特别是河口潮汐沼泽湿地有机碳矿化的研究还不多见,有待深入研究.
滨海河口湿地处于海陆交互地带,是对全球变化和人类活动响应敏感的生态系统,其对外界胁迫压力反应的特有敏感性使其成为当前碳循环研究的重要区域(Lunau et al.,2013).近年来,由于人类活动强度的不断提升,使得沿海流域通过陆源输送、大气干湿沉降、与开放海域的海水交换及沉积物-水界面交换等途径(Wade et al.,2005)向受纳河口输出的氮、硫通量不断增加.入海河口区氮、硫负荷增强已成为改变河口湿地生态系统服务与功能最重要的因素之一(Bukaveckas et al.,2013).外源氮、硫输入对河口沼泽湿地土壤碳循环和有机碳库的影响研究也已成为当前全球环境研究的热点(Wigand et al.,2009).深入研究河口湿地土壤有机碳矿化特征对氮、硫输入的响应,对于厘清氮、硫负荷增强条件下河口湿地土壤碳氮循环的耦合作用具有重要意义.闽江是我国重要的入海河流之一,地处中亚热带与南亚热带过渡区,具有流量大、流速快的特点.闽江口鳝鱼滩湿地是闽江流域最大的自然湿地,承接着来自中上游排放及潮汐携带的大量含氮、硫物质,为开展外源氮、硫输入对河口沼泽湿地土壤碳循环关键过程的影响研究提供了理想的场所.研究土壤有机碳矿化过程对于这种高氮、硫输入尤其是不同形态氮、硫输入的响应,对于全面认识氮、硫沉降对河口潮汐湿地土壤碳循环关键过程的影响及关键机制具有重要意义.因此,本文通过室内培养实验,研究氮、硫输入对闽江河口湿地土壤有机碳矿化和土壤理化性质的影响.
2 材料与方法(Materials and methods) 2.1 研究区概况闽江河口鳝鱼滩湿地(26°00′36″~26°03′42″N,119°34′12″~119°40′40″E)是福建省闽江河口湿地自然保护区内面积最大的自然湿地.气候温暖湿润,年均气温19.6 ℃,年均降水量1346 mm.该区是典型的开放式感潮河口,潮汐属典型半日潮,土壤以红壤、砖红壤为主(郑彩红等,2006).芦苇(Phragmites australis)、短叶茳芏(Cyperus malaccensis var. brevifolius)和藨草(Scirpus triqueter)是该区的土著优势植物.本研究在鳝鱼滩湿地西侧高潮滩短叶茳芏湿地选择一个典型样区进行土样采集.
2.2 土样采集与氮、硫输入2015年7月,在闽江河口鳝鱼滩短叶茳芏潮汐湿地采用多点混合的方法,多点采集0~15 cm土层土壤,去除表层腐质层后混合在一起.将采集的土样用自封袋密封带回实验室,自然风干后剔除根系和砂砾,分别过10目和100目筛,一部分用于测定土壤pH、全氮(TN)、全碳(TC)、可溶性有机碳(DOC)、电导率(EC)、氨氮(NH4+-N)、硝氮(NO3--N)等指标(作为背景值),另一部分配置泥浆用于培养实验.
室内运用培养法研究氮、硫输入及其耦合作用对河口湿地土壤有机碳矿化速率的影响.选定的氮、硫形态分别为氯化铵(NH4Cl)、硝酸钾(KNO3)、硝酸铵(NH4NO3)、硫酸钾(K2SO4),根据中国市域氮、硫沉降的一般区间及同类研究(Kivimäki et al.,2013;高伟等,2014),并结合闽江河口区实际沉降量,按照中偏高输入标准模拟研究未来氮、硫沉降量持续增加对温室气体排放的影响.其中,氮输入设置3个类型(均以土壤干重计),分别为500 μg·g-1 NH4Cl(N1)、500 μg·g-1 KNO3(N2)、500 μg·g-1 NH4NO3(N3);硫输入设置1个类型,500 μg·g-1 K2SO4(S),以土壤干重计;氮、硫耦合输入按质量比1∶1配比设置3个类型(均以土壤干重计),分别为500 μg·g-1(NH4Cl+ K2SO4:NS1)、500 μg·g-1(KNO3+ K2SO4:NS2)、500 μg·g-1(NH4NO3+ K2SO4:NS3);另设一个对照处理组(CK),共计8个处理,每个处理3个重复.
2.3 室内培养与测定实验室恒温培养法是目前最为普遍的有机碳矿化速率测定方法.室内培养的土壤样品或用鲜土,或用干土配置为泥浆,或直接采用原状鲜土柱进行培养实验.为使本底均质,本研究采用干土配置泥浆的方法进行培养试验.
称取过10目筛土样20 g放入到200 mL玻璃培养瓶中,按原位土壤实际含水率(61%)一次分别输入不同类型含氮、硫溶液到培养瓶内(输入量见2.2节),使用磁力搅拌器使样品混合均匀成泥浆状,对照则输入同等容量的蒸馏水.在培养试验开始前,将上述培养瓶在培养温度下预培养1 d.预培养结束后,将培养瓶用硅橡胶塞密封,并提前在硅橡胶塞中间打2个孔,插入玻璃管,其中一根长度以接近泥浆表层为宜(不要插入泥浆),作为空气进口;另一根较短,稍稍插入培养瓶即可,作为CO2出口和气体取样口.将培养瓶在原位平均温度下(28.5 ℃)培养18 d,期间每天用气密针从培养瓶顶部抽取气样(每次2 mL气体),使用气相色谱仪(Shimadzu GC-2014,Japan)测定CO2气体浓度.根据气体浓度与时间之间的线性回归方程(R2>0.9)计算气体通量,每3 d算作一个通量,共6个通量.每次抽气前,用力摇晃培养瓶30 s,使瓶内CO2浓度平衡.为保证培养瓶内有足够的氧气,实验分为6个阶段,每阶段实验后,打开玻璃管的密封塞,使瓶内外空气交流,下一阶段开始前封闭气瓶,立即测定作为初始值继续培养.
2.4 土壤理化指标测定土壤pH采用IQ150便携式pH仪(IQ Scientific Instruments,USA)测定;土壤EC采用2265FS便携式电导/温度计(Spectrum Technologies Inc,USA)测定;含水率用烘干法测定;容重用环刀法进行测定.土壤TC、TN使用碳氮元素分析仪(vario MAX,德国)测定,无机氮经KCl浸提后使用连续流动分析仪(Skalar San++,荷兰)测定.
整个培养期结束后,将一部分样品加去离子水至水土质量比为5∶1,25 ℃振荡0.5 h后离心,取上清液过0.45 μm滤膜,测定溶液中DOC、SO42-和Cl-含量,其中,土壤DOC使用TOC-VCPH总有机碳分析仪(Shimadzu,Japan)测定,SO42-和Cl-使用ICS-2100离子色谱仪(DIONEX,USA)测定;另一部分样品则使用KCl浸提的方法,使用连续流动分析仪测定无机氮含量.
2.5 数据处理与分析利用EXCEL 2007、SPSS17.0对数据进行分析处理,利用Origin8.0对数据作图.其中,基于SPSS 17.0的单因素方差分析模块,分析不同处理之间的差异性;基于相关性分析模块分析有机碳矿化速率与土壤参数间的相关关系;基于回归分析和多元统计分析模块进行数据深度分析.此外,由于有机碳矿化主要为活性有机碳分解,因此,采用一级动力学方程模拟分析不同处理下土壤有机碳矿化动态(Cooper et al.,2011).一级动力学方程为:
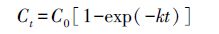
|
(1) |
式中,Ct是经过时间t(d)后累积释放的CO2-C(mg·kg-1),C0是有机碳矿化的潜在矿化势(mg·kg-1),k是有机碳矿化速率常数(d-1),t为培养时间(d).
3 结果与分析(Results and analysis) 3.1 氮、硫输入对湿地土壤有机碳矿化速率的影响氮、硫输入对闽江河口湿地土壤有机碳矿化速率的影响随时间变化存在差异(图 1).统计分析显示,CK、N1、N2、N3、S、NS1、NS2、NS3处理下土壤有机碳矿化速率变化范围分别介于38.71~172.94、76.00~308.89、51.81~297.51、62.80~286.57、66.68~347.00、56.30~333.30、52.69~337.46和48.22~294.68 μg·g-1·d-1,平均值分别为(93.13±20.94)、(156.46±37.15)、(128.26±37.35)、(142.42±34.07)、(166.68±42.85)、(141.57±41.67)、(143.67±43.15)和(126.83±36.79)μg·g-1·d-1.与CK相比,N1、N3、S、NS1处理均显著促进了土壤有机碳矿化(p<0.05),分别提高了76.57%、60.09%、83.20%和52.59%.不同处理组对湿地土壤有机碳矿化速率的促进作用大致表现为:S>N1>N3>NS1>NS2>N2>NS3.
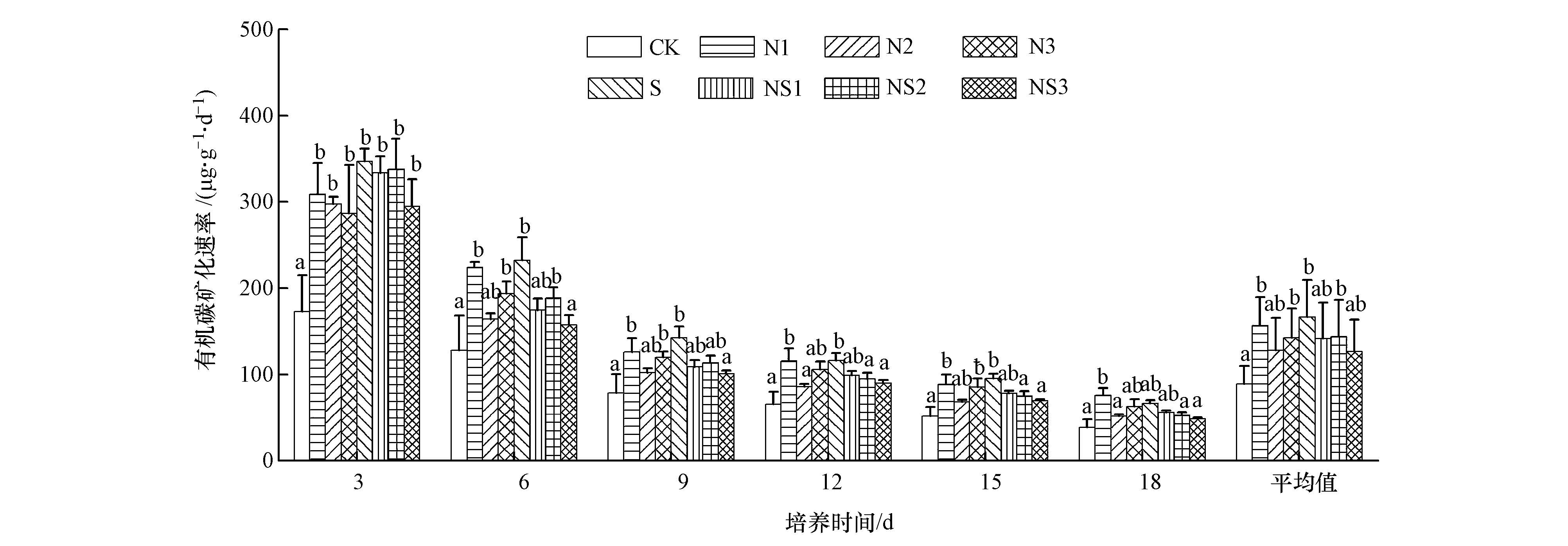 |
| 图 1 氮、硫输入对闽江河口湿地土壤有机碳矿化速率的影响(不同小写字母代表同一时间不同处理间差异性显著) Fig. 1 Effects of nitrogen and sulfate inputs on soil organic carbon mineralization rates |
氮、硫输入在不同时间对湿地土壤有机碳矿化的影响不尽一致(图 1).室内培养第3、6 d,各处理下有机碳矿化较其他时间相比明显较高,并且第6 d的平均矿化速率仅为第3 d的60%.不同时间尺度上,不同处理均促进了土壤有机碳矿化速率,但在前6 d各处理的促进作用最明显,尤以前3 d刺激作用最激烈;第9~18 d各处理土壤有机碳矿化速率差异不大,氮、硫输入对土壤有机碳矿化的促进作用也趋于平稳.整体而言,不同氮、硫输入处理并没有显著改变河口湿地土壤有机碳矿化的时间变化趋势,不同处理下土壤有机碳矿化速率均表现为随培养时间的增加而递减,最大值均发生在培养第3 d.
3.2 氮、硫输入对湿地土壤有机碳累积矿化量的影响河口湿地土壤有机碳累积矿化量在不同处理下均表现为随培养时间逐渐增加(图 2a),其增长速率在培养初始阶段较快(前6 d),而后逐渐减慢(图 2b).氮、硫输入处理下的土壤有机碳累积矿化量均高于对照处理,表明外源氮、硫增强对有机碳的矿化有一定的促进作用.氮、硫输入对土壤有机碳累积矿化量的促进作用大致表现为S>N1>NS2>N3>NS1>N2>NS3>CK.方差分析表明,与CK相比,N1、N3、S、NS1和NS2处理均显著促进了土壤有机碳累计矿化量(p<0.05).
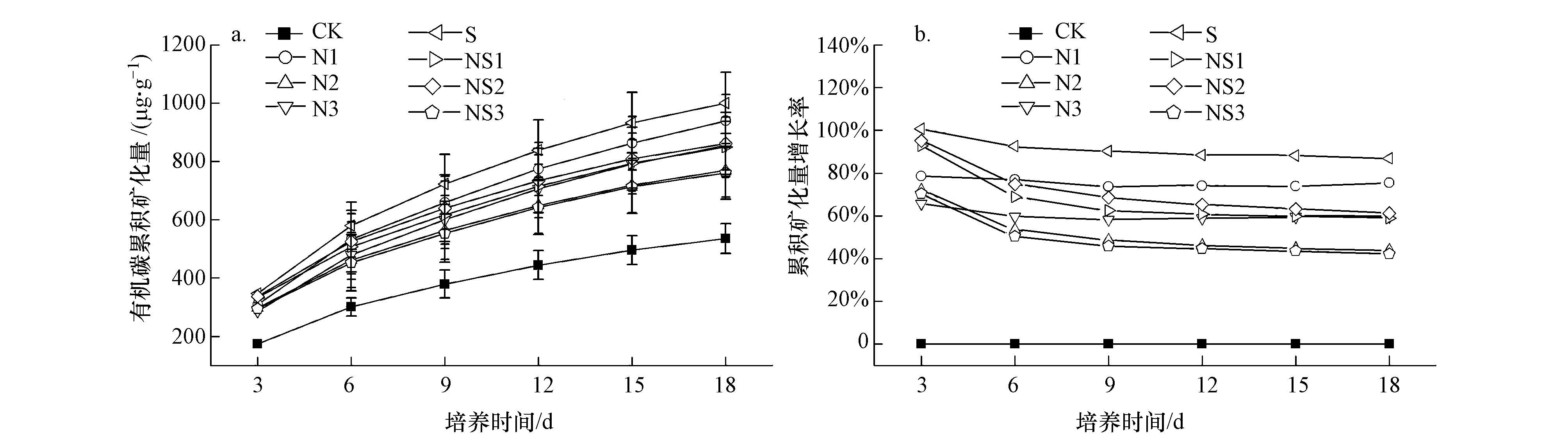 |
| 图 2 氮、硫输入对闽江河口湿地土壤有机碳累积矿化量的影响 Fig. 2 Effects of nitrogen and sulfate inputs on cumulative mineralization of soil organic carbon |
利用一元动力学模型对河口湿地土壤有机碳矿化量数据进行拟合发现,不同处理下有机碳矿化动态均符合一级动力学指数方程(R2>0.98)(表 1).各输入处理下有机碳潜在矿化势(C0)和矿化速率常数(k)均高于对照,其中,C0以S处理最高,而k以NS2处理最大.
| 表 1 氮、硫输入对闽江河口湿地土壤有机碳累积矿化的影响 Table 1 Effects of nitrogen and sulfate inputs on cumulative mineralization of soil organic carbon |
短期培养结束后,湿地土壤DOC含量发生了明显变化(表 2).除NS2处理外,氮、硫输入均提高了土壤DOC含量,但除N3、NS1处理显著增加了土壤DOC含量外(p<0.05),其他处理影响不显著(p>0.05).外源氮、硫输入对湿地土壤无机氮含量的影响各异,N1、N3、NS1和NS3处理均显著增加了土壤NH4+-N含量(p<0.05),较CK分别增加了356.81%、271.91%、406.43%和388.74%;N2、N3、NS2和NS3处理均显著增加了土壤NO3--N含量(p<0.05);其他处理对土壤NH4+-N、NO3--N含量均没有产生显著影响(p>0.05).在离子强度方面,整体上S、NS1、NS2和NS3处理均显著增加了土壤SO42-含量(p<0.05),较CK分别增加了143.40%、140.51%、144.41%和258.96%;N1和NS1处理增加了土壤Cl-含量,但与CK相比未达到显著性水平(p>0.05);其他处理对土壤SO42-、Cl-含量均没有产生显著影响(p>0.05).不同处理下湿地土壤pH具有微弱的波动变化特征,氮、硫处理下土壤pH均低于CK处理,使土壤呈弱酸性,但这种差异并未达到显著性水平(p>0.05).培养结束后,湿地土壤EC在不同处理组间均不存在显著差异(p>0.05).
| 表 2 氮、硫输入对湿地土壤理化性质的影响 Table 2 Soil physical and chemical properties after different nitrogen and sulfate treatments |
相关分析显示(表 3),氮、硫输入处理下,闽江河口湿地有机碳矿化速率与土壤DOC和SO42- 含量均具有显著正相关关系(p<0.01),与Cl-存在显著负相关关系(p<0.01),与NH4+-N呈显著正相关关系(p<0.05).
| 表 3 河口湿地土壤有机碳矿化速率与土壤理化性质间的相关关系 Table 3 Pearson correlation coefficients for soil organic carbon mineralization rates and soil parameters |
为探讨培养后土壤理化性质对土壤有机碳矿化速率的贡献率,利用多元回归分析中的逐步回归分析(Stepwise Regression Analysis)建立有机碳矿化速率与土壤DOC、NH4+-N、NO3--N、SO42-、Cl-、pH、EC的最优回归模型.闽江河口湿地有机碳矿化速率(Y)的多元回归方程为:
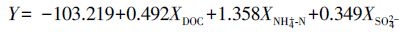
|
(2) |
逐步回归分析结果表明,DOC、NH4+-N和SO42-是氮、硫输入处理下影响河口湿地土壤有机碳矿化速率的主要控制因素,调整的R2(Adjusted R Square)分别为0.803、0.657和0.924,均达到显著水平(p<0.001).
4 讨论(Discussion) 4.1 氮、硫输入对湿地土壤有机碳矿化动态的影响土壤可利用性碳、氮底物的数量是影响土壤有机碳矿化的主要因素(刘德燕等,2008),河口湿地生态系统通常是氮限环境,外源氮的输入通过影响土壤氮可获得性,进而影响湿地土壤有机碳的矿化和累积状况.本研究中,NH4Cl、NH4NO3、K2SO4和NH4Cl+ K2SO4输入处理均显著促进了湿地土壤有机碳矿化速率(p<0.05),并且不同处理下土壤有机碳矿化速率均表现为随培养时间的增加而递减(图 1).这主要是因为外源氮输入后,显著增强了湿地土壤氮的有效性,提高了土壤氮底物的供给和可利用性,这就刺激了土壤中原先受到氮限制的微生物的活性,加快了土壤有机碳矿化;但随着单糖、有机酸和蛋白质等底物的消耗(Berg,2000),可供微生物利用的易分解底物越来越少,这时有效碳源成为微生物活动的限制因素(Stapleton et al.,2005),导致有机碳矿化速率逐渐减弱,直至达到稳定状态.Franzluebbers等(2001)也认为,培养期土壤活性有机碳的逐渐减少是影响土壤有机碳矿化速率随时间逐渐减弱的主要原因.此外,由于本研究使用的是干土配置泥浆的方法进行培养,加入含氮、硫溶液后显著激活了土壤微生物活性,也使得初始有机碳矿化速率较高.外源硫输入对湿地土壤有机碳矿化速率的促进作用主要是因为硫输入显著增加了土壤中SO42-含量,增强了硫酸盐还原作用,而硫酸盐还原是土壤有机底物碳矿化的重要终端过程(Jorgensen,1982),SO42-作为终端电子受体能够影响有机质的矿化和CO2的产生(Chambers et al.,2011).
本研究中,闽江河口湿地土壤有机碳平均矿化速率高于肖颖等(2015)在辽河口湿地及Weston等(2011)在Delaware River河口湿地的研究结果.这除了受不同河口土壤理化性质差异的影响外,还主要受温度和水位的影响.IPCC公报指出,全球气候的变暖是毋庸置疑的,并且全球平均温度与总CO2排放存在近似线性相关关系(IPCC,2013).为了响应这一变化趋势,本研究模拟的是相对高温环境下(夏季)土壤有机碳矿化特征,而高温可刺激微生物酶活性、提高了微生物分解速率(Sierra et al.,2015),进而为有机碳的分解提供了更多的碳源,加速了湿地土壤有机碳的矿化、分解.此外,高温往往伴随着水位的下降,本研究采样原位土壤含水率约61%,原位含水率添加使得土壤有机碳矿化处于低含水量环境下.Blodau(2002)研究发现,有氧和厌氧条件下土壤碳矿化作用的比例大约介于1.2~6.0,这主要是因为较低的含水量可以提高氧气在土壤中的扩散,促进有机质的有氧分解,刺激土壤微生物的活性和呼吸作用(Blodau et al.,2004),最终增强了土壤有机碳矿化.闽江河口湿地土壤有机碳累积矿化量在不同处理下均表现为随时间逐渐增加,而后增速减缓,这主要是因为初始阶段可利用的碳源较多,为有机碳矿化提供了充足的反应底物,随着碳源的消耗,增速减缓(刘德燕等,2008).
4.2 氮、硫输入处理下湿地土壤有机碳矿化的主要影响因素分析多元回归分析显示,DOC、NH4+-N和SO42-是氮、硫输入处理下影响闽江河口湿地土壤有机碳矿化速率的主要控制因素.短期培养结束后,氮、硫输入促进了湿地土壤DOC含量(表 3),这主要是因为增加的氮会刺激微生物活动且抑制木质素的产生,并可促进土壤中可溶性酚类物质的积累(DeForest et al.,2004),从而增加土壤中DOC的含量.一般认为,土壤DOC含量与有机碳矿化速率具有显著线性相关关系(Sato et al.,1999;刘德燕等,2008),DOC含量在一定程度上决定了CO2的产生与排放,本研究结果也证实了这一点(表 4).这主要是因为土壤DOC是土壤微生物活动的基质(Jagadamma et al.,2014),充足的DOC不仅为有机碳的分解提供了更多的碳源,也为微生物活动提供了充足的可利用底物,从而增强了微生物活性,加速了土壤有机碳的矿化速率.
本研究中,外源氮输入也影响了湿地土壤有机碳矿化速率(图 1).氮输入可通过提高湿地生态系统生产力和有机质含量,增强微生物活性(Bragazza et al.,2006),从而促进湿地碳的转化和CO2的释放.Bragazza等(2006)认为,氮输入有助于通过消除氮在微生物新陈代谢上的限制作用,通过促进微生物酶的活性来提高微生物的分解速率,并降低C/N,进而促进CO2的释放.不同形态氮的影响也是不一样的.本研究中,NH4+-N对湿地土壤有机碳矿化的影响可能是由于:一方面,在NH4+-N添加下,湿地土壤有更高的DOC含量(Currey et al.,2011),这就为有机碳的矿化提供了更多的碳源和能量来源,本研究也证实了这一点(表 3);另一方面,土壤酶在湿地生态系统土壤碳循环过程中扮演着重要角色,其中,土壤水解酶主要通过将复杂的有机质聚合体降解成有机小分子或单体,而后再通过裂解有机化合物中糖苷键、脂键、肽键、酸酐键等显著影响土壤有机质的矿化、分解(Sinsabaugh et al.,2002).已有研究表明,外源氮增强有助于提高水解酶的活性,而土壤水解酶活性的增强既可以通过酶促作用促进土壤有机碳的分解和转化,也可以通过增加土壤中养分元素的溶出(Taylor et al.,2002),为CO2产生提供更多的底物.此外,β-葡萄糖苷酶(βG)是参与碳素生物循环的一种重要水解酶,NH4+-N输入缓和了氮素对微生物活性的限制,增加了微生物对碳源的需求,从而提高了土壤βG的活性,而βG活性的增强可以提升土壤中碳转化能力和降解土壤植物残体的能力(Saiya-Cork et al.,2002),从而促进CO2等含碳气体的排放.
一般而言,滨海河口湿地受盐水入侵的影响,SO42-含量丰富,硫酸盐还原作用强烈.本研究中,硫输入显著促进了湿地土壤有机碳矿化速率(图 1),SO42-含量是影响土壤有机碳矿化的重要驱动因子(表 4).有机碳矿化是湿地土壤碳输出的重要途径,SO42-作为终端电子受体能够影响有机质的矿化和CO2的排放(Chambers et al.,2011).Chambers等(2011)认为,硫酸盐在土壤呼吸中发挥着重要的作用,硫酸盐还原与CO2产生的比率是1∶2.Howarth(1984)研究也发现,硫酸盐还原过程也伴随的CO2的产生,其产生量可占土壤呼吸总量的一半以上.事实上,与其他生态系统不同,滨海河口湿地土壤在通过有机碳矿化过程生成CO2的同时,还可通过土壤中电子受体的还原过程产生CO2,河口湿地电子受体含量丰富,其有机碳分解过程往往伴随着CO2产生(仝川等,2011).此外,硫酸盐是湿地生态系统土壤CH4氧化的重要电子受体,其可使土壤生成的CH4在由土壤向大气的传输过程中被氧化生成CO2(Beal et al.,2009),从而增加CO2的排放量.
5 结论(Conclusions)1) 外源氮、硫输入处理下,NH4Cl、NH4NO3、K2SO4和NH4Cl+K2SO4处理均显著促进了闽江河口湿地土壤有机碳矿化速率(p<0.05),并且不同添加处理下土壤有机碳矿化速率均表现为随培养时间的增加而递减.不同处理在不同培养时间均促进了土壤有机碳矿化速率,但在前6 d各处理的促进作用最明显.湿地土壤有机碳累积矿化量在不同处理下均表现为随培养时间逐渐增加,其增长速率在培养初始阶段较快,而后逐渐减慢.
2) 短期培养结束后,NH4NO3、NH4Cl+ K2SO4处理显著增加了湿地土壤DOC含量(p<0.05);NH4Cl、NH4NO3、NH4Cl+ K2SO4和NH4NO3+ K2SO4处理均显著增加了土壤NH4+-N含量(p<0.05);KNO3、NH4NO3、KNO3+ K2SO4和NH4NO3+ K2SO4处理均显著增加了土壤NO3--N含量(p<0.05);K2SO4、NH4Cl+ K2SO4、KNO3+ K2SO4和NH4NO3+ K2SO4处理均显著增加了土壤SO42-含量(p<0.05).不同处理下湿地土壤Cl-、pH、EC具有微弱的波动变化特征,但在不同处理组间均不存在显著差异(p>0.05).
3) 多元回归分析显示,DOC、NH4+-N和SO42-是氮、硫输入处理下影响闽江河口湿地土壤有机碳矿化速率的主要控制因素.
| [1] | Batson J, Noe G B, Hupp C R, et al. 2015. Soil greenhouse gas emissions and carbon budgeting in a short-hydroperiod floodplain wetland[J]. Journal of Geophysical Research , 120 (1) : 77–95. |
| [2] | Beal E J, House C H, Orphan V J. 2009. Manganese-and iron-dependent marine methane oxidation[J]. Science , 325 (5937) : 184–187. DOI:10.1126/science.1169984 |
| [3] | Berg B. 2000. Litter decomposition and organic matter turnover in northern forest soils[J]. Forest Ecology and Management , 133 (s 1/2) : 13–22. |
| [4] | Blodau C. 2002. Carbon cycling in peatlands: A review of processes and controls[J]. Environmental Reviews , 10 (2) : 111–134. DOI:10.1139/a02-004 |
| [5] | Blodau C, Basiliko N, Moore T R. 2004. Carbon turnover in peatland mesocosms exposed to different water table levels[J]. Biogeochemistry , 67 (3) : 331–351. DOI:10.1023/B:BIOG.0000015788.30164.e2 |
| [6] | Bragazza L, Freeman C, Jones T, et al. 2006. Atmospheric nitrogen deposition promotes carbon loss from peat bogs[J]. PNAS , 103 (51) : 19386–19389. DOI:10.1073/pnas.0606629104 |
| [7] | Bukaveckas P A, Isenberg W N. 2013. Loading,transformation,and retention of nitrogen and phosphorus in the tidal freshwater James River (Virginia)[J]. Estuaries and Coasts , 36 (6) : 1219–1236. DOI:10.1007/s12237-013-9644-x |
| [8] | Chambers L G, Reddy K R, Osborne T Z. 2011. Short-term response of carbon cycling to salinity pulses in a freshwater wetland[J]. Soil Science Society of America Journal , 75 (5) : 2000–2007. DOI:10.2136/sssaj2011.0026 |
| [9] | Cooper J M, Burton D, Daniell T J, et al. 2011. Carbon mineralization kinetics and soil biological characteristics as influenced by manure addition in soil incubated at a range of temperatures[J]. European Journal of Soil Biology , 47 (6) : 392–399. DOI:10.1016/j.ejsobi.2011.07.010 |
| [10] | Craft C, Clough J, Ehman J, et al. 2008. Forecasting the effects of accelerated sea-level rise on tidal marsh ecosystem services[J]. Frontiers in Ecology and the Environment , 7 (2) : 73–78. |
| [11] | Currey P M, Johnson D, Dawson L A, et al. 2011. Five years of simulated atmospheric nitrogen deposition have only subtle effects on the fate of newly synthesized carbon in Callunavulgaris and Eriophorum vaginatum[J]. Soil Biology and Biochemistry , 43 (3) : 495–502. DOI:10.1016/j.soilbio.2010.11.003 |
| [12] | DeForest J L, Zak D R, Pregitzer K S, et al. 2004. Atmospheric nitrate deposition,microbial community composition,and enzyme activity in northern hardwood forests[J]. Soil Science Society of America Journal , 68 (1) : 132–138. DOI:10.2136/sssaj2004.1320 |
| [13] | Franzluebbers A J, Haney R L, Honeycutt C W, et al. 2001. Climatic influences on active fractions of soil organic matter[J]. Soil Biology & Biochemistry , 33 (s 7/8) : 1103–1111. |
| [14] | Gauci V, Dise N B, Howell G, et al. 2008. Suppression of rice methane emission by sulfate deposition in simulated acid rain[J]. Journal of Geophysical Research: Biogeosciences , 113 (3) : 159–169. |
| [15] | 高伟, 郭怀成, 后希康.2014. 中国大陆市域人类活动净氮输入量(NANI)评估[J]. 北京大学学报(自然科学版) , 2014, 50 (5) : 951–959. |
| [16] | Gundale M J, From F, Bach L H, et al. 2014. Anthropogenic nitrogen deposition in boreal forests has a minor impact on the global carbon cycle[J]. Global Change Biology , 20 (1) : 276–286. DOI:10.1111/gcb.2013.20.issue-1 |
| [17] | Howarth R W. 1984. The ecological significance of sulfur in the energy dynamics of salt marsh and coastal marine sediments[J]. Biogeochemistry , 1 : 5–27. DOI:10.1007/BF02181118 |
| [18] | IP CC. 2013. Climate change 2013: The Physical Science Basis[M]. Cambridge,UK,and New York: Cambridge University Press . |
| [19] | Jagadamma S, Mayes M A, Steinweg J M, et al. 2014. Substrate quality alters the microbial mineralization of added substrate and soil organic carbon[J]. Biogeosciences , 11 (17) : 4665–4678. DOI:10.5194/bg-11-4665-2014 |
| [20] | Jorgensen B B. 1982. Mineralisation of organic matter in the sea-bed-the role of sulfate reduction[J]. Nature , 296 : 643–645. DOI:10.1038/296643a0 |
| [21] | Kivimäki S K, Sheppard L J, Leith I D, et al. 2013. Long-term enhanced nitrogen deposition increases ecosystem respiration and carbon loss from a Sphagnum bog in the Scottish Borders[J]. Environmental and Experimental Botany , 90 : 53–61. DOI:10.1016/j.envexpbot.2012.09.003 |
| [22] | 李英臣, 宋长春, 侯翠翠, 等.2011. 氮可利用性对东北不同类型湿地土壤有机碳矿化的影响[J]. 地理科学 , 2011, 31 (12) : 1480–1486. |
| [23] | 刘德燕, 宋长春, 王丽, 等.2008. 外源氮输入对湿地土壤有机碳矿化及可溶性有机碳的影响[J]. 环境科学 , 2008, 29 (12) : 3525–3530. |
| [24] | Liu X, Zhang Y, Han W, et al. 2013. Enhanced nitrogen deposition over China[J]. Nature , 494 (7438) : 459–462. DOI:10.1038/nature11917 |
| [25] | Lunau M, Voss M, Erickson M, et al. 2013. Excess nitrate loads to coastal waters reduces nitrate removal efficiency: mechanism and implications for coastal eutrophication[J]. Environmental Microbiology , 15 (5) : 1492–1504. DOI:10.1111/emi.2013.15.issue-5 |
| [26] | 马力, 杨林章, 慈恩, 等.2009. 长期不同施肥处理对水稻土有机碳分布变异及其矿化动态的影响[J]. 土壤学报 , 2009, 46 (6) : 1050–1058. |
| [27] | Neff J C, Townsend A R, Gleixner G, et al. 2002. Variable effects of nitrogen additions on the stability and turnover of soil carbon[J]. Nature , 419 (6910) : 915–917. DOI:10.1038/nature01136 |
| [28] | Saiya Cork K R, Sinsabaugh R L, Zak D R. 2002. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology and Biochemistry , 34 (9) : 1309–1315. DOI:10.1016/S0038-0717(02)00074-3 |
| [29] | Sato A, Seto M. 1999. Relationship between rate of carbon dioxide evolution,microbial biomass carbon,and amount of dissolved organic carbon as affected by temperature and water content of a forest and an arable soil[J]. Communications in Soil Science & Plant Analysis , 30 (19/20) : 2593–2605. |
| [30] | Scholz M, Harrington R, Carroll P, et al. 2007. The integrated constructed wetlands (ICW) concept[J]. Wetlands , 27 (2) : 337–354. DOI:10.1672/0277-5212(2007)27[337:TICWIC]2.0.CO;2 |
| [31] | Sierra C A, Trumbore S E, Davidson E A, et al. 2015. Sensitivity of decomposition rates of soil organic matter with respect to simultaneous changes in temperature and moisture[J]. Journal of Advances in Modeling Earth Systems , 7 (1) : 335–356. DOI:10.1002/2014MS000358 |
| [32] | Sinsabaugh R L, Carreiro M M, Repert D A. 2002. Allocation of extracellular enzymatic activity in relation to litter composition,N deposition,and mass loss[J]. Biogeochemistry , 60 (1) : 1–24. DOI:10.1023/A:1016541114786 |
| [33] | Stapleton L M, Crout N M J, Säwström C, et al. 2005. Microbial carbon dynamics in nitrogen amended Arctic tundra soil: Measurement and model testing[J]. Soil Biology and Biochemistry , 37 (11) : 2088–2098. DOI:10.1016/j.soilbio.2005.03.016 |
| [34] | Taylor J P, Wilson B, Mills M S, et al. 2002. Comparison of microbial numbers and enzymatic activities in surface soils and subsoils using various techniques[J]. Soil Biology and Biochemistry , 34 (3) : 387–401. DOI:10.1016/S0038-0717(01)00199-7 |
| [35] | 仝川, 鄂焱, 廖稷, 等.2011. 闽江河口潮汐沼泽湿地 CO2 排放通量特征[J]. 环境科学学报 , 2011, 31 (12) : 2830–2840. |
| [36] | Vitousek P M. 1994. Beyond global warming: ecology and global change[J]. Ecology , 75 (7) : 1861–1876. DOI:10.2307/1941591 |
| [37] | Wade A J, Neal C, Whitehead P G, et al. 2005. Modelling nitrogen fluxes from the land to the coastal zone in European systems: a perspective from the INCA project[J]. Journal of Hydrology , 304 (1) : 413–429. |
| [38] | Weston N B, Vile M A, Neubauer S C, et al. 2011. Accelerated microbial organic matter mineralization following salt-water intrusion into tidal freshwater marsh soils[J]. Biogeochemistry , 102 (1/3) : 135–151. |
| [39] | Wigand C, Brennan P, Stolt M, et al. 2009. Soil respiration rates in coastal marshes subject to increasing watershed nitrogen loads in southern New England,USA[J]. Wetlands , 29 (3) : 952–963. DOI:10.1672/08-147.1 |
| [40] | 肖胜生, 胡建民, 贺月玲, 等.2014. 森林土壤呼吸对氮硫沉降的响应及机制[J]. 生态学杂志 , 2014, 33 (2) : 495–501. |
| [41] | 肖颖, 杨继松.2015. 辽河口滨海湿地土壤有机碳矿化及其与盐分的关系[J]. 生态学杂志 , 2015, 34 (10) : 2792–2798. |
| [42] | 郑彩红, 曾从盛, 陈志强, 等.2006. 闽江河口区湿地景观格局演变研究[J]. 湿地科学 , 2006, 4 (1) : 29–35. |
 2016, Vol. 36
2016, Vol. 36


