近年来, 挥发性有机物(VOCs)的大量排放与累积引发一系列大气环境问题, 严重影响了人类生存环境、制约了经济发展(Wang et al., 2007).生物过滤技术与传统大气污染技术相比, 具有经济、高效、无二次污染等特点, 是近年VOCs治理主流技术之一, 在实际处理低浓度大流量有机废气工程中取得了较好效果(Li et al., 2015).生物滴滤是生物过滤的改良工艺, 采用液体循环通过不含生物质的惰性填料层, 使得单位体积填料的生物量高, 操作弹性更强, 是目前处理工业源VOCs废气应用最多的技术(陈桐生等, 2014).现在对生物滴滤塔技术相关研究多数集中在参数的优化, 降解效能测试等, 而对生物滴滤塔的微生物生态学及生物膜结构特征等方面的研究还不够系统(王小军等, 2014).
微生物是生物滴滤塔技术的核心, 结构性能良好的生物膜是生物滴滤法有效净化废气的关键.生物滴滤塔中微生物的种群结构以及生物膜结构特征对于VOCs气体的处理效率以及装置的稳定运行至关重要(Rappert et al., 2005).分子生物学的兴起与发展为从分子水平研究微生物生态学提供了更高效的手段.基于PCR技术发展起来的聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)技术已经在生物治理系统中微生物多样性和种群动态变化等研究中广泛使用(Tresse et al., 2002;魏在山等, 2012).论文分析了生物滴滤塔运行过程中生物量累积和空间分布规律, 并运用PCR-DGGE技术研究去除乙苯废气的生物滴滤塔反应体系稳定运行中细菌的16S rRNA基因信息和多样性, 探讨生物滴滤塔不同床层结构的生物膜相组成及微生物多样性, 尝试阐明生物滴滤塔性能与微生物种群多样性的相互关系, 为进一步深入研究、优化设计和合理运行生物滴滤反应体系和维持生物膜相稳定性提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验装置及流程实验的主要装置为Ø120 mm×1050 mm的生物滴滤塔, 用陶粒做填料, 陶粒直径6~8 mm, 堆积密度155 kg·m-3, 空隙率90.8%.生物滴滤塔内填料分为2个单元, 单元之间用多孔板分隔, 以保证气流均匀分布.每层高为300 mm.
实验流程如图 1所示, 由压缩机将空气吹入装有乙苯液体的储瓶, 与乙苯气体混合后得到模拟废气.乙苯废气采用动态法配制, 并从塔底进入生物滴滤塔, 在上升的过程中与湿润生物膜接触被微生物降解, 净化后的气体从塔顶排出.循环液体采用逆流操作从塔顶向下喷淋, 在填料层中自上向下流动, 由塔底排出至循环液储槽, 再由循环水泵抽回塔顶.定期向循环液储槽投加氮磷营养液, 维持微生物的生长繁殖活动.实验所用活性污泥取自广州某苯系物化工污水处理厂曝气池, 经乙苯递进式诱导筛选驯化后加进循环液槽中进行挂膜培养.
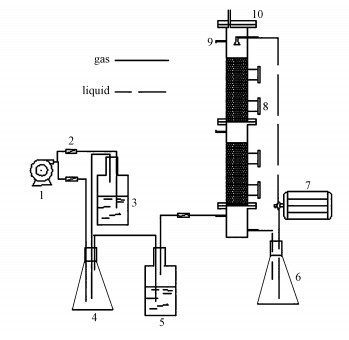 |
| 图 1 生物滴滤塔工艺流程 Fig. 1 Schematic diagram of biotrickling filter (BTF) ((1) air pump; (2) glass rotameter; (3) ethylbenzene; (4) gas mixed bottle; (5) glass humidifier; (6)nutrient solution; (7) suction pump (time controller); (8)biofim sampling ports; (9) gas sampling ports.(10) air outlet port) |
乙苯浓度用气相色谱仪GC9890A测定.分析条件:进样量:1 μL;汽化室温度:120 ℃;检测器温度:250 ℃;柱温:80 ℃;载气:N2;载气流速:30 mL·min-1;分流比:10:1;检测器:氢火焰离子化检测器(FID);色谱柱:毛细管柱, 30 m×0.53 mm×3.0 μm.
2.2.2 生物膜特征和床层压降生物膜的形态结构特征观察采用普通显微镜和扫描电镜观察(倪红等, 2011);生物膜厚度采用显微测定法(刘雨等, 2000);生物膜干重采用标准MLVSS测定, 用生物膜干重代表生物量, 以生物膜干重与洗脱后陶粒干重比值(mg·g-1)来衡量生物量变化(胡俊等, 2012);床层压降采用U型管压差计测定.
2.2.3 塔内生物PCR-DGGE分析生物滴滤塔稳定运行至第90 d, 从塔内各层取出陶粒, 漩涡震荡10 min, 用0.22 μm滤膜过滤, 根据E.Z.N.A.TM Water DNA Kit试剂盒的要求, 取出滤膜, 按照试剂盒说明书的操作步骤进行DNA的提取纯化.
以提取到的DNA作为PCR模板, 所用引物为细菌16S rDNA V3高变区518r和357f-GC(Muyzer et al., 1993), 反应程序为:94 ℃ 5 min预变性;20 cycles (94 ℃ 40 s;65 ℃ 30 s;72 ℃ 30 s); 15 cycles (94 ℃ 40 s;55℃ 30 s;72℃ 30 s); 72 ℃延伸10 min.然后采用琼脂糖凝胶电泳30%~60%变性梯度凝胶电泳技术对扩增结果检测和条带分析.在80 V电压下, 60 ℃恒温, 1 × TAE中电泳12.5 h.电泳完毕后, 用超纯水冲洗胶, 然后将胶放进EB染液中, 染色20 min后, 凝胶成像系统拍摄图谱.最后将DGGE电泳条带的切胶回收、V3区引物518r和357f再扩增并用采用琼脂糖凝胶电泳技术检测, 同时将扩增产物送到北京华大测序公司进行克隆和测序.
2.2.4 DGGE图谱多样性分析使用quantity one软件, 对DGGE图谱的条带进行自动检测和分析, 评价样品生物多样性及物种丰度, 以及不同床层间的生物菌群相似度.将每一条割胶克隆、测序得到的未知序列提交到序列比对搜索工具BLAST上, 搜索在NCBI(美国国家生物技术信息中心)中与之同源性较高的已知序列.基于16S rDNA基因序列的系统发育树通过MEGA5.1软件生成(Tamura et al., 2007).
3 结果与讨论(Results and discussion) 3.1 生物滴滤塔运行性能以乙苯为微生物生长的唯一碳源, 控制停留时间EBRT=90 s, 进气乙苯浓度为200~400 mg·m-3, 循环液pH值为6.5~7.0, 喷淋量为4.5 L·h-1, 气体流量为0.27 m3·h-1的条件下, 对BTF系统进行挂膜.挂膜阶段的乙苯进气浓度和去除率如图 2所示.
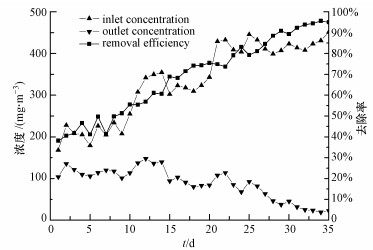 |
| 图 2 反应器挂膜阶段乙苯进出口浓度和去除率 Fig. 2 Influent concentration and removal rate of ethyl benzene during Startup phase |
从图 2可见, 挂膜启动初期, 微生物尚未在陶粒上形成生物膜, 生物滴滤塔对乙苯的去除效率为40%左右, 此时乙苯的去除率主要取决于乙苯与填料的吸附及在循环液中的部分溶解, 乙苯去除率有一定的波动且降解率比较低(刘佳等, 2014);从第8 d开始, 乙苯的去除率逐渐升高, 到第24 d降解效率达到80%左右, 同时可逐步观察到陶粒表面形成生物膜;乙苯的去除率达到90%以上且去除率趋于稳定, 表明反应运行29 d后挂膜启动成功, 填料塔内形成较厚的生物膜.随后对BTF系统进行反应负荷为400~600 mg·m-3的长期运行, 乙苯的降解率维持在90%以上.
BTF的长期运行情况如图 3a所示.在长达95 d的运行时间内, 生物滴滤塔表现出良好的稳定性以及对乙苯的高效去除率.BTF系统反应器挂膜完成后, 考察BTF系统在乙苯进口浓度在400~600 mg·m-3、EBRT分别为67.8、45、33.5 s的条件下的运行情况.当进口浓度为400 mg·m-3左右、EBRT为67.8 s时, 乙苯的降解效率稳定在95%左右;当突然提高浓度至600 mg·m-3左右时, 降解效率降到86%, 8 d后恢复到94.5%;从第55 d开始将EBRT缩短至45 s, 乙苯浓度不变, BTF对乙苯的去除率出现波动, 12 d后去除率恢复到94%左右, 在第74 d去除率达到97%;进一步缩短EBRT至33.5 s, 乙苯去除率突降至75.1%, 但其去除负荷达到50.5 g·m-3·h-1, 经过21 d适应调整, 乙苯降解率逐渐提高到91.6%以上.
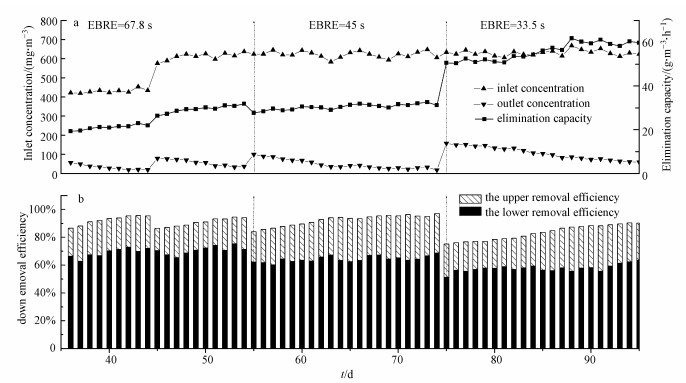 |
| 图 3 不同EBRT条件下去除负荷及各层去除率变化情况 Fig. 3 The change of the load and the removal rate of each layer in different EBRT conditions |
由图 3b可见, 在整个BTF系统长期运行过程中, 乙苯主要在下层填料中被去除, 上层填料对总去除率的贡献较小, 可能由于乙苯废气浓度经下层去除后浓度较低, 无法满足填料上层中微生物的大量生长繁殖, 进而限制了上层的生物利用率.生物量测定结果表明, 反应器内生物量逐渐增加, 下层填料上的生物量多于上层.但随着EBRT逐渐减小, 进气有机负荷的增加, 上层填料对乙苯的降解率逐渐增加, 在第71 d、第90 d降解率超过31%.随着BTF的持续运行, 第93 d开始, 下层填料去除率逐步回升.在进口浓度不变的条件下, 进气负荷取决于EBRT, 各层填料对乙苯去除率随进气负荷的波动而波动, 但去除率整体呈现出下多上少的局面.
3.2 BTF系统生物量与压降变化在反应器运行期间选取了反应器中填料高度在0.25、0.35、0.65、0.75 m处的4段比较有代表性的区域填料进行了生物量分析.结果见图 4.
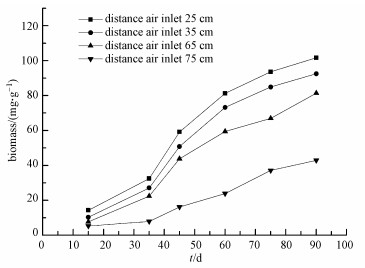 |
| 图 4 BTF长期运行各层生物量变化 Fig. 4 Development of biomass across BTF with time |
由图 4可见, 反应器在稳定运行期间, 滴滤塔生物量整体呈现逐渐增加趋势, 到80 d后生物量逐渐趋于稳定.且反应器内的生物量呈现不均匀分布, 随着从下到上的气流方向逐步递减.这主要是由于乙苯废气沿反应器径向流动而被生物吸附降解, 其在进气端则有充足的碳源提供, 生物量累积较快, 出气端的浓度非常低, 因而靠近出气端的微生物没有足够的碳源提供而生物量累积比较慢.在反应器运行到60 d时, 距进气口25 cm处填料上生物量累计超过80 mg·g-1, 而距离进气口75 cm处填料上仅为23.9 mg·g-1.因此从生物滴滤塔结构看, 填料层沿反应器径向从下到上的生物量呈现出明显的逐层降低.从反应器运行时间看, 在反应器运行的前期, 生物量累计速度较快, 随着时间延长, 生物量累计速度由高到低逐步下降.但是距离进气口65 cm和75 cm处, 生物量的累积速度随时间稍有增加, 这是因为反应器运行稳定期(35~75 d), 生物滴滤塔总进气负荷逐渐增大、废气停留时间减小, 受气液传质效率的限制, 底部生物量增长降解效率基本稳定, 而BTF上部承载废气负荷增加, 生物量累积逐渐增加.
从图 5可见, 随着反应器的稳定运行, BTF内生物量和进气量的增加, 导致BTF塔内压降逐渐增加;另外, 当降低塔内的EBRT时, 会导致反应器压降急剧增大, 但在稳定运行过程中不会出现压降急剧升高或降低的情况.当反应器运行到85 d后, 塔内压力趋于稳定;95 d时压降达10.1 mm H2O柱.填料床生物量累积和生物膜厚度呈逐渐增加趋势, 生物量呈非均匀性分布, 床层孔隙率逐渐减小, 而床层压降则逐渐增加.运行后期, 生物量的过量累积、非均匀性分布是导致反应体系压降上升的主要宏观因素.BTF整个过程运行较为稳定, 运行性能较好, 未出现BTF堵塞现象.
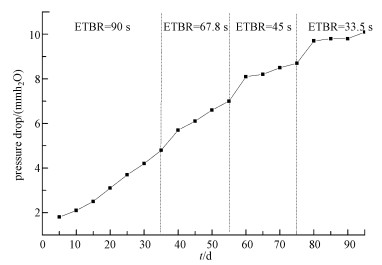 |
| 图 5 BTF长期运行过程压降变化 Fig. 5 Pressure drop comparison of the BTF |
通过定期对BTF不同床层生物膜微生物进行生物相观察及分离检测, 在反应器稳定运行期间共检出包括细菌类、真菌类、原生动物、后生动物等4大群类, 其中原生动物和后生动物主要有12种, 见表 1.
| 表 1 BTF生物膜的形态及不同塔层的生物相观察特征 Table 1 Characteristics of biofilm morphous and microorganism population at different area in BTF |
表 1反映了BTF微生物种群特征, 从进气端至BTF中段, 菌胶团中细菌为生物膜主体, 且生物膜厚度比较厚, 菌膜致密;随着取样高度远离进气口, 菌胶团中原生动物和后生动物逐渐增加, 菌膜厚度降低.由于反应器内自下而上废气进气浓度梯度下降, 且塔内生存空间和溶解氧等限制因子的作用, 致使不同类型的微生物在填料空间占据不同的空间生态位, 在不同塔层逐渐形成优势类群, 并引发食物链高端营养级微生物种群的波动和优势种群的更迭演替.
BTF生物膜菌群包括可以直接降解污染物的异养细菌、真菌, 也有捕食细菌和吞噬有机颗粒的原生动物、后生动物, 其中大量高端营养级水平微生物种群的形成, 在生物膜中所占比例较高;有助于BTF系统整体物质转化, 使系统内的种间关系更加复杂, 食物链长且相互交叉, 这种复杂的营养结构大大提高了BTF生态系统的稳定性, 为取得稳定的废气处理效果提供了可靠的保证.
3.4 BTF生物膜超微结构的扫描电镜观察在生物滴滤塔运行稳定时期, 从不同采样口中取出陶粒, 并经过2.5%戊二醛溶液固定、磷酸缓冲液清洗pH=8、梯度酒精脱水、叔丁醇置换和冷冻干燥等处理, 用扫描电镜观察陶粒表面微生物的分布及其形态, 结果如图 6所示.
 |
| 图 6 塔内生物扫描电镜图片 Fig. 6 SEM image in BTF |
从图 6可以清晰看出, 在生物塔的陶粒表面及空隙中存在大量的球状、杆状及少量短棒状微生物, 尤其以杆状和短杆状菌菌体为主.这些微生物经过生物滴滤塔的长期驯化, 逐渐形成优势菌群, 交叉或浸渍到陶粒表面和空隙中, 形成了致密的生物膜.生物膜成分复杂, 膜面粗糙程度大, 伸展起伏显著, 在生物滴滤塔生物膜反应器中降解乙苯起到关键作用.
3.5 BTF塔内生物多样性分析 3.5.1 微生物群落的DGGE分析取床层不同高度处的样品, 进行生物样品得变性梯度凝胶电泳(DGGE), 得到DGGE图谱图 7a及条带相似性示意图 7b.泳道上条带的灰度值越高, 则该条带对应的种属的丰度越大.结合图 7a中和图 7b相似性分析可以看出, 在BTF稳定运行期, 不同高度床层部分条带发生变化, 说明在不同床层微生物群落存在差异, 但整体相对来说相似性较高, BTF系统已经形成了稳定降解乙苯废气的特征性生态体系.各组相似度最低达到65.1%, 其中泳道1和3相似度达到82.4%, 泳道4、泳道2相似度比较高.这是由于BTF填料层分为上下两层的特殊构造引起的.即使在同一座反应塔内, 每层填料层底部和上部对乙苯废气的累积量和循环液的持有度不同, 造成局部不同微生态环境, 呈现出不同的生物多样性, 但由微生物菌群来源相同且挂膜繁衍条件相似, 因此各层高度微生物多样性表现出相对高的相似度.
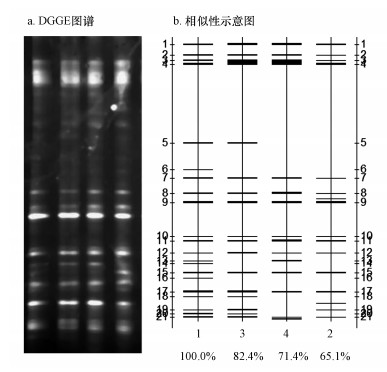 |
| 图 7 不同床层总细菌DGGE图谱以及各样品泳道相似性示意图(图a中1~4代表 25、35、65、75 cm采样点样品泳道, 图b中1~21代表泳道中的条带位置) Fig. 7 DGGE profile of bacteria in different bed and similarity diagram of sample lanes(Figure a, 1~4 representative samples in the height of 25, 35, 65, 75 cm, and numbers 1~21 in Figure b represent a stripe of the microorganism lane) |
在图 7b中, 一些条带如7、8、9、10、12、15和17在所有的床层高度都存在说明这些条带对应的菌属随着系统稳定运行, 演化为BTF系统内占主导地位的菌种;优势菌属的在不同床层的灰度值不同, 表明其在不同床层的丰度存在差异.条带5、18和条带19仅在泳道1和泳道2中出现, 表明其代表的菌属存在于BTF底层.这可能是由于这些条带所对应的菌属在从污泥接种到驯化过程中对生态环境要求比较高, 只存在于特定的生态环境中;除此之外, 一些条带只在某床层才出现, 如条带6、16.这从另一个角度反映了BTF反应器内不同床层存在生物多样性的差异.
图 8为生物滴滤塔各层DGGE泳道的密度曲线比较图.曲线与坐标轴围城的面积与生物量的多少成正比(Tang et al., 2014), 由图中曲线峰形变化可知, 各泳道曲线的峰面积存在差异, 说明其对应的菌群数量有所不同, 且泳道4所代表曲线围成面积最小, 即生物量最少, 这与图 4中生物量测定结果相符.但各个泳道峰形和峰的出现位置基本不变, 大部分条带密度也比较相似, 表明稳定运行期间生物滴滤塔内菌群数量具有相对较高的稳定性.
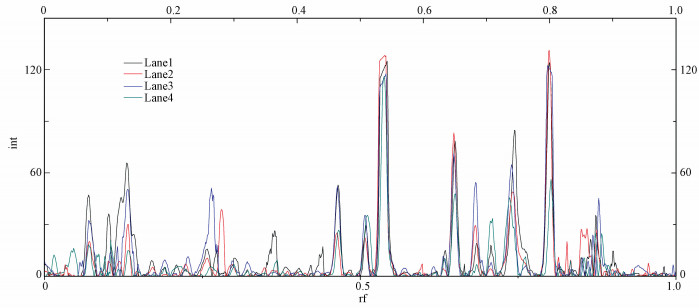 |
| 图 8 DGGE泳道的密度曲线比较 Fig. 8 Density comparison of DGGE lane |
将图谱7a中主要的DGGE条带, 包括条带1、7、8、9、10、11、12、14、18共9个样品, 进行切割回收、克隆测序分析.最终获得9条总细菌的16S rDNA序列.将每一条测序序列在BLAST上, 与NCBI中与之同源性较高的已知序列进行相似性分析.通过MEGA5.1软件生成基于16S rDNA基因序列的系统发育树, 如图 9所示.
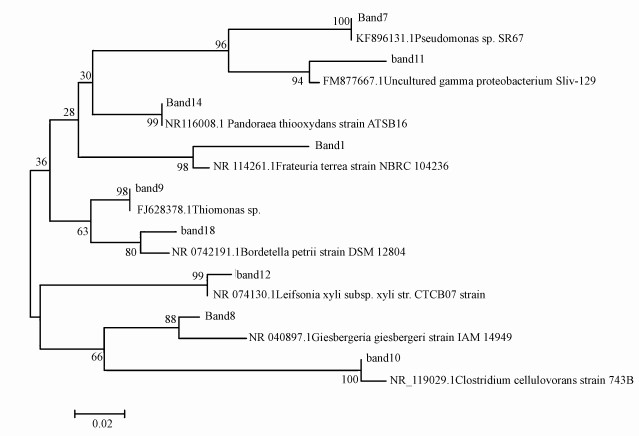 |
| 图 9 基于分离自DGGE谱图中的16SrDNA基因序列的系统发育树 Fig. 9 Phylogenetic tree based on 16 S rDNA gene sequences derived from DGGE patterns |
从图 9基因序列的系统发育树可以看出, 系统中优势菌主要为变形杆菌门(Proteobacteria)、坚壁菌门(Firmicutes)、放线菌门(Actinobacteria)3大菌群.其中主要优势菌群是变形杆菌门, 包括3种γ-变形杆菌(Gammaproteobacteria)和4种β-变形杆菌(Betaproteobacteria).以上优势菌群形态多为杆状和棒状, 与SEM观察所得结果相符.
条带7、11、1所对应的菌属, 均与伽马变形杆菌具有较高的同源性.且在BTF稳定运行阶段塔层的不同高度均被普遍检测到.伽马变形杆菌具有很强的降解外源有机物的能力, 曾被报道对氯酸、二氯苯氧基乙酸、多环芳烃等有很好的降解能力(Rani et al., 2008).条带1对应Frateuria菌是Xanthomonadaceae属, Jayamani等证实了Xanthomonadaceae具有很强的乙苯降解效果(Jayamani et al., 2015), 条带7对应Pseudomonas是降解苯系物的菌株(Chen et al., 2015);条带8、9、14、18所对应的序列被检测出来与贝塔变形杆菌纲伯克氏菌科(Burkholderiales)大类中的Giesbergeria sp、Thiomonas sp、Pandoraea sp、Bordetella sp具有较高的同源性, 且Perez-pantoja等研究发现伯克氏菌(Burkholderiales)属对芳香族化合物具有高效降解效果(Pérez-Pantoja et al., 2012), 在这些菌属中Pandoraea sp被报道是降解对二甲苯的特征菌株(Wang et al., 2015).条带10与梭菌属微生物的碱基序列相似度达到100%, 属于放线菌门.同时, 在BTF系统中也检测到了条带12对应的坚壁菌门的Leifsonia sp菌株.从优势菌属的分子测序可以发现, BTF系统中优势菌群处于多个菌属, 增强了BTF微环境的生物多样性.Poulsen等报道一些难降解污染物的好氧生物降解过程包含了多种微生物种群的相互作用(Poulsen et al., 2008).Wanger指出贝塔变形杆菌是活性污泥中最丰富的菌种(Wagner et al., 2002), Snaidr发现贝塔变形杆菌是城市污水处理厂曝气池内的主要菌种(Snaidr et al., 1997), 这与实验采用曝气池活性污泥挂膜相符.因此, 本实验采用的乙苯废气降解生物滴滤塔在自然环境中菌群的挂膜驯化过程中逐步形成了降解乙苯废气特征生物膜, 生物膜含有特定的多种菌群和复杂的生物膜结构.这种复杂的BTF生物膜的形成为乙苯废气的彻底降解和矿化提供了适宜的条件.
4 结论(Conclusions)1) 经驯化培养的生物滴滤塔能高效处理低浓度大风量乙苯废气, 在EBRT=33.5 s时, 降解效率保持在90%以上, 最大去除负荷为62.4 g·m-3·h-1.
2) 生物滴滤塔稳定运行期间生物膜形态、颜色和厚度呈现不均匀分布的特点.生物膜在空间上呈不均匀分布, 生物膜致密度, 表面粗糙和颜色均有改变.
3) 生物量的累积、非均匀性分布是导致反应体系压降上升的主要宏观因素.BTF塔内压在稳定运行期间逐渐增加, 未出现BTF堵塞现象.
4) BTF中的微生物种群组成丰富, 营养结构复杂; 不同代谢类型的微生物在BTF不同部位渐次形成优势群落.陶粒表面覆盖着大量的微生物, 形态多数为杆状, 并伴有少量的球状和短棒状.通过生物膜分子生物学检测发现乙苯废气降解BTF塔内存在优势菌主要为变形杆门菌(Proteobacteria)、坚壁菌门(Firmicutes)、放线菌门(Actinobacteria)3大菌群.其中主要优势菌群是变形杆菌门.
| [${referVo.labelOrder}] | Chen D Z, Ding Y F, Zhou Y Y, et al. 2014. Biodegradation Kinetics of Tetrahydrofuran, Benzene, Toluene, and Ethylbenzene as Multi-substrate by Pseudomonas oleovorans DT4[J]. International Journal of Environmental Research and Public Health , 12 (1) : 371–384. DOI:10.3390/ijerph120100371 |
| [${referVo.labelOrder}] | 陈桐生, 刘伟民, 黄报远.2014. 除臭生物滤池稳定运行期的微生物生态DNA指纹研究[J]. 生态科学 , 2014, 33 (4) : 735–740. |
| [${referVo.labelOrder}] | 胡俊, 郑江玲, 吴越新, 等.2012. 生物滴滤塔降解甲苯废气长期运行生物膜相特性研究[J]. 环境科学 , 2012, 33 (9) : 2979–2986. |
| [${referVo.labelOrder}] | Jayamani I, Cupples A M. 2015. Stable Isotope Probing and High-Throughput Sequencing Implicate Xanthomonadaceae and Rhodocyclaceae in Ethylbenzene Degradation[J]. Environmental Engineering Science , 32 (3) : 240–249. DOI:10.1089/ees.2014.0456 |
| [${referVo.labelOrder}] | Li G, Liang Z, An T, et al. 2015. Efficient bio-deodorization of thioanisole by a novel bacterium Brevibacillus borstelensis GIGAN1 immobilized onto different parking materials in twin biotrickling filter[J]. Bioresource Technology , 182 : 82–88. DOI:10.1016/j.biortech.2015.01.120 |
| [${referVo.labelOrder}] | 刘佳, 杨竹慧, 李坚.2014. 生物表面活性剂在疏水性VOCs生物降解中的应用潜力[J]. 中国科技论文 , 2014, 9 (3) : 355–359. |
| [${referVo.labelOrder}] | 刘雨, 赵庆良, 郑兴灿. 2000. 生物膜法污水处理技术. 北京:中国建筑工业出社[M]. : 60 -67. |
| [${referVo.labelOrder}] | Muyzer G, De Waal E C, Uitterlinden A G. 1993. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology , 59 (3) : 695–700. |
| [${referVo.labelOrder}] | 倪红, 熊哲, 张珊, 等.2011. 多孔陶粒固定化微生物效果及扫描电镜观察[J]. 湖北大学学报 , 2011, 33 (2) : 183–186. |
| [${referVo.labelOrder}] | Pérez Pantoja D, Donoso R, Agulló L, et al. 2012. Genomic analysis of the potential for aromatic compounds biodegradation in Burkholderiales[J]. Environmental Microbiology , 14 (5) : 1091–1117. DOI:10.1111/emi.2012.14.issue-5 |
| [${referVo.labelOrder}] | Poulsen P H B, Møller J, Magid J. 2008. Determination of a relationship between chitinase activity and microbial diversity in chitin amended compost[J]. Bioresource Technology , 99 (10) : 4355–4359. DOI:10.1016/j.biortech.2007.08.042 |
| [${referVo.labelOrder}] | Rani A, Porwal S, Sharma R, et al. 2008. Assessment of microbial diversity in effluent treatment plants by culture dependent and culture independent approaches[J]. Bioresource Technology , 99 (15) : 7098–7107. DOI:10.1016/j.biortech.2008.01.003 |
| [${referVo.labelOrder}] | Rappert S, Muller R. 2005. Microbial degradation of selected odorous substances[J]. Waste Management , 25 (9) : 940–954. DOI:10.1016/j.wasman.2005.07.015 |
| [${referVo.labelOrder}] | Snaidr J, Amann R, Huber I, et al. 1997. Phylogenetic analysis and in situ identification of bacteria in activated sludge[J]. Applied and Environmental Microbiology , 63 (7) : 2884–2896. |
| [${referVo.labelOrder}] | Tamura K, Dudley J, Nei M, et al. 2007. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution , 24 (8) : 1596–1599. DOI:10.1093/molbev/msm092 |
| [${referVo.labelOrder}] | Tang B, Zhang Z, Chen X, et al. 2014. Biodiversity and succession of microbial community in a multi-habitat membrane bioreactor[J]. Bioresource Technology , 164 : 354–361. DOI:10.1016/j.biortech.2014.05.007 |
| [${referVo.labelOrder}] | Tresse O, Lorrain M J, Rho D. 2002. Population dynamics of free-floating and attached bacteria in a styrene-degrading biotrickling filter analyzed by denaturing gradient gel electrophoresis[J]. Appllied Microbiology and Biotechnology , 59 (4/5) : 585–590. |
| [${referVo.labelOrder}] | Wagner M, Loy A. 2002. Bacterial community composition and function in sewage treatment systems[J]. Current Opinion in Biotechnology , 13 (3) : 218–227. DOI:10.1016/S0958-1669(02)00315-4 |
| [${referVo.labelOrder}] | Wang S, Ang H M, Tade M O. 2007. Volatile organic compounds in indoor environment and photocatalytic oxidation: state of the art[J]. Environment International , 33 (5) : 694–705. DOI:10.1016/j.envint.2007.02.011 |
| [${referVo.labelOrder}] | Wang X, Wang Q, Li S, et al. 2015. Degradation pathway and kinetic analysis for p-xylene removal by a novel Pandoraea sp. strain WL1 and its application in a biotrickling filter[J]. Journal of Hazardous Materials , 288 : 17–24. DOI:10.1016/j.jhazmat.2015.02.019 |
| [${referVo.labelOrder}] | 王小军, 徐校良, 李兵.2014. 生物法净化处理工业废气的研究进展[J]. 化工进展 , 2014, 33 (1) : 213–217. |
| [${referVo.labelOrder}] | 魏在山, 刘小红, 孙建良, 等.2012. PCR-DGGE技术用于处理苯乙烯废气的生物滴滤塔中微生物优势菌种解析[J]. 环境工程学报 , 2012, 6 (2) : 571–576. |
 2016, Vol. 36
2016, Vol. 36


