2. 华中师范大学环境生物医学实验室, 武汉 430079
2. Laboratory of Environment Biomedicine, Central China Normal University, Wuhan 430079
邻苯二甲酸二异壬酯(Diisononylphthalate,DINP)是邻苯二甲酸酯(PAEs)类化合物的一种.近年来由于其分子量高和碳链骨架长、抗迁移和抗萃取性能佳、生殖和发育毒性低,在全球范围内产量和消耗量均持续增长,因而已逐渐取代传统增塑剂邻苯二甲酸二(2-乙基己)酯(DEHP)和邻苯二甲酸二丁酯(Dibutyl Phthalate,DBP)成为“绿色”新型塑化剂的典型代表.据美国化学会(American Chemistry Council)统计,2008年全球每年DINP产量为130万t,而2013年产量已达150万t,且产量还在以2.5%的增长率逐年增加(陆杰等,2015).DINP脂溶性强,与塑料基质之间以非共价键形式结合,可通过淋洗、迁移、蒸发等多种方式释放到环境中,由于其降解性差、吸附性好,可积累存在于水体、土壤、空气、灰尘、沉积物等多种介质中,很易被人体吸收.Hershberger实验研究指出,当DINP剂量>20 mg·kg-1·d-1时,经口服灌胃10 d后会对阉割雄性大鼠的肝、肾、精囊等造成影响(Lee et al.,2007).欧盟风险评估报告(European Union Risk Assessment Report)和欧洲化学品管理局报告(European Chemicals Agency Report)则指出,DINP口服暴露剂量达到200 mg·kg-1·d-1,会使小鼠的内脏器官受到较为严重的损伤(Ma et al.,2015).
DINP的职业暴露主要是通过吸入和皮肤接触途径,而普通人群(特别是使用塑料玩具的儿童)暴露则主要是通过饮食和皮肤接触途径(Kavlocka et al.,2002),因此,经皮吸收无疑是DINP进入机体的重要途径.皮肤作为人体的最大器官,承担了机体与环境交互影响的重要功能(如调节体温、调节水分平衡等),其对毒物的反应对于机体生存至关重要.已有统计显示,约1/4的商用化学物质可被皮肤吸收,环境因子导致的疾病和损伤大都与皮肤暴露相关联,因而DINP皮肤暴露是一条应该引起我们重视的暴露途径,其毒理学影响绝不可轻视(陈晓燕等,2005).研究显示,DINP同系物DBP可通过皮肤吸收进入小鼠的肝、肾等组织,证明PAEs类物质可能通过皮肤接触途径对机体造成影响(Zeng et al.,2013).已有数据表明,DINP皮肤暴露对健康会造成影响(Koch et al.,2012),但相关毒理学研究为数不多.针对DINP对人体的潜在危害研究目前已经开展,但毒性机制尚未充分阐明(Koch et al.,2003;Matsumoto et al.,2008;Boberg et al.,2011).马萍等研究显示,DINP经口途径暴露可以直接造成小鼠肝、肾、脑组织的显著病理学改变及DNA损伤,可致小鼠出现显著的认知障碍和情绪焦虑状况,这些作用是由氧化应激介导的,证明氧化应激可能是DINP诱导毒性作用的关键机制(Ma et al.,2014;2015).
因而本研究以肝、肾为研究对象,选择剂量分别为0.02、0.2、2、20、200 mg·kg-1的DINP对小鼠进行皮肤暴露染毒,检测肝脏、肾脏组织细胞中活性氧(ROS)、谷胱甘肽(GSH)、丙二醛(MDA)的含量及DNA-蛋白质交联(DPC)系数的变化情况,研究DINP皮肤暴露途径对机体氧化应激水平的影响,以期为全面系统了解DINP的毒性效应提供有效的参考依据.
2 材料与方法(Materials and methods) 2.1 实验动物5周龄SPF级雄性Balb/c小鼠,由湖北省实验动物研究中心提供(动物合格证号:SCXK(鄂)2008-0005;动物质量合格证:42000600001251).
2.2 主要仪器与试剂仪器:低温冷冻离心机(5415R,德国Eppendorf公司),酶标分析仪(DNM-9602,北京普朗新技术有限公司),三用电热恒温水箱(HH-42,北京长源实验仪器厂),涡旋混合器(MS1 Minishaker,德国IKA公司).
试剂:邻苯二甲酸二异壬酯(DINP,≥99.6%,Sigma公司),二氯二氢荧光素-乙酰乙酸酯(DCFH-DA,>99.9%,Sigma公司),蛋白酶K(Sigma公司),Hoechst33258荧光染料(Sigma公司),硫代巴比妥酸(TBA,分析纯,国药集团化学试剂有限公司),5,5′-二硫代二硝基苯甲酸(DTNB,分析纯,国药集团化学试剂有限公司),Folin-酚试剂盒(北京鼎国昌盛生物技术有限责任公司),其他化学试剂均为国产分析纯.
2.3 实验方法雄性Balb/c小鼠42只,体重22~25 g,随机分成5个染毒组(0.02、0.2、2、20、200 mg·kg-1)和1个溶剂对照组,每组7只.剪掉小鼠背部正中央的毛,裸露出约2 cm2的皮肤.用生理盐水配制成相应浓度的DINP染毒溶液,每天将20μL溶液均匀涂抹于每只小鼠背部(溶剂对照组以等体积的生理盐水进行涂抹),连续暴露28 d,同时观察记录小鼠每周皮肤的变化情况.
2.4 小鼠体重与肝、肾脏器系数的测定染毒结束后记录小鼠体重,颈椎脱臼法处死小鼠,立即取小鼠肝脏和肾脏,分别记录肝、肾质量,并计算脏器系数(脏器质量与动物体重之比).
2.5 肝、肾组织匀浆和悬液的制备将称重后的肝、肾组织用冰冷磷酸缓冲液(PBS)漂洗,滤纸拭干,分成两部分.一部分肝组织加入PBS制成10%匀浆液,于4℃、10000 g下离心15 min,取上清液保存,用于ROS、GSH、MDA含量的检测;另一部分组织剪成约1 mm3的糜状组织块,4层擦镜纸过滤,将滤液在200 g下离心5 min后弃上清,用冰冷PBS重悬细胞制备细胞悬液,用于DPC系数的检测.
2.6 ROS含量的测定取组织匀浆后的上清液4μL,加入396μL PBS作100倍稀释.取100μL稀释液加入酶标板,并加入100μL荧光染料DCFA染色,37℃避光孵育5 min,用荧光酶标仪检测485 nm激发光、528 nm发射光的荧光强度,荧光强度以相对荧光单位(RFU)表示.
2.7 GSH含量测定取匀浆上清200μL,加入有机溶剂1 mL(V氯仿∶V正丁醇=4∶1)涡旋混匀;冰上静止10 min后,10000 r·min-1离心5 min,在不破坏蛋白层的情况下取上清液50μL加入酶标板,加150μL浓度为60 ng·mL-1的DTNB溶液,室温避光孵育5 min,测其在412 nm的光密度值.GSH含量按照公式(1)计算,蛋白质含量按照Folin-酚法测定.
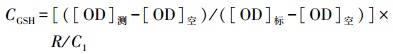
|
(1) |
式中,CGSH为GSH含量(μmol·mg-1,以prot计),[OD]测、[OD]空、[OD]标分别为测定、空白、标准OD值,R为样本稀释倍数,C1为待测匀浆蛋白浓度(mg·mL-1,以prot计).
2.8 MDA含量测定取0.5 mL细胞匀浆上清于10 mL离心管中,加入0.6%TBA溶液沸水浴15 min,冷水冷却后取1 mL,10000 r·min-1离心10 min,取上清液200μL于酶标板中测其在450、532、600 nm的吸光值(A450、A532、A600).MDA含量(CMDA,μmol·mg-1,以prot计)计算公式如下:
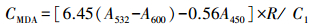
|
(2) |
DPC系数采用KCl-SDS沉淀法进行检测(Ma et al.,2014),分别测定交联DNA含量A及原液中游离DNA含量B,计算DPC系数η=A/(A+B).
2.10 统计学分析实验数据采用Mean±SD表示,采用Origin 6.1软件进行统计分析,多组间均数比较使用单因素方差分析(ANOVA),然后使用最小显著性差异性(LSD)检验法分析各两组均数间的差异,p < 0.05为差异显著,p < 0.01为差异极显著.
3 结果(Results) 3.1 小鼠皮肤的外观和形态变化小鼠皮肤的外观图反映机体对DINP刺激的外在变化,组织切片图则反映内在病理变化.由图 1a可见,溶剂对照组的皮肤在染毒期间并无变化,低剂量暴露组(0.02、0.2 mg·kg-1)和中剂量组(2 mg·kg-1)的皮肤外观变化轻微,而较高剂量组(20 mg·kg-1)和高剂量组(200 mg·kg-1)的皮肤外观随暴露时间的增加出现明显变化,在第28 d,20 mg·kg-1组和200 mg·kg-1组小鼠皮肤已出现明显皱褶和白色突起小泡.图 1b中切片所示变化趋势与图 1a一致,低、中剂量暴露组(0.02、0.2、2 mg·kg-1)的表皮层厚度没有明显增加,毛囊结构也较清晰,而较高剂量组(20 mg·kg-1)和高剂量组(200 mg·kg-1)的表皮层增厚,毛囊轮廓变大.
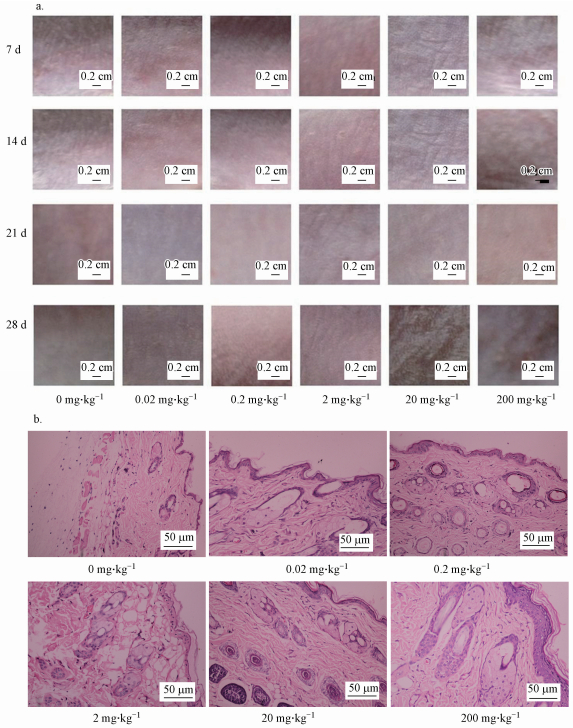 |
| 图 1 不同DINP处理组小鼠皮肤形态(a.小鼠皮肤每周的外观图(×2);b.皮肤切片图(×40, HE染色)) Fig. 1 Skin lesions of different DINP groups(a.Weekly appearance diagrams of mice skins(×2);b.Skin slices of different DINP groups (×40, HE stained)) |
脏器系数是实验动物某脏器的质量与其体重的比值,是毒理学实验中常用的指标.肝脏器系数结果表明(表 1):与对照组比较,低剂量暴露组(0.02、0.2 mg·kg-1)、中剂量组(2 mg·kg-1)差异无统计学意义(p>0.05),较高剂量组(20 mg·kg-1)和高剂量组(200 mg·kg-1)肝脏器系数显著升高(p < 0.01).肾脏器系数结果表明(表 1):与对照组比较,低剂量暴露组(0.02、0.2 mg·kg-1)、中剂量组(2 mg·kg-1)和较高剂量组(20 mg·kg-1)差异无统计学意义(p>0.05),高剂量组(200 mg·kg-1)肾脏器系数显著升高(p < 0.05).
| 表 1 不同处理组的小鼠体重及脏器系数(n=6) Table 1 Mouse body weight and organ coefficient of different groups |
ROS含量是反映细胞内氧自由基水平的重要指标.不同处理肝组织ROS含量结果表明(图 2a):与对照组比较,低剂量暴露组(0.02、0.2 mg·kg-1)ROS含量的差异无统计学意义(p>0.05),中剂量组(2 mg·kg-1)和较高剂量组(20 mg·kg-1)ROS含量升高(p < 0.05),而高剂量组(200 mg·kg-1)ROS含量升高程度更大(p < 0.01).肾组织ROS结果表明(图 2b):与对照组比较,较高剂量组(20 mg·kg-1)和高剂量组(200 mg·kg-1)ROS含量显著升高(p < 0.05).
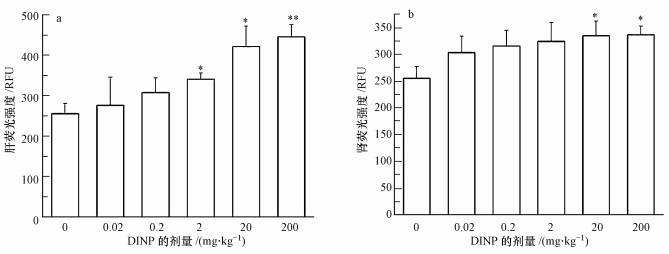 |
| 图 2 不同DINP处理组小鼠肝和肾的ROS含量(*:与对照组相比较, p < 0.05, **:与对照组相比较, p < 0.01; RFU:相对荧光单位 Fig. 2 ROS content in mouse hepatic and kidney of different DINP groups (*p < 0.05, **p < 0.01, compare with control group. RFU: relative fluorescence units) |
GSH是ROS的主要清除剂,可以直接反映机体抗氧化能力的强弱.肝组织GSH含量(以prot计)结果表明(图 3a):与对照组比较,0.02、0.2、2 mg·kg-1暴露组无差异(p>0.05),较高剂量组(20 mg·kg-1)和高剂量组(200 mg·kg-1)GSH含量显著下降(p < 0.01).肾组织GSH含量(以prot计)结果表明(图 3b):与对照组比较,20 mg·kg-1暴露组GSH含量显著下降(p < 0.05),200 mg·kg-1暴露组GSH含量下降程度更大(p < 0.01).
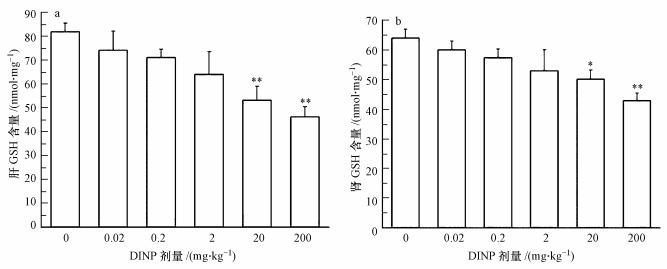 |
| 图 3 不同DINP处理组小鼠肝和肾的GSH含量(*:与对照组相比较, p < 0.05, **:与对照组相比较, p < 0.01) Fig. 3 GSH content in mouse hepatic and kidney of different DINP groups (*p < 0.05, **p < 0.01, compare with control group) |
MDA是脂质过氧化的最终分解产物,其含量可反映机体脂质过氧化程度.肝组织MDA含量结果表明(如图 4a):与对照组比较,中剂量组(2 mg·kg-1)MDA含量显著升高(p < 0.05),较高剂量组(20 mg·kg-1)和高剂量组(200 mg·kg-1)MDA含量升高更加明显(p < 0.01).肾组织MDA结果表明(图 4b),与对照组比较,较高剂量组MDA含量显著升高(20 mg·kg-1)(p < 0.05),高剂量组(200 mg·kg-1)MDA含量升高更加明显(p < 0.01).
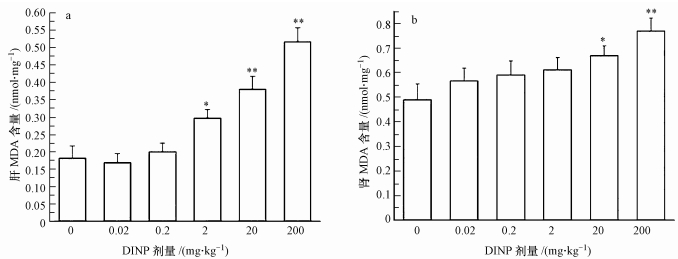 |
| 图 4 不同DINP处理组小鼠肝和肾的MDA含量(*:与对照组相比较, p < 0.05, **:与对照组相比较, p < 0.01) Fig. 4 MDA content in mouse hepatic and liver of different DINP groups (*p < 0.05, **p < 0.01, compare with control group) |
DPC是一种重要的遗传毒性分子生物标志物,其系数的大小可反映组织细胞DNA的损伤程度.随着DINP的剂量增加,DPC系数随之上升.肝组织DPC系数结果表明(图 5a),与对照组比较,较高剂量组(20 mg·kg-1)和高剂量组(200 mg·kg-1)DPC系数显著升高(p < 0.05).肾组织DPC系数结果表明(图 5b),与对照组比较,较高剂量组(20 mg·kg-1)DPC系数显著升高(p < 0.05),高剂量组(200 mg·kg-1)DPC系数升高更加明显(p < 0.01).
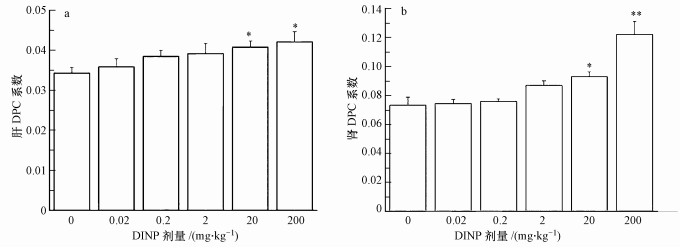 |
| 图 5 不同DINP处理组小鼠肝和肾的DPC系数(*:与对照组相比较, p < 0.05, **:与对照组相比较, p < 0.01) Fig. 5 DPC coefficients in mouse hepatic and liver of different DINP groups(*P < 0.05, **P < 0.01, compare with control group) |
增塑剂主要用于增加塑料制品的柔韧性和延展性,是产量和消费量最大的塑料助剂.国内增塑剂市场多年来都由PAEs增塑剂所主导,我国的年产量目前已突破100万t(黄婵媛等,2014).DINP在加工性能和经济性能上均明显优于DEHP、DBP等传统增塑剂,目前超过90%的DINP应用于日常的聚氯乙烯(PVC)产品中,如玩具、一次性手套和包装纸等(Kavlocka et al.,2002).
DINP属于半挥发性有机物,具有挥发性小、吸附性强、释放速率低等特点,可同时以气相、颗粒相和表面相等多种形式存在并均可通过皮肤接触渗入方式被人体吸收(Ying et al.,2011).本研究中,随着DINP染毒剂量的升高,小鼠皮肤出现明显可视化变化,切片结果显示,DINP可通过皮肤渗入机体内部,并明显造成皮肤损伤,且具有一定剂量-反应关系.目前并无DINP皮肤暴露途径的内暴露数据,但对DBP的皮肤染毒实验表明:DBP在皮下组织如汗腺和毛囊中可出现累积,且在肝和肾中的累积量较大,还发现DBP可穿透血睾屏障进入睾丸.在通过对大鼠暴露后的24、48、72 h体内DBP的残留量检测,发现通过皮肤暴露后,大部分的DBP在2~3 d内迅速代谢并排出(Zeng et al.,2013).
化学物质无论以何途径进入机体,均可通过血液循环到达肝脏并在肝脏发生生物转化,因而肝脏是对DINP毒性作用最为敏感的器官;而肾脏代偿功能强、解毒功能多样,是DINP的另一个重要靶器官(McKee et al.,2002).当受到有毒物质的暴露时,实验动物的相关脏器会受到损伤,脏器系数也会相应发生变化,因而脏器系数可以作为一个简单有效的指标来反映有毒物质对动物器官的损伤.本研究中,高剂量组DINP可以引起肝脏和肾脏脏器系数的异常增高,表明肝脏和肾脏可能已发生损伤.
肝脏和肾脏功能的维持需要大量的氧和营养物质,因而它们的代谢活动非常活跃,并会在氧代谢过程中大量产生ROS.机体内一定的ROS水平是维持生命正常活动所必须的,它可作为胞内第二信使,通过氧化还原修饰靶分子,对细胞外不同刺激在胞内产生协同或者联合的反应,与细胞的增殖、分化、凋亡等活动密切相关(Finkel,2011).生理状态下,肝脏和肾脏可通过自身所具备的抗氧化酶和抗氧化物质消除过量的ROS,因而机体的氧化和抗氧化在正常情况下处于动态平衡状态.还原型GSH是ROS的主要清除剂,可以直接与O2-和·OH发生快速反应,将其还原;同时GSH又可作为酶的底物,通过抗坏血酸-谷胱甘肽循环途径等酶促反应清除活性氧,参与细胞中抗氧化剂的再生过程,在评价氧化损伤中具重要意义(Valko et al.,2006).但当某些外源化学物质过量作用时,会导致ROS快速产生,导致机体氧化和抗氧化失衡,导致机体氧化应激.氧化应激是许多疾病和毒理作用的重要发病和作用机制,可以引发肿瘤、畸形、衰老等多种后果(Briegera et al.,2012; 马萍等,2013).本研究中20 mg·kg-1和200 mg·kg-1 DINP组小鼠肝组织和肾组织ROS水平均显著升高,GSH含量均显著下降,显示高剂量DINP可以使机体过量产生活性氧,同时大量损耗GSH,使机体氧化/抗氧化之间的平衡受到破坏.
就细胞水平而言,毒性物质产生的过量ROS会改变细胞功能及效应,破坏正常生理水平下特定细胞群体的增殖、分化与凋亡之间的平衡;在分子水平上,过量ROS会直接造成生物大分子(脂类、核酸、蛋白质、糖类等)的氧化损伤,引起细胞损伤(Birben et al.,2012),而损伤的细胞或组织本身又可引起ROS的产生,总体效应是扩大炎症反应最终导致组织受损程度增加(周宗灿,2015).活性氧分子可直接或间接进攻脂质分子,引起脂质过氧化作用.脂质过氧化是典型的链式反应过程,可导致脂质分子的大量消耗和过氧化物的大量产生,会使质膜和内膜系统的流动性、转运功能及受体功能遭到破坏或功能丧失(Briegera et al.,2012).MDA是该反应的终代谢产物,生成量被作为衡量脂质过氧化强度的指标.本研究中20 mg·kg-1和200 mg·kg-1 DINP组小鼠肝组织和肾组织MDA水平均显著升高,说明较高剂量DINP诱导小鼠肝细胞和肾细胞发生脂质过氧化,使细胞膜结构发生损伤.
DNA是ROS攻击的重要靶分子之一,损伤表现为DNA分子的碱基修饰和DNA单/双链断裂两大类.DNA断裂可以与蛋白质交联形成DPC,DPC对DNA的构象和功能可以产生严重的影响:一方面会造成部分碱基的丢失,另一方面会造成被修复DNA碱基的错误掺入和错误编码,导致基因突变,严重时损害细胞生成ATP能力,影响细胞的能量供应及胞内稳态(Stingele et al.,2014).本研究中,20 mg·kg-1 DINP组肝组织和肾组织DPC系数均显著上升,说明高剂量DINP可以引起小鼠肝和肾组织DNA-蛋白质交联物形成,造成组织DNA损伤.
综上所述,ROS的过度累积可能是导致细胞发生分子变化,并引起肝、肾组织出现损伤的关键因素,即皮肤接触DINP所致毒性与活性氧的过度积累之间存在关联.但两者之间是否存在因果关系,作用机制如何,还需进一步研究以证明.
5 结论(Conclusions)本研究表明,较高剂量的DINP(≥20 mg·kg-1)可通过皮肤暴露的方式造成小鼠肝脏和肾脏组织细胞的氧化损伤,对机体的代谢功能存在潜在的不良影响.
| [${referVo.labelOrder}] | Birben E, Sahiner U M, Sackesen C, et al. 2012. Oxidative stress and antioxidant defense[J]. World Allergy Organization Journal , 5 (1) : 9–19. DOI:10.1097/WOX.0b013e3182439613 |
| [${referVo.labelOrder}] | Boberg J, Christiansen S, Axelstad M, et al. 2011. Reproductive and behavioral effects of diisononylphthalate (DINP) in perinatally exposed rats[J]. Reproductive Toxicology , 31 (2) : 200–209. DOI:10.1016/j.reprotox.2010.11.001 |
| [${referVo.labelOrder}] | Briegera K, Schiavonea S, Miller F J, et al. 2012. Reactive oxygen species:from health to disease[J]. Swiss Medical Weekly , 142 : 1365. |
| [${referVo.labelOrder}] | 陈晓燕, 黄海燕, 林忠宁, 等. 2005. 北京:化学工业出版社. 靶器官毒理学[M]. : 194 -219. |
| [${referVo.labelOrder}] | 黄婵媛, 蔡玮红, 莫锡乾.2014. 邻苯二甲酸酯类的特性及在食品中的限量分析[J]. 包装与食品机械 , 2014, 32 (2) : 66–69. |
| [${referVo.labelOrder}] | Finkel T. 2011. Signal transduction by reactive oxygen species[J]. The Journal of Cell Biology , 195 (1) : 7–15. DOI:10.1083/jcb.201103148 |
| [${referVo.labelOrder}] | Kavlocka R, Boekelheideb K, Chapin R, et al. 2002. NTP center for the evaluation of risks to human reproduction:Phthalates expert panel report on the reproductive and developmental toxicity of di-isononylphthalate[J]. Reproductive Toxicology , 16 : 679–708. DOI:10.1016/S0890-6238(02)00034-5 |
| [${referVo.labelOrder}] | Kevy S V, Jacobson M S. 1982. Hepatic effects of a phthalate ester plasticizer leached from poly (vinyl chloride) blood bags following transfusion[J]. Environmental Health Perspectives , 45 : 57–64. DOI:10.1289/ehp.824557 |
| [${referVo.labelOrder}] | Koch H M, Haller A, Weiss T, et al. 2012. Phthalate exposure during cold plastisol application-a human biomonitoringstudy[J]. Toxicology Letters , 213 (1) : 100–106. DOI:10.1016/j.toxlet.2011.06.010 |
| [${referVo.labelOrder}] | Koch H M, Rossbach B, Drexler H, et al. 2003. Internal exposure of the general population to DEHP and Otherphthalates-determination of secondary and primary phthalate monoester metabolites in urine[J]. Environmental research , 93 (2) : 177–185. DOI:10.1016/S0013-9351(03)00083-5 |
| [${referVo.labelOrder}] | Lee B M, Koo H J. 2007. Hershberger assay for anti and rogenic effects of phthalates[J]. Journal of Toxicology & Environmental Health Part A , 70 (15/16) : 1365–1370. |
| [${referVo.labelOrder}] | 陆杰, 代园园, 罗慧, 等.2015. 邻苯二甲酸二异壬酯致小鼠肝组织氧化损伤的研究[J]. 中国环境科学 , 2015, 35 (1) : 285–290. |
| [${referVo.labelOrder}] | Ma P, Liu XD, Wu J L, et al. 2015. Cognitive deficits and anxiety induced by diisononyl phthalate in mice and the neuroprotective effects of melatonin[J]. Scientific Reports , 5 : 14676. DOI:10.1038/srep14676 |
| [${referVo.labelOrder}] | Ma P, Yan B, Zeng Q, et al. 2014. Oral exposure of Kunming mice to diisononyl phthalate induces hepatic and renal tissue injury through the accumulation of ROS[J]. Protective effect of melatonin[J].Food and Chemical Toxicology , 68 : 247–256. DOI:10.1016/j.fct.2014.03.027 |
| [${referVo.labelOrder}] | Matsumoto M, Hirata-Koizumi M, Ema M. 2008. Potential adverse effects of phthalic acid esters on human health:a review of recent studies on reproduction[J]. Regulatory Toxicology and Pharmacology , 50 (1) : 37–49. DOI:10.1016/j.yrtph.2007.09.004 |
| [${referVo.labelOrder}] | McKee R H, El-Hawari M, Stoltz M, et al. 2002. Absorption, disposition and metabolism of di-isononylphthalate (DINP) in F-344 rats[J]. Journal of Applied Toxicology , 22 (5) : 293–302. DOI:10.1002/(ISSN)1099-1263 |
| [${referVo.labelOrder}] | 马萍, 焦铭, 尤会会, 等.2013. 农药毒死蜱对小鼠脑细胞氧化损伤的研究[J]. 环境科学学报 , 2013, 33 (3) : 867–871. |
| [${referVo.labelOrder}] | Stingele J, Schwarz M S, Bloemeke N, et al. 2014. A DNA-dependent protease involved in DNA-protein crosslink repair[J]. Cell , 158 (2) : 327–338. DOI:10.1016/j.cell.2014.04.053 |
| [${referVo.labelOrder}] | Valko M, Rhodes C J, Moncol J, et al. 2006. Free radicals, metals and antioxidants in oxidative stress-induced cancer[J]. Chemico-biological Interactions , 160 (1) : 1–40. DOI:10.1016/j.cbi.2005.12.009 |
| [${referVo.labelOrder}] | Ying X, Zhang J S. 2011. Understanding SVOCs[J]. ASHRAE Journal , 53 (12) : 121–125. |
| [${referVo.labelOrder}] | Zeng Q, Wei C, Wu Y, et al. 2013. Approach to distribution and accumulation of dibutyl phthalate in rats by immunoassay[J]. Food and Chemical Toxicology , 56 : 18–27. DOI:10.1016/j.fct.2013.01.045 |
| [${referVo.labelOrder}] | 周宗灿.2015. 氧化还原信号和氧化应激/还原应激[J]. 毒理学杂志 , 2015, 29 (1) : 1–14. |
 2016, Vol. 36
2016, Vol. 36


