2. 南开大学环境科学与工程学院, 环境污染过程与基准教育部重点实验室/天津市城市生态环境修复与污染防治重点实验室, 天津 300071
2. Ministry of Education Key Laboratory of Pollution Processes and Environmental Criteria/Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071
生物炭是生物质残体(如木屑、果皮、作物秸秆、动物粪便和污泥等)在缺氧或无氧条件下热解产生的一类富含碳的高聚产物(Kong et al., 2014).生物炭结构特殊, 性质稳定, 被认为在减少碳足迹(carbon footprint)、缓解温室效应及改善土壤肥力等方面具有重要影响(Chan et al., 2007; Glaser et al., 2009; Kong et al., 2014).生物炭被证实可有效影响土壤中潜在的有毒元素(Potentially toxic elements, PTEs)、农药(阿特拉津、西玛津等)及有机物(疏水和亲水有机污染物)等污染物的迁移和转化(Cao et al., 2009; Hossain et al., 2010; Jones et al., 2011; 郎印海等, 2014; 王林等, 2014).多孔碳材料(如活性炭、石墨烯等)在污染土壤修复中的应用由来已久.相较于其它煤基碳材料, 生物炭具有更低的环境足迹及经济投入(Sparrevik et al., 2011), 显示出更好的应用前景.
当前, 石油污染问题日益突出(Zhou et al., 2005).特别是其重要组分多环芳烃(PAHs), 因其对土壤系统结构和功能有巨大的破坏作用及剧毒性, 得到广泛关注(周启星等, 2001).多项研究发现(Nguyen et al., 2007; Beesley et al., 2010), 添加生物炭可有效吸附PAHs, 达到钝化效果.然而, 大部分研究局限于水相体系, 仅有少量着眼于生物炭对土壤体系中石油烃的影响(Spokas et al., 2009; Bushnaf et al., 2011), 且多数受试土壤为配土而非实际场地污染已久的土壤.因此, 添加生物炭研究实际污染场地土壤中石油烃的去除是十分有必要的.另外, 生物炭的强吸附作用将导致污染物的生物可利用性降低(Yang et al., 2006; Yu et al., 2009; Wang et al., 2013), 从而长久的残留于环境中, 某些情况下可能会发生解吸附、产生二次污染等风险.近年有研究表明生物炭的添加导致土壤微生物丰度和群落结构的变化(Anderson et al., 2011; Gell et al., 2011), 促进土壤有机污染物的生物降解(Yang et al., 2003; Yang et al., 2003).因此, 生物炭与土壤微生物对石油烃的复合作用也需要进一步研究.
本研究选用300 ℃和500 ℃条件下制备的木屑和麦秆生物炭加入石油污染土壤中, 考察污染土壤中石油烃及其组分(正链烷烃nC8~C40和16种环境优先控制的PAHs)的降解效果, 研究生物炭在石油烃微生物降解过程中的作用机制, 并进一步探讨生物炭制备条件、污染物性质和土壤环境(土壤有机质)对生物炭强化作用的影响.
2 材料与方法(Materials and methods) 2.1 试验材料 2.1.1 生物炭生物炭的制备参照文献(孔露露等, 2015).简单而言, 是将木屑和麦秆经前处理后在限氧条件下分别于300和500 ℃热解3 h制备而成.制备产物过20目筛, 选用筛上物(即大颗粒生物炭)进行降解试验, 选用筛下物(即小颗粒生物炭)进行进一步表面性质表征.采用麦秆于300和500 ℃下热解制备的生物炭分别标记为Wh300和Wh500;采用木屑于300和500 ℃下制备的生物炭分别标记为Wd300和Wd500.
生物炭产率、元素组成、表面官能团、比表面积和微孔结构的测定和分析结果参见文献(孔露露等, 2015).供试生物炭基本的理化性质:Wh300和Wd300中C元素含量较低, 分别为52%和64%, O、H和N元素含量较高, Wh500和Wd500中C元素含量显著升高, 分别为81%和88%, 其它元素含量降低;Wh300和Wd300存在表面官能团如羧基(—COOH)、羰基(CO)等, 且含量较高, 而500 ℃制备两种生物炭表面形成了高度碳化的芳香化结构;Wh300和Wd300的比表面积非常小, 分别为4.8和5.9 m2·g-1, 而Wh500和Wd500随着孔容的增大比表面积大幅度提高, 分别为28.5和33.5 m2·g-1.
2.1.2 试验土壤石油污染土壤采于天津市大港油田废弃的采油场地(海滨大道与南港二号路交口, GPS定位点是北纬38°44′49″, 东经117°33′55″).采集表层土壤, 部分放置于阴暗通风处风干, 过20目筛后收集以测定土壤理化性质;部分去除动植物残体及大颗粒放置于冰箱中, 供降解试验采用.土壤基本的理化性质为(孔露露等, 2015):污染土壤的pH为7.61, 属于弱碱性土壤;总磷、总氮含量分别为0.04%和0.12%, 属于肥力较差土壤.采用重量法测定的大港污染土壤中总石油烃浓度为52367 mg·kg-1.其中, 饱和烃和芳香烃组分的含量分别为78.13%和9.85%, 其余组分为沥青质和极性物等.
2.1.3 化学药品正链烷烃标样, nC8~C40, 包含异构烷烃姥鲛烷和植烷(500 μg·mL-1), 购买自北京百灵威科技有限公司;16种美国EPA优先控制的PAHs的混合标准品(2000 μg·mL-1), 包括萘(Nap)、苊(Acy)、二氢苊(Ace)、芴(Flu)、菲(Phe)、蒽(Ant)、荧蒽(Flt)、芘(Pyr)、苯并[a]蒽(BaA)、(Chr)、苯并[b]荧蒽(BbF)、苯并[k]荧蒽(BkF)、苯并[a]芘(BaP)、茚并[1, 2, 3-cd]芘(IPY)、二苯并[a、h]蒽(DBA)、苯并[g, h, i]北(BPE), 购买自美国Sigma-Aldrich公司.
2.2 试验设计共设3组处理:①CK, 即未添加生物炭的新鲜土壤;②BC+NaN3处理, 即新鲜土壤中添加一定量的灭菌生物炭, 并加入NaN3水溶液(含量为每克土壤中含有0.1% NaN3)以抑制土壤中微生物活动(袁馨等, 2009);③BC处理, 即新鲜土壤中添加一定量的灭菌生物炭.将处理土壤加入套有封口膜的组培瓶中, 调节土壤含水率为饱和含水率的50%, 每隔10 d通过称重法检查水分的损失, 加入超纯水或NaN3水溶液保持土壤含水率.每组设置3个平行试验.将 3组试验样品放入人工气候箱, 保持箱内温度为30 ℃, 湿度为100%, 光照为60%.根据需要添加易分解有机质(葡萄糖)考察其对土壤中石油烃微生物降解的影响.84 d后将土壤样品过滤去除生物炭颗粒, 随后冷冻干燥用于测定土壤中石油烃及其组分的浓度变化.表 1列出了降解试验编号及试验条件.
| 表 1 石油污染土壤试验组编号及试验条件 Table 1 Experimental conditions for the petroleum-contaminated soil with/without biochars |
土壤中总石油烃及其组分的测定具体参见文献(Wang et al., 2012).简单而言, 样品过滤去除土壤中混杂的生物炭, 经过冷冻干燥、超声萃取后采用重量法测定土壤中总石油烃(TPHs).
过自制硅胶氧化铝复合层析柱(内径1 cm, 自上而下分别为1 cm 无水硫酸钠、6 cm 3%去活化氧化铝和12 cm 2%去活化硅胶)分离土壤样品中的石油烃组分, 分别采用20 mL 正已烷、70 mL 的二氯甲烷/正己烷(1:1, V /V)混合液淋洗饱和烃和芳香烃, 转移至样品瓶, 旋转蒸发并在氮气流下吹干后用色谱纯正己烷定容至10 mL, 备气相色谱质谱联用(GC-MS)分析来分析正链烷烃(nC8~C40) 和16种优先控制的PAHs.
2.4 数据处理采用SPSS 22进行数据统计分析, 采用多样本Duncan法对不同处理间的差异显著性进行分析, p<0.05时认为处理间差异显著;采用Origin Pro 8.5制图.
3 结果与讨论(Results and discussion) 3.1 添加生物炭后土壤中总石油烃及其组分的降解图 1为恒温培养(土壤含水率为50%, 温度30 ℃, 光照60%)84 d后, CK、BC+NaN3和BC试验组土壤中TPHs去除率的变化.尽管生物炭的原料和热解温度不同, 加入不同生物炭(Wd300、Wd500、Wh300和Wh500) 后土壤中TPHs浓度变化的整体趋势相同.CK试验组中未添加生物炭, 84 d后TPHs较初始值有所下降, 由52367 mg·kg-1降低至39700 mg·kg-1, 去除率为24.19%.研究发现, 随着土壤深度的增加, 石油烃不易挥发和光解, 也不易在微生物作用下通过氧化作用分解.本试验将采集土壤充分混合, 因此可能存在未挥发和光解的石油烃组分.试验过程中, 培养箱为了维持恒温不断有风送出, 维持光照在60%, 因此CK试验组中TPHs的损失可能归因于土壤中的非生物损失(如挥发、水解和光降解等)和土著微生物降解.BC+NaN3试验组加入生物炭, 并加入一定浓度的NaN3来抑制土壤微生物的活动.生物炭对污染场地土壤中的总石油烃的吸附效果非常低(孔露露等, 2015), 因此BC+NaN3试验组中TPHs浓度的降低主要来源于土壤的非生物损失.由图 1可以看出, BC+NaN3试验组土壤中TPHs的浓度虽然较初始值有所下降, 然而却高于CK试验组中TPHs的浓度, 去除率显著低于CK处理组的去除率(p<0.05) , 为19%左右.相比较于CK和BC+NaN3试验组, BC试验组土壤中TPHs的去除率得到显著提高(p<0.05) , 达35%~45%, 比CK试验组高出至少11%, 比BC+NaN3试验组高出至少16%, 说明添加生物炭显著提高了石油烃的微生物降解作用.Qin等(2013) 针对中国胜利油田污染土壤进行研究, 添加2%生物炭经过180 d培养后也发现了相似的试验结果.TPHs的去除率达77.8%, 高于空白对照组(去除率为61.2%), 这被归因于生物炭输入产生的生物刺激(biostimulation)作用.相较于空白对照TPHs去除率提高了23.6%, 与本研究中TPHs去除率的提高(10%~20%左右)相近.
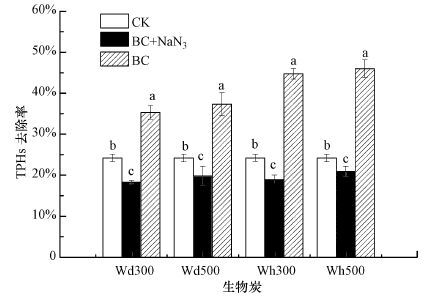 |
| 图 1 恒温培养84 d后CK、BC+NaN3和BC试验组污染土壤中TPHs的去除率(同一处理具有不同小写字母的数据间差异显著(p<0.05) , 下同) Fig. 1 Total removal percentages of TPHs in soils of CK, BC+NaN3 and BC treatment after 84d incubation |
烷烃和芳香烃是石油烃的主要组分.PAHs作为芳香烃重要组分, 由于其强毒性及致癌性, 早在1976年美国环保局(EPA)就将16种PAHs列入优先控制的有毒有机污染物黑名单(焦文涛等, 2009).经GC-MS测定发现, 16种优先控制的PAHs在大港污染土壤中均有不同程度的检出.图 2为污染土壤中16种典型PAHs的含量分布.其中, 低环(2~3环)PAHs含量在3~239 ng·g-1之间, 高环(4~6环)PAHs含量除了BkF和IPY之外, 其余含量均高于80 ng·g-1.Chr含量最高, 为1399.63 ng·g-1.这是由于低环PAHs溶解性高, 易于通过挥发、光解、生物降解等过程进入大气或迁移至更深层的土壤, 而高环PAHs损失相对较小, 因此土壤中高环PAHs分布比例较高.
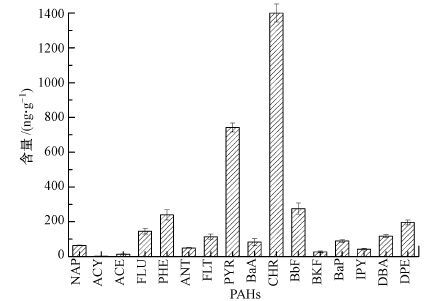 |
| 图 2 污染土壤中16种PAHs的含量 Fig. 2 16 PAHs concentrations in the contaminated soil |
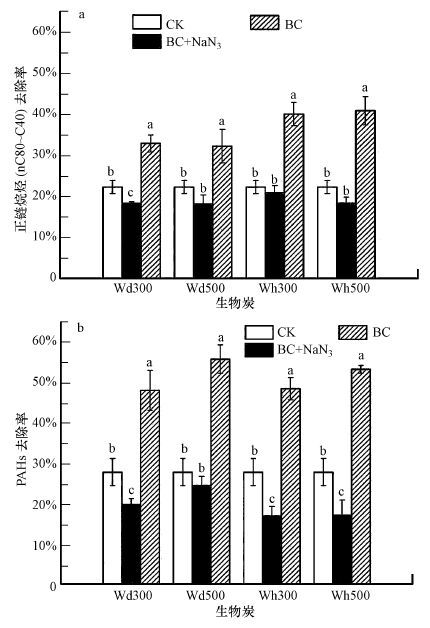 |
| 图 3 恒温培养84 d后BC、BC+NaN3和BC试验组污染土壤中正链烷烃(nC8~C40) 和PAHs的去除率变化 Fig. 3 Total removal percentages of n-alkanes(nC8~C40) (a)and PAHs(b)in soils of CK, BC+NaN3 and BC treatment after 84-day incubation |
图 3为恒温培养(土壤含水率为50%, 温度30 ℃, 光照60%)84 d后, CK、BC+NaN3和BC试验组石油污染土壤中正链烷烃(nC8~C40) (a)和PAHs(b)的去除率变化.污染土壤中二者浓度的变化趋势与TPHs相类似.CK试验组中正链烷烃(nC8~C40) 的去除率为22.26%, PAHs去除率为27.72%, 这被归因于光降解、挥发等非生物损失和土著微生物的降解.BC+NaN3试验组中抑制了土壤微生物的活动, 正链烷烃(nC8~C40) 的去除率下降至18%左右.生物炭对烷烃几乎不具有吸附作用(孔露露等, 2015), 因此BC+NaN3试验组中nC8~C40浓度的降低完全来源于光降解、挥发等非生物损失.在4种生物炭作用下PAHs的去除率为16%~24%, 除了非生物损失, 还可能存在生物炭对PAHs的吸附作用.相较于CK试验组, PAHs去除率反而降低了至少3%, 说明生物炭对PAHs的吸附强度低于土著微生物对PAHs的降解强度.BC试验组添加了灭菌生物炭, nC8~C40去除率显著提高(p<0.05) , 分别提高至32.91%(Wd300) 、32.21%(Wd500) 、40.04%(Wh300) 和40.87%(Wh500) , 显著高于CK和BC+NaN3试验组.PAHs去除率相较于CK试验组也得到显著增加(p<0.05) , 分别提高至48.08%(Wd300) 、55.80%(Wd500) 、51.54%(Wh300) 和46.71%(Wh500) .这说明添加生物炭强化了烷烃(nC8~C40) 和PAHs的生物降解作用, 有效提高了二者的去除率.
多项研究表明(Nguyen et al., 2007; Beesley et al., 2010), 生物炭可有效吸附土壤和沉积物中的PAHs, 其吸附强度至少是一般土壤有机质的10倍.例如, Gomez-Eyles等(2011) 经过56 d的试验, 发现添加生物炭有效降低了PAHs的总浓度(449 mg·kg-1降低至306 mg·kg-1)和生物可利用态浓度(276降低至182 mg·kg-1).作者之前研究也发现木屑和麦秆生物炭可有效吸附土壤中的PAHs, 其中, 加入质量分数为5%的Wh500吸附33 d后PAHs的去除率达到了72.62%(孔露露等, 2015).然而, 本研究中土壤添加生物炭后PAHs的生物可利用性并没有下降, 去除率反而得到显著提高(见图 3).原因可能有二:一是加入生物炭后土壤中微生物活性或群落结构可能发生变化, 将会影响污染物的微生物降解作用.有研究发现加入生物炭后石油降解菌丰度提高, 促使土壤中PAHs去除率增大(Qin et al., 2013).二是生物炭进入土壤后, 将会与土壤有机质或矿物质发生反应(Uchimiya et al., 2010a;2010b), 造成生物炭孔隙阻塞, 因此对PAHs的吸附大部分发生在生物炭表面, 不会对微生物利用造成影响.
3.2 生物炭制备对生物炭强化作用的影响生物炭制备条件(生物质原料和热解温度)被证明显著影响其表面性质(Beesley et al., 2011; Lehmann et al., 2011; Kong et al., 2014).木屑和麦秆作为典型的森林和农业废弃物, 因其木质素含量不同而被本研究选为受试材料.由图 3a可见, 麦秆生物炭对正链烷烃(nC8~C40) 微生物降解的促进作用高于木屑生物炭原因可能在于以下3点:首先, 麦秆木质素含量较低, 热解制备的生物炭具有较高的比表面积, 孔隙丰富(孔露露等, 2015), 为微生物提供良好栖息环境的同时还可以保护微生物躲过“捕猎者”;生物炭对水肥的吸附作用还可提高土壤养分有效性, 从而促进微生物生长.多项研究发现土壤生物炭中存在丰富的真菌和微生物(Lehmann et al., 2011).另外, 生物炭倾向于聚集在土壤团聚体中(Brodowski et al., 2006).孔隙率高的麦秆生物炭更有利于增加土壤孔隙率, 促进土壤空气的流通, 提高微生物的活性.有研究(董亚明等, 2013)发现, 在生物修复过程中加入牛粪、壳质素、农作物茎秆、锯末及腐殖酸等有机物作为土壤膨松剂, 有利于增强土壤中水分的保持及适当的孔隙度, 有效提高了土壤微生物的活性.土壤微生物活性得到提高, 进而促进污染物的微生物降解.其次, 根据生物炭的元素组成(孔露露等, 2015)可知, 300 ℃和500 ℃下制备的麦秆生物炭的(O+N)/C高于同等温度下制备的木屑生物炭, 说明Wh300和Wh500表面存在更为丰富的含氧官能团(即不稳定的有机质, labile organic matter, LOC).这部分不稳定有机质可被微生物作为营养源分解, 促进微生物的生长(Zimmerman, 2010)和生物炭的矿化(Kong et al., 2013).早在20世纪60年代, 惰性碳材料(如木炭、煤炭、石墨等)被土壤微生物代谢利用就有报道(Shneour, 1966; Scott et al., 1986; Zimmerman, 2010).近年, Zimmerman(2010) 通过分析CO2的释放量, 发现经过1年培养生物炭表面官能团发生矿化, 且一半都来源于生物代谢.生物炭发生矿化作用, 表面易分解的含氧官能团被土壤微生物代谢分解, 导致原来被堵塞的孔隙暴露, 表面积增大, 进而将如上所述对土壤微生物产生一系列积极的影响.最后, 草本植物制备的生物炭矿物质含量高于木本植物生物炭(Keiluweit et al., 2010), 也将作为营养物质促进微生物的生长.
然而, 生物炭原料对PAHs的降解没有影响, 这可能是由于生物炭对土壤微生物的影响具有选择性.Gell等(2011) 研究加入生物炭后土壤微生物群落的变化, 发现微生物群落多样性降低, 特殊种数量增加.Anderson等(2011) 为研究生物炭对土壤微生物群落结构以及土壤理化性质的影响进行了一系列试验, 加入生物炭后土壤中某些微生物(如慢生根瘤菌科、生丝微菌科、放线菌和高温单孢菌科)的丰度增加超过5%, 而链霉菌科的丰度下降11%, 微单孢菌科的丰度也减少7%.因此, PAHs降解未受影响的原因可能在于不同生物炭对PAHs降解菌的影响不显著, 需要进一步研究.
另外, 加入热解温度为500 ℃的生物炭后石油烃各组分的降解效果高于低温生物炭的强化效果.高温制备生物炭比表面积大、孔隙度高(孔露露等, 2015), 因此将会促进土壤微生物的生长.
3.3 污染物性质对生物炭强化作用的影响在适合的条件下, 石油中所含的各种烃类几乎都可被微生物降解, 然而难易程度和降解速度不同.一般而言, 饱和烃的降解率最高, 特别是直链化合物, 其次是小分子量的芳香烃, 而多环芳烃则更难降解(朱永官, 2008).然而, 本研究中生物炭对PAHs生物降解的强化效果甚至高于烷烃, 这可能是由于添加生物炭后土壤微生物群落结构或丰度发生变化所导致的, 需要进一步研究.
图 4为加入生物炭(Wd300、Wd500、Wh300和Wh500) 培养84 d后土壤中不同环数PAHs的去除占初始浓度的比例.由图可以看出, CK试验组中不同环数PAHs在土著微生物的作用下均有所降解.由于2环PAHs(即Nap)初始浓度较低, 因此可能存在试验误差.3环PAHs的降解效率为46%, 4环PAHs降解效率为25%, 5~6环PAHs的降解效率不及20%.加入生物炭后, 不同环数PAHs的去除率均有不同程度的提高.以添加Wh500为例, 3环PAHs的降解效率提高至69.95%, 高环PAHs的降解效率增幅较小, 4环、5环和6环PAHs分别增至45.96%、37.92%和30.66%.尽管添加生物炭种类不同, 土壤中低环PAHs的降解效率高于高环PAHs.这是因为不同PAHs性质差异很大.随着环数的增加, PAHs的辛醇-水分配系数(Kow)增加, 水溶解性降低, 分子体积增加, 使得其与土壤颗粒结合的更加牢固, 向水溶液中的释放变慢, 因此生物有效性较低, 很难被微生物利用(Wang et al., 2009).Waqas等(2014) 采用污泥制备生物炭考察其对土壤中PAHs和PTEs生物可利用性的影响, 发现生物炭对高环PAHs的吸附效果显著低于低环PAHs.Beesley等(2010) 经过为期60 d的场地暴露试验, 发现加入落叶木制备的生物炭通过吸附作用后可有效减低污染土壤中4~5环PAHs含量超过其背景值的50%, 降低2~3环PAHs含量超过其背景值的40%.这些结果都指出高环PAHs易于被生物炭吸附, 导致其微生物降解效率相应降低.PAHs化合物具有三致性, 其中尤以2环和3环PAHs毒性最大, 因此生物炭显著强化了低环PAHs的生物降解具有重要的环境健康效应.
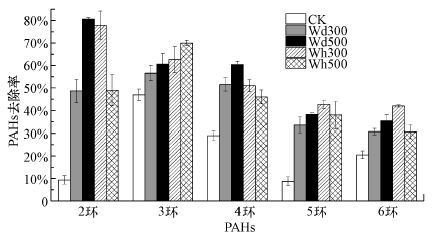 |
| 图 4 加入生物炭(Wd300、Wd500、Wh300和Wh500) 后土壤中不同环数PAHs的去除率 Fig. 4 Removal percentages of PAHs with different rings in soils amended with biochars(Wd300, Wd500, Wh300 and Wh500) |
土壤环境复杂, 特别是土壤有机质对生物炭表面性质具有重要影响.生物炭可吸附土壤有机质或矿物质形成团聚体, 从而保护其不被氧化(Liang et al., 2006).Liang等(2008) 发现anthrosols土壤中存在高达72%~90%的生物炭与土壤矿物质相互作用形成相对稳定的有机-矿物复合体(organo-mineral fraction).然而, 土壤中存在不稳定的有机质(LOC)也可能加速生物炭矿化.研究发现, 土壤中加入甘蔗渣并培养120 d后, 木屑生物炭部分(0.4%~1.1%)发生矿化.随着不稳定有机质加入量的增多, 生物炭矿化率增大(Keith et al., 2011).生物炭表面性质发生变化, 将会影响其在土壤体系中的作用.因此, 本研究添加葡萄糖作为典型LOC研究其对生物炭强化石油烃微生物降解的影响是十分有必要的.图 5为CK和BC试验组中(Wd300、Wd500、Wh300和Wh500) 添加葡萄糖培养84 d后(土壤含水率为50%, 恒温30 ℃, 光照60%)后正链烷烃(nC8~C40) 的去除率变化.加入葡萄糖后, 添加不同生物炭的土壤中烷烃的降解效率均有所提高, 均达到40%以上.特别对于木屑生物炭而言, 去除率显著上升(p<0.05) , 幅度达到8%左右.这可能是由于葡萄糖的添加产生激发效应, 促使生物炭矿化.所谓激发效应, 是指加入有机物质或含氮物质而使土壤中原有机质的分解速率改变的现象, 称之为激发效应(priming effect).使分解速率增加的称为正激发效应;使分解速率降低的称为负激发效应(Hamer et al., 2004).Hamer等(2004) 的研究发现, 往培养的黑碳中加入葡萄糖, 基于微生物的共代谢作用, 会显著地提高生物炭的分解, 表现出明显的激发效应.这一结果得到Kuzyakov等(2009) 的结果支持.生物炭加速矿化, 表面官能团分解, 从而暴露出可能被官能团堵塞的孔隙.Nguyen等(2007) 曾研究发现采用CH2Cl2索氏萃取处理生物炭48 h后, 表面有机质被有效去除, 生物炭表面积增大、孔隙度提高.生物炭矿化后孔隙度增高、表面积增大将为微生物提供更好的栖息地和营养源, 促进微生物的生长, 进而提高污染物的微生物降解效率.
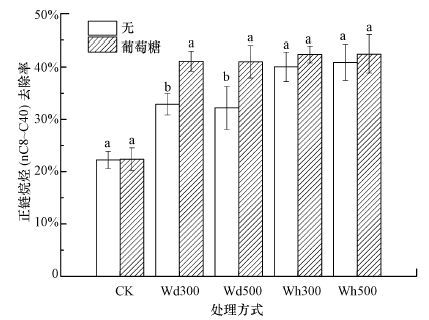 |
| 图 5 恒温培养84 d后, CK和BC试验组中添加葡萄糖对正链烷烃(nC8~C40) 去除率的影响(注: 无, 试验组中未添加葡萄糖;葡萄糖, 试验组中添加葡萄糖) Fig. 5 Effect of adding glucose on the removal of n-alkanes(nC8~C40) in soils of CK and BC treatment after 84d incubation |
微生物生长离不开营养物质.葡萄糖是微生物生长所需要的重要有机质之一, 作为最简单的碳水化合物, 它能够直接参与糖酵解和三羧酸循环, 最终完全氧化为水和二氧化碳, 并产生38个ATP, 是能够被所有微生物利用的有机物.因此, 添加葡萄糖促进微生物生长也可能是造成烷烃去除率提高的原因之一.由图 5可见, CK试验组石油污染土壤添加葡萄糖后, 烷烃的降解效果与未添加葡萄糖的条件下相近, 说明单独添加葡萄糖对烷烃的降解没有影响.进一步而言, BC试验组中添加葡萄糖导致污染土壤中烷烃的去除率提高, 是由于生物炭和葡萄糖共同作用的结果.
表 2为加入不同生物炭(Wd300、Wd500、Wh300和Wh500) 培养84 d后(土壤含水率为50%, 温度30 ℃, 光照60%), BC试验组葡萄糖输入对土壤中PAHs降解效率的影响.整体来看, 加入葡萄糖后PAHs的去除率与烷烃不同, 略有下降.由上文可知, 由于土壤微生物的共代谢作用, 加入葡萄糖将会导致生物炭表面有机质分解, 孔隙度和表面积增加.而高比表面积和孔隙度的生物炭可有效吸附土壤中的PAHs, 因此可能导致生物炭对PAHs的吸附性增强, 降低了PAHs的生物降解率.
| 表 2 葡萄糖对生物炭强化PAHs的去除率的影响 Table 2 Effect of adding glucose on the removal of PAHs in soils of BC treatment |
1) 添加不同生物炭(Wd300、Wd500、Wh300和Wh500) 后, 大港油田污染土壤中TPHs、正链烷烃(nC8~C40) 和16种优先控制PAHs的浓度均有所下降, 说明污染物的微生物降解作用得到了强化.
2) 以麦秆为原料热解制备的生物炭对正链烷烃(nC8~C40) 降解的强化作用显著高于木屑生物炭, 这被归因于麦秆生物炭具有丰富的表面有机质、较大的比表面积和多孔结构, 而这些因素均有利于提高土壤微生物的活性, 进而促进污染物的降解和去除.然而, 生物炭原料对PAHs的降解没有影响, 这可能是由于不同生物炭对PAHs降解菌的影响不显著.加入高温(500 ℃)制备的生物炭对石油烃各组分降解的强化效果高于低温(300 ℃)生物炭的强化效果.
3) 生物炭输入对PAHs生物降解的强化效果高于正链烷烃(nC8~C40) .其中, 低环PAHs的降解效率显著高于高环PAHs.这是由于高环PAHs具有较高的辛醇-水分配系数, 易于吸附于土壤有机质, 阻碍了微生物代谢降解.
4) 作为土壤不稳定有机质代表的葡萄糖加入土壤后, 产生正激发作用促使生物炭矿化, 暴露出被表面官能团堵塞的孔隙, 提高了正链烷烃(nC8~C40) 的降解, 抑制了PAHs的去除.
| [1] | Anderson C R, Condron L M, Clough T J, et al. 2011. Biochar induced soil microbial community change: Implications for biogeochemical cycling of carbon, nitrogen and phosphorus[J]. Pedobiologia , 54 (5/6) : 309–320. |
| [2] | Beesley L, Moreno-Jiménez E, Gomez-Eyles J L. 2010. Effects of biochar and greenwaste compost amendments on mobility, bioavailability and toxicity of inorganic and organic contaminants in a multi-element polluted soil[J]. Environmental Pollution , 158 (6) : 2282–2287. DOI:10.1016/j.envpol.2010.02.003 |
| [3] | Beesley L, Moreno-Jiménez E, Gomez-Eyles J L, et al. 2011. A review of biochars' potential role in the remediation, revegetation and restoration of contaminated soils[J]. Environmental Pollution , 159 (12) : 3269–3282. DOI:10.1016/j.envpol.2011.07.023 |
| [4] | Brodowski S, John B, Flessa H, et al. 2006. Aggregate-occluded black carbon in soil[J]. European Journal of Soil Science , 57 (4) : 539–546. DOI:10.1111/ejs.2006.57.issue-4 |
| [5] | Bushnaf K M, Puricelli S, Saponaro S, et al. 2011. Effect of biochar on the fate of volatile petroleum hydrocarbons in an aerobic sandy soil[J]. Journal of Contaminant Hydrology , 126 (3/4) : 208–215. |
| [6] | Cao X, Ma L, Gao B, et al. 2009. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environmental Science & Technology , 43 (9) : 3285–3291. |
| [7] | Chan K Y, Van Zwieten L, Meszaros I, et al. 2007. Agronomic values of greenwaste biochar as a soil amendment[J]. Soil Research , 45 (8) : 629–634. DOI:10.1071/SR07109 |
| [8] | 董亚明, 刘其友, 赵东风, 等.2013. 石油烃降解混合菌修复稠油污染土壤的影响因素[J]. 干旱区研究 , 2013, 30 (4) : 603–608. |
| [9] | Gell K, van Groenigen J, Cayuela M L. 2011. Residues of bioenergy production chains as soil amendments: Immediate and temporal phytotoxicity[J]. Journal of Hazardous materials , 186 (2/3) : 2017–2025. |
| [10] | Glaser B, Parr M, Braun C, et al. 2009. Biochar is carbon negative[J]. Nature Geosci , 2 (1) : 2–2. DOI:10.1038/ngeo395 |
| [11] | Gomez-Eyles J L, Sizmur T, Collins C D, et al. 2011. Effects of biochar and the earthworm Eisenia fetida on the bioavailability of polycyclic aromatic hydrocarbons and potentially toxic elements[J]. Environmental Pollution , 159 (2) : 616–622. DOI:10.1016/j.envpol.2010.09.037 |
| [12] | Hamer U, Marschner B, Brodowski S, et al. 2004. Interactive priming of black carbon and glucose mineralisation[J]. Organic Geochemistry , 35 (7) : 823–830. DOI:10.1016/j.orggeochem.2004.03.003 |
| [13] | Hossain M K, Strezov V, Yin Chan K, et al. 2010. Agronomic properties of wastewater sludge biochar and bioavailability of metals in production of cherry tomato (Lycopersicon esculentum)[J]. Chemosphere , 78 (9) : 1167–1171. DOI:10.1016/j.chemosphere.2010.01.009 |
| [14] | Jones D L, Edwards-Jones G, Murphy D V. 2011. Biochar mediated alterations in herbicide breakdown and leaching in soil[J]. Soil Biology and Biochemistry , 43 (4) : 804–813. DOI:10.1016/j.soilbio.2010.12.015 |
| [15] | 焦文涛, 吕永龙, 王铁宇, 等.2009. 化工区土壤中多环芳烃的污染特征及其来源分析[J]. 环境科学 , 2009, 30 (4) : 1166–1172. |
| [16] | Keiluweit M, Nico P S, Johnson M G, et al. 2010. Dynamic molecular structure of plant biomass-derived black carbon (Biochar)[J]. Environmental Science & Technology , 44 (4) : 1247–1253. |
| [17] | Keith A, Singh B, Singh B P. 2011. Interactive priming of biochar and labile organic matter mineralization in a smectite-rich soil[J]. Environmental Science & Technology , 45 (22) : 9611–9618. |
| [18] | Kong L L, Liu W T, Zhou Q X. 2014. Biochar: An Effective Amendment for Remediating Contaminated Soil[M]//Reviews of Environmental Contamination and Toxicology Volume 228. Springer International Publishing, 83-99 |
| [19] | Kong L L, Zhou Q X. 2013. Influences of biochar aging processes by eco-environmental conditions[J]. Advanced Materials Research , 790 : 467–470. DOI:10.4028/www.scientific.net/AMR.790 |
| [20] | 孔露露, 周启星.2015. 新制备生物炭的特性表征及其对石油烃污染土壤的吸附效果[J]. 环境工程学报 , 2015, 9 (5) : 2462–2468. |
| [21] | Kuzyakov Y, Subbotina I, Chen H, et al. 2009. Black carbon decomposition and incorporation into soil microbial biomass estimated by 14C labeling[J]. Soil Biology and Biochemistry , 41 (2) : 210–219. DOI:10.1016/j.soilbio.2008.10.016 |
| [22] | Lehmann J, Rillig M C, Thies J, et al. 2011. Biochar effects on soil biotaA review[J]. Soil Biology and Biochemistry , 43 (9) : 1812–1836. DOI:10.1016/j.soilbio.2011.04.022 |
| [23] | Liang B, Lehmann J, Solomon D, et al. 2006. Black carbon increases cation exchange capacity in soils[J]. Soil Science Society of America Journal , 70 (5) : 1719–1730. DOI:10.2136/sssaj2005.0383 |
| [24] | 郎印海, 刘伟, 王慧.2014. 生物炭对水中五氯酚的吸附性能研究[J]. 中国环境科学 , 2014, 34 (8) : 2017–2023. |
| [25] | Liang B, Lehmann J, Solomon D, et al. 2008. Stability of biomass-derived black carbon in soils[J]. Geochimica et Cosmochimica Acta , 72 (24) : 6069–6078. DOI:10.1016/j.gca.2008.09.028 |
| [26] | 马强, 林爱军, 马薇, 等.2008. 土壤中总石油烃污染(TPH)的微生物降解与修复研究进展[J]. 生态毒理学报 , 2008, 3 (1) : 1–8. |
| [27] | Nguyen T H, Cho H H, Poster D L, et al. 2007. Evidence for a pore-filling mechanism in the adsorption of aromatic hydrocarbons to a natural wood char[J]. Environmental Science & Technology , 41 (4) : 1212–1217. |
| [28] | Qin G, Gong D, Fan M Y. 2013. Bioremediation of petroleum-contaminated soil by biostimulation amended with biochar[J]. International Biodeterioration & Biodegradation , 85 : 150–155. |
| [29] | Scott C D, Strandberg G W, Lewis S N. 1986. Microbial Solubilization of Coal[J]. Biotechnology Progress , 2 (3) : 131–139. DOI:10.1002/btpr.v2:3 |
| [30] | Shneour E A. 1966. Oxidation of graphitic carbon in certain soils[J]. Science , 151 (3713) : 991–992. DOI:10.1126/science.151.3713.991 |
| [31] | Sparrevik M, Saloranta T, Cornelissen G, et al. 2011. Use of Life Cycle Assessments To Evaluate the Environmental Footprint of Contaminated Sediment Remediation[J]. Environmental Science & Technology , 45 (10) : 4235–4241. |
| [32] | Spokas K A, Koskinen W C, Baker J M, et al. 2009. Impacts of woodchip biochar additions on greenhouse gas production and sorption/degradation of two herbicides in a Minnesota soil[J]. Chemosphere , 77 (4) : 574–581. DOI:10.1016/j.chemosphere.2009.06.053 |
| [33] | Uchimiya M, Lima I M, Klasson K T, et al. 2010a. Contaminant immobilization and nutrient release by biochar soil amendment: Roles of natural organic matter[J]. Chemosphere , 80 (8) : 935–940. DOI:10.1016/j.chemosphere.2010.05.020 |
| [34] | Uchimiya M, Lima I M, Thomas Klasson K, et al. 2010b. Immobilization of heavy metal ions (CuⅡ, CdⅡ, NiⅡ, and PbⅡ) by broiler litter-derived biochars in water and soil[J]. Journal of Agricultural and Food Chemistry , 58 (9) : 5538–5544. DOI:10.1021/jf9044217 |
| [35] | Wang C, Sun H, Li J, et al. 2009. Enzyme activities during degradation of polycyclic aromatic hydrocarbons by white rot fungus Phanerochaete chrysosporium in soils[J]. Chemosphere , 77 (6) : 733–738. DOI:10.1016/j.chemosphere.2009.08.028 |
| [36] | Wang X, Cai Z, Zhou Q, et al. 2012. Bioelectrochemical stimulation of petroleum hydrocarbon degradation in saline soil using U-tube microbial fuel cells[J]. Biotechnology and Bioengineering , 109 (2) : 426–433. DOI:10.1002/bit.23351 |
| [37] | Wang Y, Wang L, Fang G, et al. 2013. Enhanced PCBs sorption on biochars as affected by environmental factors: Humic acid and metal cations[J]. Environmental Pollution , 172 (0) : 86–93. |
| [38] | Waqas M, Khan S, Qing H, et al. 2014. The effects of sewage sludge and sewage sludge biochar on PAHs and potentially toxic element bioaccumulation in Cucumis sativa L[J]. Chemosphere , 105 : 53–61. DOI:10.1016/j.chemosphere.2013.11.064 |
| [39] | 王林, 徐应明, 梁学峰, 等.2014. 生物炭和鸡粪对镉低积累油菜吸收镉的影响[J]. 中国环境科学 , 2014, 34 (11) : 2851–2858. |
| [40] | Yang Y, Sheng G. 2003. Enhanced pesticide sorption by soils containing particulate matter from crop residue burns[J]. Environmental Science & Technology , 37 (16) : 3635–3639. |
| [41] | Yang Y, Sheng G. 2003. Pesticide adsorptivity of aged particulate matter arising from crop residue burns[J]. Journal of Agricultural and Food Chemistry , 51 (17) : 5047–5051. DOI:10.1021/jf0345301 |
| [42] | Yang Y, Sheng G, Huang M. 2006. Bioavailability of diuron in soil containing wheat-straw-derived char[J]. Science of the Total Environment , 354 (2/3) : 170–178. |
| [43] | 袁馨, 魏世强, 潘声旺.2009. 苏丹草对土壤中菲芘的修复作用[J]. 农业环境科学学报 , 2009, 26 (4) : 295–299. |
| [44] | Yu X Y, Ying G G, Kookana R S. 2009. Reduced plant uptake of pesticides with biochar additions to soil[J]. Chemosphere , 76 (5) : 665–671. DOI:10.1016/j.chemosphere.2009.04.001 |
| [45] | Zhou Q, Sun F, Liu R. 2005. Joint chemical flushing of soils contaminated with petroleum hydrocarbons[J]. Environment International , 31 (6) : 835–839. DOI:10.1016/j.envint.2005.05.039 |
| [46] | Zimmerman A R. 2010. Abiotic and Microbial Oxidation of Laboratory-Produced Black Carbon (Biochar)[J]. Environmental Science & Technology , 44 (4) : 1295–1301. |
| [47] | 周启星, 黄国宏. 2001. 环境生物地球化学及全球环境变化[M]. 北京: 科学出版社 . |
 2016, Vol. 36
2016, Vol. 36


